GB 15193.20-2014
基本信息
标准号: GB 15193.20-2014
中文名称:食品安全国家标准 体外哺乳类细胞TK基因突变试验
标准类别:国家标准(GB)
标准状态:现行
出版语种:简体中文
下载格式:.rar .pdf
下载大小:599KB
相关标签: 食品安全 国家标准 体外 哺乳类 细胞 基因突变 试验

标准分类号
关联标准
出版信息
相关单位信息
标准简介
GB 15193.20-2014 食品安全国家标准 体外哺乳类细胞TK基因突变试验
GB15193.20-2014
标准压缩包解压密码:www.bzxz.net
标准图片预览




标准内容
中华人民共和国国家标准
GB15193.20—2014
食品安全国家标准
体外哺乳类细胞TK基因突变试验2014-12-24发布
中华人民共和国
国家卫生和计划生育委员会
2015-05-01实施
本标准代替GB15193.20—2003《TK基因突变试验》。本标准与GB15193.20—2003相比,主要变化如下:GB 15193.20—2014
-标准名称修改为食品安全国家标准体外哺乳类细胞TK基因突变试验”;修改了范围:
增加了术语和定义;
修改了试验目的和原理;
-增加了代谢活化系统;
增加了THMG和THG选择培养基的配制方法;一增加了CHAT和CHT选择培养基的配制方法;增加了三氟胸昔的配制方法;
增加了磷酸盐缓冲液的配制方法;修改了受试物剂量设定的要求;修改了对照的设定;
增加了备选细胞系及相应的试验方法及数据处理;增加了试验报告的要求;
增加了试验的解释的要求。
1范围
食品安全国家标准
体外哺乳类细胞TK基因突变试验GB15193.20—2014
本标准规定了体外哺乳类胸苷激酶(thymidinekinase,TK)基因突变试验的基本试验方法与技术要求。
本标准适用于评价受试物的致突变作用。2术语和定义
2.1TK基因
哺乳类动物的胸苷激酶基因。人类的TK基因定位于17号染色体长臂远端;小鼠的则定位于11号染色体。
2突变频率
在某种细胞系中,某一特定基因突变型的细胞(集落)占细胞(集落)总数的比例(单位通常为10一)。3试验目的和原理
TK基因突变试验的检测终点是TK基因的突变。TK基因突变属于常染色体基因突变TK基因的产物胸苷激酶在体内催化从脱氧胸苷(TdR)生成胸苷酸(TMP)的反应。在正常情况下,此反应并非生命所必需,原因是体内的TMP主要来自于脱氧尿嘧啶核苷酸(dUMP),即由胸苷酸合成酶催化的dUMP甲基化反应生成TMP。但如在细胞培养物中加入胸苷类似物(如三氟胸苷,即trifluorothymidine,TFT),则TFT在胸苷激酶的催化下可生成三氟胸苷酸,进而掺入DNA,造成致死性突变,故细胞不能存活。若TK基因发生突变,导致胸苷激酶缺陷,则TFT不能磷酸化,亦不能掺入DNA,故突变细胞在含有TFT的培养基中能够生长,即表现出对TFT的抗性。根据突变集落形成数,可计算突变频率,从而推断受试物的致突变性。在TK基因突变试验结果观察中可发现两类明显不同的集落,即大/小集落(L5178Y细胞)或正常生长/缓慢生长集落(TK6细胞),有研究表明,大集落/正常生长集落主要由点突变或较小范围的缺失等引起,而小集落/缓慢生长集落主要由较大范围的染色体畸变,或由涉及调控细胞增殖的基因缺失引起。4仪器和试剂
4.1仪器
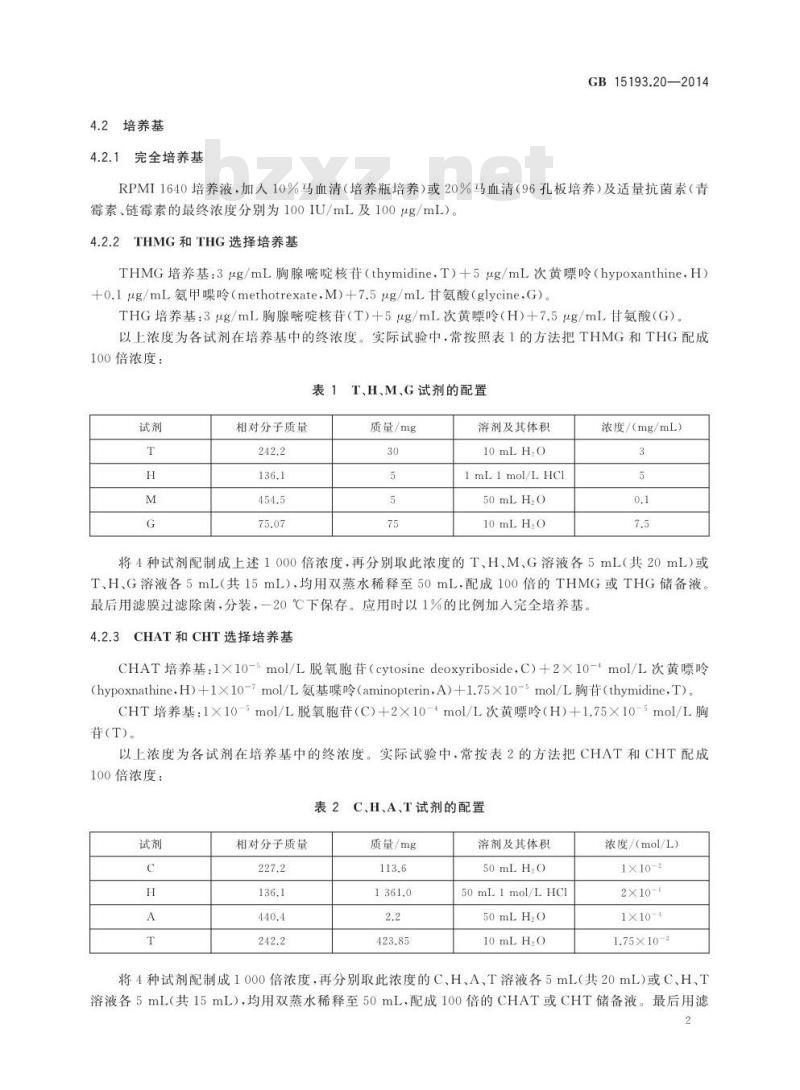
实验室常用设备、低温冰箱(一80℃)或液氮罐、生物安全柜、细胞培养箱、倒置显微镜、离心机。4.2培养基
4.2.1完全培养基
GB15193.20—2014
RPMI1640培养液,加人10%马血清(培养瓶培养)或20%马血清(96孔板培养)及适量抗菌素(青霉素、链霉素的最终浓度分别为100IU/mL及100μg/mL)。4.2.2THMG和THG选择培养基
THMG培养基:3μg/mL胸腺嘧啶核苷(thymidine,T)十5μg/mL次黄嘌呤(hypoxanthine,H)+o.1μg/mL氨甲噪呤(methotrexate,M)+7.5μg/mL甘氨酸(glycine,G)。THG培养基:3μg/mL胸腺嘧啶核苷(T)+5μg/mL次黄嘌呤(H)+7.5μg/mL甘氨酸(G)。以上浓度为各试剂在培养基中的终浓度。实际试验中,常按照表1的方法把THMG和THG配成100倍浓度:
表1T、H、M.G试剂的配置
相对分子质量
质量/mg
溶剂及其体积
10mLHO
1 mL 1 mol/L HCI
50mLH,0
10mLHO
浓度/(mg/mL)
将4种试剂配制成上述1000倍浓度,再分别取此浓度的T、H、M、G溶液各5mL(共20mL)或T、HG溶液各5mL(共15mL),均用双蒸水稀释至50mL,配成100倍的THMG或THG储备液。最后用滤膜过滤除菌,分装,一20℃下保存。应用时以1%的比例加入完全培养基。4.2.3CHAT和CHT选择培养基
CHAT培养基:1X10-5mol/L脱氧胞苷(cytosinedeoxyriboside,C)+2×10-+mol/L次黄嘌岭(hypoxnathineH)+1×1o-7mol/L氨基噪呤(aminopterin,A)+1.75×10-5mol/L胸苷(thymidine,T)。CHT培养基:1×10-5mol/L脱氧胞苷(C)+2×10-+mol/L次黄嘌呤(H)+1.75×10-mol/L胸(T)
以上浓度为各试剂在培养基中的终浓度。实际试验中,常按表2的方法把CHAT和CHT配成100倍浓度:
表2C、H、A、T试剂的配置
相对分子质量
质量/mg
溶剂及其体积
50mLH,0
50mL1mol/LHCl
50mLH,0
浓度/(mol/L)
1×10-2
2×10-
1×10-4
1.75×10-2
将4种试剂配制成1000倍浓度,再分别取此浓度的C、H、A、T溶液各5mL(共20mL)或C、H、T溶液各5mL(共15mL),均用双蒸水稀释至50mL,配成100倍的CHAT或CHT储备液。最后用滤2
膜过滤除菌,分装,一20℃下保存。应用时以1%的比例加入完全培养基4.3代谢活化系统
4.3.1S9辅助因子
4.3.1.1镁钾溶液
氯化镁1.9g和氯化钾6.15g加蒸馏水溶解至100mL。4.3.1.20.2mol/L磷酸盐缓冲液(pH7.4)GB15193.20—2014
磷酸氢二钠NaHPO.28.4g/L)440mL.磷酸二氢钠(NaHPOH,O.27.6g/L)60mL.调pH至7.4,0.103MPa20min灭菌或滤菌。4.3.1.3辅酶-Ⅱ(氧化型)溶液无菌条件下称取辅酶-IⅡl,用无菌蒸馏水溶解配制成0.025mol/L溶液。现用现配,4.3.1.4葡萄糖-6-磷酸钠盐溶液称取葡萄糖-6-磷酸钠盐,用蒸馏水溶解配制成0.05mol/L,过滤灭菌。现用现配。4.3.2大鼠肝S9组分的制备
选健康雄性成年SD或Wistar天鼠,体重150g~200g左右,约5周龄~6周龄。采用苯巴比要钠和β-萘黄酮联合诱导的方法进行制备,经口灌胃给予大鼠苯巴比要钠和β-萘黄酮,剂量均为80mg/kg体重,连续3d,禁食16h后断头处死动物,处死前禁食12h。处死动物后取出肝脏,称重后用新鲜冰冷的氯化钾溶液(0.15mol/L)连续冲洗肝脏数次,以便除去能抑制微粒体酶活性的血红蛋白。每克肝(湿重)加氯化钾溶液(0.1mol/L)3mL.连同烧杯移人冰浴中,用消毒剪刀剪碎肝脏,在玻璃匀浆器(低于4000r/min,1min~2min)或组织勾浆器(低于20000r/min,1min)中制成肝匀浆。以上操作需注意无菌和局部冷环境。将制成的肝匀浆在低温(0℃~4℃)高速离心机上以9000g离心10min,吸出上清液为S9组分,分装于无菌冷冻管中,每管2mL左右,用液氮或干冰速冻后置一80℃低温保存。S9组分制成后,经无菌检查,测定蛋白含量(Lowry法),每毫升蛋白含量不超过40mg为宜,并经间接致突变剂鉴定其生物活性合格后贮存于一80℃低温或冰冻干燥,保存期不超过1年。4.3.310%S9混合液
一般由S9组分和辅助因子按1:9组成10%的S9混合液,无菌,现用现配或过滤除菌。10%S9混合液10mL配制如下:
磷酸盐缓冲液
镁钾溶液
葡萄糖-6-磷酸钠盐溶液
辅酶-Ⅱ溶液
肝S9组分
混匀,置冰浴中待用。
S9混合液浓度一般为1%~10%,实际使用浓度可由各实验室自行决定,但需对其活性进行鉴定应能明显活化阳性对照物,且对细胞无明显毒性。3
4.4磷酸盐缓冲液(phosphatebuefferdsalinePBS)GB15193.20—2014
将8.0gNaCl、0.20gKCl、2.74gNazHPO4:7HzO、0.20gKHzPO4溶于双蒸水并定容至1000mL.pH7.2~7.4。
4.5三氟胸苷(trifluorothymidine,TFT)的配制取TFT30mg,用PBS溶解加至10mL,配成3mg/mL的储备液。应用时按1%的体积比加人培养基。
5试验方法
5.1细胞和培养条件
tk+/-基因型的L5178Y-3.7.2C小鼠淋巴瘤细胞或TK6人类淋巴母细胞。两种细胞均在5%二氧化碳、37℃、饱和湿度条件下作常规悬浮培养。为避免在培养和传代期间自发突变的细胞对试验结果的影响,在正式试验前,应清除自发突变的tk-/-基因型细胞。方法是:
a)对于L5178Y细胞,使用THMG培养基处理24h,以800r/min~1000r/min的速度离心4min~6min、洗涤后在不含氨甲噪呤的THG培养基中培养2d;对于TK6细胞,使用CHAT培养基处理48h,以800r/min~1000r/min的速度离心4min~b)
6min、洗涤后在不含氨基噪呤的CHT培养基中继续培养3d5.2受试物
5.2.1受试物的配制
受试物在使用前应现用现配,否则须证实在特定贮存条件下不影响其稳定性。5.2.2受试物剂量设定
至少应设置3个~4个可供分析的浓度。对于有细胞毒性的受试物,应根据细胞毒性预试验结果在RS或RSG为20%~80%范围内设3个~4个剂量(浓度)水平,同时应该考虑受试物对溶解度、pH和摩尔渗透压浓度的影响。方法是:取生长良好的细胞,调整密度为5×10°/mL,按1%体积加人不同浓度受试物.37℃震摇处理3h(L5178Y细胞)或4h(TK6细胞),细胞经离心洗涤后,作2d(L5178Y细胞)或3dTK6细胞)表达培养,每天计数细胞密度并计算相对悬浮生长(RSG)。或取上述处理后细胞感液,作梯度稀释至8个细胞/mL,接种96孔板(每孔加0.2mL,即平均1.6个细胞/孔),每个剂量种1块~2块平板,37℃,5%二氧化碳,饱和湿度条件下培养12d,计数每块平板有集落生长的孔数,计算相对存活率(RS)。
对于细胞毒性极低的受试物,最高浓度应设为5mg/mL、5uL/mL或0.01mol/L。对于相对不溶解的物质,其最高浓度的设置应达到不影响细胞培养的最大可加人浓度。5.2.3对照的设定bzxz.net
一股情况下,每一项试验中,在代谢活化系统存在和不存在的条件下均应设阳性和阴性(溶媒)对照组。
当使用代谢活化系统时,阳性对照物应使用要求代谢活化、并能引起典型突变集落的物质,可以使用3-甲基胆葱(3-methylcholanthrene)、环磷酰胺(cyclophosphamide,CP)等。在没有代谢活化系统时4
GB15193.20—2014
阳性对照物可使用甲基磺酸甲酯(methylmethanesulfonate,MMS)、丝裂霉素C(mitomycinC,MMC)、甲基磺酸乙酯(ethylmethanesulfonate,EMS)等。也可使用其他适宜的阳性对照物。溶媒应是非致突变物,不与受试物发生化学反应,不影响细胞存活和S9活性。溶媒首选蒸馏留水,如使用非水溶媒(可选择二甲基亚砜、丙酮、乙醇等),则需增设溶媒对照。5.3处理
取生长良好的细胞,调整密度为5×10°/mL,按1%体积加人受试物(需代谢活化的情况下,同时加人终浓度为1%~10%的S9混合物),37℃振摇处理3h(L5178Y细胞)或4h(TK6细胞),以800r/min1.000r/min的速度离心4min~6min,弃上清液,用PBS或不含血清的培养基洗涤细胞2遍,重新悬浮细胞于含10%马血清的RPMI1640培养液中,并调整细胞密度为2×10°/mL。5.4PE。(0d的平板接种效率)测定取适量细胞悬液,作梯度稀释至8个细胞/mL,接种96孔板(每孔加0.2mL即平均1.6个细胞孔),每个剂量种1块~2块平板,37℃,5%二氧化碳,饱和湿度条件下培养12d.计数每块平板有集落生长的孔数。
5.5表达
取5.3所得细胞悬液,作2d(L5178Y细胞)或3d(TK6细胞)表达培养,每天计数细胞密度并保持密度在10°/mL以下,计算相对悬浮生长(RSG)。5.6PE(L5178Y细胞)或PE,(TK6细胞)测定表达培养结束后,取适量细胞悬液,按5.4方法测定PE2/PE3。5.7
突变频率(MF)测定
5.7.1L5178Y细胞
L5178Y细胞表达培养2d后,取适量细胞悬液,调整细胞密度为1X10+/mL,加人TFT(终浓度为3μg/mL),混匀,接种96孔板(每孔加0.2mL,即平均2000个细胞/孔),每个剂量作2块~4块板37℃,5%二氧化碳,饱和湿度条件下培养12d,计数有突变集落生长的孔数。突变集落按大集落(LargeColony,LC:直径≥1/4孔径,密度低)和小集落(smallcolony,SC:直径<1/4孔径,密度高)分别计数。极小集落可再继续培养3d后计数。5.7.2TK6细胞
TK6细胞表达培养3d后,取适量细胞悬液,调整细胞密度至1.5X10°/mL,加人TFT(终浓度为3μg/mL),混匀,接种96孔板(每孔加0.2mL,即平均30000个细胞/孔),每个剂量作2块~4块板,37℃.5%二氧化碳,饱和湿度条件下培养12d,计数正常生长突变集落(normal-growthcolony,NC)。然后每孔再追加适量TFT.继续培养12d,计数新长成的缓慢生长突变集落(slow-growthcolony,SC)。6数据处理与结果评价
6.1数据处理
6.1.1平板效率(PE。、PE2/PE)平板效率(%)的计算见式(1):5
式中:
无集落生长的孔数;
总孔数;
每孔接种细胞数。
6.1.2相对存活率(RS)
相对存活率(%)的计算见式(2):RS
注:溶媒使用非水溶媒时,与溶媒对照比较。6.1.3相对悬浮生长(RSG)
相对悬浮生长(%)的计算见式(3):RSG
-In(EW/TW)
PE处理
PE附性/器媒对照
处理组表达期间细胞增殖倍数
×100%
阴性/溶媒对照组表达期间细胞增殖倍数注:溶媒使用非水溶媒时,与溶媒对照比较。6.1.4相对总生长(relativetotalgrowth,RTG)相对总生长(%)的计算见式(4):RTG=RSGXRSnX100%
式中:
RSn—第2天(L5178Y细胞)或第3天(TK6细胞)的相对存活率6.1.5突变频率(MF)
突变频率的计算见式(5):
MF(× 10-)=
式中:
无集落生长的孔数;
总孔数;
-In(EW/TW)/N
每孔接种细胞数(L5178Y细胞为2000,TK6细胞为30000);第2天(L5178Y细胞)或第3天(TK6细胞)的平板效率GB15193.20—2014
(1)
(3)
此外,对于L5178Y细胞,可分别计算大集落突变频率(L-MF)、小集落突变频率(S-MF)和总突变频率(T-MF)。对于TK6细胞,可分别计算正常集落突变频率(N-MF)、缓慢生长集落突变频率(S-MF)和总突变频率(T-MF)。
6.1.6小集落突变百分率(smallcolonymutation,SCM)或缓慢生长集落突变百分率(slowly-growthcolony mutation,SCM)
小集落突变百分率或缓慢生长集落突变百分率的计算见式(6):SCM
(6)
6.2结果评价
6.2.1试验成立的条件
GB15193.20—2014
试验所用L5178Y细胞的自发突变频率应在50X10-6~200X10-6之间;TK6细胞的自发突变频率应在1.5×10-6~5.5×10-之间,同时自发突变频率应在本实验室历史记录范围内。阴性/溶媒对照的PE。在60%~140%之间,PE2/PE的值在70%~130%之间。阳性对照的T-MF与阴性/溶媒对照有显著差异,或是阴性/溶媒对照3倍以上。6.2.2受试物阳性和阴性结果的判定6.2.2.1阳性结果的判定。受试物一个以上剂量(浓度)组的T-MF显著高于阴性/溶媒对照,或是阴性/溶媒对照的3倍以上,并有剂量-反应趋势,则可判定为阳性。但如仅在相对存活率低于20%的高剂量情况下出现阳性,则结果判为“可疑”。6.2.2.2阴性结果的判定。在相对存活率低于20%的情况下未见突变频率的增加,可判定为阴性7试验报告
试验名称、试验单位名称和联系方式、报告编号。7.2
试验委托单位名称和联系方式、样品受理日期,7.3
试验开始和结束日期、试验项目负责人、试验单位技术负责人、签发日期。试验摘要。
受试物:名称、鉴定资料、CAS编号(如已知)、纯度、与本试验有关的受试物的物理和化学性质及7.5
稳定性等。
溶媒和载体:溶媒或载体的选择依据,受试物在溶媒和载体中的溶解性和稳定性。7.6
细胞系:名称、来源及其特性。7.8试验条件:溶媒、剂量、代谢活化系统、阳性对照物、操作步骤等。7.9试验结果:每个剂量(浓度)表达培养期间细胞的密度、0d的平板接种效率、第2天或第3天的平板接种效率、相对存活率、相对悬浮生长和相对总生长、总突变频率必要时给出大集落突变频率、小集落突变频率和小集落突变突变百分率(L5178Y细胞)、或正常集落突变频率、缓慢生长集落突变频率和缓慢生长集落突变百分率(TK6细胞)、统计结果、是否具有剂量-反应趋势、同时进行的溶媒对照和阳性对照的结果及其本实验室溶媒对照和阳性对照结果的历史范围。7.10试验结论。
8试验的解释
TK基因突变试验具有较高的敏感性,可检出包括点突变、大的缺失、重组、异倍体和其他较大范围基因组改变在内的多种遗传改变,长时间处理还可检出某些断裂剂、纺锤体毒物和多倍体诱导剂等。但体外试验不能完全模拟哺乳动物体内代谢条件,因此,本试验结果不能直接外推到哺乳动物。阳性结果表明受试样品在该试验条件下可引起所用哺乳类细胞基因突变:阴性结果表明在该试验条件下受试样品不引起所用乳类细胞基因突变。评价时应综合考虑生物学意义和统计学意义。7
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
GB15193.20—2014
食品安全国家标准
体外哺乳类细胞TK基因突变试验2014-12-24发布
中华人民共和国
国家卫生和计划生育委员会
2015-05-01实施
本标准代替GB15193.20—2003《TK基因突变试验》。本标准与GB15193.20—2003相比,主要变化如下:GB 15193.20—2014
-标准名称修改为食品安全国家标准体外哺乳类细胞TK基因突变试验”;修改了范围:
增加了术语和定义;
修改了试验目的和原理;
-增加了代谢活化系统;
增加了THMG和THG选择培养基的配制方法;一增加了CHAT和CHT选择培养基的配制方法;增加了三氟胸昔的配制方法;
增加了磷酸盐缓冲液的配制方法;修改了受试物剂量设定的要求;修改了对照的设定;
增加了备选细胞系及相应的试验方法及数据处理;增加了试验报告的要求;
增加了试验的解释的要求。
1范围
食品安全国家标准
体外哺乳类细胞TK基因突变试验GB15193.20—2014
本标准规定了体外哺乳类胸苷激酶(thymidinekinase,TK)基因突变试验的基本试验方法与技术要求。
本标准适用于评价受试物的致突变作用。2术语和定义
2.1TK基因
哺乳类动物的胸苷激酶基因。人类的TK基因定位于17号染色体长臂远端;小鼠的则定位于11号染色体。
2突变频率
在某种细胞系中,某一特定基因突变型的细胞(集落)占细胞(集落)总数的比例(单位通常为10一)。3试验目的和原理
TK基因突变试验的检测终点是TK基因的突变。TK基因突变属于常染色体基因突变TK基因的产物胸苷激酶在体内催化从脱氧胸苷(TdR)生成胸苷酸(TMP)的反应。在正常情况下,此反应并非生命所必需,原因是体内的TMP主要来自于脱氧尿嘧啶核苷酸(dUMP),即由胸苷酸合成酶催化的dUMP甲基化反应生成TMP。但如在细胞培养物中加入胸苷类似物(如三氟胸苷,即trifluorothymidine,TFT),则TFT在胸苷激酶的催化下可生成三氟胸苷酸,进而掺入DNA,造成致死性突变,故细胞不能存活。若TK基因发生突变,导致胸苷激酶缺陷,则TFT不能磷酸化,亦不能掺入DNA,故突变细胞在含有TFT的培养基中能够生长,即表现出对TFT的抗性。根据突变集落形成数,可计算突变频率,从而推断受试物的致突变性。在TK基因突变试验结果观察中可发现两类明显不同的集落,即大/小集落(L5178Y细胞)或正常生长/缓慢生长集落(TK6细胞),有研究表明,大集落/正常生长集落主要由点突变或较小范围的缺失等引起,而小集落/缓慢生长集落主要由较大范围的染色体畸变,或由涉及调控细胞增殖的基因缺失引起。4仪器和试剂
4.1仪器
实验室常用设备、低温冰箱(一80℃)或液氮罐、生物安全柜、细胞培养箱、倒置显微镜、离心机。4.2培养基
4.2.1完全培养基
GB15193.20—2014
RPMI1640培养液,加人10%马血清(培养瓶培养)或20%马血清(96孔板培养)及适量抗菌素(青霉素、链霉素的最终浓度分别为100IU/mL及100μg/mL)。4.2.2THMG和THG选择培养基
THMG培养基:3μg/mL胸腺嘧啶核苷(thymidine,T)十5μg/mL次黄嘌呤(hypoxanthine,H)+o.1μg/mL氨甲噪呤(methotrexate,M)+7.5μg/mL甘氨酸(glycine,G)。THG培养基:3μg/mL胸腺嘧啶核苷(T)+5μg/mL次黄嘌呤(H)+7.5μg/mL甘氨酸(G)。以上浓度为各试剂在培养基中的终浓度。实际试验中,常按照表1的方法把THMG和THG配成100倍浓度:
表1T、H、M.G试剂的配置
相对分子质量
质量/mg
溶剂及其体积
10mLHO
1 mL 1 mol/L HCI
50mLH,0
10mLHO
浓度/(mg/mL)
将4种试剂配制成上述1000倍浓度,再分别取此浓度的T、H、M、G溶液各5mL(共20mL)或T、HG溶液各5mL(共15mL),均用双蒸水稀释至50mL,配成100倍的THMG或THG储备液。最后用滤膜过滤除菌,分装,一20℃下保存。应用时以1%的比例加入完全培养基。4.2.3CHAT和CHT选择培养基
CHAT培养基:1X10-5mol/L脱氧胞苷(cytosinedeoxyriboside,C)+2×10-+mol/L次黄嘌岭(hypoxnathineH)+1×1o-7mol/L氨基噪呤(aminopterin,A)+1.75×10-5mol/L胸苷(thymidine,T)。CHT培养基:1×10-5mol/L脱氧胞苷(C)+2×10-+mol/L次黄嘌呤(H)+1.75×10-mol/L胸(T)
以上浓度为各试剂在培养基中的终浓度。实际试验中,常按表2的方法把CHAT和CHT配成100倍浓度:
表2C、H、A、T试剂的配置
相对分子质量
质量/mg
溶剂及其体积
50mLH,0
50mL1mol/LHCl
50mLH,0
浓度/(mol/L)
1×10-2
2×10-
1×10-4
1.75×10-2
将4种试剂配制成1000倍浓度,再分别取此浓度的C、H、A、T溶液各5mL(共20mL)或C、H、T溶液各5mL(共15mL),均用双蒸水稀释至50mL,配成100倍的CHAT或CHT储备液。最后用滤2
膜过滤除菌,分装,一20℃下保存。应用时以1%的比例加入完全培养基4.3代谢活化系统
4.3.1S9辅助因子
4.3.1.1镁钾溶液
氯化镁1.9g和氯化钾6.15g加蒸馏水溶解至100mL。4.3.1.20.2mol/L磷酸盐缓冲液(pH7.4)GB15193.20—2014
磷酸氢二钠NaHPO.28.4g/L)440mL.磷酸二氢钠(NaHPOH,O.27.6g/L)60mL.调pH至7.4,0.103MPa20min灭菌或滤菌。4.3.1.3辅酶-Ⅱ(氧化型)溶液无菌条件下称取辅酶-IⅡl,用无菌蒸馏水溶解配制成0.025mol/L溶液。现用现配,4.3.1.4葡萄糖-6-磷酸钠盐溶液称取葡萄糖-6-磷酸钠盐,用蒸馏水溶解配制成0.05mol/L,过滤灭菌。现用现配。4.3.2大鼠肝S9组分的制备
选健康雄性成年SD或Wistar天鼠,体重150g~200g左右,约5周龄~6周龄。采用苯巴比要钠和β-萘黄酮联合诱导的方法进行制备,经口灌胃给予大鼠苯巴比要钠和β-萘黄酮,剂量均为80mg/kg体重,连续3d,禁食16h后断头处死动物,处死前禁食12h。处死动物后取出肝脏,称重后用新鲜冰冷的氯化钾溶液(0.15mol/L)连续冲洗肝脏数次,以便除去能抑制微粒体酶活性的血红蛋白。每克肝(湿重)加氯化钾溶液(0.1mol/L)3mL.连同烧杯移人冰浴中,用消毒剪刀剪碎肝脏,在玻璃匀浆器(低于4000r/min,1min~2min)或组织勾浆器(低于20000r/min,1min)中制成肝匀浆。以上操作需注意无菌和局部冷环境。将制成的肝匀浆在低温(0℃~4℃)高速离心机上以9000g离心10min,吸出上清液为S9组分,分装于无菌冷冻管中,每管2mL左右,用液氮或干冰速冻后置一80℃低温保存。S9组分制成后,经无菌检查,测定蛋白含量(Lowry法),每毫升蛋白含量不超过40mg为宜,并经间接致突变剂鉴定其生物活性合格后贮存于一80℃低温或冰冻干燥,保存期不超过1年。4.3.310%S9混合液
一般由S9组分和辅助因子按1:9组成10%的S9混合液,无菌,现用现配或过滤除菌。10%S9混合液10mL配制如下:
磷酸盐缓冲液
镁钾溶液
葡萄糖-6-磷酸钠盐溶液
辅酶-Ⅱ溶液
肝S9组分
混匀,置冰浴中待用。
S9混合液浓度一般为1%~10%,实际使用浓度可由各实验室自行决定,但需对其活性进行鉴定应能明显活化阳性对照物,且对细胞无明显毒性。3
4.4磷酸盐缓冲液(phosphatebuefferdsalinePBS)GB15193.20—2014
将8.0gNaCl、0.20gKCl、2.74gNazHPO4:7HzO、0.20gKHzPO4溶于双蒸水并定容至1000mL.pH7.2~7.4。
4.5三氟胸苷(trifluorothymidine,TFT)的配制取TFT30mg,用PBS溶解加至10mL,配成3mg/mL的储备液。应用时按1%的体积比加人培养基。
5试验方法
5.1细胞和培养条件
tk+/-基因型的L5178Y-3.7.2C小鼠淋巴瘤细胞或TK6人类淋巴母细胞。两种细胞均在5%二氧化碳、37℃、饱和湿度条件下作常规悬浮培养。为避免在培养和传代期间自发突变的细胞对试验结果的影响,在正式试验前,应清除自发突变的tk-/-基因型细胞。方法是:
a)对于L5178Y细胞,使用THMG培养基处理24h,以800r/min~1000r/min的速度离心4min~6min、洗涤后在不含氨甲噪呤的THG培养基中培养2d;对于TK6细胞,使用CHAT培养基处理48h,以800r/min~1000r/min的速度离心4min~b)
6min、洗涤后在不含氨基噪呤的CHT培养基中继续培养3d5.2受试物
5.2.1受试物的配制
受试物在使用前应现用现配,否则须证实在特定贮存条件下不影响其稳定性。5.2.2受试物剂量设定
至少应设置3个~4个可供分析的浓度。对于有细胞毒性的受试物,应根据细胞毒性预试验结果在RS或RSG为20%~80%范围内设3个~4个剂量(浓度)水平,同时应该考虑受试物对溶解度、pH和摩尔渗透压浓度的影响。方法是:取生长良好的细胞,调整密度为5×10°/mL,按1%体积加人不同浓度受试物.37℃震摇处理3h(L5178Y细胞)或4h(TK6细胞),细胞经离心洗涤后,作2d(L5178Y细胞)或3dTK6细胞)表达培养,每天计数细胞密度并计算相对悬浮生长(RSG)。或取上述处理后细胞感液,作梯度稀释至8个细胞/mL,接种96孔板(每孔加0.2mL,即平均1.6个细胞/孔),每个剂量种1块~2块平板,37℃,5%二氧化碳,饱和湿度条件下培养12d,计数每块平板有集落生长的孔数,计算相对存活率(RS)。
对于细胞毒性极低的受试物,最高浓度应设为5mg/mL、5uL/mL或0.01mol/L。对于相对不溶解的物质,其最高浓度的设置应达到不影响细胞培养的最大可加人浓度。5.2.3对照的设定bzxz.net
一股情况下,每一项试验中,在代谢活化系统存在和不存在的条件下均应设阳性和阴性(溶媒)对照组。
当使用代谢活化系统时,阳性对照物应使用要求代谢活化、并能引起典型突变集落的物质,可以使用3-甲基胆葱(3-methylcholanthrene)、环磷酰胺(cyclophosphamide,CP)等。在没有代谢活化系统时4
GB15193.20—2014
阳性对照物可使用甲基磺酸甲酯(methylmethanesulfonate,MMS)、丝裂霉素C(mitomycinC,MMC)、甲基磺酸乙酯(ethylmethanesulfonate,EMS)等。也可使用其他适宜的阳性对照物。溶媒应是非致突变物,不与受试物发生化学反应,不影响细胞存活和S9活性。溶媒首选蒸馏留水,如使用非水溶媒(可选择二甲基亚砜、丙酮、乙醇等),则需增设溶媒对照。5.3处理
取生长良好的细胞,调整密度为5×10°/mL,按1%体积加人受试物(需代谢活化的情况下,同时加人终浓度为1%~10%的S9混合物),37℃振摇处理3h(L5178Y细胞)或4h(TK6细胞),以800r/min1.000r/min的速度离心4min~6min,弃上清液,用PBS或不含血清的培养基洗涤细胞2遍,重新悬浮细胞于含10%马血清的RPMI1640培养液中,并调整细胞密度为2×10°/mL。5.4PE。(0d的平板接种效率)测定取适量细胞悬液,作梯度稀释至8个细胞/mL,接种96孔板(每孔加0.2mL即平均1.6个细胞孔),每个剂量种1块~2块平板,37℃,5%二氧化碳,饱和湿度条件下培养12d.计数每块平板有集落生长的孔数。
5.5表达
取5.3所得细胞悬液,作2d(L5178Y细胞)或3d(TK6细胞)表达培养,每天计数细胞密度并保持密度在10°/mL以下,计算相对悬浮生长(RSG)。5.6PE(L5178Y细胞)或PE,(TK6细胞)测定表达培养结束后,取适量细胞悬液,按5.4方法测定PE2/PE3。5.7
突变频率(MF)测定
5.7.1L5178Y细胞
L5178Y细胞表达培养2d后,取适量细胞悬液,调整细胞密度为1X10+/mL,加人TFT(终浓度为3μg/mL),混匀,接种96孔板(每孔加0.2mL,即平均2000个细胞/孔),每个剂量作2块~4块板37℃,5%二氧化碳,饱和湿度条件下培养12d,计数有突变集落生长的孔数。突变集落按大集落(LargeColony,LC:直径≥1/4孔径,密度低)和小集落(smallcolony,SC:直径<1/4孔径,密度高)分别计数。极小集落可再继续培养3d后计数。5.7.2TK6细胞
TK6细胞表达培养3d后,取适量细胞悬液,调整细胞密度至1.5X10°/mL,加人TFT(终浓度为3μg/mL),混匀,接种96孔板(每孔加0.2mL,即平均30000个细胞/孔),每个剂量作2块~4块板,37℃.5%二氧化碳,饱和湿度条件下培养12d,计数正常生长突变集落(normal-growthcolony,NC)。然后每孔再追加适量TFT.继续培养12d,计数新长成的缓慢生长突变集落(slow-growthcolony,SC)。6数据处理与结果评价
6.1数据处理
6.1.1平板效率(PE。、PE2/PE)平板效率(%)的计算见式(1):5
式中:
无集落生长的孔数;
总孔数;
每孔接种细胞数。
6.1.2相对存活率(RS)
相对存活率(%)的计算见式(2):RS
注:溶媒使用非水溶媒时,与溶媒对照比较。6.1.3相对悬浮生长(RSG)
相对悬浮生长(%)的计算见式(3):RSG
-In(EW/TW)
PE处理
PE附性/器媒对照
处理组表达期间细胞增殖倍数
×100%
阴性/溶媒对照组表达期间细胞增殖倍数注:溶媒使用非水溶媒时,与溶媒对照比较。6.1.4相对总生长(relativetotalgrowth,RTG)相对总生长(%)的计算见式(4):RTG=RSGXRSnX100%
式中:
RSn—第2天(L5178Y细胞)或第3天(TK6细胞)的相对存活率6.1.5突变频率(MF)
突变频率的计算见式(5):
MF(× 10-)=
式中:
无集落生长的孔数;
总孔数;
-In(EW/TW)/N
每孔接种细胞数(L5178Y细胞为2000,TK6细胞为30000);第2天(L5178Y细胞)或第3天(TK6细胞)的平板效率GB15193.20—2014
(1)
(3)
此外,对于L5178Y细胞,可分别计算大集落突变频率(L-MF)、小集落突变频率(S-MF)和总突变频率(T-MF)。对于TK6细胞,可分别计算正常集落突变频率(N-MF)、缓慢生长集落突变频率(S-MF)和总突变频率(T-MF)。
6.1.6小集落突变百分率(smallcolonymutation,SCM)或缓慢生长集落突变百分率(slowly-growthcolony mutation,SCM)
小集落突变百分率或缓慢生长集落突变百分率的计算见式(6):SCM
(6)
6.2结果评价
6.2.1试验成立的条件
GB15193.20—2014
试验所用L5178Y细胞的自发突变频率应在50X10-6~200X10-6之间;TK6细胞的自发突变频率应在1.5×10-6~5.5×10-之间,同时自发突变频率应在本实验室历史记录范围内。阴性/溶媒对照的PE。在60%~140%之间,PE2/PE的值在70%~130%之间。阳性对照的T-MF与阴性/溶媒对照有显著差异,或是阴性/溶媒对照3倍以上。6.2.2受试物阳性和阴性结果的判定6.2.2.1阳性结果的判定。受试物一个以上剂量(浓度)组的T-MF显著高于阴性/溶媒对照,或是阴性/溶媒对照的3倍以上,并有剂量-反应趋势,则可判定为阳性。但如仅在相对存活率低于20%的高剂量情况下出现阳性,则结果判为“可疑”。6.2.2.2阴性结果的判定。在相对存活率低于20%的情况下未见突变频率的增加,可判定为阴性7试验报告
试验名称、试验单位名称和联系方式、报告编号。7.2
试验委托单位名称和联系方式、样品受理日期,7.3
试验开始和结束日期、试验项目负责人、试验单位技术负责人、签发日期。试验摘要。
受试物:名称、鉴定资料、CAS编号(如已知)、纯度、与本试验有关的受试物的物理和化学性质及7.5
稳定性等。
溶媒和载体:溶媒或载体的选择依据,受试物在溶媒和载体中的溶解性和稳定性。7.6
细胞系:名称、来源及其特性。7.8试验条件:溶媒、剂量、代谢活化系统、阳性对照物、操作步骤等。7.9试验结果:每个剂量(浓度)表达培养期间细胞的密度、0d的平板接种效率、第2天或第3天的平板接种效率、相对存活率、相对悬浮生长和相对总生长、总突变频率必要时给出大集落突变频率、小集落突变频率和小集落突变突变百分率(L5178Y细胞)、或正常集落突变频率、缓慢生长集落突变频率和缓慢生长集落突变百分率(TK6细胞)、统计结果、是否具有剂量-反应趋势、同时进行的溶媒对照和阳性对照的结果及其本实验室溶媒对照和阳性对照结果的历史范围。7.10试验结论。
8试验的解释
TK基因突变试验具有较高的敏感性,可检出包括点突变、大的缺失、重组、异倍体和其他较大范围基因组改变在内的多种遗传改变,长时间处理还可检出某些断裂剂、纺锤体毒物和多倍体诱导剂等。但体外试验不能完全模拟哺乳动物体内代谢条件,因此,本试验结果不能直接外推到哺乳动物。阳性结果表明受试样品在该试验条件下可引起所用哺乳类细胞基因突变:阴性结果表明在该试验条件下受试样品不引起所用乳类细胞基因突变。评价时应综合考虑生物学意义和统计学意义。7
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。