GB 1886.174-2016
基本信息
标准号: GB 1886.174-2016
中文名称:食品安全国家标准 食品添加剂 食品工业用酶制剂
标准类别:国家标准(GB)
标准状态:现行
出版语种:简体中文
下载格式:.rar .pdf
下载大小:549KB

标准分类号
关联标准
出版信息
相关单位信息
标准简介
GB 1886.174-2016 食品安全国家标准 食品添加剂 食品工业用酶制剂
GB1886.174-2016
标准压缩包解压密码:www.bzxz.net
标准图片预览




标准内容
中华人民共和国国家标准
GB1886.174—2016
食品安全国家标准
食品添加剂
2016-08-31发布
食品工业用酶制剂
2017-01-01实施
人民共和国
国家卫生和计划生育委员会
GB1886.174—2016
本标准代替GB25594一2010《食品安全国家标准食品工业用酶制剂》,GB8276—2006《食品添加剂糖化酶制剂》,GB20713—2006《食品添加剂α-乙酰乳酸脱酶制剂》,GB8275—2009《食品添加剂α-淀粉酶制剂》。
本标准与GB255942010相比,主要变化如下:增加了酶活力的术语和定义;
一增加了产品分类、理化要求;—在附录中给出了部分酶制剂的酶活力测定方法I
1范围
食品安全国家标准
食品添加剂
厂食品工业用酶制剂
本标准适用于GB2760允许使用的食品工业用酶制剂。2术语和定义
食品工业用酶制剂
GB1886.174—2016
由动物或植物的可食或非可食部分直接提取,或由传统或通过基因修饰的微生物(包括但不限于细菌、放线菌、真菌菌种)发酵、提取制得,用于食品加工,具有特殊催化功能的生物制品。注:商品化的酶制剂产品充许加入易于产品贮存、使用的配料成分2.2酶活力
酶在一定条件下催化某一特定反应的能力,即为酶活力,是表达酶制剂产品的一个特征性专属指标。
2.3抗菌活性
抑制或杀灭微生物的能力。
3产品分类
按产品形态分为固体剂型和液体剂型两类4技术要求
原料要求
4.1.1用于生产酶制剂的原料必须符合良好生产规范或相关要求,在正常使用条件下不应对最终食品产生有害健康的残留污染。
4.1.2来源于动物的酶制剂,其动物组织必须符合肉类检疫要求。4.1.3来源于植物的酶制剂,其植物组织不得霉变。4.1.4对微生物生产菌种应进行分类学和(或)遗传学的鉴定,并应符合有关规定。菌种的保藏方法和条件应保证发酵批次之间的稳定性和可重复性4.2
2产品要求
4.2.1理化指标
产品酶活力在标示值的85%~115%。1
GB 1886.174—2016
注:本标准附录A给出的酶活力测定方法供参考。企业可按相应标准中给出的或企业规定的方法测定。4.2.2
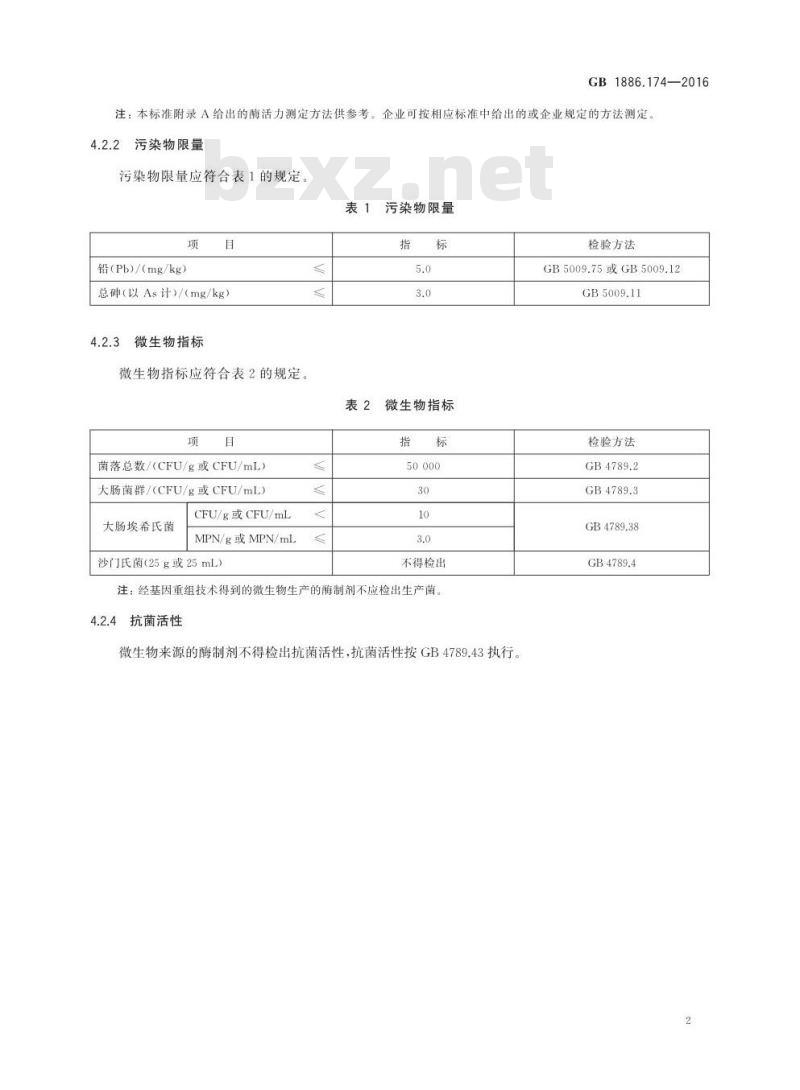
污染物限量
污染物限量应符合表1的规定。
铅(Pb)/(mg/kg)
总砷(以As计)/(mg/kg)
微生物指标
微生物指标应符合表2的规定。
菌落总数/(CFU/g或CFU/mL)
大肠菌群/(CFU/g或CFU/mL)
大肠埃希氏菌
CFU/g或CFU/mL
MPN/g或MPN/mL
沙门氏菌(25g或25mL)
污染物限量
微生物指标
不得检出
注:经基因重组技术得到的微生物生产的酶制剂不应检出生产菌。4.2.4
抗菌活性
微生物来源的酶制剂不得检出抗菌活性,抗菌活性按GB4789.43执行。检验方法
GB5009.75或GB5009.12
GB5009.11
检验方法
GB4789.38
A.1一般规定
附录A
酶活力测定方法
GB1886.174—2016
本标准所用试剂和水,在没有注明其他要求时,均指分析纯试剂和GB/T6682规定的三级水。试验中所用标准溶液、杂质标准溶液、制剂及制品,在没有注明其他要求时,均按GB/T601、GB/T602和GB/T603的规定制备。试验中所用溶液在未注明用何种溶剂配制时,均指水溶液。A.2α-淀粉酶活力的测定
A.2.1、α-淀粉酶
能水解淀粉分子链中的α-1,4葡萄糖苷键,将淀粉链切断成为短链糊精和少量麦芽糖和葡萄糖,使淀粉黏度迅速下降的酶。
A.2.2α-淀粉酶活力
A.2.2.1中温α-淀粉酶活力单位1g固体酶粉(或1mL液体酶),于60℃、pH6.0条件下.1h液化1g可溶性淀粉,即为1个酶活力单位,以U/g(U/mL)表尔。
A.2.2.2耐高温α-淀粉酶活力单位1g固体酶粉(或1mL液体酶),于70℃、pH6.0条件下,1min液化1mg可溶性淀粉,即为1个酶活力单位,以U/g(U/mL)表示。
A.2.3原理
α-淀粉酶制剂能将淀粉分子链中的α-1,4葡萄糖苷键随机切断成长短不一的短链糊精、少量麦芽糖和葡萄糖,而使淀粉对碘呈蓝紫色的特性反应逐渐消失,呈现棕红色,其颜色消失的速度与酶活性有关,据此可通过反应后的吸光度计算酶活力。A.2.4试剂和材料
A.2.4.1碘。
A.2.4.2碘化钾。
原碘液:称取11.0g碘和22.0g碘化钾,用少量水使碘完全溶解,定容至500mL,贮存于棕色瓶中。A.2.4.3
稀碘液:吸取原碘液2.00mL.加20.0.g碘化钾用水溶解并定容至500mL.贮存于棕色瓶中A.2.4.4
A.2.4.5可溶性淀粉溶液(20g/L):称取2.000g(精确至0.001g)可溶性淀粉(以绝干计)于烧杯中,用少量水调成浆状物,边搅拌边缓缓加入70mL沸水中,然后用水分次冲洗装淀粉的烧杯,洗液倒入其中,搅拌加热至完全透明,冷却定容至100mL。溶液现配现用,注:可溶性淀粉应采用酶制剂分析专用淀粉。A.2.4.6磷酸缓冲液(pH6.0):称取45.23g磷酸氢二钠(NazHPO·12HzO)和8.07g柠檬酸(C,HO,H,O),用水溶解并定容至1000mL。用pH计校正后使用。3
盐酸溶液c(HCD)=0.1mol/L。
A.2.5仪器和设备
分光光度计。
恒温水浴:精度士0.1℃。
自动移液器。
试管:25mm×200mm。
A.2.5.5秒表。
A.2.6分析步骤
A.2.6.1待测酶液的制备
GB 1886.174—2016
称取试样1g~2g(精确至0.0001g)或准确吸取1.00mL,用少量磷酸缓冲液充分溶解,将上清液小心倾人容量瓶中,若有剩余残渣,再加少量磷酸缓冲液充分研磨,最终样品全部移入容量瓶中,用磷酸缓冲液定容至刻度,摇匀。用四层纱布过滤,滤液待用。注:待测中温α-淀粉酶酶液酶活力控制酶浓度在3.4U/ml4.5U/mL范围内,待测耐高温α-淀粉酶活力控制酶浓度在60U/mL~65U/mL范围内。
A.2.6.2测定
吸取20.0mL可溶性淀粉溶液于试管中,加人磷酸缓冲液5.00mL.摇匀后,置于60℃土0.2℃(耐高温α-淀粉酶制剂置于70℃土0.2℃)恒温水浴中预热8min;加入1.00mL稀释好的待测酶液,立即计时,摇勾,准确反应5min;b)
立即用自动移液器吸取1.00mL反应液,加到预先盛有0.5mL盐酸溶液和5.00mL稀碘液的试管c
中,摇匀,并以0.5mL盐酸溶液和5.00mL稀碘液为空白,于660nm波长下,用10mm比色血迅速测定其吸光度(A)。根据吸光度查表附录B,求得测试酶液的浓度。A.2.6.3结果计算
A.2.6.3.1
中温α-淀粉酶制剂的酶活力
中温α-淀粉酶制剂的酶活力X,单位为U/mL或U/g,按式(A1)计算:X=eXn
式中:
测试酶样浓度,单位为U/mL或U/g;n-样品的稀释倍数。
所得结果表示至整数。
(A.1)
试验结果以平行测定结果的算术平均值为准。在重复性条件下获得的两次独立测定结果的绝对差值不大于算术平均值的5%。
A.2.6.3.2耐高温α-淀粉酶制剂的酶活力耐高温α-淀粉酶制剂的酶活力X,,以U/mL或U/g计,按式(A.2)计算:X,= cXnX16.67
式中:
测试酶样的浓度,单位为U/mL或U/g;一样品的稀释倍数;
16.67一一根据酶活力定义计算的换算系数,所得结果表示至整数
GB1886.174—2016
试验结果以平行测定结果的算术平均值为准。在重复性条件下获得的两次独立测定结果的相对误差不得超过5%。
A.3葡糖淀粉酶(淀粉葡糖苷酶)活力的测定(黑曲霉及其变异株来源)A.3.1葡糖淀粉酶(淀粉葡糖苷酶)以淀粉为底物,在一定条件下从淀粉的非还原性末端开始水解α-1.4、α-1.6、α-1,3葡萄糖苷键产生葡萄糖的淀粉葡萄糖苷酶。
A.3.2葡糖淀粉酶(淀粉葡糖苷酶)活力1mL酶液或1g酶粉在40℃、pH4.6的条件下,1h水解可溶性淀粉产生1mg葡萄糖,即为一个酶活力单位,以U/mL(或U/g)表示。
A.3.3试剂和材料
A.3.3.10.05mol/L乙酸-乙酸钠缓冲溶液(pH4.6):称取乙酸钠(CH.COONa·3H,O)6.7g,吸取冰乙酸2.6mL,用水溶解并定容至1000mL。上述缓冲溶液的pH,应使用酸度计加以校正。A.3.3.20.05mol/L硫代硫酸钠标准滴定溶液,A.3.3.30.1mol/L碘标准溶液。
A.3.3.40.1mol/L氢氧化钠溶液
A.3.3.52mol/L硫酸溶液:吸取分析纯浓硫酸(相对密度1.84)5.6mL缓缓加人适量水中,冷却后,用水定容至100mL,摇匀。
A.3.3.6200g/L氢氧化钠溶液:称取氢氧化钠20g,用水溶解,并定容至100mL。20g/L可溶性淀粉溶液:称取可溶性淀粉2g士0.001g,然后用少量水调匀,缓缓倾入已沸腾的水中,A.3.3.72
煮沸、搅拌直至透明,冷却,用水定容至100mL。此溶液需当天配制,注:可溶性淀粉应采用酶制剂分析专用淀粉A.3.4仪器和设备
分析天平:精度0.2mg。
酸度计:精度0.01pH。
分析天平:精度0.2mg。
恒温水浴:40℃土0.1℃。
连续多档分配器(移液枪)。
磁力搅拌器
A.3.5分析步骤
待测酶液的制备
液体酶:使用连续多档分配器准确吸取适量酶样,移人容量瓶中,用缓冲溶液稀释至刻度,充分摇A.3.5.1.1
匀,待测。
A.3.5.1.2固体酶:用50mL小烧杯准确称取适量酶样,精确至1mg,用少量乙酸-乙酸钠缓冲溶液溶解,并用玻璃棒仔细捣研,将上层清液小心倾人适当的容量瓶中,在沉渣中再加入少量缓冲溶液,如此反复捣研3次~5
GB1886.174—2016
4次,取上清液,最后全部移人容量瓶中,用缓冲溶液定容,磁力搅拌30min以充分混匀,取上清液测定。注:1.制备待测酶液时,样液浓度应控制在滴定空白和样品时消耗0.05mol/L硫代硫酸钠标准滴定溶液的差值在4.5mL~5.5mL范围内(酶活力约为120U/mL~150U/mL)。2.液体酶根据产品特性也可称取.按克计算。A.3.5.2测定
取A,B两支50mL比色管,分别加人可溶性淀粉溶液25mL和乙酸-乙酸钠缓冲溶液5mL,摇勾。于40℃士0.2℃的恒温水浴中预热5min~10min。在B管中加人待测酶液2.0mL,立即记时,摇匀。在此温度下准确反应30min后,立即向A、B两管中各加氢氧化钠溶液0.2mL,摇匀.同时将两管取出,迅速用水冷却,并于A管中补加待测酶液2.0mL(作为空白对照)。吸取上述A,B两管中的反应液各5.0mL,分别于两个碘量瓶中,准确加入碘标准溶液0.0mL,再加氢氧化钠溶液15mL,边加边摇勾,并于暗处放置15min,取出。用水淋洗瓶盖,加人硫酸溶液2mL,用硫代硫酸钠标准滴定溶液滴定蓝紫色溶液,直至刚好无色为其终点,分别记录空白和样品消耗硫代硫酸钠标准滴定溶液的体积(A、B)。
A.3.6结果计算
葡糖淀粉酶制剂的酶活力X,单位为U/mL或U/g.按式(A.3)计算:(A-B)XciX90.05X32.2XnX2
式中:
滴定空白时,消耗硫代硫酸钠标准滴定溶液的体积,单位为毫升(mL);滴定样品时,消耗硫代硫酸钠标准滴定溶液的体积,单位为毫升(mL);硫代硫酸钠标准滴定溶液的准确浓度,单位为摩尔每升(mol/L);与1.00mL硫代硫酸钠标准溶液相当的葡萄糖的摩尔质量,g/mol(M一90.05);反应液的总体积,单位为毫升(mL);吸取反应液的体积;
折算成1mL酶液的量;下载标准就来标准下载网
稀释倍数;
反应30min.换算成1h的酶活力系数以样品测定结果的算术平均值表示,保留3位有效数字。......A3)
试验结果以平行测定结果的算术平均值为准。在重复性条件下获得的两次独立测定结果的绝对差值不大于算术平均值的10%。
蛋自酶活力的测定
A.4.1蛋白酶
能切断蛋白质分子内部的肽键,使蛋白质分子变成小分子多肽和氨基酸的酶。A.4.2蛋白酶活力
蛋白酶活力以蛋白酶活力单位表示,定义为1g或1mL酶,在一定温度和pH条件下,1min水解酪蛋白产生1μg酪氨酸.即为1个酶活力单位,以U/g(U/mL)表示。A.4.3原理
蛋白酶在一定的温度与pH条件下,水解酪蛋白底物,产生含有酚基的氨基酸(如:酪氨酸、色氨酸等),在6
GB1886.174—2016
碱性条件下,将福林试剂还原,生成钼蓝与钨蓝,用分光光度计于波长680nm下测定溶液的吸光度。酶活力与吸光度成比例,由此可以计算产品的酶活力,A.4.4试剂和材料
A.4.4.1福林试剂:于2000mL磨口回流装置中加入钨酸钠(NaWO·2H,O)100.0g、钼酸钠(NazMoO2H,O)25.0g、水700mL、85%磷酸50mL、浓盐酸100mL。小火沸腾回流10h,取下回流冷却器,在通风橱中加人硫酸锂(Li.SO,)50g、水50mL和数滴浓溴水(99%),再微沸15min,以除去多余的溴(冷后仍有绿色需再加溴水,再煮沸除去过量的溴),冷却,加水定容至1000mL。混勾.过滤。制得的试剂应呈金黄色,贮存于棕色瓶内。
福林使用溶液:一份福林试剂与二份水混合,摇匀。也可使用市售福林溶液配制。A.4.4.2
A.4.4.3石
碳酸钠溶液(42.4g/L):称取无水碳酸钠(NazCO,)42.4g,用水溶解并定容至1000mL。A.4.4.4
三氯乙酸(65.4g/L):称取三氯乙酸65.4g,用水溶解并定容至1000mL。氢氧化钠溶液(20g/L):称取氢氧化钠片剂20.0g,加水900mL并搅拌溶解。待溶液到室温后续水A.4.4.5
定容至1000mL,搅拌均匀。
A.4.4.6盐酸溶液:c(HCI)=1mol/L。A.4.4.7
盐酸溶液:c(HCI)=0.1mol/L。
A.4.4.8缓冲溶液。
以下各种缓冲溶液配制时需用pH计测定并调整pH。A.4.4.8.1磷酸缓冲液(pH=7.5.适用于中性蛋白酶制剂)。分别称取磷酸氢二钠(NaHPO.·12H,O)6.02g和磷酸二氢钠(NaH,PO,·2H,O)0.5g,加水溶解并定容至1000mL
A.4.4.8.2乳酸钠缓冲液(pH一3.0.适用于酸性蛋白酶制剂)。取乳酸(80%~90%)4.71g和乳酸钠(70%)0.89g,加水至900mL,搅拌至均匀。用乳酸或乳酸钠调整pH到3.0±0.05,定容至1000mL。A.4.4.8.3硼酸缓冲溶液(pH=10.5,适用于碱性蛋白酶制剂)。称硼酸钠9.54g,氢氧化钠1.60g,加水900mL,搅拌至均匀。用1mol/L盐酸溶液或0.5mol/L氢氧化钠溶液调整pH=10.5士0.05,定容至1000mL。A.4.4.9酪蛋白溶液(10.0g/L):称取标准酪蛋白(NICPBP国家药品标准物质)1.000g,精确到0.001g,用少量氢氧化钠溶液(若酸性蛋白酶制剂则用浓乳酸2滴~3滴)湿润后,加入相应的缓冲溶液约80mL,在沸水浴中加热煮沸30min,并不时搅拌至酪蛋白全部溶解。冷却到室温后转人100mL容量瓶中,用适宜的pH缓冲落液稀释至刻度。定容前检查并调整pH至相应缓冲液的规定值。此溶液在冰箱内贮存,有效期为3天。使用前重新确认并调整pH至规定值。注:不同来源或批号的酪蛋白对试验结果有影响。如使用不同的酪蛋白作为底物,使用前应与以上标准酪蛋白进行结果比对。
A4.4.9.1L-酪氨酸标准储备溶液(100ug/mL):精确称取预先于105℃干燥至恒重的L-酪氨酸0.1000g士0.0002g,用1mol/L盐酸溶液60mL溶解后定容至100mL,即为1mg/mL酪氨酸溶液。吸取1mg/mL酪氨酸溶液10.00mL,用0.1mol/L盐酸溶液定容至100mL,即得到100μg/mL的L-酪氨酸标准储备溶液。
注:除上述蛋白酶的溶解/稀释缓冲体系外,生产者和使用者还可以探讨使用其他适用的缓冲体系。A.4.5仪器和设备
分析天平:精度为0.0001g。
紫外-可见分光光度计。
A.4.5.3恒温水浴锅:精度士0.2℃。A.4.5.4pH计:精度为0.01pH单位。A.4.6分析步骤
标准曲线的绘制
标准曲线的绘制按如下操作:
a)L-酪氨酸标准溶液:按表A1配制。表A.1L-酪氨酸标准溶液
酪氨酸标准溶液的浓度
1ag/mL
酪氨酸标准储备溶液的体积
GB1886.174—2016
加水的体积
分别取上述溶液各1.00mL(应做平行试验),各加碳酸钠溶液5.00mL、福林试剂使用溶液1.00mL,b)
振荡均匀,置于40℃土0.2℃水浴中显色20min,取出,用分光光度计于波长680nm,10mm比色皿,以不含酪氨酸的0管为空白,分别测定其吸光度。以吸光度A为纵坐标,酪氨酸的浓度为横坐标,绘制标准曲线。
c)利用回归方程,计算出当吸光度为1时的酪氨酸的量(ug),即为吸光常数K值。其K值应在95~100范围内。如不符合,需重新配制试剂,进行试验。注:L-酪氨酸稀释液应在稀释后立即进行测定。A.4.6.2待测酶液的制备
称取酶样品1g~2g,精确至0.0002g。然后用相应的缓冲液溶解并稀释到一定浓度,推荐浓度范围为酶活力10U/mL~15U/mL。
对于粉状的样品,可以用相应的缓冲液充分溶解,然后取滤液(慢速定性滤纸)稀释至适当浓度。A.4.6.3测定
按如下进行测定:
a)先将酪蛋白溶液放人40℃士0.2℃恒温水浴中,预热5min;b)按下列程序操作:
试管A(空白)
加酶液1.00mL
40℃±0.2℃.2min
试管B(酶试样,需作三个平行试样)→
加酶液1.00ml
+40℃±0.2℃,2min
加三氯乙酸2.00mL(摇勺)
40℃±0.2℃.10min
加酪蛋白溶液1.00mL(摇匀)
取出静置10min,过滤(慢速定性滤纸)+
取1.00mL滤液
加碳酸钠溶液5.0mL
加福林试剂使用溶液1.00mL
+40℃±0.2℃,显色20min
于680nm波长.用10mm比色Ⅲ测定吸光度加酪蛋白溶液1.00mL(摇匀)
*40℃±0.2℃,10min
加三氯乙酸2.00mL(摇匀)
GB 1886.174—2016
取出静置10min,过滤(慢速定性滤纸)取1.00mL滤液
加碳酸钠溶液5.0mL
加福林试剂使用溶液1.00mL
+40℃±0.2℃,显色20min
于680nm波长,用10mm比色Ⅲ测定吸光度注:枯草芽孢来源的中性蛋白酶制剂.除反应与显色温度为30℃士0.2℃外,其他操作同上标准曲线做同样处理A.4.7结果计算
从标准曲线上读出样品最终稀释液的酶活力,蛋白酶制剂的酶活力X,,单位为U/mL或U/g,按式(A.4)计算:
式中:
A, XViX4Xn
由标准曲线得出的样品最终稀释液的活力,单位为U/mL;溶解样品所使用的容量瓶的体积,单位为毫升(mL):反应试剂的总体积,单位为毫升(mL);样品的稀释倍数;
样品的质量,单位为克(g);
反应时间,单位为分钟(min)。所得结果表示至整数。
·(A4)
试验结果以平行测定结果的算术平均值为准。在重复性条件下获得的两次独立测定结果的绝对差值不大于算术平均值的3%。
A.5果胶酶活力的测定(黑曲需来源)A.5.1果胶酶
能水解果胶,生成含有还原性基团产物的酶。A.5.2果胶酶活力
在50℃、pH3.5的反应条件下,1g固体酶粉(或1mL液体酶),1h分解果胶产生1mg半乳糖醛酸,即为1个酶活力单位.以U/g或U/mL表示。A.5.3原理
果胶酶能水解果胶,生成的半乳糖醛酸的还原性糖醛基可用次亚碘酸法定量测定,以此来表示果胶酶的活性。
GB1886.174—2016
本方法主要用于检测果胶酶产品中多聚半乳糖醛酸酶和果胶裂解酶的活力,对于果胶酶中的果胶(甲基)酯酶不适用。
A.5.4试剂和材料
A.5.4.110g/L柑橘果胶溶液:称取果胶粉1.0000g(SigmaP9135或相当,精确至0.1mg),加水溶解,煮沸冷却,过滤。调整pH至3.5.用水定容至100mL,冰箱储存备用。使用时间不超过3天注:果胶底物对试验的影响大。如使用不同来源或批号的果胶粉,应与旧批次进行对照试验,A.5.4.2硫代硫酸钠标准溶液:c(NazS,O,)=0.05mol/L。碳酸钠标准溶液:c(
NazCO,)=2mol/L。
A.5.4.3在
碘标准溶液:c(()=0.1 mol/L。A.5.4.4
2mol/L硫酸溶液:取浓硫酸5.6mL,缓慢加人适量水中,冷却后用水定容至100mL,摇匀,备用A.5.4.52
可溶性淀粉指示液(10g/L)。
A.5.4.70.1mol/L柠檬酸-柠檬酸钠缓冲液(pH3.5):称取柠檬酸(C,HO·H,O)14.71g,柠檬酸三钠(C,H,NaO,:2H,O)8.82g,加950mL水溶解,调节pH至3.5.再用水定容至1000mL。A.5.5仪器和设备
比色管:25mL。
带加热装置的恒温水浴:控温精度士0.1℃。碘量瓶:250mL。
A.5.5.3石
滴定管:25mL。
A.5.6分析步骤
样品溶液的制备
用已知质量的50mL烧杯,称取1g~2g酶粉(精确至0.0001g)或准确吸取1.00mL,用少量柠檬酸-柠檬酸钠缓冲液充分溶解,并用玻璃棒捣研,将上清液小心倾入容量瓶中,若有剩余残渣,再加少量上述缓冲液充分研磨,最终样品全部移人容量瓶中,定容至刻度,摇匀。用四层纱布过滤,滤液待用,注:待测酶液需准确稀释至一定倍数,酶液浓度控制在消耗硫代硫酸钠标准溶液与空白消耗之差在0.5mL~1.0mL范围内。必要时可先做预备试验
A.5.6.2测定
于甲乙两支比色管中.分别加入5mL果胶溶液,置于50℃土0.2℃恒温水浴中预热8min;向甲管(空白)加入5mL柠檬酸-柠檬酸钠缓冲液;向乙管(样品)中加入1mL稀释酶液和4mL柠檬酸-柠檬酸钠缓冲液,立即摇匀,计时.准确反应30min后,立即取出,加热煮沸5min终止反应,冷却;取上述甲、乙管反应液各5mL放人碘量瓶中,准确加人4mL碳酸钠标准溶液和5ml碘标准溶液,摇匀,于暗处放置20min;取出,加人2mL硫酸溶液,用硫代硫酸钠标准溶液滴定至浅黄色,加淀粉指示液3滴,继续滴定至蓝色刚好消失为其终点,记录甲管、乙管反应液消耗硫代硫酸钠标准溶液的体积。同时做平行样品测定、A.5.7结果计算
果胶酶制剂的酶活力X:,单位为U/mL或U/g.按式(A.5)计算:X=(A:B.)Xc.×0.51×194.14×n×105X1X0.5
(A5)
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
GB1886.174—2016
食品安全国家标准
食品添加剂
2016-08-31发布
食品工业用酶制剂
2017-01-01实施
人民共和国
国家卫生和计划生育委员会
GB1886.174—2016
本标准代替GB25594一2010《食品安全国家标准食品工业用酶制剂》,GB8276—2006《食品添加剂糖化酶制剂》,GB20713—2006《食品添加剂α-乙酰乳酸脱酶制剂》,GB8275—2009《食品添加剂α-淀粉酶制剂》。
本标准与GB255942010相比,主要变化如下:增加了酶活力的术语和定义;
一增加了产品分类、理化要求;—在附录中给出了部分酶制剂的酶活力测定方法I
1范围
食品安全国家标准
食品添加剂
厂食品工业用酶制剂
本标准适用于GB2760允许使用的食品工业用酶制剂。2术语和定义
食品工业用酶制剂
GB1886.174—2016
由动物或植物的可食或非可食部分直接提取,或由传统或通过基因修饰的微生物(包括但不限于细菌、放线菌、真菌菌种)发酵、提取制得,用于食品加工,具有特殊催化功能的生物制品。注:商品化的酶制剂产品充许加入易于产品贮存、使用的配料成分2.2酶活力
酶在一定条件下催化某一特定反应的能力,即为酶活力,是表达酶制剂产品的一个特征性专属指标。
2.3抗菌活性
抑制或杀灭微生物的能力。
3产品分类
按产品形态分为固体剂型和液体剂型两类4技术要求
原料要求
4.1.1用于生产酶制剂的原料必须符合良好生产规范或相关要求,在正常使用条件下不应对最终食品产生有害健康的残留污染。
4.1.2来源于动物的酶制剂,其动物组织必须符合肉类检疫要求。4.1.3来源于植物的酶制剂,其植物组织不得霉变。4.1.4对微生物生产菌种应进行分类学和(或)遗传学的鉴定,并应符合有关规定。菌种的保藏方法和条件应保证发酵批次之间的稳定性和可重复性4.2
2产品要求
4.2.1理化指标
产品酶活力在标示值的85%~115%。1
GB 1886.174—2016
注:本标准附录A给出的酶活力测定方法供参考。企业可按相应标准中给出的或企业规定的方法测定。4.2.2
污染物限量
污染物限量应符合表1的规定。
铅(Pb)/(mg/kg)
总砷(以As计)/(mg/kg)
微生物指标
微生物指标应符合表2的规定。
菌落总数/(CFU/g或CFU/mL)
大肠菌群/(CFU/g或CFU/mL)
大肠埃希氏菌
CFU/g或CFU/mL
MPN/g或MPN/mL
沙门氏菌(25g或25mL)
污染物限量
微生物指标
不得检出
注:经基因重组技术得到的微生物生产的酶制剂不应检出生产菌。4.2.4
抗菌活性
微生物来源的酶制剂不得检出抗菌活性,抗菌活性按GB4789.43执行。检验方法
GB5009.75或GB5009.12
GB5009.11
检验方法
GB4789.38
A.1一般规定
附录A
酶活力测定方法
GB1886.174—2016
本标准所用试剂和水,在没有注明其他要求时,均指分析纯试剂和GB/T6682规定的三级水。试验中所用标准溶液、杂质标准溶液、制剂及制品,在没有注明其他要求时,均按GB/T601、GB/T602和GB/T603的规定制备。试验中所用溶液在未注明用何种溶剂配制时,均指水溶液。A.2α-淀粉酶活力的测定
A.2.1、α-淀粉酶
能水解淀粉分子链中的α-1,4葡萄糖苷键,将淀粉链切断成为短链糊精和少量麦芽糖和葡萄糖,使淀粉黏度迅速下降的酶。
A.2.2α-淀粉酶活力
A.2.2.1中温α-淀粉酶活力单位1g固体酶粉(或1mL液体酶),于60℃、pH6.0条件下.1h液化1g可溶性淀粉,即为1个酶活力单位,以U/g(U/mL)表尔。
A.2.2.2耐高温α-淀粉酶活力单位1g固体酶粉(或1mL液体酶),于70℃、pH6.0条件下,1min液化1mg可溶性淀粉,即为1个酶活力单位,以U/g(U/mL)表示。
A.2.3原理
α-淀粉酶制剂能将淀粉分子链中的α-1,4葡萄糖苷键随机切断成长短不一的短链糊精、少量麦芽糖和葡萄糖,而使淀粉对碘呈蓝紫色的特性反应逐渐消失,呈现棕红色,其颜色消失的速度与酶活性有关,据此可通过反应后的吸光度计算酶活力。A.2.4试剂和材料
A.2.4.1碘。
A.2.4.2碘化钾。
原碘液:称取11.0g碘和22.0g碘化钾,用少量水使碘完全溶解,定容至500mL,贮存于棕色瓶中。A.2.4.3
稀碘液:吸取原碘液2.00mL.加20.0.g碘化钾用水溶解并定容至500mL.贮存于棕色瓶中A.2.4.4
A.2.4.5可溶性淀粉溶液(20g/L):称取2.000g(精确至0.001g)可溶性淀粉(以绝干计)于烧杯中,用少量水调成浆状物,边搅拌边缓缓加入70mL沸水中,然后用水分次冲洗装淀粉的烧杯,洗液倒入其中,搅拌加热至完全透明,冷却定容至100mL。溶液现配现用,注:可溶性淀粉应采用酶制剂分析专用淀粉。A.2.4.6磷酸缓冲液(pH6.0):称取45.23g磷酸氢二钠(NazHPO·12HzO)和8.07g柠檬酸(C,HO,H,O),用水溶解并定容至1000mL。用pH计校正后使用。3
盐酸溶液c(HCD)=0.1mol/L。
A.2.5仪器和设备
分光光度计。
恒温水浴:精度士0.1℃。
自动移液器。
试管:25mm×200mm。
A.2.5.5秒表。
A.2.6分析步骤
A.2.6.1待测酶液的制备
GB 1886.174—2016
称取试样1g~2g(精确至0.0001g)或准确吸取1.00mL,用少量磷酸缓冲液充分溶解,将上清液小心倾人容量瓶中,若有剩余残渣,再加少量磷酸缓冲液充分研磨,最终样品全部移入容量瓶中,用磷酸缓冲液定容至刻度,摇匀。用四层纱布过滤,滤液待用。注:待测中温α-淀粉酶酶液酶活力控制酶浓度在3.4U/ml4.5U/mL范围内,待测耐高温α-淀粉酶活力控制酶浓度在60U/mL~65U/mL范围内。
A.2.6.2测定
吸取20.0mL可溶性淀粉溶液于试管中,加人磷酸缓冲液5.00mL.摇匀后,置于60℃土0.2℃(耐高温α-淀粉酶制剂置于70℃土0.2℃)恒温水浴中预热8min;加入1.00mL稀释好的待测酶液,立即计时,摇勾,准确反应5min;b)
立即用自动移液器吸取1.00mL反应液,加到预先盛有0.5mL盐酸溶液和5.00mL稀碘液的试管c
中,摇匀,并以0.5mL盐酸溶液和5.00mL稀碘液为空白,于660nm波长下,用10mm比色血迅速测定其吸光度(A)。根据吸光度查表附录B,求得测试酶液的浓度。A.2.6.3结果计算
A.2.6.3.1
中温α-淀粉酶制剂的酶活力
中温α-淀粉酶制剂的酶活力X,单位为U/mL或U/g,按式(A1)计算:X=eXn
式中:
测试酶样浓度,单位为U/mL或U/g;n-样品的稀释倍数。
所得结果表示至整数。
(A.1)
试验结果以平行测定结果的算术平均值为准。在重复性条件下获得的两次独立测定结果的绝对差值不大于算术平均值的5%。
A.2.6.3.2耐高温α-淀粉酶制剂的酶活力耐高温α-淀粉酶制剂的酶活力X,,以U/mL或U/g计,按式(A.2)计算:X,= cXnX16.67
式中:
测试酶样的浓度,单位为U/mL或U/g;一样品的稀释倍数;
16.67一一根据酶活力定义计算的换算系数,所得结果表示至整数
GB1886.174—2016
试验结果以平行测定结果的算术平均值为准。在重复性条件下获得的两次独立测定结果的相对误差不得超过5%。
A.3葡糖淀粉酶(淀粉葡糖苷酶)活力的测定(黑曲霉及其变异株来源)A.3.1葡糖淀粉酶(淀粉葡糖苷酶)以淀粉为底物,在一定条件下从淀粉的非还原性末端开始水解α-1.4、α-1.6、α-1,3葡萄糖苷键产生葡萄糖的淀粉葡萄糖苷酶。
A.3.2葡糖淀粉酶(淀粉葡糖苷酶)活力1mL酶液或1g酶粉在40℃、pH4.6的条件下,1h水解可溶性淀粉产生1mg葡萄糖,即为一个酶活力单位,以U/mL(或U/g)表示。
A.3.3试剂和材料
A.3.3.10.05mol/L乙酸-乙酸钠缓冲溶液(pH4.6):称取乙酸钠(CH.COONa·3H,O)6.7g,吸取冰乙酸2.6mL,用水溶解并定容至1000mL。上述缓冲溶液的pH,应使用酸度计加以校正。A.3.3.20.05mol/L硫代硫酸钠标准滴定溶液,A.3.3.30.1mol/L碘标准溶液。
A.3.3.40.1mol/L氢氧化钠溶液
A.3.3.52mol/L硫酸溶液:吸取分析纯浓硫酸(相对密度1.84)5.6mL缓缓加人适量水中,冷却后,用水定容至100mL,摇匀。
A.3.3.6200g/L氢氧化钠溶液:称取氢氧化钠20g,用水溶解,并定容至100mL。20g/L可溶性淀粉溶液:称取可溶性淀粉2g士0.001g,然后用少量水调匀,缓缓倾入已沸腾的水中,A.3.3.72
煮沸、搅拌直至透明,冷却,用水定容至100mL。此溶液需当天配制,注:可溶性淀粉应采用酶制剂分析专用淀粉A.3.4仪器和设备
分析天平:精度0.2mg。
酸度计:精度0.01pH。
分析天平:精度0.2mg。
恒温水浴:40℃土0.1℃。
连续多档分配器(移液枪)。
磁力搅拌器
A.3.5分析步骤
待测酶液的制备
液体酶:使用连续多档分配器准确吸取适量酶样,移人容量瓶中,用缓冲溶液稀释至刻度,充分摇A.3.5.1.1
匀,待测。
A.3.5.1.2固体酶:用50mL小烧杯准确称取适量酶样,精确至1mg,用少量乙酸-乙酸钠缓冲溶液溶解,并用玻璃棒仔细捣研,将上层清液小心倾人适当的容量瓶中,在沉渣中再加入少量缓冲溶液,如此反复捣研3次~5
GB1886.174—2016
4次,取上清液,最后全部移人容量瓶中,用缓冲溶液定容,磁力搅拌30min以充分混匀,取上清液测定。注:1.制备待测酶液时,样液浓度应控制在滴定空白和样品时消耗0.05mol/L硫代硫酸钠标准滴定溶液的差值在4.5mL~5.5mL范围内(酶活力约为120U/mL~150U/mL)。2.液体酶根据产品特性也可称取.按克计算。A.3.5.2测定
取A,B两支50mL比色管,分别加人可溶性淀粉溶液25mL和乙酸-乙酸钠缓冲溶液5mL,摇勾。于40℃士0.2℃的恒温水浴中预热5min~10min。在B管中加人待测酶液2.0mL,立即记时,摇匀。在此温度下准确反应30min后,立即向A、B两管中各加氢氧化钠溶液0.2mL,摇匀.同时将两管取出,迅速用水冷却,并于A管中补加待测酶液2.0mL(作为空白对照)。吸取上述A,B两管中的反应液各5.0mL,分别于两个碘量瓶中,准确加入碘标准溶液0.0mL,再加氢氧化钠溶液15mL,边加边摇勾,并于暗处放置15min,取出。用水淋洗瓶盖,加人硫酸溶液2mL,用硫代硫酸钠标准滴定溶液滴定蓝紫色溶液,直至刚好无色为其终点,分别记录空白和样品消耗硫代硫酸钠标准滴定溶液的体积(A、B)。
A.3.6结果计算
葡糖淀粉酶制剂的酶活力X,单位为U/mL或U/g.按式(A.3)计算:(A-B)XciX90.05X32.2XnX2
式中:
滴定空白时,消耗硫代硫酸钠标准滴定溶液的体积,单位为毫升(mL);滴定样品时,消耗硫代硫酸钠标准滴定溶液的体积,单位为毫升(mL);硫代硫酸钠标准滴定溶液的准确浓度,单位为摩尔每升(mol/L);与1.00mL硫代硫酸钠标准溶液相当的葡萄糖的摩尔质量,g/mol(M一90.05);反应液的总体积,单位为毫升(mL);吸取反应液的体积;
折算成1mL酶液的量;下载标准就来标准下载网
稀释倍数;
反应30min.换算成1h的酶活力系数以样品测定结果的算术平均值表示,保留3位有效数字。......A3)
试验结果以平行测定结果的算术平均值为准。在重复性条件下获得的两次独立测定结果的绝对差值不大于算术平均值的10%。
蛋自酶活力的测定
A.4.1蛋白酶
能切断蛋白质分子内部的肽键,使蛋白质分子变成小分子多肽和氨基酸的酶。A.4.2蛋白酶活力
蛋白酶活力以蛋白酶活力单位表示,定义为1g或1mL酶,在一定温度和pH条件下,1min水解酪蛋白产生1μg酪氨酸.即为1个酶活力单位,以U/g(U/mL)表示。A.4.3原理
蛋白酶在一定的温度与pH条件下,水解酪蛋白底物,产生含有酚基的氨基酸(如:酪氨酸、色氨酸等),在6
GB1886.174—2016
碱性条件下,将福林试剂还原,生成钼蓝与钨蓝,用分光光度计于波长680nm下测定溶液的吸光度。酶活力与吸光度成比例,由此可以计算产品的酶活力,A.4.4试剂和材料
A.4.4.1福林试剂:于2000mL磨口回流装置中加入钨酸钠(NaWO·2H,O)100.0g、钼酸钠(NazMoO2H,O)25.0g、水700mL、85%磷酸50mL、浓盐酸100mL。小火沸腾回流10h,取下回流冷却器,在通风橱中加人硫酸锂(Li.SO,)50g、水50mL和数滴浓溴水(99%),再微沸15min,以除去多余的溴(冷后仍有绿色需再加溴水,再煮沸除去过量的溴),冷却,加水定容至1000mL。混勾.过滤。制得的试剂应呈金黄色,贮存于棕色瓶内。
福林使用溶液:一份福林试剂与二份水混合,摇匀。也可使用市售福林溶液配制。A.4.4.2
A.4.4.3石
碳酸钠溶液(42.4g/L):称取无水碳酸钠(NazCO,)42.4g,用水溶解并定容至1000mL。A.4.4.4
三氯乙酸(65.4g/L):称取三氯乙酸65.4g,用水溶解并定容至1000mL。氢氧化钠溶液(20g/L):称取氢氧化钠片剂20.0g,加水900mL并搅拌溶解。待溶液到室温后续水A.4.4.5
定容至1000mL,搅拌均匀。
A.4.4.6盐酸溶液:c(HCI)=1mol/L。A.4.4.7
盐酸溶液:c(HCI)=0.1mol/L。
A.4.4.8缓冲溶液。
以下各种缓冲溶液配制时需用pH计测定并调整pH。A.4.4.8.1磷酸缓冲液(pH=7.5.适用于中性蛋白酶制剂)。分别称取磷酸氢二钠(NaHPO.·12H,O)6.02g和磷酸二氢钠(NaH,PO,·2H,O)0.5g,加水溶解并定容至1000mL
A.4.4.8.2乳酸钠缓冲液(pH一3.0.适用于酸性蛋白酶制剂)。取乳酸(80%~90%)4.71g和乳酸钠(70%)0.89g,加水至900mL,搅拌至均匀。用乳酸或乳酸钠调整pH到3.0±0.05,定容至1000mL。A.4.4.8.3硼酸缓冲溶液(pH=10.5,适用于碱性蛋白酶制剂)。称硼酸钠9.54g,氢氧化钠1.60g,加水900mL,搅拌至均匀。用1mol/L盐酸溶液或0.5mol/L氢氧化钠溶液调整pH=10.5士0.05,定容至1000mL。A.4.4.9酪蛋白溶液(10.0g/L):称取标准酪蛋白(NICPBP国家药品标准物质)1.000g,精确到0.001g,用少量氢氧化钠溶液(若酸性蛋白酶制剂则用浓乳酸2滴~3滴)湿润后,加入相应的缓冲溶液约80mL,在沸水浴中加热煮沸30min,并不时搅拌至酪蛋白全部溶解。冷却到室温后转人100mL容量瓶中,用适宜的pH缓冲落液稀释至刻度。定容前检查并调整pH至相应缓冲液的规定值。此溶液在冰箱内贮存,有效期为3天。使用前重新确认并调整pH至规定值。注:不同来源或批号的酪蛋白对试验结果有影响。如使用不同的酪蛋白作为底物,使用前应与以上标准酪蛋白进行结果比对。
A4.4.9.1L-酪氨酸标准储备溶液(100ug/mL):精确称取预先于105℃干燥至恒重的L-酪氨酸0.1000g士0.0002g,用1mol/L盐酸溶液60mL溶解后定容至100mL,即为1mg/mL酪氨酸溶液。吸取1mg/mL酪氨酸溶液10.00mL,用0.1mol/L盐酸溶液定容至100mL,即得到100μg/mL的L-酪氨酸标准储备溶液。
注:除上述蛋白酶的溶解/稀释缓冲体系外,生产者和使用者还可以探讨使用其他适用的缓冲体系。A.4.5仪器和设备
分析天平:精度为0.0001g。
紫外-可见分光光度计。
A.4.5.3恒温水浴锅:精度士0.2℃。A.4.5.4pH计:精度为0.01pH单位。A.4.6分析步骤
标准曲线的绘制
标准曲线的绘制按如下操作:
a)L-酪氨酸标准溶液:按表A1配制。表A.1L-酪氨酸标准溶液
酪氨酸标准溶液的浓度
1ag/mL
酪氨酸标准储备溶液的体积
GB1886.174—2016
加水的体积
分别取上述溶液各1.00mL(应做平行试验),各加碳酸钠溶液5.00mL、福林试剂使用溶液1.00mL,b)
振荡均匀,置于40℃土0.2℃水浴中显色20min,取出,用分光光度计于波长680nm,10mm比色皿,以不含酪氨酸的0管为空白,分别测定其吸光度。以吸光度A为纵坐标,酪氨酸的浓度为横坐标,绘制标准曲线。
c)利用回归方程,计算出当吸光度为1时的酪氨酸的量(ug),即为吸光常数K值。其K值应在95~100范围内。如不符合,需重新配制试剂,进行试验。注:L-酪氨酸稀释液应在稀释后立即进行测定。A.4.6.2待测酶液的制备
称取酶样品1g~2g,精确至0.0002g。然后用相应的缓冲液溶解并稀释到一定浓度,推荐浓度范围为酶活力10U/mL~15U/mL。
对于粉状的样品,可以用相应的缓冲液充分溶解,然后取滤液(慢速定性滤纸)稀释至适当浓度。A.4.6.3测定
按如下进行测定:
a)先将酪蛋白溶液放人40℃士0.2℃恒温水浴中,预热5min;b)按下列程序操作:
试管A(空白)
加酶液1.00mL
40℃±0.2℃.2min
试管B(酶试样,需作三个平行试样)→
加酶液1.00ml
+40℃±0.2℃,2min
加三氯乙酸2.00mL(摇勺)
40℃±0.2℃.10min
加酪蛋白溶液1.00mL(摇匀)
取出静置10min,过滤(慢速定性滤纸)+
取1.00mL滤液
加碳酸钠溶液5.0mL
加福林试剂使用溶液1.00mL
+40℃±0.2℃,显色20min
于680nm波长.用10mm比色Ⅲ测定吸光度加酪蛋白溶液1.00mL(摇匀)
*40℃±0.2℃,10min
加三氯乙酸2.00mL(摇匀)
GB 1886.174—2016
取出静置10min,过滤(慢速定性滤纸)取1.00mL滤液
加碳酸钠溶液5.0mL
加福林试剂使用溶液1.00mL
+40℃±0.2℃,显色20min
于680nm波长,用10mm比色Ⅲ测定吸光度注:枯草芽孢来源的中性蛋白酶制剂.除反应与显色温度为30℃士0.2℃外,其他操作同上标准曲线做同样处理A.4.7结果计算
从标准曲线上读出样品最终稀释液的酶活力,蛋白酶制剂的酶活力X,,单位为U/mL或U/g,按式(A.4)计算:
式中:
A, XViX4Xn
由标准曲线得出的样品最终稀释液的活力,单位为U/mL;溶解样品所使用的容量瓶的体积,单位为毫升(mL):反应试剂的总体积,单位为毫升(mL);样品的稀释倍数;
样品的质量,单位为克(g);
反应时间,单位为分钟(min)。所得结果表示至整数。
·(A4)
试验结果以平行测定结果的算术平均值为准。在重复性条件下获得的两次独立测定结果的绝对差值不大于算术平均值的3%。
A.5果胶酶活力的测定(黑曲需来源)A.5.1果胶酶
能水解果胶,生成含有还原性基团产物的酶。A.5.2果胶酶活力
在50℃、pH3.5的反应条件下,1g固体酶粉(或1mL液体酶),1h分解果胶产生1mg半乳糖醛酸,即为1个酶活力单位.以U/g或U/mL表示。A.5.3原理
果胶酶能水解果胶,生成的半乳糖醛酸的还原性糖醛基可用次亚碘酸法定量测定,以此来表示果胶酶的活性。
GB1886.174—2016
本方法主要用于检测果胶酶产品中多聚半乳糖醛酸酶和果胶裂解酶的活力,对于果胶酶中的果胶(甲基)酯酶不适用。
A.5.4试剂和材料
A.5.4.110g/L柑橘果胶溶液:称取果胶粉1.0000g(SigmaP9135或相当,精确至0.1mg),加水溶解,煮沸冷却,过滤。调整pH至3.5.用水定容至100mL,冰箱储存备用。使用时间不超过3天注:果胶底物对试验的影响大。如使用不同来源或批号的果胶粉,应与旧批次进行对照试验,A.5.4.2硫代硫酸钠标准溶液:c(NazS,O,)=0.05mol/L。碳酸钠标准溶液:c(
NazCO,)=2mol/L。
A.5.4.3在
碘标准溶液:c(()=0.1 mol/L。A.5.4.4
2mol/L硫酸溶液:取浓硫酸5.6mL,缓慢加人适量水中,冷却后用水定容至100mL,摇匀,备用A.5.4.52
可溶性淀粉指示液(10g/L)。
A.5.4.70.1mol/L柠檬酸-柠檬酸钠缓冲液(pH3.5):称取柠檬酸(C,HO·H,O)14.71g,柠檬酸三钠(C,H,NaO,:2H,O)8.82g,加950mL水溶解,调节pH至3.5.再用水定容至1000mL。A.5.5仪器和设备
比色管:25mL。
带加热装置的恒温水浴:控温精度士0.1℃。碘量瓶:250mL。
A.5.5.3石
滴定管:25mL。
A.5.6分析步骤
样品溶液的制备
用已知质量的50mL烧杯,称取1g~2g酶粉(精确至0.0001g)或准确吸取1.00mL,用少量柠檬酸-柠檬酸钠缓冲液充分溶解,并用玻璃棒捣研,将上清液小心倾入容量瓶中,若有剩余残渣,再加少量上述缓冲液充分研磨,最终样品全部移人容量瓶中,定容至刻度,摇匀。用四层纱布过滤,滤液待用,注:待测酶液需准确稀释至一定倍数,酶液浓度控制在消耗硫代硫酸钠标准溶液与空白消耗之差在0.5mL~1.0mL范围内。必要时可先做预备试验
A.5.6.2测定
于甲乙两支比色管中.分别加入5mL果胶溶液,置于50℃土0.2℃恒温水浴中预热8min;向甲管(空白)加入5mL柠檬酸-柠檬酸钠缓冲液;向乙管(样品)中加入1mL稀释酶液和4mL柠檬酸-柠檬酸钠缓冲液,立即摇匀,计时.准确反应30min后,立即取出,加热煮沸5min终止反应,冷却;取上述甲、乙管反应液各5mL放人碘量瓶中,准确加人4mL碳酸钠标准溶液和5ml碘标准溶液,摇匀,于暗处放置20min;取出,加人2mL硫酸溶液,用硫代硫酸钠标准溶液滴定至浅黄色,加淀粉指示液3滴,继续滴定至蓝色刚好消失为其终点,记录甲管、乙管反应液消耗硫代硫酸钠标准溶液的体积。同时做平行样品测定、A.5.7结果计算
果胶酶制剂的酶活力X:,单位为U/mL或U/g.按式(A.5)计算:X=(A:B.)Xc.×0.51×194.14×n×105X1X0.5
(A5)
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。