GB 8369-1998
基本信息
标准号: GB 8369-1998
中文名称:一次性使用输血器
标准类别:国家标准(GB)
英文名称: Disposable blood transfusion set
标准状态:已作废
发布日期:1998-01-01
实施日期:1999-02-01
作废日期:2006-07-01
出版语种:简体中文
下载格式:.rar.pdf
下载大小:343016

标准分类号
标准ICS号:医药卫生技术>>医疗设备>>11.040.20输血、输液和注射设备
中标分类号:医药、卫生、劳动保护>>医疗器械>>C31一般与显微外科器械
出版信息
出版社:中国标准出版社
书号:155066.1-15511
标准价格:12.0 元
出版日期:2004-04-05
相关单位信息
复审日期:2004-10-14
起草单位:国家医药管理局医用高分子产品质量检测中心
标准简介
本标准规定了一次性使用输血器的要求,以保证与血液或血制品容器和静脉器具相适应。本标准还规定了用于硬质血液及血液成分容器的进气器件的要求。本标准为输血器所用材料的性能及其质量规范提供了指南,并给出输血器组件的标记。 GB 8369-1998 一次性使用输血器 GB8369-1998 标准下载解压密码:www.bzxz.net
标准图片预览




标准内容
GB8369--1998
本标准等效采用ISO1135-4:1998《医用输血器具第4部分:--次性使用输血器》。向时也是GB8369--93的修订版。
本标准与IS1135-4:1998的主要技术差异如下:本标准增加了空气过滤器的滤除率、软管壁厚与外径、流量调节器调节行程、环氧乙烷残留量等技术指标;化学要求中酸碱度检验国际标准是采用滴定法,而本标准是采用酸度计法;增加了附录H检验规则。
本标准与GB8369-93的主要技术差异如下:物理要求方面,对微粒污染、密封性、瓶塞穿刺器、空气过滤器、软管尺寸、滴斗、流量调节器、注射件、保护套、外圆锥接头等要求都有所改变;化学要求方面,试验方法由参照采用改为等效采用国际标准,因此技术指标相应有了很大的改变,试验项目取消了氯化物,增加了含量的测定和紫外吸光度等:在包装标志方面过做了一的改动。本标准的这次修订,将YY0029—90一次性使用输血器用血液过滤网》、YY/T0142--9.1《--次性使用输液、输血器具用空气过滤器》的有关内容并入到本标准中。本标准自实施之日起代替GB8369~-93。YY0029—90和YY/T0142—94同时废止。本标准的附录 A、附录B、附录 C、附录D、附录 E、附录F、附录 G和附录H都是标准的附录。本标的附录J是提示的附录。
本标准由国家药品监督管理局提出。本标准由全国医用输液器具标准化技术委员会归口。本标准起草单位:国家医药管理局医用高分子产品质量检测中心。本标准主要起草人:吴平、骆红宇、王延伟、秦冬立、宋金子。本标准于1987年首次发布。
GB 8369--1998
ISO前言
ISO(国际标准化组织)是由各国标准化团体(ISO成员团体)组成的世界性的联合会。制定国际标的工作通常由ISO的技术委员会完成,各成员团体若对某技术委员会已确立的标推项目感兴趣,均有权参加该委员会的工作。与ISO保持联系的各国际组织(官方的或非官方的)也可参加有关工作。在电工技术标准化方面IS)与国际电工委员会(IEC)保持密切合作关系。由技术委员会正式通过的国际标准草案提交各成员团体表决,国际标准需取得至少75%参加表决的成员团体的同意才能正式通过国际标准ISO1135-4是由ISO/TC76国际标准化组织医用输血、输液和注射器具技术委员会制定的。
本版本是第二版,替代第版(ISO1135-4:1987)。ISO1135的总题目是医用输血器具,由下列部分组成:第1部分:玻璃输血瓶、瓶塞和瓶盖第3部分:采器
第4部分:---次性使用输班器
附录A、附录B、附录C、附录D、附录E和附录F是标准的组成部分,附录G、附录H和附录J仪供参考。
1范围
中华人民共和国国家标准
一次性使用输血器
Transfusion sets for single useGB8369.. 1998
eqvIs01135-4:1998
代替 GB 836993
本标准规定了-次性使用输血器的要求,以保证与血液或血制品容器和静脉器具相适应。本标准还规定了用于硬质血液及血液成分容器的进气器件的要求。本标准为输血器所用材料的性能及其质量规范提供了指南,并给出输血器组件的标记。2引用标准
下列标准所包含的条文,通过在本标准中引用而构成为本标准的条文。本标准出版时,所示版本均为有效,所有标准都会被修订,使用本标准的各方应探讨使用下列标准最新版本的可能性。GH1962--1995注射器、注射针及其他医疗器械6:100圆锥接头(cqVISO594-1:1996)GB2828一87逐批检查计数抽样程序及抽样表(适用于连续批的检查)(R8368—1998-次性使用输液器(eqvISO8536-4:1998)G3/T14233.1--1998医用输液、输血、注射器具检验方法第--部分:化学分析方法GB/T14233.2-93医用输液、输血、注射器具检验方法第部分:生物试验方法GB/T14437--93产品质量计数一次监督抽样检验程序(适用于总体量较大的情形)GB 15811—1995
-次性使用无菌注射针(neqIS)7864:1993)GB/T16886.1-1997医疗器械生物学评价第1部分:试验选择指南(idtIS0)10993-1:1992)YY/T0313—1998医用高分子产品包装、标志,运输和贮存IS()94-2:1991注射器、注射针及其他医疗器械6%(鲁尔)圆锥接头第二部分:锁定锥头3通用要求
3.1输血器组件名称
输血器组件的名称如图1所示,用于血液及血液成分硬质容器的进气器件如图2所示。注:图1、图2列举了输血器和分离式进气器件的结构,只要能达到相同效果,也可采用其他结构,3.2无菌的保持
输血器应有保护套.使输血器内腔在使用前保持无菌。进气器件的瓶塞穿刺器或穿刺针应有保护套。
3.3标记
3.3.1输血器
符合本标准要求的输血器的标记示例如下:输血器GB8369TS
3.3.2进气器件
符合本标准要求的进气器件的标记示例如下:进气器件GB8369AD
国家质量技术监督局1998.11~26批准382
1999-02-01实施
GB 8369-1998
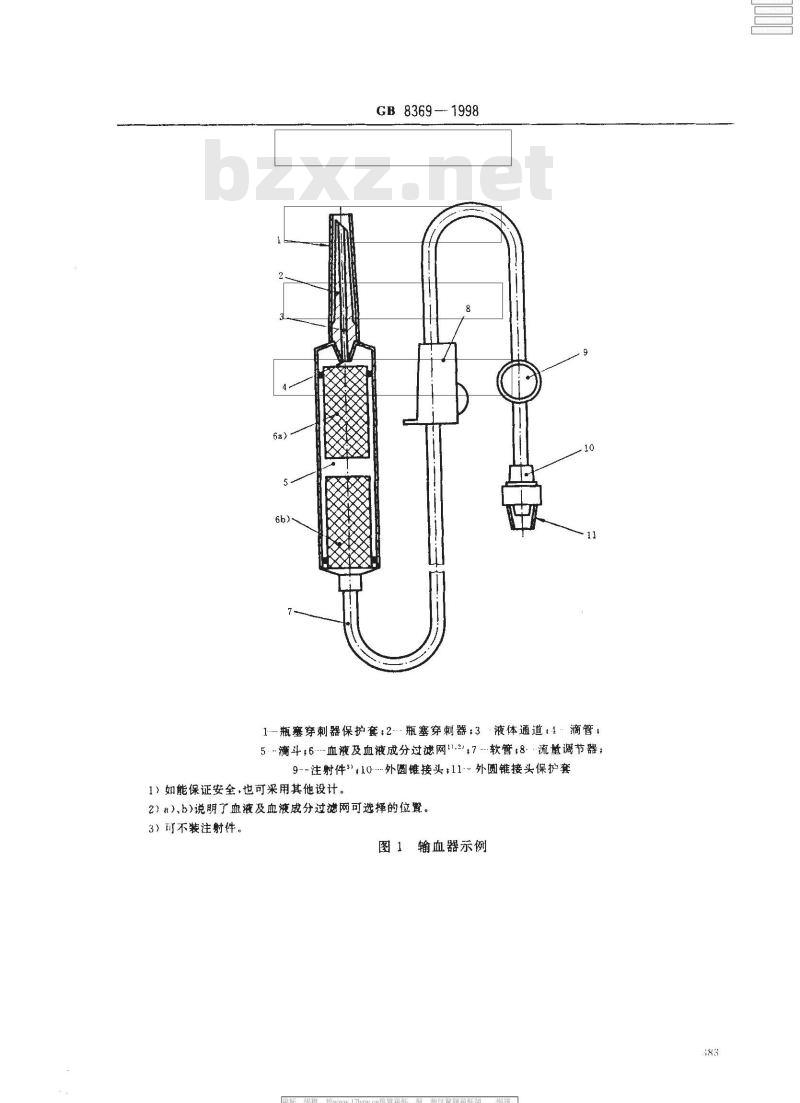
1--瓶塞穿刺器保护套:2瓶塞穿刺器3·液体通道:1·滴管,5滴斗;6--血液及血液成分过滤网.*;7-软管:8.流量调节器;9-注射件10外圆锥接头;11·外圆锥接头保护套1)如能保证安全,也可采用其他设计。2)a)、b)说明了血液及血液成分过滤网可选择的位置。3)可不装注射件,
图1输血器示例
GB83691998
1保护套;2瓶塞穿刺器或穿刺针;3软管\;4夹具\5带空气过滤器的进气口1)如能保证安全,也可采用其他设计。图2进气器件示例
4材料
制造第3章给出的输血器及其组件的材料应满足第5章规定的要求。输血器与血液和血液成分接触的组件,还应符舍第6章和第7章规定的要求。注:输血器用聚筑乙烯原材料的标准见GB15593。5物理要求
5.1微粒污染
按附录F或其他等效方法测定,200mL洗脱液中,15μm~25μm的微粒数不得超过1个/ml;大于25μm的微粒数不得超过0.5个/mL。5.2密封性
当按照附录A试验时,应无气体泄漏现象。5.3连接强度
输血器各组件间的连接,不包括保护套,应能承受不小于15N的静拉力,持续15s。5.4瓶塞穿刺器
5.4.1瓶寒穿刺器的尺寸应符合图3所示。注:金属穿刺器不受图3尺寸限制。5.4.2瓶塞穿刺器和进气器件(如果使用)应能刺透未穿刺过的血液及血液成分用容器的瓶塞,上不会引起落屑。
5.5进气器件
GB 8369 - 1998
图3瓶塞穿刺器尺
5.5.1进气器件应符合3.2和7.2的要求。尺寸:mm
5.5.2进气器件应有空气过滤器,以防止微生物进入它所插入的容器,当按附录B试验时.空气过滤器对空气中0.5um以上微粒的滤除率应不小于90%\。5.5.3进气器件应与输血器的瓶塞穿刺器分离。5.5.4如果进气器件的-一端通过一软管与空气过滤器连接,管长应不短于250mm。5.5.5空气过滤器的安装应使所有进入硬质容器的空气都通过它。按附录B试验时,相对自由进气容器的流出液的流量应不降低20%。5.6软管
5.6.1由软质材料制成的管子应塑化均勾,并透明或足够透明,当有气泡通过时,用正常或矫正视力可以发现水和空气的分界面。
5.6.2末端至滴斗的软管[包括注射座(如果有)和外圆锥接头7长度不小于1500mm5.6.3软管壁厚应大于0.5mm,外径应不小于4.0mm。5.7血液及血液成分过滤器
输血器应有--血液及血液成分过滤器,过滤器网孔应均匀,总面积不小于10cm。当按附录C试验时,过滤器上的干燥残渣不少于标准过滤器上的80%(m/m)。5.8滴斗与滴管
5.8.1滴斗应可以连续观察液滴。液体应经过一-插入滴斗的滴管进入滴斗。滴管的端部至滴斗出口的距离应不小于40mm,或滴管和血液及血液成分过滤网间的距离应不小于20mm。滴斗壁与滴管终端的外壁间的距离应不小于5mm。在23℃±2℃,流速为50滴/min士10滴/min的条件下,滴管滴下20滴蒸馏水应为1 mL±0.1mL(1g士0.1g)。5.8.2滴斗应能借助其弹性将输血容器中血液引入输血器。5.9流量调节器
流量调节器应能调节血液及血液成分的液流从零至最大,其调节行程应不小于30mm。注:流量调节器应能在一-次输血中持续使用而不损伤软管。流量调节器和软管接触在--起贮存时不应产生有害反应。
5.10血液及血液成分的流速bzxZ.net
输血器在1m静压头下,在温23℃土2℃下,30min内应能输出不少于1000ml.的血液。在高于大汽压强30kPa的压力下,2min内还应能输出不少于500ml的血液。采用说明:
11、2]、33ISO)1135-4:1998无此项技术指标。365
GB8369--1998
血液应采集到合适的抗凝剂中,贮存不少于2周且无大血块注:试验可以用400g/1.的葡萄糖水溶液代替血液45.11注射件
如有注射件,按附录1)试验时,水的泄漏量应不超过一滴。注:注射座宜位于外圆锥接头附近。5.12外圆锥接头
软管的末端应有符合GB1962或IS594-2的外圆锥接头。5.13保护套
输血器终端的保护套应保持瓶塞穿刺器、外圆锥接头和输血器内表面无菌。保护套不应自然脱落、并易于拆除。6化学要求
6.1还原物质(易氧化物)
按附录E试验时,检验液和空白液消耗高锰酸钾溶液[c(KMnO,)=0.002mol/L7的体积之差应不超过 2. 0 ml
6.2金属离子
当按E3.1用源子吸收分光光度法(AAS)或相当的方法进行测定时、检验液中锁、铬、铜、沿、锡的总含量应不超过1μg/mL。镉的含量应不超过0.1ug/mL。当按E3.2试验时,试验液呈现的颜色应不超过质量浓度p(Pb2+)=1μg/ml.的标准对照液。6.3酸碱度5
按附录E试验时,检验液与空白液pH值之差应不超过1.5。6.4蒸发残渣
按附录E试验时,蒸发残渣的总量应不超过2mg。6.5紫外吸光度
按附录E试验时,检验液的吸光度应不大于0.1。6.6环氧乙烷残留量)
按(GB/T14233.1试验时,每套输血器环氧乙烷残留量应不大于0.5mg。7生物要求
7.1总则
输血器应不释放出任何对患者产生副作用的物质。应用适宜的试验来评价输血器材料的毒性,试验结果应表明无毒性。GB/T16886.1给出了毒性试验指南。7.2无菌
单包装内的输血器和/或进气器件应经过一有效的灭菌过程使产品无菌。附录(给出了无菌试验方法。
7.3热原
应用适当的试验来评价输逝器和/或进气器件的致热性,结果应表明输血器无热原。附录(给出了热原试验方法。
采用说明:
1IS0)1135-4:1998无此项规定。51IS)1135-4:1998是用滴定法。61IS))1135-4:1998是5mg
71150)1135-4:1998元此项技术指标。386
GB 8369—1998
应评价输血器无溶血成分,试验结果应表明输血器无溶班反应。GB/T14233.2给出了游血试验方法。
7.5急性全身毒性
应评价输血器急性全身毒性作用,试验结果应明输血器无急性全身毒性。GB/T14233.2给出了急性全身毒性试验方法,
8标志
8.1单包装
单包装上应至少标有下列信息:a)文字说明内装物;
b)使用YY/T0313中给出的图形符号,标明输血器无菌;c)输血器无热原;
d)输血器和/或进气器件仅供一次性使用,或同等说明;注:可另外给出符合YY/T0313的“一次性使用”图形符号。e)使用说明,包括检查包装密封完整性和有关保护套脱落情况的警示;注:使用说明也可采用插负形式。{)批号,以\批”字开头,
g)失效年月(必须能清晰识别);h)制造商和/或经销商名称和地址:i)滴管滴出20滴蒸馏水相当于1mL±0.1mL(1g土0.1g)的说明;j)如配静脉针,应注明规格。
8.2中包装
中包装上应至少有下列信息:
a)文字说明内装物;
b)输血器数量;
c)使用YY/T0313中给出的图形符号,标明输血器无菌;d)批号,以“批\字开头;
e)失效年月;
1)制造商和/或经销商名称和地址:g)推荐的贮存条件(如果有)。8.3外包装
外包装上信息应符合YY/T0313。9包装
9.1输血器和/或进气器件应单件包装,以使其在贮存期内保持无菌。单包装打开后应留有打开过的迹象。9.2输血器和/或进气器件的包装和灭菌应使其在备用时无扁瘾或打折。9.3单包装内不应有肉眼可见异物。387
GB 8369—1998
附录A
(标准的附录)
密封性试验
输血器-端封口,漫入20℃~30(的水中,通大高于大气压强50kPa的气压2min。检查输血器漏气的迹象。
附录B
(标准的附录)
空气过滤器滤除率、流量降低率试验方法同B8368—1998附录B
附录C
(标推的附录)
血液及血液成分过滤器效率试验C1原理
使·定体积的已过滤的贮备血液流过供试过滤器和标准过滤器,比较两种过滤器滤除物的质量。C2标准过滤器
标准过滤器应用聚酰胺6-6单丝编织而成,单丝直径为100μm土10um,单经单纬,孔径为200umt:20 μm.
C3步骤
准备抗凝的同种AB30)血型人体全血,贮存不少于2周,从其容器中通过一孔径为2250μm粗过滤[网注人…41的容器中,使血液充分混匀。让容器中的血液在重力作用下,流经过滤材料各800mL,使过滤器多余的血液流尽,在60土2(的烘箱内和约0.65kPa(6.5mbar)的压力下,使过滤材料干燥至基本恒重。C3.1万法A(用于过滤材料)
从标准过滤材料和供试过滤材料上各剪取两片直径为40mm的圆形材料,试验时将片过滤材料固定到能使过滤材料的全部表面都被血液覆盖的试验装貿上。C3.2“方法B(用于过滤器组件)标准过滤器组件应有底端封口、面积为32cm2的标准过滤材料,过滤材料应装在·-·底部有出的塑料过滤斗之中,滤斗的出口是一每20滴蒸馏水为1mL的标准滴管,进液管伸入到滤斗,[图C1示出了适用的标准过滤器组件。试验步骤按C3进行。注:方法A和法B任选,
C4结果表示
供试滤器(材)相对于标准滤器(材)滤除固体物质的质盐百分数由式(C1)给出:388
式中:mr。
GB8369
mti— mra
一液通过前供试过滤器(材)的质量;一血液通过后供试过滤器(材)的质量;一班液通过前标准过滤器(材)的质量:mk——血液通过后标准过滤器(材)的质量。1998
1进液管2·滤斗,3--标准过滤网;4-过滤网固定装置;5滤斗出口处20滴/ml,的滴管
图 C1标准过滤器组件
附录D
(标准的附录)
注射件自密封性试验
同GB8368-1998附录D。
(C1)
F1试验液制备
GB 8369—1998
附录E
(标准的附录)
溶出物化学分析
按GB/T14233.1-1998中规定制备检验液(按表1方法~)。还原物质(易氧化物)试验
按GB/T14233.1-1998中5.2.2方法规定进行E3金属离子试验
E3.1原于吸收:按GB/T14233.1-1998中5.9.1规定进行E3.2比色:按GB/T14233.1-1998中5.6.1方法规定进行。E4酸碱度试验
按GB3/T11233.1-1998中5.4.1方法-规定进行,F5蒸发残渣试验
按(GB3/T14233.1--1998中规定进行。E6紫外吸光度试验
按(:13,T14233.1~1998中规定在250nm~320nm波长范用内进行。附录F
(标准的附录)
微粒含量测定方法
间G8368--1998附录F
附录G
(标准的附录)
无菌、热原试验及生物学评价试验G1(G1BT14233.2中1规楚了无菌、热原试验注:(B,T14233,2同时还规定了细菌内毒索试验方法。G2(13/T16886.1描述的生物学评价试验方法应作为材料生物相容性评价的指南。注:(小15593规笼「聚氟乙烯材料生物相容性试验。H1·型式检验
H1.1在下列情况下应进行型式检验:GB8369-1998
附录H
(标准的附录)
检验规则
a)新产品投产、材料来源或配方改变时;b)结构、关键零配件、工艺有重大改变时;c)连续生产中每年不少于两次;d)停产整顿恢复生产时;
e)每一原料批制成的产品
f)合同规定或管理部门要求时。H1.2型式检验为全性能检验。在a)情况下,还应对所选用的聚氯乙烯材料进行全面的生物学评价。H1.3,型式检验时,第5章、第8.1条和第9章规定的各项要求若无特殊规定,各随机抽检5套。如果配有静脉针,其相应产品标准规定的所有物理要求各随机抽检5套。H1.4所有型式检验项目均合格,则通过型式检验。型式检验未通过时,不得进行批量生产。H2出厂检验
H2.1出厂检验按GB2828规定逐批进行检验,合格后方可出厂。H2.2以同种输血器日产量组成生产批。H2.3出厂检验的物理要求项目(计数项目)、不合格分类、检查水平(IL)和合格质量水平(AQL)按表H1规定。
检验项目
微粒污染
密封性
连接强度
瓶塞穿刺器
进气器件
H2.4每一生产批还应检验还原物质(6.1)、酸碱度(6.3)、紫外吸光度(6.5)和热原(7.3)。H2.5同一·灭菌过程的产品组成灭菌批,每一灭菌批应用有效的方法监测灭菌效果(7.2)。用环氧乙烷灭菌的产品,灭菌后环氧乙烷残留量控制在低于规定值(6.6)后方可出厂。H3国家监督抽查
按GB/T14437规定进行。
采用说明:
8]IS)1135-4:1998无检验规则。391
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
本标准等效采用ISO1135-4:1998《医用输血器具第4部分:--次性使用输血器》。向时也是GB8369--93的修订版。
本标准与IS1135-4:1998的主要技术差异如下:本标准增加了空气过滤器的滤除率、软管壁厚与外径、流量调节器调节行程、环氧乙烷残留量等技术指标;化学要求中酸碱度检验国际标准是采用滴定法,而本标准是采用酸度计法;增加了附录H检验规则。
本标准与GB8369-93的主要技术差异如下:物理要求方面,对微粒污染、密封性、瓶塞穿刺器、空气过滤器、软管尺寸、滴斗、流量调节器、注射件、保护套、外圆锥接头等要求都有所改变;化学要求方面,试验方法由参照采用改为等效采用国际标准,因此技术指标相应有了很大的改变,试验项目取消了氯化物,增加了含量的测定和紫外吸光度等:在包装标志方面过做了一的改动。本标准的这次修订,将YY0029—90一次性使用输血器用血液过滤网》、YY/T0142--9.1《--次性使用输液、输血器具用空气过滤器》的有关内容并入到本标准中。本标准自实施之日起代替GB8369~-93。YY0029—90和YY/T0142—94同时废止。本标准的附录 A、附录B、附录 C、附录D、附录 E、附录F、附录 G和附录H都是标准的附录。本标的附录J是提示的附录。
本标准由国家药品监督管理局提出。本标准由全国医用输液器具标准化技术委员会归口。本标准起草单位:国家医药管理局医用高分子产品质量检测中心。本标准主要起草人:吴平、骆红宇、王延伟、秦冬立、宋金子。本标准于1987年首次发布。
GB 8369--1998
ISO前言
ISO(国际标准化组织)是由各国标准化团体(ISO成员团体)组成的世界性的联合会。制定国际标的工作通常由ISO的技术委员会完成,各成员团体若对某技术委员会已确立的标推项目感兴趣,均有权参加该委员会的工作。与ISO保持联系的各国际组织(官方的或非官方的)也可参加有关工作。在电工技术标准化方面IS)与国际电工委员会(IEC)保持密切合作关系。由技术委员会正式通过的国际标准草案提交各成员团体表决,国际标准需取得至少75%参加表决的成员团体的同意才能正式通过国际标准ISO1135-4是由ISO/TC76国际标准化组织医用输血、输液和注射器具技术委员会制定的。
本版本是第二版,替代第版(ISO1135-4:1987)。ISO1135的总题目是医用输血器具,由下列部分组成:第1部分:玻璃输血瓶、瓶塞和瓶盖第3部分:采器
第4部分:---次性使用输班器
附录A、附录B、附录C、附录D、附录E和附录F是标准的组成部分,附录G、附录H和附录J仪供参考。
1范围
中华人民共和国国家标准
一次性使用输血器
Transfusion sets for single useGB8369.. 1998
eqvIs01135-4:1998
代替 GB 836993
本标准规定了-次性使用输血器的要求,以保证与血液或血制品容器和静脉器具相适应。本标准还规定了用于硬质血液及血液成分容器的进气器件的要求。本标准为输血器所用材料的性能及其质量规范提供了指南,并给出输血器组件的标记。2引用标准
下列标准所包含的条文,通过在本标准中引用而构成为本标准的条文。本标准出版时,所示版本均为有效,所有标准都会被修订,使用本标准的各方应探讨使用下列标准最新版本的可能性。GH1962--1995注射器、注射针及其他医疗器械6:100圆锥接头(cqVISO594-1:1996)GB2828一87逐批检查计数抽样程序及抽样表(适用于连续批的检查)(R8368—1998-次性使用输液器(eqvISO8536-4:1998)G3/T14233.1--1998医用输液、输血、注射器具检验方法第--部分:化学分析方法GB/T14233.2-93医用输液、输血、注射器具检验方法第部分:生物试验方法GB/T14437--93产品质量计数一次监督抽样检验程序(适用于总体量较大的情形)GB 15811—1995
-次性使用无菌注射针(neqIS)7864:1993)GB/T16886.1-1997医疗器械生物学评价第1部分:试验选择指南(idtIS0)10993-1:1992)YY/T0313—1998医用高分子产品包装、标志,运输和贮存IS()94-2:1991注射器、注射针及其他医疗器械6%(鲁尔)圆锥接头第二部分:锁定锥头3通用要求
3.1输血器组件名称
输血器组件的名称如图1所示,用于血液及血液成分硬质容器的进气器件如图2所示。注:图1、图2列举了输血器和分离式进气器件的结构,只要能达到相同效果,也可采用其他结构,3.2无菌的保持
输血器应有保护套.使输血器内腔在使用前保持无菌。进气器件的瓶塞穿刺器或穿刺针应有保护套。
3.3标记
3.3.1输血器
符合本标准要求的输血器的标记示例如下:输血器GB8369TS
3.3.2进气器件
符合本标准要求的进气器件的标记示例如下:进气器件GB8369AD
国家质量技术监督局1998.11~26批准382
1999-02-01实施
GB 8369-1998
1--瓶塞穿刺器保护套:2瓶塞穿刺器3·液体通道:1·滴管,5滴斗;6--血液及血液成分过滤网.*;7-软管:8.流量调节器;9-注射件10外圆锥接头;11·外圆锥接头保护套1)如能保证安全,也可采用其他设计。2)a)、b)说明了血液及血液成分过滤网可选择的位置。3)可不装注射件,
图1输血器示例
GB83691998
1保护套;2瓶塞穿刺器或穿刺针;3软管\;4夹具\5带空气过滤器的进气口1)如能保证安全,也可采用其他设计。图2进气器件示例
4材料
制造第3章给出的输血器及其组件的材料应满足第5章规定的要求。输血器与血液和血液成分接触的组件,还应符舍第6章和第7章规定的要求。注:输血器用聚筑乙烯原材料的标准见GB15593。5物理要求
5.1微粒污染
按附录F或其他等效方法测定,200mL洗脱液中,15μm~25μm的微粒数不得超过1个/ml;大于25μm的微粒数不得超过0.5个/mL。5.2密封性
当按照附录A试验时,应无气体泄漏现象。5.3连接强度
输血器各组件间的连接,不包括保护套,应能承受不小于15N的静拉力,持续15s。5.4瓶塞穿刺器
5.4.1瓶寒穿刺器的尺寸应符合图3所示。注:金属穿刺器不受图3尺寸限制。5.4.2瓶塞穿刺器和进气器件(如果使用)应能刺透未穿刺过的血液及血液成分用容器的瓶塞,上不会引起落屑。
5.5进气器件
GB 8369 - 1998
图3瓶塞穿刺器尺
5.5.1进气器件应符合3.2和7.2的要求。尺寸:mm
5.5.2进气器件应有空气过滤器,以防止微生物进入它所插入的容器,当按附录B试验时.空气过滤器对空气中0.5um以上微粒的滤除率应不小于90%\。5.5.3进气器件应与输血器的瓶塞穿刺器分离。5.5.4如果进气器件的-一端通过一软管与空气过滤器连接,管长应不短于250mm。5.5.5空气过滤器的安装应使所有进入硬质容器的空气都通过它。按附录B试验时,相对自由进气容器的流出液的流量应不降低20%。5.6软管
5.6.1由软质材料制成的管子应塑化均勾,并透明或足够透明,当有气泡通过时,用正常或矫正视力可以发现水和空气的分界面。
5.6.2末端至滴斗的软管[包括注射座(如果有)和外圆锥接头7长度不小于1500mm5.6.3软管壁厚应大于0.5mm,外径应不小于4.0mm。5.7血液及血液成分过滤器
输血器应有--血液及血液成分过滤器,过滤器网孔应均匀,总面积不小于10cm。当按附录C试验时,过滤器上的干燥残渣不少于标准过滤器上的80%(m/m)。5.8滴斗与滴管
5.8.1滴斗应可以连续观察液滴。液体应经过一-插入滴斗的滴管进入滴斗。滴管的端部至滴斗出口的距离应不小于40mm,或滴管和血液及血液成分过滤网间的距离应不小于20mm。滴斗壁与滴管终端的外壁间的距离应不小于5mm。在23℃±2℃,流速为50滴/min士10滴/min的条件下,滴管滴下20滴蒸馏水应为1 mL±0.1mL(1g士0.1g)。5.8.2滴斗应能借助其弹性将输血容器中血液引入输血器。5.9流量调节器
流量调节器应能调节血液及血液成分的液流从零至最大,其调节行程应不小于30mm。注:流量调节器应能在一-次输血中持续使用而不损伤软管。流量调节器和软管接触在--起贮存时不应产生有害反应。
5.10血液及血液成分的流速bzxZ.net
输血器在1m静压头下,在温23℃土2℃下,30min内应能输出不少于1000ml.的血液。在高于大汽压强30kPa的压力下,2min内还应能输出不少于500ml的血液。采用说明:
11、2]、33ISO)1135-4:1998无此项技术指标。365
GB8369--1998
血液应采集到合适的抗凝剂中,贮存不少于2周且无大血块注:试验可以用400g/1.的葡萄糖水溶液代替血液45.11注射件
如有注射件,按附录1)试验时,水的泄漏量应不超过一滴。注:注射座宜位于外圆锥接头附近。5.12外圆锥接头
软管的末端应有符合GB1962或IS594-2的外圆锥接头。5.13保护套
输血器终端的保护套应保持瓶塞穿刺器、外圆锥接头和输血器内表面无菌。保护套不应自然脱落、并易于拆除。6化学要求
6.1还原物质(易氧化物)
按附录E试验时,检验液和空白液消耗高锰酸钾溶液[c(KMnO,)=0.002mol/L7的体积之差应不超过 2. 0 ml
6.2金属离子
当按E3.1用源子吸收分光光度法(AAS)或相当的方法进行测定时、检验液中锁、铬、铜、沿、锡的总含量应不超过1μg/mL。镉的含量应不超过0.1ug/mL。当按E3.2试验时,试验液呈现的颜色应不超过质量浓度p(Pb2+)=1μg/ml.的标准对照液。6.3酸碱度5
按附录E试验时,检验液与空白液pH值之差应不超过1.5。6.4蒸发残渣
按附录E试验时,蒸发残渣的总量应不超过2mg。6.5紫外吸光度
按附录E试验时,检验液的吸光度应不大于0.1。6.6环氧乙烷残留量)
按(GB/T14233.1试验时,每套输血器环氧乙烷残留量应不大于0.5mg。7生物要求
7.1总则
输血器应不释放出任何对患者产生副作用的物质。应用适宜的试验来评价输血器材料的毒性,试验结果应表明无毒性。GB/T16886.1给出了毒性试验指南。7.2无菌
单包装内的输血器和/或进气器件应经过一有效的灭菌过程使产品无菌。附录(给出了无菌试验方法。
7.3热原
应用适当的试验来评价输逝器和/或进气器件的致热性,结果应表明输血器无热原。附录(给出了热原试验方法。
采用说明:
1IS0)1135-4:1998无此项规定。51IS)1135-4:1998是用滴定法。61IS))1135-4:1998是5mg
71150)1135-4:1998元此项技术指标。386
GB 8369—1998
应评价输血器无溶血成分,试验结果应表明输血器无溶班反应。GB/T14233.2给出了游血试验方法。
7.5急性全身毒性
应评价输血器急性全身毒性作用,试验结果应明输血器无急性全身毒性。GB/T14233.2给出了急性全身毒性试验方法,
8标志
8.1单包装
单包装上应至少标有下列信息:a)文字说明内装物;
b)使用YY/T0313中给出的图形符号,标明输血器无菌;c)输血器无热原;
d)输血器和/或进气器件仅供一次性使用,或同等说明;注:可另外给出符合YY/T0313的“一次性使用”图形符号。e)使用说明,包括检查包装密封完整性和有关保护套脱落情况的警示;注:使用说明也可采用插负形式。{)批号,以\批”字开头,
g)失效年月(必须能清晰识别);h)制造商和/或经销商名称和地址:i)滴管滴出20滴蒸馏水相当于1mL±0.1mL(1g土0.1g)的说明;j)如配静脉针,应注明规格。
8.2中包装
中包装上应至少有下列信息:
a)文字说明内装物;
b)输血器数量;
c)使用YY/T0313中给出的图形符号,标明输血器无菌;d)批号,以“批\字开头;
e)失效年月;
1)制造商和/或经销商名称和地址:g)推荐的贮存条件(如果有)。8.3外包装
外包装上信息应符合YY/T0313。9包装
9.1输血器和/或进气器件应单件包装,以使其在贮存期内保持无菌。单包装打开后应留有打开过的迹象。9.2输血器和/或进气器件的包装和灭菌应使其在备用时无扁瘾或打折。9.3单包装内不应有肉眼可见异物。387
GB 8369—1998
附录A
(标准的附录)
密封性试验
输血器-端封口,漫入20℃~30(的水中,通大高于大气压强50kPa的气压2min。检查输血器漏气的迹象。
附录B
(标准的附录)
空气过滤器滤除率、流量降低率试验方法同B8368—1998附录B
附录C
(标推的附录)
血液及血液成分过滤器效率试验C1原理
使·定体积的已过滤的贮备血液流过供试过滤器和标准过滤器,比较两种过滤器滤除物的质量。C2标准过滤器
标准过滤器应用聚酰胺6-6单丝编织而成,单丝直径为100μm土10um,单经单纬,孔径为200umt:20 μm.
C3步骤
准备抗凝的同种AB30)血型人体全血,贮存不少于2周,从其容器中通过一孔径为2250μm粗过滤[网注人…41的容器中,使血液充分混匀。让容器中的血液在重力作用下,流经过滤材料各800mL,使过滤器多余的血液流尽,在60土2(的烘箱内和约0.65kPa(6.5mbar)的压力下,使过滤材料干燥至基本恒重。C3.1万法A(用于过滤材料)
从标准过滤材料和供试过滤材料上各剪取两片直径为40mm的圆形材料,试验时将片过滤材料固定到能使过滤材料的全部表面都被血液覆盖的试验装貿上。C3.2“方法B(用于过滤器组件)标准过滤器组件应有底端封口、面积为32cm2的标准过滤材料,过滤材料应装在·-·底部有出的塑料过滤斗之中,滤斗的出口是一每20滴蒸馏水为1mL的标准滴管,进液管伸入到滤斗,[图C1示出了适用的标准过滤器组件。试验步骤按C3进行。注:方法A和法B任选,
C4结果表示
供试滤器(材)相对于标准滤器(材)滤除固体物质的质盐百分数由式(C1)给出:388
式中:mr。
GB8369
mti— mra
一液通过前供试过滤器(材)的质量;一血液通过后供试过滤器(材)的质量;一班液通过前标准过滤器(材)的质量:mk——血液通过后标准过滤器(材)的质量。1998
1进液管2·滤斗,3--标准过滤网;4-过滤网固定装置;5滤斗出口处20滴/ml,的滴管
图 C1标准过滤器组件
附录D
(标准的附录)
注射件自密封性试验
同GB8368-1998附录D。
(C1)
F1试验液制备
GB 8369—1998
附录E
(标准的附录)
溶出物化学分析
按GB/T14233.1-1998中规定制备检验液(按表1方法~)。还原物质(易氧化物)试验
按GB/T14233.1-1998中5.2.2方法规定进行E3金属离子试验
E3.1原于吸收:按GB/T14233.1-1998中5.9.1规定进行E3.2比色:按GB/T14233.1-1998中5.6.1方法规定进行。E4酸碱度试验
按GB3/T11233.1-1998中5.4.1方法-规定进行,F5蒸发残渣试验
按(GB3/T14233.1--1998中规定进行。E6紫外吸光度试验
按(:13,T14233.1~1998中规定在250nm~320nm波长范用内进行。附录F
(标准的附录)
微粒含量测定方法
间G8368--1998附录F
附录G
(标准的附录)
无菌、热原试验及生物学评价试验G1(G1BT14233.2中1规楚了无菌、热原试验注:(B,T14233,2同时还规定了细菌内毒索试验方法。G2(13/T16886.1描述的生物学评价试验方法应作为材料生物相容性评价的指南。注:(小15593规笼「聚氟乙烯材料生物相容性试验。H1·型式检验
H1.1在下列情况下应进行型式检验:GB8369-1998
附录H
(标准的附录)
检验规则
a)新产品投产、材料来源或配方改变时;b)结构、关键零配件、工艺有重大改变时;c)连续生产中每年不少于两次;d)停产整顿恢复生产时;
e)每一原料批制成的产品
f)合同规定或管理部门要求时。H1.2型式检验为全性能检验。在a)情况下,还应对所选用的聚氯乙烯材料进行全面的生物学评价。H1.3,型式检验时,第5章、第8.1条和第9章规定的各项要求若无特殊规定,各随机抽检5套。如果配有静脉针,其相应产品标准规定的所有物理要求各随机抽检5套。H1.4所有型式检验项目均合格,则通过型式检验。型式检验未通过时,不得进行批量生产。H2出厂检验
H2.1出厂检验按GB2828规定逐批进行检验,合格后方可出厂。H2.2以同种输血器日产量组成生产批。H2.3出厂检验的物理要求项目(计数项目)、不合格分类、检查水平(IL)和合格质量水平(AQL)按表H1规定。
检验项目
微粒污染
密封性
连接强度
瓶塞穿刺器
进气器件
H2.4每一生产批还应检验还原物质(6.1)、酸碱度(6.3)、紫外吸光度(6.5)和热原(7.3)。H2.5同一·灭菌过程的产品组成灭菌批,每一灭菌批应用有效的方法监测灭菌效果(7.2)。用环氧乙烷灭菌的产品,灭菌后环氧乙烷残留量控制在低于规定值(6.6)后方可出厂。H3国家监督抽查
按GB/T14437规定进行。
采用说明:
8]IS)1135-4:1998无检验规则。391
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。