GB∕T 38165-2019 人
基本信息
标准号: GB∕T 38165-2019 人
中文名称:外周血中循环游离DNA浓度检测 基于Alu序列实时荧光PCR法
标准类别:国家标准(GB)
标准状态:现行
出版语种:简体中文
下载格式:.zip .pdf
下载大小:417587
相关标签: 外周血 循环 游离 DNA 浓度 检测 基于 序列 实时 荧光 PCR

标准分类号
关联标准
出版信息
相关单位信息
标准简介
标准号:GB∕T 38165-2019
标准名称:人体外周血中循环游离DNA浓度检测 基于Alu序列实时荧光PCR法
英文名称:Detection of circulating cell-free DNA concentration in human peripheral bl
Real-time PCR method based on Alu sequence
标准格式:PDF
发布时间:2019-10-18
实施时间:2019-10-18
标准大小:496K
标准介绍:本标准规定了人体外周血中循环游离脱氧核糖核酸(DNA)基于Alu序列的实时荧光聚合酶链式反应(PCR)定量检测方法
本标准适用于循环游离DNA样品中Alu序列的定量检测
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件
GBT6682分析实验室用水规格和试验方法
GB19489窦验室生物安全通用要求
3术语和定义
列术语和定义适用于本文件
循环游离 DNA circulating cell-free DNA;cDNA
血液中来源于细胞调亡和坏死的细胞外游离状态的短片段DNA
实时荧光 PCR real-time PCr
在PCR反应体系中加入荧光基团,通过荧光信号的积累实时监控整个PCR扩增过程,实现对起始模板的定量及定性分析
Ct值 cele threshold
每个反应管内的荧光信号达到设定的阙值时所经历的循环
l序列 Aln sequence
散在分布于灵长类动物基因组中的中度重复序列
注:Au序列具有70%~98%同源性,占人类基因组序列的5%~10%,每个元件长度约为30hp
标准名称:人体外周血中循环游离DNA浓度检测 基于Alu序列实时荧光PCR法
英文名称:Detection of circulating cell-free DNA concentration in human peripheral bl
Real-time PCR method based on Alu sequence
标准格式:PDF
发布时间:2019-10-18
实施时间:2019-10-18
标准大小:496K
标准介绍:本标准规定了人体外周血中循环游离脱氧核糖核酸(DNA)基于Alu序列的实时荧光聚合酶链式反应(PCR)定量检测方法
本标准适用于循环游离DNA样品中Alu序列的定量检测
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件
GBT6682分析实验室用水规格和试验方法
GB19489窦验室生物安全通用要求
3术语和定义
列术语和定义适用于本文件
循环游离 DNA circulating cell-free DNA;cDNA
血液中来源于细胞调亡和坏死的细胞外游离状态的短片段DNA
实时荧光 PCR real-time PCr
在PCR反应体系中加入荧光基团,通过荧光信号的积累实时监控整个PCR扩增过程,实现对起始模板的定量及定性分析
Ct值 cele threshold
每个反应管内的荧光信号达到设定的阙值时所经历的循环
l序列 Aln sequence
散在分布于灵长类动物基因组中的中度重复序列
注:Au序列具有70%~98%同源性,占人类基因组序列的5%~10%,每个元件长度约为30hp
标准图片预览




标准内容
ICS07.080
中华人民共和国国家标准
GB/T38165—2019
人体外周血中循环游离DNA浓度检测基于Alu序列实时荧光PCR法
Detection of circulating cell-free DNA concentration in human peripheral blood-Real-timePCRmethodbasedonAlusequence2019-10-18发布
国家市场监督管理总局
中国国家标准化管理委员会
2019-10-18实施
本标准按照GB/T1.1-2009给出的规则起草本标准由全国生化检测标准化技术委员会(SAC/TC387)提出并归口。GB/T38165—2019
本标准起草单位:成都中医药大学、四川省肿瘤医院、上海市计量测试技术研究院本标准主要起草人:何洋、肖洪涛、宋填、李燕、闻艳丽、冷平、刘刚、李东梅。I
1范围
人体外周血中循环游离DNA浓度检测基于Alu序列实时荧光PCR法
GB/T38165—2019
本标准规定了人体外周血中循环游离脱氧核糖核酸(DNA)基于Alu序列的实时荧光聚合酶链式反应(PCR)定量检测方法。
本标准适用于循环游离DNA样品中Alu序列的定量检测。2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。GB/T6682分析实验室用水规格和试验方法GB19489实验室生物安全通用要求术语和定义
下列术语和定义适用于本文件
循环游离DNAcirculatingcell-freeDNA;cfDNA血液中来源于细胞凋亡和坏死的细胞外游离状态的短片段DNA。3.2
实时荧光PCRreal-timePCR
在PCR反应体系中加人荧光基团,通过荧光信号的积累实时监控整个PCR扩增过程,实现对起始模板的定量及定性分析。
Ct值cyclethreshold
每个反应管内的荧光信号达到设定的阈值时所经历的循环数。3.4
JAlusequence
Alu序列
散在分布于灵长类动物基因组中的中度重复序列注:Alu序列具有70%~98%同源性,占人类基因组序列的5%~10%,每个元件长度约为300bp。4原理
以提取的外周血循环游离DNA作为检测目标样品,以符合要求的人基因组DNA定量标准物质为标准品,采用实时荧光PCR技术,设计特异性引物分别扩增Alu序列中长度为115bp和219bp的片段,以标准品起始模板DNA浓度的对数为横坐标,Ct值为纵坐标,制作标准曲线。根据标准曲线方程计算样品中的Alu序列拷贝数,结果用copies/μL表示。1免费标准下载网bzxz
GB/T38165—2019
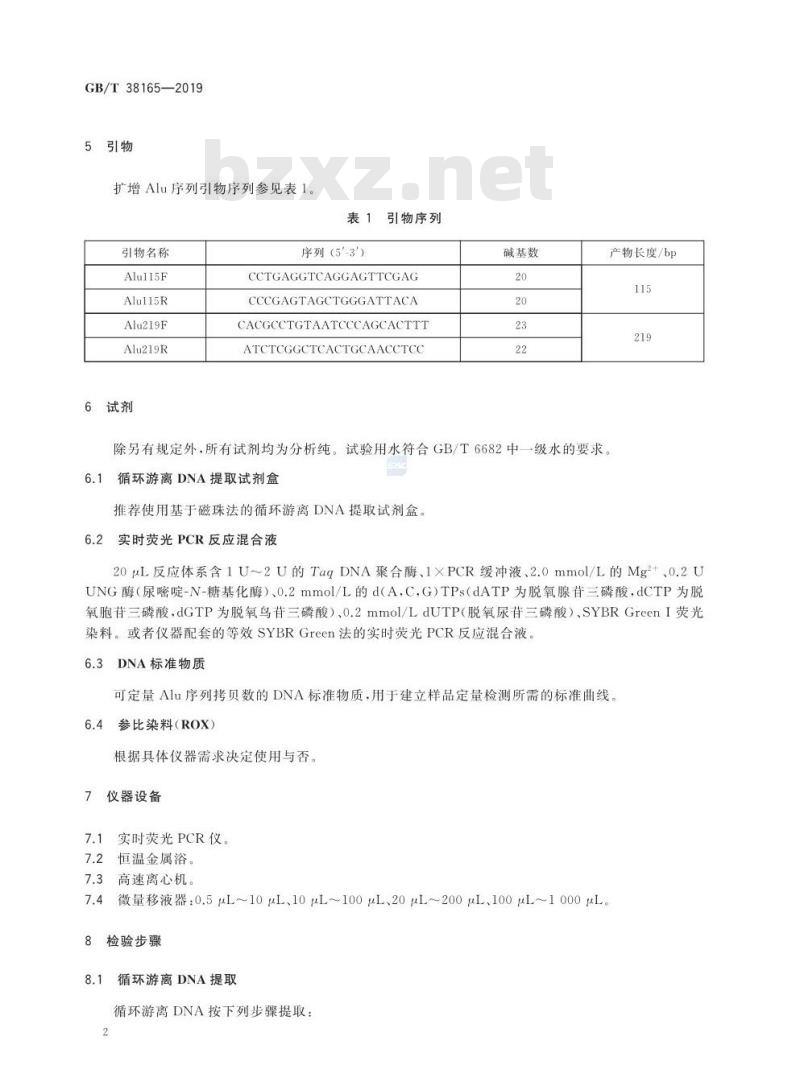
5引物
扩增Alu序列引物序列参见表1。引物名称
Alul15F
Alu115R
Alu219F
Alu219R
6试剂
引物序列
序列(5-3')
CCTGAGGTCAGGAGTTCGAG
CCCGAGTAGCTGGGATTACA
CACGCCTGTAATCCCAGCACTTT
ATCTCGGCTCACTGCAACCTCC
碱基数
除另有规定外,所有试剂均为分析纯。试验用水符合GB/T6682中一级水的要求6.1
循环游离DNA提取试剂盒
推荐使用基于磁珠法的循环游离DNA提取试剂盒。实时荧光PCR反应混合液
产物长度/bp
20μL反应体系含1U~2U的TaqDNA聚合酶、1XPCR缓冲液、2.0mmol/L的Mg+、0.2UUNG酶(尿嘧啶-N-糖基化酶)、O.2mmol/L的d(A,C,G)TPs(dATP为脱氧腺苷三磷酸,dCTP为脱氧胞苷三磷酸,dGTP为脱氧鸟苷三磷酸)、O.2mmol/LdUTP(脱氧尿苷三磷酸)SYBRGreenI荧光染料。或者仪器配套的等效SYBRGreen法的实时荧光PCR反应混合液,6.3
DNA标准物质
可定量Alu序列拷贝数的DNA标准物质,用于建立样品定量检测所需的标准曲线参比染料(ROX)
根据具体仪器需求决定使用与否。仪器设备
实时荧光PCR仪。
2恒温金属浴。
3高速离心机。
微量移液器:0.5μ~10μL10μL~100μL,20μL200μL100μL~1000μL。检验步骤
循环游离DNA提取
循环游离DNA按下列步骤提取:
GB/T38165—2019
a)2mL人体外周血于4℃以1600×g离心10min,离心后将上清转移到1.5mL的离心管中,避免吸到中间层的白细胞;
b)再次以4℃16000×g离心10min去除残余细胞,将上清转入新的离心管中,即得所需的血浆;
按照每500μL的血浆中加入1mL结合缓冲液(Bindingbuffer)35μL(20μg/μL)蛋白酶Kc)
60μL(1μg/μL)carrierRNA比例加人试剂.混匀后于室温放置1min~2min;将上述混合样品于10000×g,4℃离心5min,吸取上清到另一个新1.5mL离心管中,然后加d)
人10μL微型磁珠,室温,混匀15min~20min;e)
将上一步产物分装到1.5mL离心管中,放于磁力架上,静置1min~2min,吸去废液加入洗涤缓冲液500μL.混匀后放于磁力架上,静置1min~2min,吸去废液;加入70%乙醇500μL,混勾后放于磁力架上,静置1min~2min,吸去废液:加入40μLTE缓冲液,55℃金属浴10min(每30s混匀一次);放于磁力架上,静置1min~2min,收集溶液至新的离心管中,即得到循环游离DNA;提取后的循环游离DNA样品应立即开展后续的实时荧光PCR扩增试验。注:可使用磁珠法或其他等效方法提取循环游离DNA。2DNA标准品工作液的配制
取DNA标准物质制备标准品工作液。用非接触式超声波破碎仪将DNA标准物质按超声功率280W、超声时间5s、间隙时间5s、总工作时间20min的程序片段化为300bp~500bp片段,用一级水按照表2方法进行梯度稀释。
注1:DNA标准物质片段化程序可根据实际使用的仪器进行调整。注2:超声片段化后,可经过1.5%琼脂糖凝胶电泳检测DNA片段化范围在300bp~500bp。表2DNA标准品工作液配制方法
DNA标准品工作浓度
Xx10°copies/μl
XX10°copies/μL
XX10'copies/μL
Xx10°copies/μl
Xx10-'copies/μL
配制方法
取10μL标准物质母液至90μL水中取10μLX×10copies/μL标准品工作液至90μL水中取10aLXX10~copies/μL标准品工作液至90uL水中取10μLX×10°copies/μL标准品工作液至90μL水中取10μLX×10°copies/μL标准品工作液至90μL水中注:X为实际应用的DNA标准物质的赋值,DNA标准品浓度按此进行计算,8.3
实时荧光PCR扩增
8.3.1实时荧光PCR反应体系
本方法采用SYBRGreen法,按表3配制反应体系,各样品配制3个复孔,加样过程先将除DNA模板以外的各组分预混合,分装到荧光定量PCR反应孔中19uL/孔,最后加人标准品或待测样品1uL/孔.加好后盖紧盖子,短暂离心,立刻进行PCR扩增3
GB/T38165—2019
表3实时荧光PCR扩增体系(总体积20μL)体系组分
实时荧光PCR反应混合液(2×)PCR上游引物(10mmol/L)
PCR下游引物(10mmol/L)
一级水
DNA模板(标准品或待测样品)
8.3.2实时荧光PCR反应程序
加样量/μL
将配制好的PCR反应体系放入实时荧光PCR仪,按表4的反应程序扩增表4实时荧光PCR扩增反应程序
步骤1(1个循环)
步骤2(1个循环)
变性环节
注:可根据不同品牌预混液、仪器设备说明书要求对程序进行调整,9
质量控制
步骤3(40个循环)
退火延伸环节(采集荧光)
所有样品设3个重复,根据检测数值的取舍标准如下a)、b)选择有效孔:a)标准曲线上各数据点复孔,可根据标准曲线线性关系的好坏来判断是否舍去,可舍去明显影响标准曲线相关性(使R≥0.99)的复孔数据。整条曲线上舍去的复孔数不得超过3个。当待测样品各复孔间检测Ct值的标准差大于0.5时,该数据应重新检测。b)
扩增效率应在70%~110%之间:
标准曲线的相关系数R≥0.99;
空白对照:Ct值≥30.0,若空白对照Ct值小于30.0可采用脱氧核糖核酸酶I(DNaseI)处理实时荧光PCR反应混合液和试验用水,灭活DNaseI后重新检测。10
结果计算
采用标准曲线法,对结果进行定量分析,直接测得各稀释梯度标准物质的Ct值,以Ct值为纵坐标、各稀释梯度标准物质浓度的对数(1IgX。)为横坐标作图,得到标准曲线和线性回归方程,最后将待测样品的Ct值带人式(1)。计算出待测样品的Alu序列115bp片段和Alu序列219bp片段的拷贝数X。=M×(1+E)-c
式中:
X。样品初始浓度,单位为拷贝数每微升(copies/μL);M
荧光阈值,基线内3个~15个循环荧光信号标准差的10倍;.1
E—扩增效率,计算方法为E=10-1/slape)-1,slope为标准曲线斜率。检测过程中生物安全措施
按照GB/T19489的规定执行。
GB/T38165—2019
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
中华人民共和国国家标准
GB/T38165—2019
人体外周血中循环游离DNA浓度检测基于Alu序列实时荧光PCR法
Detection of circulating cell-free DNA concentration in human peripheral blood-Real-timePCRmethodbasedonAlusequence2019-10-18发布
国家市场监督管理总局
中国国家标准化管理委员会
2019-10-18实施
本标准按照GB/T1.1-2009给出的规则起草本标准由全国生化检测标准化技术委员会(SAC/TC387)提出并归口。GB/T38165—2019
本标准起草单位:成都中医药大学、四川省肿瘤医院、上海市计量测试技术研究院本标准主要起草人:何洋、肖洪涛、宋填、李燕、闻艳丽、冷平、刘刚、李东梅。I
1范围
人体外周血中循环游离DNA浓度检测基于Alu序列实时荧光PCR法
GB/T38165—2019
本标准规定了人体外周血中循环游离脱氧核糖核酸(DNA)基于Alu序列的实时荧光聚合酶链式反应(PCR)定量检测方法。
本标准适用于循环游离DNA样品中Alu序列的定量检测。2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。GB/T6682分析实验室用水规格和试验方法GB19489实验室生物安全通用要求术语和定义
下列术语和定义适用于本文件
循环游离DNAcirculatingcell-freeDNA;cfDNA血液中来源于细胞凋亡和坏死的细胞外游离状态的短片段DNA。3.2
实时荧光PCRreal-timePCR
在PCR反应体系中加人荧光基团,通过荧光信号的积累实时监控整个PCR扩增过程,实现对起始模板的定量及定性分析。
Ct值cyclethreshold
每个反应管内的荧光信号达到设定的阈值时所经历的循环数。3.4
JAlusequence
Alu序列
散在分布于灵长类动物基因组中的中度重复序列注:Alu序列具有70%~98%同源性,占人类基因组序列的5%~10%,每个元件长度约为300bp。4原理
以提取的外周血循环游离DNA作为检测目标样品,以符合要求的人基因组DNA定量标准物质为标准品,采用实时荧光PCR技术,设计特异性引物分别扩增Alu序列中长度为115bp和219bp的片段,以标准品起始模板DNA浓度的对数为横坐标,Ct值为纵坐标,制作标准曲线。根据标准曲线方程计算样品中的Alu序列拷贝数,结果用copies/μL表示。1免费标准下载网bzxz
GB/T38165—2019
5引物
扩增Alu序列引物序列参见表1。引物名称
Alul15F
Alu115R
Alu219F
Alu219R
6试剂
引物序列
序列(5-3')
CCTGAGGTCAGGAGTTCGAG
CCCGAGTAGCTGGGATTACA
CACGCCTGTAATCCCAGCACTTT
ATCTCGGCTCACTGCAACCTCC
碱基数
除另有规定外,所有试剂均为分析纯。试验用水符合GB/T6682中一级水的要求6.1
循环游离DNA提取试剂盒
推荐使用基于磁珠法的循环游离DNA提取试剂盒。实时荧光PCR反应混合液
产物长度/bp
20μL反应体系含1U~2U的TaqDNA聚合酶、1XPCR缓冲液、2.0mmol/L的Mg+、0.2UUNG酶(尿嘧啶-N-糖基化酶)、O.2mmol/L的d(A,C,G)TPs(dATP为脱氧腺苷三磷酸,dCTP为脱氧胞苷三磷酸,dGTP为脱氧鸟苷三磷酸)、O.2mmol/LdUTP(脱氧尿苷三磷酸)SYBRGreenI荧光染料。或者仪器配套的等效SYBRGreen法的实时荧光PCR反应混合液,6.3
DNA标准物质
可定量Alu序列拷贝数的DNA标准物质,用于建立样品定量检测所需的标准曲线参比染料(ROX)
根据具体仪器需求决定使用与否。仪器设备
实时荧光PCR仪。
2恒温金属浴。
3高速离心机。
微量移液器:0.5μ~10μL10μL~100μL,20μL200μL100μL~1000μL。检验步骤
循环游离DNA提取
循环游离DNA按下列步骤提取:
GB/T38165—2019
a)2mL人体外周血于4℃以1600×g离心10min,离心后将上清转移到1.5mL的离心管中,避免吸到中间层的白细胞;
b)再次以4℃16000×g离心10min去除残余细胞,将上清转入新的离心管中,即得所需的血浆;
按照每500μL的血浆中加入1mL结合缓冲液(Bindingbuffer)35μL(20μg/μL)蛋白酶Kc)
60μL(1μg/μL)carrierRNA比例加人试剂.混匀后于室温放置1min~2min;将上述混合样品于10000×g,4℃离心5min,吸取上清到另一个新1.5mL离心管中,然后加d)
人10μL微型磁珠,室温,混匀15min~20min;e)
将上一步产物分装到1.5mL离心管中,放于磁力架上,静置1min~2min,吸去废液加入洗涤缓冲液500μL.混匀后放于磁力架上,静置1min~2min,吸去废液;加入70%乙醇500μL,混勾后放于磁力架上,静置1min~2min,吸去废液:加入40μLTE缓冲液,55℃金属浴10min(每30s混匀一次);放于磁力架上,静置1min~2min,收集溶液至新的离心管中,即得到循环游离DNA;提取后的循环游离DNA样品应立即开展后续的实时荧光PCR扩增试验。注:可使用磁珠法或其他等效方法提取循环游离DNA。2DNA标准品工作液的配制
取DNA标准物质制备标准品工作液。用非接触式超声波破碎仪将DNA标准物质按超声功率280W、超声时间5s、间隙时间5s、总工作时间20min的程序片段化为300bp~500bp片段,用一级水按照表2方法进行梯度稀释。
注1:DNA标准物质片段化程序可根据实际使用的仪器进行调整。注2:超声片段化后,可经过1.5%琼脂糖凝胶电泳检测DNA片段化范围在300bp~500bp。表2DNA标准品工作液配制方法
DNA标准品工作浓度
Xx10°copies/μl
XX10°copies/μL
XX10'copies/μL
Xx10°copies/μl
Xx10-'copies/μL
配制方法
取10μL标准物质母液至90μL水中取10μLX×10copies/μL标准品工作液至90μL水中取10aLXX10~copies/μL标准品工作液至90uL水中取10μLX×10°copies/μL标准品工作液至90μL水中取10μLX×10°copies/μL标准品工作液至90μL水中注:X为实际应用的DNA标准物质的赋值,DNA标准品浓度按此进行计算,8.3
实时荧光PCR扩增
8.3.1实时荧光PCR反应体系
本方法采用SYBRGreen法,按表3配制反应体系,各样品配制3个复孔,加样过程先将除DNA模板以外的各组分预混合,分装到荧光定量PCR反应孔中19uL/孔,最后加人标准品或待测样品1uL/孔.加好后盖紧盖子,短暂离心,立刻进行PCR扩增3
GB/T38165—2019
表3实时荧光PCR扩增体系(总体积20μL)体系组分
实时荧光PCR反应混合液(2×)PCR上游引物(10mmol/L)
PCR下游引物(10mmol/L)
一级水
DNA模板(标准品或待测样品)
8.3.2实时荧光PCR反应程序
加样量/μL
将配制好的PCR反应体系放入实时荧光PCR仪,按表4的反应程序扩增表4实时荧光PCR扩增反应程序
步骤1(1个循环)
步骤2(1个循环)
变性环节
注:可根据不同品牌预混液、仪器设备说明书要求对程序进行调整,9
质量控制
步骤3(40个循环)
退火延伸环节(采集荧光)
所有样品设3个重复,根据检测数值的取舍标准如下a)、b)选择有效孔:a)标准曲线上各数据点复孔,可根据标准曲线线性关系的好坏来判断是否舍去,可舍去明显影响标准曲线相关性(使R≥0.99)的复孔数据。整条曲线上舍去的复孔数不得超过3个。当待测样品各复孔间检测Ct值的标准差大于0.5时,该数据应重新检测。b)
扩增效率应在70%~110%之间:
标准曲线的相关系数R≥0.99;
空白对照:Ct值≥30.0,若空白对照Ct值小于30.0可采用脱氧核糖核酸酶I(DNaseI)处理实时荧光PCR反应混合液和试验用水,灭活DNaseI后重新检测。10
结果计算
采用标准曲线法,对结果进行定量分析,直接测得各稀释梯度标准物质的Ct值,以Ct值为纵坐标、各稀释梯度标准物质浓度的对数(1IgX。)为横坐标作图,得到标准曲线和线性回归方程,最后将待测样品的Ct值带人式(1)。计算出待测样品的Alu序列115bp片段和Alu序列219bp片段的拷贝数X。=M×(1+E)-c
式中:
X。样品初始浓度,单位为拷贝数每微升(copies/μL);M
荧光阈值,基线内3个~15个循环荧光信号标准差的10倍;.1
E—扩增效率,计算方法为E=10-1/slape)-1,slope为标准曲线斜率。检测过程中生物安全措施
按照GB/T19489的规定执行。
GB/T38165—2019
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。