GB 27949-2020
标准分类号
关联标准
出版信息
相关单位信息
标准简介
GB 27949-2020.General requirements of disinfectant of medical instruments.
1范围
GB 27949规定了医疗器械消毒、灭菌用化学消毒剂的原料要求、技术要求、检验方法、使用方法、标识、包装、储存及运输要求。
GB 27949适用于医疗器械用消毒剂。
GB 27949不适用于带消毒因子发生装置的消毒器械及气体类或在特定条件下气(汽)化后发挥作用的消毒、灭菌产品。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 191包装 储运图示标志
GB 30689内镜自动清洗消毒机卫生要求
GBZ 2(所有部分)工作场所有害因素职业接触限值
WS 507软式内 镜清洗消毒技术规范
消毒技术规范(2002年版)[卫生部(卫法监发[2002]282号)]
内镜清洗消毒机消毒效果检验技术规范(试行) [卫生部(卫法监发[2003]330号)]
中华人民共和国药典(2015 年版,四部)
3术语和定义
下列术语和定义适用于本文件。
3.1
医疗器械 medical instruments
单独或组合使用于人体的仪器、设备、器具、材料或其他物品。
注:根据使用中造成感染的危险程度,分为高度危险性医疗器械、中度危险性医疗器械、低度危险性医疗器械。
3.2
医疗器械消毒剂 disinfectant of medical instruments
用于医疗器械处理,使其达到消毒或灭菌要求的化学制剂。
4原料要求
4.1消毒剂原料应符合《中华人民共和国药典》(2015年版,四部)、相应的国家标准或行业标准等有关规定,并有相应的合格证明材料。
4.2生产用水应为纯化水。
1范围
GB 27949规定了医疗器械消毒、灭菌用化学消毒剂的原料要求、技术要求、检验方法、使用方法、标识、包装、储存及运输要求。
GB 27949适用于医疗器械用消毒剂。
GB 27949不适用于带消毒因子发生装置的消毒器械及气体类或在特定条件下气(汽)化后发挥作用的消毒、灭菌产品。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 191包装 储运图示标志
GB 30689内镜自动清洗消毒机卫生要求
GBZ 2(所有部分)工作场所有害因素职业接触限值
WS 507软式内 镜清洗消毒技术规范
消毒技术规范(2002年版)[卫生部(卫法监发[2002]282号)]
内镜清洗消毒机消毒效果检验技术规范(试行) [卫生部(卫法监发[2003]330号)]
中华人民共和国药典(2015 年版,四部)
3术语和定义
下列术语和定义适用于本文件。
3.1
医疗器械 medical instruments
单独或组合使用于人体的仪器、设备、器具、材料或其他物品。
注:根据使用中造成感染的危险程度,分为高度危险性医疗器械、中度危险性医疗器械、低度危险性医疗器械。
3.2
医疗器械消毒剂 disinfectant of medical instruments
用于医疗器械处理,使其达到消毒或灭菌要求的化学制剂。
4原料要求
4.1消毒剂原料应符合《中华人民共和国药典》(2015年版,四部)、相应的国家标准或行业标准等有关规定,并有相应的合格证明材料。
4.2生产用水应为纯化水。
标准图片预览




标准内容
ICS11.080
中华人民共和国国家标准
GB27949—2020
代替GB/T27949—2011
医疗器械消毒剂通用要求
General requirements of disinfectant of medical instruments2020-04-09发布
国家市场监督管理总局
国家标准化管理委员会
2020-11-01实施
本标准的全部技术内容为强制性前言
本标准按照GB/T1.1—2009给出的规则起草。GB27949—2020
本标准代替GB/T27949一2011《医疗器械消毒剂卫生要求》。与GB/T27949一2011相比,主要技术变化如下:
修改了“范围”中的不适用范围为“不适用于带消毒因子发生装置的消毒器械及气体类或在特定条件下气(汽)化后发挥作用的消毒、灭菌产品”(见第1章);修改了规范性引用文件;
一删除了部分术语;
—修改了原料要求;
删除了对消毒剂的感官性状要求,相关要求在5.2中体现;修改了有效期要求(见5.2);
增加了“消毒剂与器械的相容性”(见5.4)。一技术要求增加了实验微生物的菌株号或病毒株要求(见5.5);一增加了“与消毒器械配套用消毒剂的要求”(见5.6);将“连续使用稳定性”单独列出(见5.7);检验方法中增加了《内镜清洗消毒机消毒效果检验技术规范(试行)》等测试依据;对使用方法进行了修订;
增加了标识部分,并注明了相应的要求(见第8章);本标准由中华人民共和国国家卫生健康委员会提出并归口本标准起草单位:浙江省疾病预防控制中心、中国疾病预防控制中心环境与健康相关产品安全所、江苏省疾病预防控制中心、上海市疾病预防控制中心、浙江大学医学院附属第二医院、中国人民解放军总医院、中国人民解放军空军特色医学中心、浙江省卫生健康监测与评价中心、杭州市疾病预防控制中心、广州海关技术中心。
本标准主要起草人:魏兰芬、李涛、陆烨、陆龙喜、林军明、张流波、胡国庆、徐燕、廖如燕、陆群、刘运喜、曹晋桂、朱仁义、徐浩行、孙建荣、傅剑云、孙文胜、苗大娟、朱汉泉、马明洁、王裕荣、戴彦榛、刘俊峰、王忠权、俞致健。
本标准所代替标准的历次版本发布情况为:—GB/T27949—2011。
1范围
医疗器械消毒剂通用要求
GB27949—2020
本标准规定了医疗器械消毒、灭菌用化学消毒剂的原料要求、技术要求、检验方法、使用方法、标识、包装、储存及运输要求。
本标准适用于医疗器械用消毒剂。本标准不适用于带消毒因子发生装置的消毒器械及气体类或在特定条件下气(汽)化后发挥作用的消毒、灭菌产品。
规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件GB/T191包装储运图示标志
GB30689内镜自动清洗消毒机卫生要求GBZ2(所有部分)工作场所有害因素职业接触限值WS507软式内镜清洗消毒技术规范消毒技术规范(2002年版)[卫生部(卫法监发(2002)282号)内镜清洗消毒机消毒效果检验技术规范(试行)[卫生部(卫法监发【2003]330号)]中华人民共和国药典(2015年版,四部)术语和定义
下列术语和定义适用于本文件,3.1
medicalinstruments
医疗器械
单独或组合使用于人体的仪器、设备、器具、材料或其他物品注:根据使用中造成感染的危险程度,分为高度危险性医疗器械、中度危险性医疗器械、低度危险性医疗器械,3.2
disinfectant of medical instruments医疗器械消毒剂
用于医疗器械处理,使其达到消毒或灭菌要求的化学制剂。原料要求
消毒剂原料应符合《中华人民共和国药典》(2015年版,四部)、相应的国家标准或行业标准等有关4.1
规定,并有相应的合格证明材料。4.2生产用水应为纯化水。
GB27949—2020
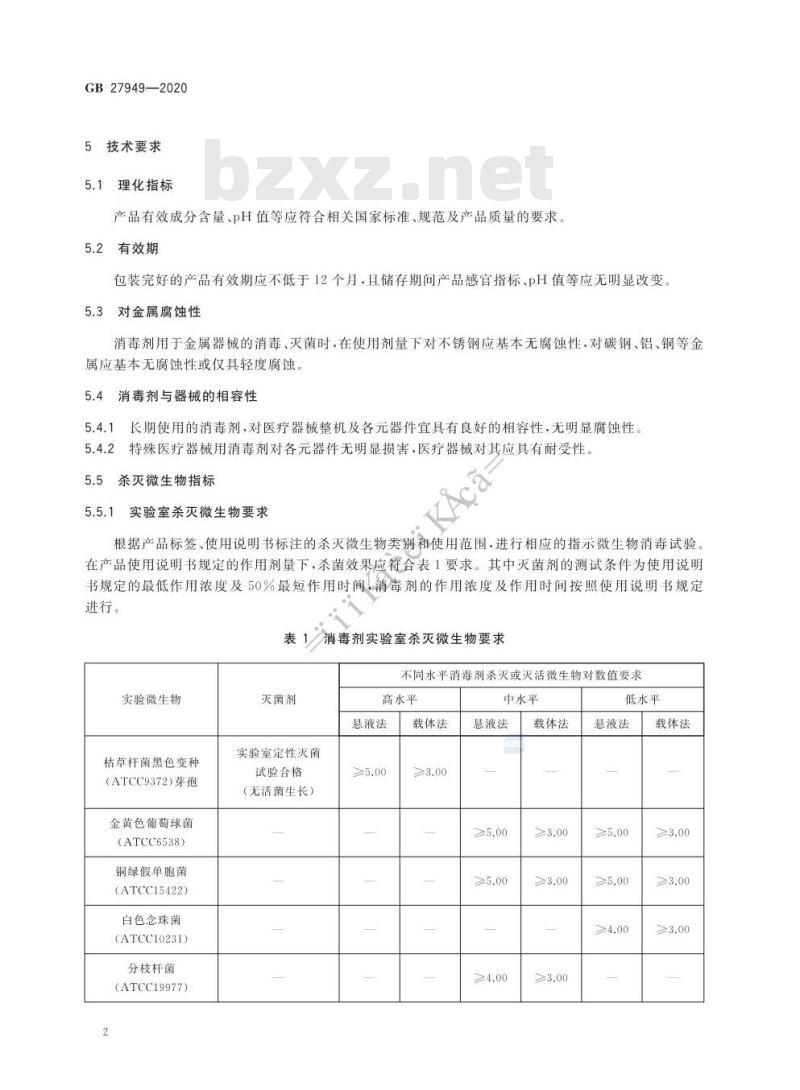
5技术要求
5.1理化指标
产品有效成分含量、PH值等应符合相关国家标准、规范及产品质量的要求5.2有效期
包装完好的产品有效期应不低于12个月,且储存期间产品感官指标、pH值等应无明显改变,5.3对金属腐蚀性
消毒剂用于金属器械的消毒、灭菌时,在使用剂量下对不锈钢应基本无腐蚀性,对碳钢、铝、铜等金属应基本无腐蚀性或仅具轻度腐蚀。5.4消毒剂与器械的相容性
5.4.1长期使用的消毒剂,对医疗器械整机及各元器件宜具有良好的相容性,无明显腐蚀性。5.4.2特殊医疗器械用消毒剂对各元器件无明显损害,医疗器械对其应具有耐受性。5.5杀灭微生物指标
实验室杀灭微生物要求
根据产品标签、使用说明书标注的杀灭微生物类别和使用范围,进行相应的指示微生物消毒试验。在产品使用说明书规定的作用剂量下,杀菌效果应符合表1要求。其中灭菌剂的测试条件为使用说明书规定的最低作用浓度及50%最短作用时间,消毒剂的作用浓度及作用时间按照使用说明书规定进行。
表1消毒剂实验室杀灭微生物要求不同水平消毒剂杀灭或灭活微生物对数值要求实验微生物
枯草杆菌黑色变种
(ATCC9372)芽孢
金黄色葡萄球菌
(ATCC6538)
铜绿假单胞菌
(ATCC15422)
白色念珠菌
(ATCC10231)
分枝杆菌
(ATCC19977)
灭菌剂
实验室定性灭菌
试验合格
(无活菌生长)
高水平
悬液法
载体法
中水平
悬液法
载体法
低水平
悬液法
载体法
实验微生物
脊髓灰质炎病毒
(I型疫苗株)
灭菌剂
表1(续)
GB27949—2020
不同水平消毒剂杀灭或灭活微生物对数值要求高水平
悬液法
载体法
中水平
悬液法
注1:试样稀薄状或稀释后使用者宜采用悬液法进行实验室定量杀菌试验载体法
注2:试样黏稠状或原液使用及冲洗消毒者宜采用载体法进行实验室定量杀菌试验。注3:“二”可不设该项目。
5.5.2模拟现场试验要求
5.5.2.1灭菌剂
低水平
悬液法
载体法
在使用说明书规定的最低作用浓度及50%最短作用时间的剂量下,所试模拟医疗器械上应无活菌[枯草杆菌黑色变种(ATCC9372)芽孢]生长,判为医疗器械的模拟现场灭菌试验合格。5.5.2.2高水平消毒剂
在使用说明书规定的最低作用浓度及最短作用时间的剂量下,对所试模拟医疗器械上枯草杆菌黑色变种(ATCC9372)芽孢的杀灭或灭除对数值应不低于3.00,判为医疗器械的模拟现场消毒试验合格。5.5.2.3中水平消毒剂
在使用说明书规定的最低作用浓度及最短作用时间的剂量下,对所试模拟医疗器械上的分枝杆菌(ATCC19977)杀灭或灭除对数值应不低于3.00,判为医疗器械的模拟现场消毒试验合格。5.5.2.4低水平消毒剂
在金黄色葡萄球菌(ATCC6538)、铜绿假单胞菌(ATCC15422)、白色念珠菌(ATCC10231)中选择对所试消毒剂抵抗力最强的微生物作为实验微生物,在使用说明书规定的最低作用浓度及最短作用时间的剂量下,对模拟医疗器械上的所试微生物的杀灭或灭除对数值应不低于3.00,判为医疗器械的模拟现场消毒试验合格。
5.6与消毒器械配套用消毒剂的要求与相关消毒灭菌装置配套使用的特定用途消毒剂,如内镜用消毒剂、透析机管路消毒剂等,应符合WS507、GB30689等相应消毒灭菌装置及国家相关标准的要求,并应验证与相关设备配套使用的模拟消毒、灭菌效果。
5.7连续使用稳定性bzxz.net
连续使用的消毒剂,在使用期间对医疗器械的模拟现场灭菌或消毒效果应符合上述各分类要求,有效成分的含量应符合相应国家标准、规范规定。5.8毒理学安全性要求
消毒剂或最高应用浓度5倍溶液应呈实际无毒或低毒级,无致突变性。GB27949—2020
6检验方法
6.1理化指标、有效期
按《消毒技术规范》(2002年版)或其他相应的国家标准或产品质量标准规定的方法进行测定。6.2杀灭微生物效果
按《消毒技术规范》(2002年版)、《内镜清洗消毒机消毒效果检验技术规范(试行)》等规范、标准或其他相应的国家标准或产品质量标准规定的方法进行测定。6.3对金属腐蚀性
按《消毒技术规范》(2002年版)或其他相应的国家标准或产品质量标准规定的方法进行测定。6.4消毒剂与器械相容性
按相应的国家标准、规范或产品质量标准规定的方法进行测定。6.5连续使用稳定性
按《消毒技术规范》(2002年版)或其他相应的国家标准或产品质量标准规定的方法进行测定。6.6毒理学安全性指标
iiikae
按《消毒技术规范》(2002年版)中相关试验方法进行测定7使用方法
7.1总则
医疗器械首选热力消毒与灭菌的方式进行处理。7.1.1
7.1.2使用方法应符合各类别消毒剂的标准、规范要求。7.1.3新启用的医疗器械消毒或灭菌前应先除去油污及保护膜,再用洗涤剂清洗去除油脂,干燥。7.1.4使用后污染的医疗器械消毒或灭菌处理前,应充分清洗干净、干燥,处理时应打开轴节,使其充分暴露于消毒剂中。
7.1.5需稀释后使用的灭菌剂及高、中水平消毒剂,应采用纯化水稀释,以避免钙、镁等其他杂质对消毒效果的影响。
7.2浸泡消毒
7.2.1将待处理的医疗器械放人消毒剂中浸泡,使其完全浸没,再将消毒容器加盖,作用至规定时间。7.2.2高度、中度危险性医疗器械,消毒、灭菌结束后、使用前应以无菌水冲洗干净或采用其他方法清除残留消毒剂
7.2.3浸泡灭菌后的医疗器械在冲洗、转运、储存等环节中应避免二次污染。其中高度危险性医疗器械灭菌后应无菌保存;中度危险性医疗器械经灭菌或高水平消毒处理后,应清洁保存;低度危险性医疗器械经低、中度水平消毒后,应清洁保存。7.3擦拭消毒
7.3.1按消毒剂说明书规定要求,对医疗器械进行擦拭消毒处理后,视情况采用适当的方法去除残留4
的消毒剂。
7.3.2低水平消毒剂用于污染明显的医疗器械的擦拭消毒时,应反复多次擦拭标识
应符合GB/T191、消毒产品标签说明书有关规范和标准的要求。8.1
8.2产品使用说明书应标注以下注意事项:GB 27949—2020
a)对金属具有腐蚀性、对织物具有漂白性的消毒剂,在使用说明书中应明确标明,并注明相应的注意事项。
应明确标明消毒剂的拮抗物质,并注明相应的注意事项。b)
应注明使用场所注意通风,并做好个人安全防护工作等内容,使用现场消毒剂允许浓度应符合GBZ2等规定。
包装、储存及运输
9.1所采用的小包装材料应与消毒剂理化性质相符合,不应与消毒剂发生化学反应产生毒副产物或导致包装破损。
9.2消毒剂储存应符合有关国家标准的要求,产品应密封,避光,置于阴凉、干燥、通风处保存,特殊要求者,如过氧乙酸溶液,应在最小包装上留置有排气孔。不得露天存放,不得与其他有毒物品混储9.3消毒剂的运输应符合有关国家标准要求。装卸应轻搬轻放,运输过程中不得倒置,防压、防撞、防Hiiae
挤,防止暴晒、雨淋;防止外包装破损;车辆应保持干燥
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
中华人民共和国国家标准
GB27949—2020
代替GB/T27949—2011
医疗器械消毒剂通用要求
General requirements of disinfectant of medical instruments2020-04-09发布
国家市场监督管理总局
国家标准化管理委员会
2020-11-01实施
本标准的全部技术内容为强制性前言
本标准按照GB/T1.1—2009给出的规则起草。GB27949—2020
本标准代替GB/T27949一2011《医疗器械消毒剂卫生要求》。与GB/T27949一2011相比,主要技术变化如下:
修改了“范围”中的不适用范围为“不适用于带消毒因子发生装置的消毒器械及气体类或在特定条件下气(汽)化后发挥作用的消毒、灭菌产品”(见第1章);修改了规范性引用文件;
一删除了部分术语;
—修改了原料要求;
删除了对消毒剂的感官性状要求,相关要求在5.2中体现;修改了有效期要求(见5.2);
增加了“消毒剂与器械的相容性”(见5.4)。一技术要求增加了实验微生物的菌株号或病毒株要求(见5.5);一增加了“与消毒器械配套用消毒剂的要求”(见5.6);将“连续使用稳定性”单独列出(见5.7);检验方法中增加了《内镜清洗消毒机消毒效果检验技术规范(试行)》等测试依据;对使用方法进行了修订;
增加了标识部分,并注明了相应的要求(见第8章);本标准由中华人民共和国国家卫生健康委员会提出并归口本标准起草单位:浙江省疾病预防控制中心、中国疾病预防控制中心环境与健康相关产品安全所、江苏省疾病预防控制中心、上海市疾病预防控制中心、浙江大学医学院附属第二医院、中国人民解放军总医院、中国人民解放军空军特色医学中心、浙江省卫生健康监测与评价中心、杭州市疾病预防控制中心、广州海关技术中心。
本标准主要起草人:魏兰芬、李涛、陆烨、陆龙喜、林军明、张流波、胡国庆、徐燕、廖如燕、陆群、刘运喜、曹晋桂、朱仁义、徐浩行、孙建荣、傅剑云、孙文胜、苗大娟、朱汉泉、马明洁、王裕荣、戴彦榛、刘俊峰、王忠权、俞致健。
本标准所代替标准的历次版本发布情况为:—GB/T27949—2011。
1范围
医疗器械消毒剂通用要求
GB27949—2020
本标准规定了医疗器械消毒、灭菌用化学消毒剂的原料要求、技术要求、检验方法、使用方法、标识、包装、储存及运输要求。
本标准适用于医疗器械用消毒剂。本标准不适用于带消毒因子发生装置的消毒器械及气体类或在特定条件下气(汽)化后发挥作用的消毒、灭菌产品。
规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件GB/T191包装储运图示标志
GB30689内镜自动清洗消毒机卫生要求GBZ2(所有部分)工作场所有害因素职业接触限值WS507软式内镜清洗消毒技术规范消毒技术规范(2002年版)[卫生部(卫法监发(2002)282号)内镜清洗消毒机消毒效果检验技术规范(试行)[卫生部(卫法监发【2003]330号)]中华人民共和国药典(2015年版,四部)术语和定义
下列术语和定义适用于本文件,3.1
medicalinstruments
医疗器械
单独或组合使用于人体的仪器、设备、器具、材料或其他物品注:根据使用中造成感染的危险程度,分为高度危险性医疗器械、中度危险性医疗器械、低度危险性医疗器械,3.2
disinfectant of medical instruments医疗器械消毒剂
用于医疗器械处理,使其达到消毒或灭菌要求的化学制剂。原料要求
消毒剂原料应符合《中华人民共和国药典》(2015年版,四部)、相应的国家标准或行业标准等有关4.1
规定,并有相应的合格证明材料。4.2生产用水应为纯化水。
GB27949—2020
5技术要求
5.1理化指标
产品有效成分含量、PH值等应符合相关国家标准、规范及产品质量的要求5.2有效期
包装完好的产品有效期应不低于12个月,且储存期间产品感官指标、pH值等应无明显改变,5.3对金属腐蚀性
消毒剂用于金属器械的消毒、灭菌时,在使用剂量下对不锈钢应基本无腐蚀性,对碳钢、铝、铜等金属应基本无腐蚀性或仅具轻度腐蚀。5.4消毒剂与器械的相容性
5.4.1长期使用的消毒剂,对医疗器械整机及各元器件宜具有良好的相容性,无明显腐蚀性。5.4.2特殊医疗器械用消毒剂对各元器件无明显损害,医疗器械对其应具有耐受性。5.5杀灭微生物指标
实验室杀灭微生物要求
根据产品标签、使用说明书标注的杀灭微生物类别和使用范围,进行相应的指示微生物消毒试验。在产品使用说明书规定的作用剂量下,杀菌效果应符合表1要求。其中灭菌剂的测试条件为使用说明书规定的最低作用浓度及50%最短作用时间,消毒剂的作用浓度及作用时间按照使用说明书规定进行。
表1消毒剂实验室杀灭微生物要求不同水平消毒剂杀灭或灭活微生物对数值要求实验微生物
枯草杆菌黑色变种
(ATCC9372)芽孢
金黄色葡萄球菌
(ATCC6538)
铜绿假单胞菌
(ATCC15422)
白色念珠菌
(ATCC10231)
分枝杆菌
(ATCC19977)
灭菌剂
实验室定性灭菌
试验合格
(无活菌生长)
高水平
悬液法
载体法
中水平
悬液法
载体法
低水平
悬液法
载体法
实验微生物
脊髓灰质炎病毒
(I型疫苗株)
灭菌剂
表1(续)
GB27949—2020
不同水平消毒剂杀灭或灭活微生物对数值要求高水平
悬液法
载体法
中水平
悬液法
注1:试样稀薄状或稀释后使用者宜采用悬液法进行实验室定量杀菌试验载体法
注2:试样黏稠状或原液使用及冲洗消毒者宜采用载体法进行实验室定量杀菌试验。注3:“二”可不设该项目。
5.5.2模拟现场试验要求
5.5.2.1灭菌剂
低水平
悬液法
载体法
在使用说明书规定的最低作用浓度及50%最短作用时间的剂量下,所试模拟医疗器械上应无活菌[枯草杆菌黑色变种(ATCC9372)芽孢]生长,判为医疗器械的模拟现场灭菌试验合格。5.5.2.2高水平消毒剂
在使用说明书规定的最低作用浓度及最短作用时间的剂量下,对所试模拟医疗器械上枯草杆菌黑色变种(ATCC9372)芽孢的杀灭或灭除对数值应不低于3.00,判为医疗器械的模拟现场消毒试验合格。5.5.2.3中水平消毒剂
在使用说明书规定的最低作用浓度及最短作用时间的剂量下,对所试模拟医疗器械上的分枝杆菌(ATCC19977)杀灭或灭除对数值应不低于3.00,判为医疗器械的模拟现场消毒试验合格。5.5.2.4低水平消毒剂
在金黄色葡萄球菌(ATCC6538)、铜绿假单胞菌(ATCC15422)、白色念珠菌(ATCC10231)中选择对所试消毒剂抵抗力最强的微生物作为实验微生物,在使用说明书规定的最低作用浓度及最短作用时间的剂量下,对模拟医疗器械上的所试微生物的杀灭或灭除对数值应不低于3.00,判为医疗器械的模拟现场消毒试验合格。
5.6与消毒器械配套用消毒剂的要求与相关消毒灭菌装置配套使用的特定用途消毒剂,如内镜用消毒剂、透析机管路消毒剂等,应符合WS507、GB30689等相应消毒灭菌装置及国家相关标准的要求,并应验证与相关设备配套使用的模拟消毒、灭菌效果。
5.7连续使用稳定性bzxz.net
连续使用的消毒剂,在使用期间对医疗器械的模拟现场灭菌或消毒效果应符合上述各分类要求,有效成分的含量应符合相应国家标准、规范规定。5.8毒理学安全性要求
消毒剂或最高应用浓度5倍溶液应呈实际无毒或低毒级,无致突变性。GB27949—2020
6检验方法
6.1理化指标、有效期
按《消毒技术规范》(2002年版)或其他相应的国家标准或产品质量标准规定的方法进行测定。6.2杀灭微生物效果
按《消毒技术规范》(2002年版)、《内镜清洗消毒机消毒效果检验技术规范(试行)》等规范、标准或其他相应的国家标准或产品质量标准规定的方法进行测定。6.3对金属腐蚀性
按《消毒技术规范》(2002年版)或其他相应的国家标准或产品质量标准规定的方法进行测定。6.4消毒剂与器械相容性
按相应的国家标准、规范或产品质量标准规定的方法进行测定。6.5连续使用稳定性
按《消毒技术规范》(2002年版)或其他相应的国家标准或产品质量标准规定的方法进行测定。6.6毒理学安全性指标
iiikae
按《消毒技术规范》(2002年版)中相关试验方法进行测定7使用方法
7.1总则
医疗器械首选热力消毒与灭菌的方式进行处理。7.1.1
7.1.2使用方法应符合各类别消毒剂的标准、规范要求。7.1.3新启用的医疗器械消毒或灭菌前应先除去油污及保护膜,再用洗涤剂清洗去除油脂,干燥。7.1.4使用后污染的医疗器械消毒或灭菌处理前,应充分清洗干净、干燥,处理时应打开轴节,使其充分暴露于消毒剂中。
7.1.5需稀释后使用的灭菌剂及高、中水平消毒剂,应采用纯化水稀释,以避免钙、镁等其他杂质对消毒效果的影响。
7.2浸泡消毒
7.2.1将待处理的医疗器械放人消毒剂中浸泡,使其完全浸没,再将消毒容器加盖,作用至规定时间。7.2.2高度、中度危险性医疗器械,消毒、灭菌结束后、使用前应以无菌水冲洗干净或采用其他方法清除残留消毒剂
7.2.3浸泡灭菌后的医疗器械在冲洗、转运、储存等环节中应避免二次污染。其中高度危险性医疗器械灭菌后应无菌保存;中度危险性医疗器械经灭菌或高水平消毒处理后,应清洁保存;低度危险性医疗器械经低、中度水平消毒后,应清洁保存。7.3擦拭消毒
7.3.1按消毒剂说明书规定要求,对医疗器械进行擦拭消毒处理后,视情况采用适当的方法去除残留4
的消毒剂。
7.3.2低水平消毒剂用于污染明显的医疗器械的擦拭消毒时,应反复多次擦拭标识
应符合GB/T191、消毒产品标签说明书有关规范和标准的要求。8.1
8.2产品使用说明书应标注以下注意事项:GB 27949—2020
a)对金属具有腐蚀性、对织物具有漂白性的消毒剂,在使用说明书中应明确标明,并注明相应的注意事项。
应明确标明消毒剂的拮抗物质,并注明相应的注意事项。b)
应注明使用场所注意通风,并做好个人安全防护工作等内容,使用现场消毒剂允许浓度应符合GBZ2等规定。
包装、储存及运输
9.1所采用的小包装材料应与消毒剂理化性质相符合,不应与消毒剂发生化学反应产生毒副产物或导致包装破损。
9.2消毒剂储存应符合有关国家标准的要求,产品应密封,避光,置于阴凉、干燥、通风处保存,特殊要求者,如过氧乙酸溶液,应在最小包装上留置有排气孔。不得露天存放,不得与其他有毒物品混储9.3消毒剂的运输应符合有关国家标准要求。装卸应轻搬轻放,运输过程中不得倒置,防压、防撞、防Hiiae
挤,防止暴晒、雨淋;防止外包装破损;车辆应保持干燥
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
