GB 4789.49-2024
基本信息
标准号: GB 4789.49-2024
中文名称:食品安全国家标准食品 微生物学检验 产志贺毒素大肠埃希氏菌检验
标准类别:国家标准(GB)
标准状态:现行
发布日期:2024-02-08
实施日期:2024-08-08
出版语种:简体中文
下载格式:.pdf .zip
下载大小:2193172
相关标签: 食品安全 国家标准 食品 微生物学 检验 毒素 大肠 埃希氏

标准分类号
中标分类号:食品>>食品综合>>X09卫生、安全、劳动保护
关联标准
出版信息
出版社:中国标准出版社
页数:16页
标准价格:31.0
相关单位信息
发布部门:国家卫生健康委员会 国家市场监督管理总局
标准简介
本标准规定了食品中产志贺毒素大肠埃希氏菌(Shigatoxin-producingEscherichiacoli,STEC)的检验方法。
本标准适用于食品中产志贺毒素大肠埃希氏菌的检验。
标准图片预览



标准内容
中华人民共和国国家标准
GB 4789.49—2024
食品安全国家标准
食品微生物学检验
产志贺毒素大肠埃希氏菌检验
2024-02-08发布bZxz.net
中华人民共和国国家卫生健康委员会国家市场监督管理总局
2024-08-08实施
1范围
食品安全国家标准
食品微生物学检验
产志贺毒素大肠埃希氏菌检验
GB4789.49—2024
本标准规定了食品中产志贺毒素大肠埃希氏菌(Shigatoxin-producingEscherichiacoli,STEC)的检验方法。
本标准适用于食品中产志贺毒素大肠埃希氏菌的检验。2设备和材料
除微生物实验室常规灭菌及培养设备外,其他设备和材料如下。2.1恒温培养箱:36℃±1℃、44℃±1℃。2.2 冰箱:2℃~5℃、-18℃~-20℃。2.3天平:感量为 0.001 g。
2.4均质器。
2.5旋涡振荡器。
2.6恒温水浴箱50℃~55℃、恒温金属浴99℃±1℃。2.7离心机:最大转速至少16000g。2.8实时荧光定量PCR仪。
2.9混匀仪。
2.10无菌吸管:1mL(具0.01mL刻度)、10mL(具0.1mL刻度)。2.11
电动移液枪或吸耳球。
无菌具塞锥形瓶:容量250mL、500mL、1000mL。无菌培养血:直径90mm。
无菌均质袋:带滤网,无菌均质杯。平盖八联排管或96孔PCR微孔板。磁珠分离富集装置。
微量移液器及吸头:0.2μ~2μL、2μ~20μL、20μl~200μl、100μ~1000μl。10μL无菌接种环。
1.5mL无菌EP管,无菌微量离心管,无菌15mL离心管。0.22μm孔径无菌过滤膜。
全自动微生物生化鉴定系统
基质辅助激光解析电离飞行时间质谱仪(MALDI-TOFMS)。3培养基和试剂
改良胰蛋白陈大豆液体培养基(mTSB):见A.1。3.2EC肉汤培养基(EC):见A.2。3.3胰蛋白陈大豆琼脂培养基(TSA):见A.3。3.4STEC显色培养基:见A.4。
GB4789.49—2024
3.5麦康凯琼脂培养基(MAC):见A.5。3.6脑心浸出液肉汤(BHI)-50%甘油:见A.6。3.70.85%灭菌生理盐水。
3.85%Chelex-100溶液见A.7。
3.9E-buffer溶液:见A.8。
1mol/L盐酸溶液。
1×TE缓冲液:见A.9。
无菌PBS缓冲液:见A.10。
实时荧光定量PCR反应体系配制用试剂(10×buffer、dNTPs、Tag酶和ddH2O)。STEC免疫磁珠分离相关试剂或等效试剂盒。3.14
生化鉴定试剂盒或生化鉴定相关试剂。具有菌种保藏资质单位提供的志贺毒素基因(Shigatoxingene,stx)阳性大肠埃希氏菌标准菌3.16
株,即携带stx1和/或stx2,如O157H7[CMCC(B)44939,GDMCC1.2702或等效菌株]和stx阴性大肠埃希氏菌标准菌株,即不携带stx1和stx2,如CMCC(B)44102,GDMCC1.223或等效菌株。免疫磁珠富集处理的标准菌株:血清型O26型大肠埃希氏菌标准菌株,如CMCC(B)43221、GDMCC1.3807或等效菌株;血清型O45,CMCC(B)43242,GDMCC1.3808或等效菌株;血清型O103,CMCC(B)43234GDMCC1.3809或等效菌株;血清型O111,CMCC(B)43211,GDMCC1.3810或等效菌株;血清型O121CMCC(B)43228,GDMCC1.3811或等效菌株;血清型O145,CMCC(B)43243,GDMCC1.3812或等效菌株。4检验程序
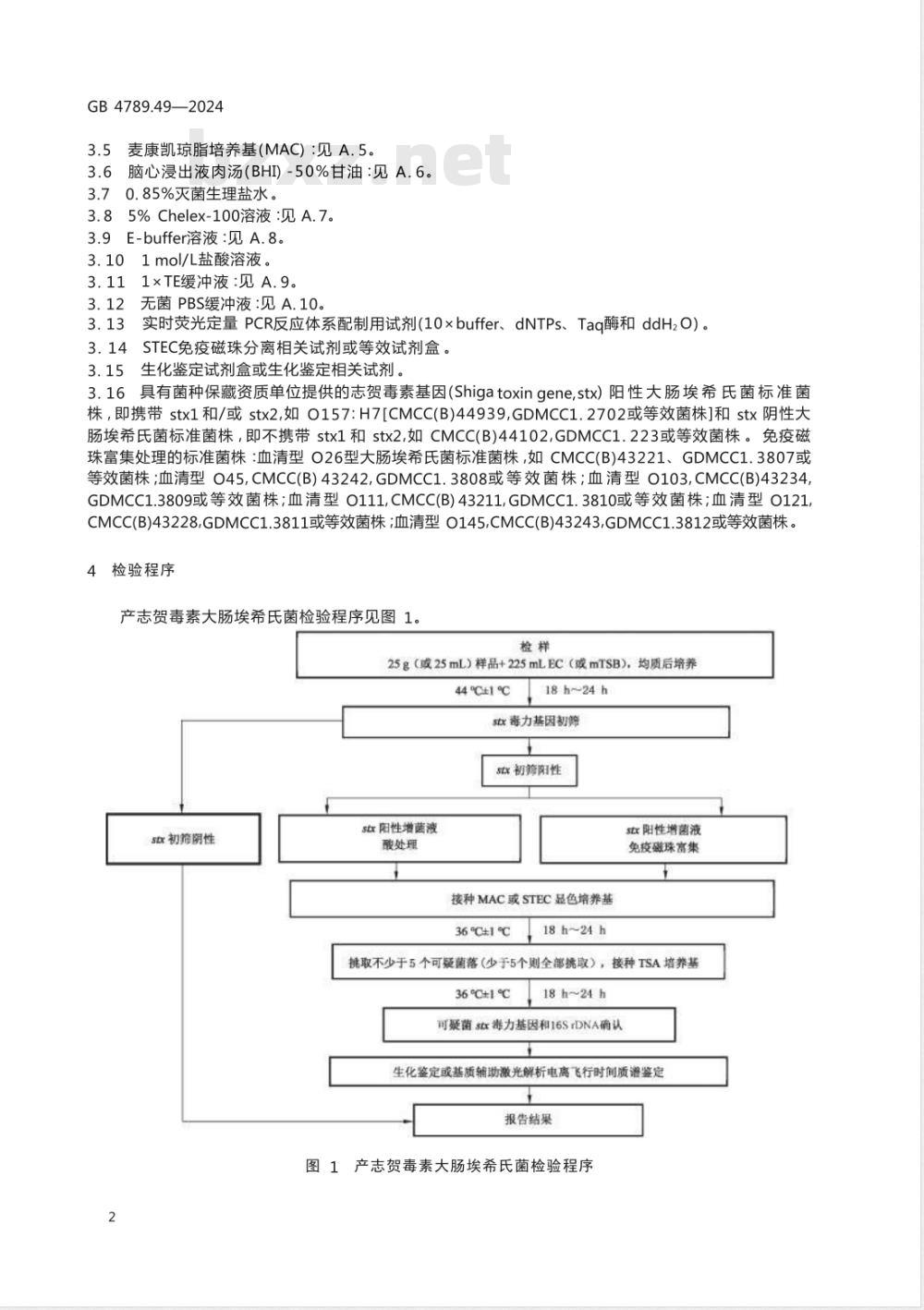
产志贺毒素大肠埃希氏菌检验程序见图1。检样
25g(或25mL)样品+225mLEC(或mTSB),均质后培养44℃1℃
18h~24h
stx毒力基因初筛
SX初阳性
x初筛阴性
sx阳性增菌波
酸处理
接种MAC或STEC显色培养基
36℃±1℃
18h~24h
s 阳性增菌液
免疫磁珠富集
挑取不少于5个可疑菌落(少于5个则全部挑取),接种TSA培养基36℃±1℃
18h~24h
可聚菌stx毒力基因和16SDNA确认生化鉴定或基质辅助激光解析电高飞行时间质谱监定报告结果
图1产志贺毒素大肠埃希氏菌检验程序5操作步骤
5.1样品制备
5.1.1样品保存
GB4789.49—2024
样品采集后应尽快送往实验室进行检测,如不能及时检测,应将待检样品根据样品贮存要求进行保存,无特殊要求的,应置于2℃~5℃冰箱中冷藏,24h内完成检测。5.1.2固态或半固态样品
以无菌操作称取检样25g,加入装有225mLEC(或mTSB)的无菌带滤网均质袋内,用拍击式均质器均质1min~2min;或放入盛有225mLEC(或mTSB)的无菌均质杯中,用旋转刀片式均质器以8000r/min~10000r/min均质1min~2min,制成1:10的样品匀液。5.1.3液态样品
以无菌操作量取检样25mL,加入装有225mLEC(或mTSB)的无菌均质袋或无菌锥形瓶中,充分混匀制成1:10的样品匀液。
5.2增菌
将5.1制备的样品匀液44℃±1℃下培养18h~24h。同时设置对照试验,以携带stx1和/或stx2的大肠埃希氏菌标准菌株在EC(或mTSB)中培养为阳性对照,以不携带stx1和 stx2的大肠埃希氏菌标准菌株在EC(或mTSB)中培养为阴性对照,并做培养基空白对照。5.3stx毒力基因初筛
5.3.1试验环境与过程控制
实时荧光定量PCR试验环境条件和过程控制应按GB/T27403一2008规定的要求执行。5.3.2DNA模板制备
混匀后吸取1mL增菌液(油脂含量高的样品不混匀,在距离液面下1cm处吸取)置于1.5mLEP管中,500g离心1min。取上清液(避免带入底层沉淀物)至新的EP管中,10000g离心5min,弃去上清液。向沉淀中加入500uL无菌生理盐水,重悬,10000g离心3min,弃去上清液。向沉淀中加入100μL的1×TE缓冲液,重悬(若样本为生肉制品,则用5%的Chelex-100溶液替代TE)。99℃±1℃加热15min,室温冷却2min,10000g离心4min,取上清液作为DNA模板。4h内完成分析,若不能及时分析则于-20℃短暂保存。注:也可用商品化DNA提取试剂盒按其说明书要求提取制备DNA模板。5.3.3实时荧光定量PCR初筛
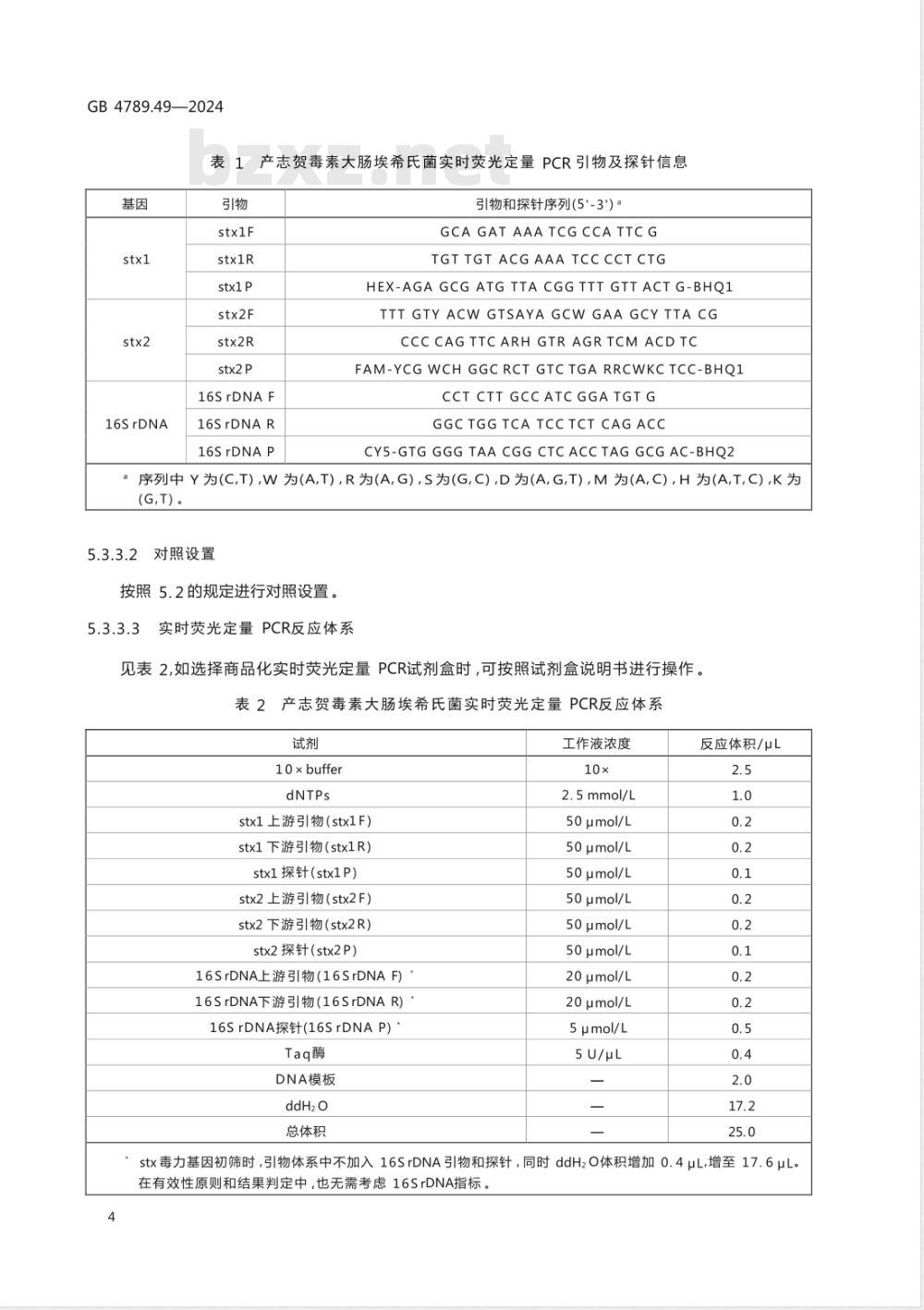
5.3.3.1引物及探针
见表1。
GB4789.49—2024
16SrDNA
产志贺毒素大肠埃希氏菌实时荧光定量PCR引物及探针信息引物和探针序列(5'-3\)a
stx2 p
16SrDNAF
16SrDNAR
16SrDNAP
GCAGATAAATCGCCATTCG
TGTTGT ACG AAA TCCCCT CTG
HEX-AGAGCG ATGTTACGGTTTGTTACTG-BHQ1TTT GTY ACW GTSAYA GCW GAA GCY TTACGCCC CAG TTC ARH GTR AGR TCM ACD TCFAM-YCG WCH GGC RCT GTC TGA RRCWKC TCC-BHQ1CCT CTT GCC ATC GGA TGT G
GGCTGGTCATCCTCTCAGACC
CY5-GTG GGG TAA CGG CTC ACC TAG GCG AC-BHQ2序列中Y为(C,T),W 为(A,T),R为(A,G),S为(G,C),D为(A,G,T),M 为(A,C),H 为(A,T,C),K为(G,T) 。
对照设置
按照5.2的规定进行对照设置。
实时荧光定量PCR反应体系
见表2,如选择商品化实时荧光定量PCR试剂盒时,可按照试剂盒说明书进行操作。表2产志贺毒素大肠埃希氏菌实时荧光定量PCR反应体系试剂
10× buffer
stx1上游引物(stx1F)
stx1下游引物(stx1R)
stx1探针(stx1P)
stx2上游引物(stx2F)
stx2下游引物(stx2R)
stx2探针(stx2P)
16SrDNA上游引物(16SrDNAF)
16SrDNA下游引物(16SrDNAR)
16SrDNA探针(16SrDNAP)
Taq酶
DNA模板
总体积
工作液浓度
2.5mmol/L
50 μmol/L
50 μmol/L
50μmol/L
50 μmol/L
50 μmol/L
50 μmol/L
20 μmol/L
20 μmol/L
5 μmol/L
5u/μl
反应体积/μL
stx毒力基因初筛时,引物体系中不加入16SrDNA引物和探针,同时ddH2O体积增加0.4μL,增至17.6μL。在有效性原则和结果判定中,也无需考虑16SrDNA指标。4
5.3.3.4实时荧光定量PCR反应程序GB 4789.49—2024
预变性:95℃10min;变性:95℃15s;退火:60℃40s;延伸:72℃1min40个循环。在延伸阶段于3条荧光检测通道中,分别采集已标记的荧光信号。5.3.3.5结果有效性原则
若同一批次实验中同时满足下列要求,则实时荧光定量PCR实验结果有效;否则实时荧光定量PCR实验结果无效,需重新进行实验。空白对照:stx1、stx2和16SrDNA基因均无荧光对数增长(16SrDNA基因可能在35个循环a
后出现较弱的荧光对数增长);阴性对照:stx1和stx2均无荧光对数增长;16SrDNA基因有荧光对数增长,相应的Ctb)
值30;
阳性对照:stx1、stx2和16SrDNA基因均有荧光对数增长,相应的Ct值<30。5.3.3.6
实时荧光定量PCR结果判定
在符合5.3.3.5结果有效性原则的情况下,待检样品进行检测时,若:a)stx1和stx2的Ct值≥40,则判定为stx阴性;stx1或stx2的Ct值<3516SrDNA基因的Ct值<35,则判定为stx阳性;b)
stx1和stx2的Ct值均≥35且<40,应重新进行实时荧光定量PCR扩增实验。再次扩增后cs
stx1或stx2的Ct值<40,16SrDNA基因的Ct值<35,判定为stx阳性;若 stx1和stx2的Ct值≥40,则判定为stx阴性。
判定为stx阴性的样品,按流程报告结果为“25g(mL)样品中未检出产志贺毒素大肠埃希氏菌”。判定为stx阳性的样品增菌液按5.4、5.5的规定分别进行酸处理及免疫磁珠富集处理。5.4增菌液酸处理
吸取450μL5.3中stx阳性的样品增菌液至1.5mL无菌EP管,10000g离心2min,弃上清,菌体沉淀重悬于450μL的E-buffer溶液中,加入25μL的1mol/L盐酸(pH2.0~2.5),室温条件振荡1h用10μL无菌接种环划线接种于STEC显色培养基或麦康凯琼脂培养基平板,36℃±1℃培养18h~24h。
吸取上述酸处理液100μL至900μLE-buffer溶液进行稀释,涡旋混匀后用10μL无菌接种环划线接种于STEC显色培养基或麦康凯琼脂培养基平板,36℃±1℃培养18h~24h。5.57种重要血清型STEC免疫磁珠富集处理5.5.15.3中判定为stx阳性的样品增菌液除进行5.4酸处理外,还需同时进行免疫磁珠富集,按生产商提供的使用说明对7种重要血清型(O26、O45、O103、O111、O121、O145、O157)的STEC进行了富集处理,并设置具有相应血清型的标准菌株作为阳性对照组。当生产商使用说明与下面的描述存在偏差时,按生产商使用说明进行操作,每个样品换用1根吸管避免交叉污染。5.5.2将微量离心管按样品和标准菌株编号,每个样品使用7个微量离心管(7种免疫磁珠各1管),置于磁板架上。将7种STEC免疫磁珠悬液试剂轻柔振荡混匀后,分别加至相应编号的微量离心管中。5.5.3吸取stx阳性增菌液8mL加入15mL离心管中,10000g离心3min,弃去上清液,加入3mL无菌PBS重悬沉淀并涡旋混匀,10000g离心3min,PBS洗菌步骤重复2~3遍后弃去上清液,菌体沉淀备用。
5.5.4向5.5.3菌体沉淀中加入800μL无菌PBS缓冲液重悬,涡旋混匀后分别吸取100μL菌悬液至5
GB4789.49—2024
5.5.2加有免疫磁珠的7个微量离心管中,并盖好离心管盖。每个样品更换加样吸头,标准菌株必须与样品分开进行实验,以避免交叉污染。每个样品均需进行7种血清型免疫磁珠富集。5.5.5结合:颠倒混匀数次。37℃条件下,在混匀仪上孵育60min,速度设置宜轻柔,使目标菌体与免疫磁珠充分接触。
5.5.6捕获:孵育结束后,将磁板插入磁板架中捕获磁珠,在3min内不断倾斜磁板架,确保悬液中与盖子上的免疫磁珠全部被收集,在微量离心管管壁中间位置可见圆形或椭圆形棕色聚集物。5.5.7磁珠纯化:小心将离心管盖打开,从免疫磁珠聚集物的对侧轻轻移取上清液。当液面接近免疫磁珠聚集物附近时,应缓慢吸液直至液面远离聚集物附近,确保免疫磁珠聚集物不被吸走。如吸取的上清液内含有磁珠,则将其放回微量离心管,并重复5.5.6步骤。此步骤为纯化关键步骤,需要谨慎完成。5.5.8洗涤:向去除液体后的微量离心管中加入1mL无菌PBS缓冲液,涡旋混匀,重复5.5.6和5.5.7步骤的要求回收磁珠。
5.5.9重复步骤5.5.8一次。
5.5.10免疫磁珠重悬:移去磁板,将免疫磁珠聚集物重新悬浮于100μL无菌PBS缓冲液。5.5.11重悬混匀后的免疫磁珠悬液涂布或划线接种于STEC显色培养基或麦康凯琼脂培养基平板,36℃±1℃培养18h~24h。
5.6STEC菌株的分离和复核鉴定
5.6.1分离
观察STEC显色培养基或麦康凯平板上的菌落生长情况及菌落形态。在STEC显色培养基上的菌落特征按产品说明书进行判定;在麦康凯琼脂培养基平板上,典型大肠埃希氏菌为桃红色菌落和无色或淡粉色菌落。分别挑取经酸处理或磁珠富集处理的典型菌落(均不少于5个,少于5个全部挑取),划线接种于TSA琼脂平板进行再次分离纯化。5.6.2stx毒力基因鉴定
5.6.2.1DNA提取
使用接种环挑取TSA琼脂上培养18h~24h的可疑单菌落,悬浮于50μL无菌水中,充分混匀制成菌悬液,99℃±1℃加热15min,室温冷却2min,16000g离心4min,取上清液作为DNA模板。5.6.2.2stx毒力基因和16SrDNA检测stx毒力基因和16SrDNA的检测及结果判定按5.3.3的要求进行。5.6.2.3菌株生化鉴定
stx毒力基因和16SrDNA检测为阳性的菌株,进行大肠埃希氏菌典型生化鉴定。三糖铁斜面产酸或不产酸,底层产酸,靛基质阳性,H2S阴性和尿素酶阴性的培养物为大肠埃希氏菌。三糖铁斜面底层不产酸,或H2S、KCN、尿素酶有任一项为阳性的培养物,均非大肠埃希氏菌。菌株鉴定可选择全自动微生物生化鉴定系统、微生物生化鉴定试剂条(盒)或基质辅助激光解析电离飞行时间质谱仪进行鉴定,按仪器或试剂盒的使用说明进行操作及判定。5.7血清学试验(选做项目)
条件允许的实验室,可对分离到的stx阳性大肠埃希氏菌进行血清学试验。按照生产商提供的使用说明进行O抗原和H抗原鉴定。6
结果与报告
初筛stx阴性,报告“25g(mL)样品中未检出产志贺毒素大肠埃希氏菌”GB 4789.49—2024
初筛stx阳性,但未分离到stx阳性大肠埃希氏菌,报告“25g(mL)样品中未检出产志贺毒素大肠埃希氏菌”。
初筛stx阳性,且分离到stx阳性菌株,经鉴定为大肠埃希氏菌,报告“25g(mL)样品中检出产志贺毒素大肠埃希氏菌“。
GB 4789.49—2024
改良胰蛋白陈大豆液体培养基(mTSB)A.1
A.1.1成分
胰酪蛋白陈
氯化钠
磷酸氢二钾
大豆蛋白陈
葡萄糖
3号胆盐
蒸馏水
A.1.2制法
附录A
培养基和试剂
1000ml
将A.1.1中的各种成分混匀,加热煮沸至完全溶解,调节pH至7.4±0.2,121℃高压灭菌15min。2EC 肉汤培养基(EC)
A.2.1成分
胰酪蛋白陈
3号胆盐
磷酸氢二钾
磷酸二氢钾
氯化钠
蒸馏水
A.2.2制法
1000ml
将A.2.1中的各种成分混匀,加热煮沸至完全溶解,调节pH至6.9±0.2,121℃高压灭菌15min。A.3胰蛋白陈大豆琼脂培养基(TSA)A.3.1成分
胰酪蛋白陈
大豆蛋白陈
氯化钠
蒸馏水
1000ml
A.3.2制法
GB4789.49—2024
将A.3.1中的各种成分混匀,加热煮沸至完全溶解,调节pH至7.3±0.2,121℃高压灭菌15min。冷却至45℃~50℃,倾注平板
A.4STEC显色培养基
1基础培养基成分
牛肉蛋白陈+酵母粉
蒸馏水
增补剂成分
增补剂
A.4.3制法
将A.4.1中成分混匀,加热至100℃使其完全溶解后,冷却至455℃~50℃,制成基础培养基。将A.4.2中增补剂成分加入制好的基础培养基中(如增补剂为粉末状,则一瓶加入10mL无菌水搅拌均匀),轻轻摇动使其充分混匀,制作平板。培养基的pH为6.9±0.2。5麦康凯琼脂培养基(MAC)
A.5.1成分
牛肉蛋白陈
3号胆盐
氯化钠
中性红
结晶紫
蒸馏水
A.5.2制法
1000ml
将A.5.1中的各种成分混匀,加热煮沸至完全溶解,调节pH至7.2±0.2.121℃高压灭菌15min。冷却至45℃~50℃,倾注平板。
5脑心浸出液肉汤(BHI)-50%甘油A.6
A.6.1成分
胰酪蛋白陈
GB4789.49—2024
葡萄糖
牛脑心粉
氯化钠
磷酸氢二钠
蒸馏水
2制法
将A.6.1中的各种成分混匀,加热煮沸至完全溶解,加入500mL甘油,按每管1mL分装于冻存管中,121℃高压灭菌15min(可依据实际用量按比例缩放配制)。A.75%Chelex-100溶液
无菌称取5gChelex-100干粉,加100mL灭菌纯水溶解,依据说明书置于2℃~5℃保存。A.8E-buffer溶液
A.8.1成分
牛血清白蛋白
吐温20
牛肉蛋白陈
氯化钠
磷酸二钠
磷酸二氢钾
蒸馏水
A.8.2制法
1000ml
将A.8.1中各种成分充分溶解混匀,再用0.22μm孔径的无菌滤膜过滤除菌(可依据实际用量按比例缩放配制),依据说明书置于2℃~5℃冷藏备用。A.9
TE-buffer溶液
A.9.1成分
1 mol/LTrispH 7.5
0. 05 mol/ L EDTA
PCR级水(无DNA酶/RNA酶)
A.9.2制法
100μl
将A.9.1中各种成分混匀,高温高压灭菌后,室温保存(可依据实际用量按比例缩放配制)。A.10
PBS缓冲液
A.10.1成分
氯化钠
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
GB 4789.49—2024
食品安全国家标准
食品微生物学检验
产志贺毒素大肠埃希氏菌检验
2024-02-08发布bZxz.net
中华人民共和国国家卫生健康委员会国家市场监督管理总局
2024-08-08实施
1范围
食品安全国家标准
食品微生物学检验
产志贺毒素大肠埃希氏菌检验
GB4789.49—2024
本标准规定了食品中产志贺毒素大肠埃希氏菌(Shigatoxin-producingEscherichiacoli,STEC)的检验方法。
本标准适用于食品中产志贺毒素大肠埃希氏菌的检验。2设备和材料
除微生物实验室常规灭菌及培养设备外,其他设备和材料如下。2.1恒温培养箱:36℃±1℃、44℃±1℃。2.2 冰箱:2℃~5℃、-18℃~-20℃。2.3天平:感量为 0.001 g。
2.4均质器。
2.5旋涡振荡器。
2.6恒温水浴箱50℃~55℃、恒温金属浴99℃±1℃。2.7离心机:最大转速至少16000g。2.8实时荧光定量PCR仪。
2.9混匀仪。
2.10无菌吸管:1mL(具0.01mL刻度)、10mL(具0.1mL刻度)。2.11
电动移液枪或吸耳球。
无菌具塞锥形瓶:容量250mL、500mL、1000mL。无菌培养血:直径90mm。
无菌均质袋:带滤网,无菌均质杯。平盖八联排管或96孔PCR微孔板。磁珠分离富集装置。
微量移液器及吸头:0.2μ~2μL、2μ~20μL、20μl~200μl、100μ~1000μl。10μL无菌接种环。
1.5mL无菌EP管,无菌微量离心管,无菌15mL离心管。0.22μm孔径无菌过滤膜。
全自动微生物生化鉴定系统
基质辅助激光解析电离飞行时间质谱仪(MALDI-TOFMS)。3培养基和试剂
改良胰蛋白陈大豆液体培养基(mTSB):见A.1。3.2EC肉汤培养基(EC):见A.2。3.3胰蛋白陈大豆琼脂培养基(TSA):见A.3。3.4STEC显色培养基:见A.4。
GB4789.49—2024
3.5麦康凯琼脂培养基(MAC):见A.5。3.6脑心浸出液肉汤(BHI)-50%甘油:见A.6。3.70.85%灭菌生理盐水。
3.85%Chelex-100溶液见A.7。
3.9E-buffer溶液:见A.8。
1mol/L盐酸溶液。
1×TE缓冲液:见A.9。
无菌PBS缓冲液:见A.10。
实时荧光定量PCR反应体系配制用试剂(10×buffer、dNTPs、Tag酶和ddH2O)。STEC免疫磁珠分离相关试剂或等效试剂盒。3.14
生化鉴定试剂盒或生化鉴定相关试剂。具有菌种保藏资质单位提供的志贺毒素基因(Shigatoxingene,stx)阳性大肠埃希氏菌标准菌3.16
株,即携带stx1和/或stx2,如O157H7[CMCC(B)44939,GDMCC1.2702或等效菌株]和stx阴性大肠埃希氏菌标准菌株,即不携带stx1和stx2,如CMCC(B)44102,GDMCC1.223或等效菌株。免疫磁珠富集处理的标准菌株:血清型O26型大肠埃希氏菌标准菌株,如CMCC(B)43221、GDMCC1.3807或等效菌株;血清型O45,CMCC(B)43242,GDMCC1.3808或等效菌株;血清型O103,CMCC(B)43234GDMCC1.3809或等效菌株;血清型O111,CMCC(B)43211,GDMCC1.3810或等效菌株;血清型O121CMCC(B)43228,GDMCC1.3811或等效菌株;血清型O145,CMCC(B)43243,GDMCC1.3812或等效菌株。4检验程序
产志贺毒素大肠埃希氏菌检验程序见图1。检样
25g(或25mL)样品+225mLEC(或mTSB),均质后培养44℃1℃
18h~24h
stx毒力基因初筛
SX初阳性
x初筛阴性
sx阳性增菌波
酸处理
接种MAC或STEC显色培养基
36℃±1℃
18h~24h
s 阳性增菌液
免疫磁珠富集
挑取不少于5个可疑菌落(少于5个则全部挑取),接种TSA培养基36℃±1℃
18h~24h
可聚菌stx毒力基因和16SDNA确认生化鉴定或基质辅助激光解析电高飞行时间质谱监定报告结果
图1产志贺毒素大肠埃希氏菌检验程序5操作步骤
5.1样品制备
5.1.1样品保存
GB4789.49—2024
样品采集后应尽快送往实验室进行检测,如不能及时检测,应将待检样品根据样品贮存要求进行保存,无特殊要求的,应置于2℃~5℃冰箱中冷藏,24h内完成检测。5.1.2固态或半固态样品
以无菌操作称取检样25g,加入装有225mLEC(或mTSB)的无菌带滤网均质袋内,用拍击式均质器均质1min~2min;或放入盛有225mLEC(或mTSB)的无菌均质杯中,用旋转刀片式均质器以8000r/min~10000r/min均质1min~2min,制成1:10的样品匀液。5.1.3液态样品
以无菌操作量取检样25mL,加入装有225mLEC(或mTSB)的无菌均质袋或无菌锥形瓶中,充分混匀制成1:10的样品匀液。
5.2增菌
将5.1制备的样品匀液44℃±1℃下培养18h~24h。同时设置对照试验,以携带stx1和/或stx2的大肠埃希氏菌标准菌株在EC(或mTSB)中培养为阳性对照,以不携带stx1和 stx2的大肠埃希氏菌标准菌株在EC(或mTSB)中培养为阴性对照,并做培养基空白对照。5.3stx毒力基因初筛
5.3.1试验环境与过程控制
实时荧光定量PCR试验环境条件和过程控制应按GB/T27403一2008规定的要求执行。5.3.2DNA模板制备
混匀后吸取1mL增菌液(油脂含量高的样品不混匀,在距离液面下1cm处吸取)置于1.5mLEP管中,500g离心1min。取上清液(避免带入底层沉淀物)至新的EP管中,10000g离心5min,弃去上清液。向沉淀中加入500uL无菌生理盐水,重悬,10000g离心3min,弃去上清液。向沉淀中加入100μL的1×TE缓冲液,重悬(若样本为生肉制品,则用5%的Chelex-100溶液替代TE)。99℃±1℃加热15min,室温冷却2min,10000g离心4min,取上清液作为DNA模板。4h内完成分析,若不能及时分析则于-20℃短暂保存。注:也可用商品化DNA提取试剂盒按其说明书要求提取制备DNA模板。5.3.3实时荧光定量PCR初筛
5.3.3.1引物及探针
见表1。
GB4789.49—2024
16SrDNA
产志贺毒素大肠埃希氏菌实时荧光定量PCR引物及探针信息引物和探针序列(5'-3\)a
stx2 p
16SrDNAF
16SrDNAR
16SrDNAP
GCAGATAAATCGCCATTCG
TGTTGT ACG AAA TCCCCT CTG
HEX-AGAGCG ATGTTACGGTTTGTTACTG-BHQ1TTT GTY ACW GTSAYA GCW GAA GCY TTACGCCC CAG TTC ARH GTR AGR TCM ACD TCFAM-YCG WCH GGC RCT GTC TGA RRCWKC TCC-BHQ1CCT CTT GCC ATC GGA TGT G
GGCTGGTCATCCTCTCAGACC
CY5-GTG GGG TAA CGG CTC ACC TAG GCG AC-BHQ2序列中Y为(C,T),W 为(A,T),R为(A,G),S为(G,C),D为(A,G,T),M 为(A,C),H 为(A,T,C),K为(G,T) 。
对照设置
按照5.2的规定进行对照设置。
实时荧光定量PCR反应体系
见表2,如选择商品化实时荧光定量PCR试剂盒时,可按照试剂盒说明书进行操作。表2产志贺毒素大肠埃希氏菌实时荧光定量PCR反应体系试剂
10× buffer
stx1上游引物(stx1F)
stx1下游引物(stx1R)
stx1探针(stx1P)
stx2上游引物(stx2F)
stx2下游引物(stx2R)
stx2探针(stx2P)
16SrDNA上游引物(16SrDNAF)
16SrDNA下游引物(16SrDNAR)
16SrDNA探针(16SrDNAP)
Taq酶
DNA模板
总体积
工作液浓度
2.5mmol/L
50 μmol/L
50 μmol/L
50μmol/L
50 μmol/L
50 μmol/L
50 μmol/L
20 μmol/L
20 μmol/L
5 μmol/L
5u/μl
反应体积/μL
stx毒力基因初筛时,引物体系中不加入16SrDNA引物和探针,同时ddH2O体积增加0.4μL,增至17.6μL。在有效性原则和结果判定中,也无需考虑16SrDNA指标。4
5.3.3.4实时荧光定量PCR反应程序GB 4789.49—2024
预变性:95℃10min;变性:95℃15s;退火:60℃40s;延伸:72℃1min40个循环。在延伸阶段于3条荧光检测通道中,分别采集已标记的荧光信号。5.3.3.5结果有效性原则
若同一批次实验中同时满足下列要求,则实时荧光定量PCR实验结果有效;否则实时荧光定量PCR实验结果无效,需重新进行实验。空白对照:stx1、stx2和16SrDNA基因均无荧光对数增长(16SrDNA基因可能在35个循环a
后出现较弱的荧光对数增长);阴性对照:stx1和stx2均无荧光对数增长;16SrDNA基因有荧光对数增长,相应的Ctb)
值30;
阳性对照:stx1、stx2和16SrDNA基因均有荧光对数增长,相应的Ct值<30。5.3.3.6
实时荧光定量PCR结果判定
在符合5.3.3.5结果有效性原则的情况下,待检样品进行检测时,若:a)stx1和stx2的Ct值≥40,则判定为stx阴性;stx1或stx2的Ct值<3516SrDNA基因的Ct值<35,则判定为stx阳性;b)
stx1和stx2的Ct值均≥35且<40,应重新进行实时荧光定量PCR扩增实验。再次扩增后cs
stx1或stx2的Ct值<40,16SrDNA基因的Ct值<35,判定为stx阳性;若 stx1和stx2的Ct值≥40,则判定为stx阴性。
判定为stx阴性的样品,按流程报告结果为“25g(mL)样品中未检出产志贺毒素大肠埃希氏菌”。判定为stx阳性的样品增菌液按5.4、5.5的规定分别进行酸处理及免疫磁珠富集处理。5.4增菌液酸处理
吸取450μL5.3中stx阳性的样品增菌液至1.5mL无菌EP管,10000g离心2min,弃上清,菌体沉淀重悬于450μL的E-buffer溶液中,加入25μL的1mol/L盐酸(pH2.0~2.5),室温条件振荡1h用10μL无菌接种环划线接种于STEC显色培养基或麦康凯琼脂培养基平板,36℃±1℃培养18h~24h。
吸取上述酸处理液100μL至900μLE-buffer溶液进行稀释,涡旋混匀后用10μL无菌接种环划线接种于STEC显色培养基或麦康凯琼脂培养基平板,36℃±1℃培养18h~24h。5.57种重要血清型STEC免疫磁珠富集处理5.5.15.3中判定为stx阳性的样品增菌液除进行5.4酸处理外,还需同时进行免疫磁珠富集,按生产商提供的使用说明对7种重要血清型(O26、O45、O103、O111、O121、O145、O157)的STEC进行了富集处理,并设置具有相应血清型的标准菌株作为阳性对照组。当生产商使用说明与下面的描述存在偏差时,按生产商使用说明进行操作,每个样品换用1根吸管避免交叉污染。5.5.2将微量离心管按样品和标准菌株编号,每个样品使用7个微量离心管(7种免疫磁珠各1管),置于磁板架上。将7种STEC免疫磁珠悬液试剂轻柔振荡混匀后,分别加至相应编号的微量离心管中。5.5.3吸取stx阳性增菌液8mL加入15mL离心管中,10000g离心3min,弃去上清液,加入3mL无菌PBS重悬沉淀并涡旋混匀,10000g离心3min,PBS洗菌步骤重复2~3遍后弃去上清液,菌体沉淀备用。
5.5.4向5.5.3菌体沉淀中加入800μL无菌PBS缓冲液重悬,涡旋混匀后分别吸取100μL菌悬液至5
GB4789.49—2024
5.5.2加有免疫磁珠的7个微量离心管中,并盖好离心管盖。每个样品更换加样吸头,标准菌株必须与样品分开进行实验,以避免交叉污染。每个样品均需进行7种血清型免疫磁珠富集。5.5.5结合:颠倒混匀数次。37℃条件下,在混匀仪上孵育60min,速度设置宜轻柔,使目标菌体与免疫磁珠充分接触。
5.5.6捕获:孵育结束后,将磁板插入磁板架中捕获磁珠,在3min内不断倾斜磁板架,确保悬液中与盖子上的免疫磁珠全部被收集,在微量离心管管壁中间位置可见圆形或椭圆形棕色聚集物。5.5.7磁珠纯化:小心将离心管盖打开,从免疫磁珠聚集物的对侧轻轻移取上清液。当液面接近免疫磁珠聚集物附近时,应缓慢吸液直至液面远离聚集物附近,确保免疫磁珠聚集物不被吸走。如吸取的上清液内含有磁珠,则将其放回微量离心管,并重复5.5.6步骤。此步骤为纯化关键步骤,需要谨慎完成。5.5.8洗涤:向去除液体后的微量离心管中加入1mL无菌PBS缓冲液,涡旋混匀,重复5.5.6和5.5.7步骤的要求回收磁珠。
5.5.9重复步骤5.5.8一次。
5.5.10免疫磁珠重悬:移去磁板,将免疫磁珠聚集物重新悬浮于100μL无菌PBS缓冲液。5.5.11重悬混匀后的免疫磁珠悬液涂布或划线接种于STEC显色培养基或麦康凯琼脂培养基平板,36℃±1℃培养18h~24h。
5.6STEC菌株的分离和复核鉴定
5.6.1分离
观察STEC显色培养基或麦康凯平板上的菌落生长情况及菌落形态。在STEC显色培养基上的菌落特征按产品说明书进行判定;在麦康凯琼脂培养基平板上,典型大肠埃希氏菌为桃红色菌落和无色或淡粉色菌落。分别挑取经酸处理或磁珠富集处理的典型菌落(均不少于5个,少于5个全部挑取),划线接种于TSA琼脂平板进行再次分离纯化。5.6.2stx毒力基因鉴定
5.6.2.1DNA提取
使用接种环挑取TSA琼脂上培养18h~24h的可疑单菌落,悬浮于50μL无菌水中,充分混匀制成菌悬液,99℃±1℃加热15min,室温冷却2min,16000g离心4min,取上清液作为DNA模板。5.6.2.2stx毒力基因和16SrDNA检测stx毒力基因和16SrDNA的检测及结果判定按5.3.3的要求进行。5.6.2.3菌株生化鉴定
stx毒力基因和16SrDNA检测为阳性的菌株,进行大肠埃希氏菌典型生化鉴定。三糖铁斜面产酸或不产酸,底层产酸,靛基质阳性,H2S阴性和尿素酶阴性的培养物为大肠埃希氏菌。三糖铁斜面底层不产酸,或H2S、KCN、尿素酶有任一项为阳性的培养物,均非大肠埃希氏菌。菌株鉴定可选择全自动微生物生化鉴定系统、微生物生化鉴定试剂条(盒)或基质辅助激光解析电离飞行时间质谱仪进行鉴定,按仪器或试剂盒的使用说明进行操作及判定。5.7血清学试验(选做项目)
条件允许的实验室,可对分离到的stx阳性大肠埃希氏菌进行血清学试验。按照生产商提供的使用说明进行O抗原和H抗原鉴定。6
结果与报告
初筛stx阴性,报告“25g(mL)样品中未检出产志贺毒素大肠埃希氏菌”GB 4789.49—2024
初筛stx阳性,但未分离到stx阳性大肠埃希氏菌,报告“25g(mL)样品中未检出产志贺毒素大肠埃希氏菌”。
初筛stx阳性,且分离到stx阳性菌株,经鉴定为大肠埃希氏菌,报告“25g(mL)样品中检出产志贺毒素大肠埃希氏菌“。
GB 4789.49—2024
改良胰蛋白陈大豆液体培养基(mTSB)A.1
A.1.1成分
胰酪蛋白陈
氯化钠
磷酸氢二钾
大豆蛋白陈
葡萄糖
3号胆盐
蒸馏水
A.1.2制法
附录A
培养基和试剂
1000ml
将A.1.1中的各种成分混匀,加热煮沸至完全溶解,调节pH至7.4±0.2,121℃高压灭菌15min。2EC 肉汤培养基(EC)
A.2.1成分
胰酪蛋白陈
3号胆盐
磷酸氢二钾
磷酸二氢钾
氯化钠
蒸馏水
A.2.2制法
1000ml
将A.2.1中的各种成分混匀,加热煮沸至完全溶解,调节pH至6.9±0.2,121℃高压灭菌15min。A.3胰蛋白陈大豆琼脂培养基(TSA)A.3.1成分
胰酪蛋白陈
大豆蛋白陈
氯化钠
蒸馏水
1000ml
A.3.2制法
GB4789.49—2024
将A.3.1中的各种成分混匀,加热煮沸至完全溶解,调节pH至7.3±0.2,121℃高压灭菌15min。冷却至45℃~50℃,倾注平板
A.4STEC显色培养基
1基础培养基成分
牛肉蛋白陈+酵母粉
蒸馏水
增补剂成分
增补剂
A.4.3制法
将A.4.1中成分混匀,加热至100℃使其完全溶解后,冷却至455℃~50℃,制成基础培养基。将A.4.2中增补剂成分加入制好的基础培养基中(如增补剂为粉末状,则一瓶加入10mL无菌水搅拌均匀),轻轻摇动使其充分混匀,制作平板。培养基的pH为6.9±0.2。5麦康凯琼脂培养基(MAC)
A.5.1成分
牛肉蛋白陈
3号胆盐
氯化钠
中性红
结晶紫
蒸馏水
A.5.2制法
1000ml
将A.5.1中的各种成分混匀,加热煮沸至完全溶解,调节pH至7.2±0.2.121℃高压灭菌15min。冷却至45℃~50℃,倾注平板。
5脑心浸出液肉汤(BHI)-50%甘油A.6
A.6.1成分
胰酪蛋白陈
GB4789.49—2024
葡萄糖
牛脑心粉
氯化钠
磷酸氢二钠
蒸馏水
2制法
将A.6.1中的各种成分混匀,加热煮沸至完全溶解,加入500mL甘油,按每管1mL分装于冻存管中,121℃高压灭菌15min(可依据实际用量按比例缩放配制)。A.75%Chelex-100溶液
无菌称取5gChelex-100干粉,加100mL灭菌纯水溶解,依据说明书置于2℃~5℃保存。A.8E-buffer溶液
A.8.1成分
牛血清白蛋白
吐温20
牛肉蛋白陈
氯化钠
磷酸二钠
磷酸二氢钾
蒸馏水
A.8.2制法
1000ml
将A.8.1中各种成分充分溶解混匀,再用0.22μm孔径的无菌滤膜过滤除菌(可依据实际用量按比例缩放配制),依据说明书置于2℃~5℃冷藏备用。A.9
TE-buffer溶液
A.9.1成分
1 mol/LTrispH 7.5
0. 05 mol/ L EDTA
PCR级水(无DNA酶/RNA酶)
A.9.2制法
100μl
将A.9.1中各种成分混匀,高温高压灭菌后,室温保存(可依据实际用量按比例缩放配制)。A.10
PBS缓冲液
A.10.1成分
氯化钠
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。