GB 535-1995
基本信息
标准号: GB 535-1995
中文名称:硫酸铵
标准类别:国家标准(GB)
英文名称: Ammonium sulfate
标准状态:现行
发布日期:1995-12-20
实施日期:1996-08-01
出版语种:简体中文
下载格式:.rar.pdf
下载大小:539849
相关标签: 硫酸铵

标准分类号
标准ICS号:化工技术>>无机化学>>71.060.50盐
中标分类号:化工>>化肥、农药>>G21化肥、化学土壤调理剂
出版信息
出版社:中国标准出版社
页数:平装16开, 页数:17, 字数:33千字
标准价格:13.0 元
出版日期:1996-08-01
相关单位信息
首发日期:1965-01-19
复审日期:2004-10-14
起草人:钟凤园
起草单位:上海化工研究院
提出单位:中华人民共和国化学工业部
发布部门:国家技术监督局
主管部门:中国石油和化学工业协会
标准简介
本标准规定了硫酸铵的技术要求、试验方法、检验规则以及标志、包装、运输和贮存。本标准适用于由合成氨与硫酸中和所制得的硫酸铵、炼焦所制得的副产硫酸铵和其他副产硫酸铵。 GB 535-1995 硫酸铵 GB535-1995 标准下载解压密码:www.bzxz.net
标准图片预览



标准内容
中华人民共和国国家标准
Ammonium sulphate
主题内容与适用范围
代 07
本标准规定了硫酸铵的技术要求、试验方法、检验规则以及标志、包装、运输和贮存。本标准适用于由合成氨与硫酸中利所制得的硫酸铵、炼焦所制得的副产硫酸铵、本标准不适川于火电厂脱硫法或其它烟汽脱硫法生产的副产硫酸铵产品。分子式:(NH,),SO)
相对分子质量:132、141(根据1989年国际相对原子质量)2
引用标准
GB/T 601
GB/T 602
GB/T 603
GB/T 611
GB 1250
化学试剂滴定分析(容量分析)用标准溶液的制备化学试剂杂质测定用标准溶液的制备化学试剂试验方法中所用制剂及制品的制备化学试剂密度测定通用方法
极限数值的表示方法和判定方法分析实验室用水规格和试验方法GB/T 6682
G138569固体化学肥料包装
3技术要求
3.1硫酸铵质量应符合表1要求:表1
优等品
白色结晶,无可见机械杂质
氮()含基(以干基计)
水分(H.0)
游离酸(H2S())含量
铁(Fc)含量
砷(As)含量
重金属(以Pb计)含凰:
水不溶物含量
-等品
无可见机械杂质
注:1)硫酸铵作农业用时可不检验铁、砷、重金属和水不溶物含量等指标。国家技术监督局1995-12-20批准20
合格品
1996-08-01实施
4试验方法
GB 535--- 1995
分析中,除另有说明外,均使用分析纯试剂;所使用的水应符合GB/T6682中三级水(仅测定pH值范围和电导率)规格;所有滴定分析用标准溶液按GB/T601配制和标定;所有杂质测定用标准溶液按GB/T602配制;所有试验方法中所用制剂及制品按GB/T603配制。4.1外观
目测。
4.2氮含量的测定蒸馏后滴定法(仲裁法)。本方法等效采用ISO333275《工业用硫酸铵-~氮态氮含量的测定--蒸馏后滴定法》。4.2.1方法提要
硫酸铵在碱性溶液中蒸馏出的氨,用过量的硫酸标准滴定溶液吸收,在指示剂存在下,以氢氧化钠标准滴定溶液回滴过量的硫酸。4.2.2试剂和材料
4.2.2.1氢氧化钠(GB/T629),450g/L溶液;4.2.2.2硫酸(GB/T625)标准滴定溶液,c÷H,SO,)=0.5mol/L;4.2.2.3氢氧化钠标准滴定溶液,c(NaOH)=0.5mol/I.;4.2.2.4甲基红-亚甲基蓝混合指示剂;溶解0.1g甲基红(HG/T3-958)于50mL乙醇(GB/T679)中,再加入0.05g亚甲基蓝,溶解后,用相同的乙醇稀释至100mL。
4.2.2.5硅脂或其他不含氮的润滑脂。4.2.3仪器、设备
般实验室仪器和:
4.2.3.1蒸馏仪器
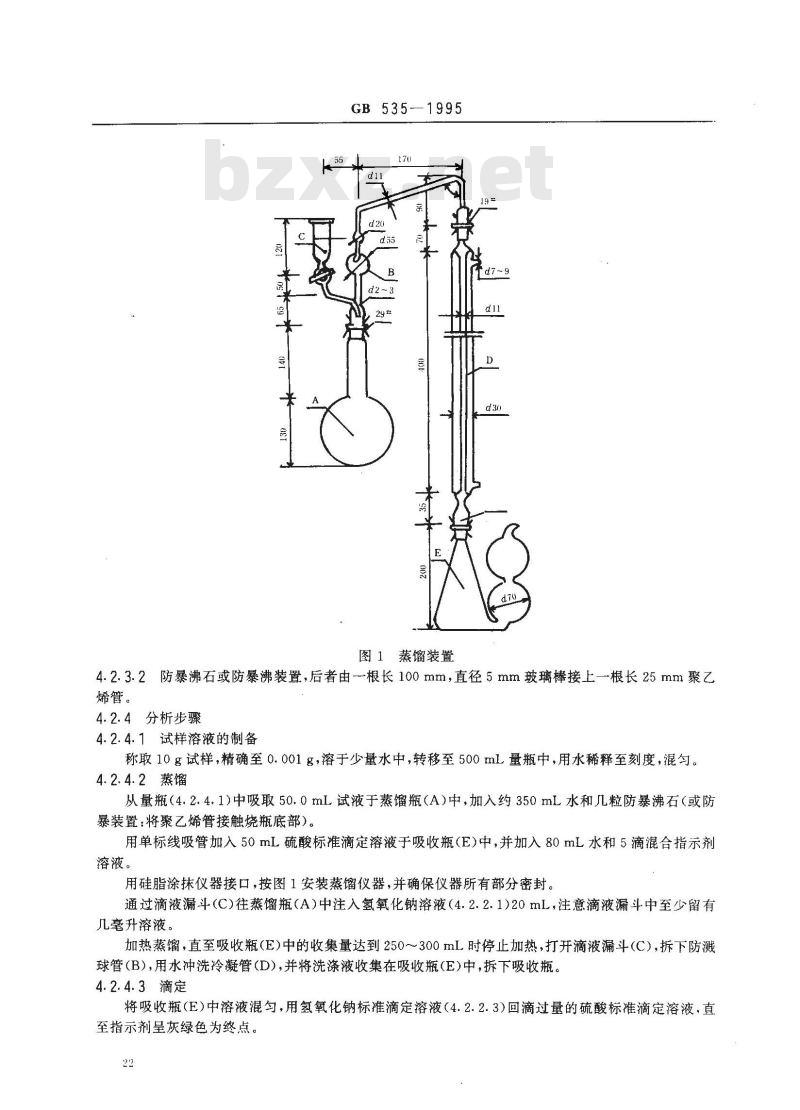
本方法使用的仪器如图1所示:
蒸馏瓶(A):容积为1L;
防溅球管(B):平行地插入滴液漏斗(C);滴液漏斗(C):容积为50mL;
直形冷凝管(D):有效长度约400mm;吸收瓶(E):容积为500mI、瓶侧连接双连球。21
GB535-1995
图1蒸馏装置
4.2.3.2防暴沸石或防暴沸装置,后者由根长100mm,直径5mm玻璃棒接上一根长25mm聚乙烯管。
4.2.4分析步骤
4.2.4.1试样溶液的制备
称取10g试样,精确至0.001g,溶于少量水中,转移至500mL量瓶中,用水稀释至刻度,混匀。4.2.4.2蒸馏
从量瓶(4.2.4.1)中吸取50.0mL试液于蒸馏瓶(A)中,加入约350mL水和几粒防暴沸石(或防暴装置:将聚乙烯管接触烧瓶底部)。用单标线吸管加入50mL硫酸标准滴定溶液于吸收瓶(E)中,并加入80mL水和5滴混合指示剂溶液。
用硅脂涂抹仪器接口,按图1安装蒸馏仪器,并确保仪器所有部分密封。通过滴液漏斗(C)往蒸馏瓶(A)中注入氢氧化钠溶液(4.2.2.1)20mL,注意滴液漏斗中至少留有几毫升溶液。
加热蒸馏,直至吸收瓶(E)中的收集量达到250~300mL时停止加热,打开滴液漏斗(C),拆下防溅球管(B),用水冲洗冷凝管(D),并将洗涤液收集在吸收瓶(E)中,拆下吸收瓶。4.2.4.3滴定
将吸收瓶(E)中溶液混匀,用氢氧化钠标准滴定溶液(4.2.2.3)回滴过量的硫酸标准滴定溶液,直至指示剂呈灰绿色为终点。
4.2.4.4空白试验
GB535-1995
在测定的同时,除不加试样外,按4.2.4.1~4.2.4.3完全相同的分析步骤、试剂和用量进行平行操作。
4.2.5分析结果的表述
氮(N)含量(ri,以干基计),以质量百分数(%)表示,按式(1)计算:T
(V - V1)c × 0. 014 01
100-H,0
(V2 - Vi)c × 1 401
m(100 -
式中:V,—一测定时使用氢氧化钠标准滴定溶液的体积,mL,V--—空白试验使用氢氧化钠标准滴定溶液的体积,mL;氢氧化钠标准滴定溶液实际浓度,mol/L;m—试样的质量,g;
H,O—试样中水的百分含量;
(1)
0.01401-—与1.00mL氢氧化钠标准滴定溶液Cc(NaOH)=1.000mol/LJ相当的以克表示的氮的质量。
4.2.6允许差
取平行测定结果的算术平均值为测定结果,平行测定的绝对差值不大于0.06%;不同实验室测定结果的绝对差值不大于0.12%。4.3氮含量的测定甲醛法
4.3.1方法提要
在中性溶液中,铵盐与甲醛作用生成六次甲基四胺和相当于铵盐含量的酸,在指示剂存在下,用氢氧化钠标准滴定溶液滴定。
4.3.2试剂和材料
4.3.2.1氢氧化钠(GB/T629),4g/L溶液;4.3.2.2氢氧化钠标准滴定溶液c(NaOH)=0.5mol/L;4.3.2.3甲醛,250g/L溶液;
按附录A配制和测定。
4.3.2.4甲基红(HG/T3—-958)指示液,1g/L乙醇(GB/T678)溶液;4.3.2.5酚酸(GB/T10729)指示液,10g/L乙醇(GB/T678)溶液。4.3.3分析步骤
4.3.3.1试样溶液的制备
称取1g试样,精确至0.001g,置于250mL锥形瓶中,加100~120mL水溶解,再加1滴甲基红指示剂溶液,用氢氧化钠溶液(4.3.2.1)调节至溶液呈橙色。4.3.3.2测定
加入15mL甲醛溶液至试液(4.3.3.1)中,再加入3滴酚酸指示剂溶液,混勾。放置5min,用氢氧化钠标准滴定溶液(4.3.2.2)滴定至浅红色,经1min不消失(或滴定至pH计指示pH8.5)为终点。4.3.3.3空白试验
在测定的同时,除不加试样外,按4.3.3.1和4.3.3.2完全相同的分析步骤,试剂和用量进行平行操作。
4.3.4分析结果的表述
氮(N)含量(2,以干基计),以质量百分数(%)表示,按式(2)计算:23
式中:V,-
GB535—1995
(V, -- V,) : c X 0. 014 01
× 100
100-X,0
(V1-V2) ·c X 140. 1
m(100 -- XH,0)
测定时使用氢氧化钠标准滴定溶液的体积,mL;V2—一空白试验使用氢氧化钠标准滴定溶液的体积,mL;氢氧化钠标准滴定溶液实际浓度,mol/I.;m-
---试样的质量,g;
TH,O—-试样中水的百分含量;
.(2)
与1.00ml.氢氧化钠标准滴定溶液Cc(NaOH)=1.000mol/L)相当的以克表示的氮的质量。
4.3.5允许差
取平行测定结果的算术平均值为测定结果,平行测定结果的绝对差值不大于0.06%;不同实验室测定结果的绝对差值不大于0.12%。4.4水分的测定重量法
4.4.1方法提要
在一定温度的电热恒温干燥箱内,将试样烘干至恒重,然后测定试样减少的质量。本方法适用于所取试样中水分质量不小于0.001g。4.4.2仪器、设备
-般实验室仪器和:
4.4.2.1带盖磨口称量瓶,直径50mm,高30mm;4.4.2.2电热恒温干燥箱,能维持温度105士2℃。4.4.3分析步骤
称取5g试样,精确至0.0002g,置于预先在105士2℃于燥至恒重的称量瓶(4.4.2.1)中,将称量瓶盖子稍微打开,置称量瓶于干燥箱中接近于温度计的水银球水平位置上,在105土2C的温度中干燥30min后,取出称量瓶,盖上盖子,在干燥器中冷却至室温称重,重复操作,直至恒重。取最后一次测量值作为测定结果。
4.4.4分析结果的表述
水分(H20)(:),以质量百分数(%)表示,按式(3)计算:3
ml - m2 × 100
式中:m1--称量瓶及试样在干燥前质量,g;m.称量瓶及试样在干燥后质量.
.--试样的质量.。免费标准bzxz.net
4.4.5允许差
取平行测定结果的算术平均值作为测定结果,平行测定结果的绝对差值不大于0.05%。4.5游离酸含量的测定·容量法
本方法等效采用ISO2993--74《工业用硫酸铵游离酸度的测定滴定法》。4.5.1方法提要
试样溶液中的游离酸,在指示剂存在下,用氢氧化钠标准滴定溶液滴定。4.5.2试剂和材料
4.5.2.1氢氧化钠(GB/T629)标准滴定溶液.c(Na()H)=0.1mol/L;24
(3)
GB 5351995
4.5.2.2盐酸(GB/T622)溶液,c(HC1)=0.1mol/I;4.5.2.3甲基红-亚甲基蓝混合指示剂配制方法同4.2.2.4。
4.5.2.4分析中用的水
在1000mL水中,加2~3滴指示剂溶液(4.5.2.3),如溶液不呈灰绿色,则用氢氧化钠溶液(4.5.2.1)或盐酸溶液(4.5.2.2),调节至溶液呈灰绿色(或酸度计指示在pH5.4~5.6)。4.5.3仪器、设备
一般实验室仪器和:
4.5.3.1微量滴定管,5mL,分度值0.02mL;4.5.3.2酸度计。
4.5.4分析步骤
称取10g试样,精确至0.01g,置于100ml烧杯中,加50ml水(4.5.2.4)溶解,如果溶液混浊,可用中速滤纸过滤,用水(4.5.2.4)洗涤烧杯和滤纸,收集滤液于250mL的锥形瓶中。加1~2滴指示剂溶液于滤液中,用氢氧化钠标准滴定溶液滴定至灰绿色为终点。若试液有色,终点难以观察,也可滴定至酸度计指示pH5.4~5.6为终点。4.5.5分析结果的表述
游离酸(H,SO)含量(x4),以质量百分数(%)表示,按式(4)计算:× 0. 049 0 × 100 = 9
一氢氧化钠标准滴定溶液实际浓度,mol/L;式中:c-
V—一测定时使用氢氧化钠标准滴定溶液体积,mL,m—试样的质量,g;
cV × 4. 90
0.0490——与1.00mL氢氧化钠标准滴定溶液Lc(NaOH)=1.000mol/L>相当的以克表示的硫酸的质量。
4.5.6允许差
取平行测定结果的算术平均值为测定结果,平行测定结果的绝对差值不大于:游离酸含量,%
绝对差值,%
不同实验室测定结果的绝对差值不大于:游离酸含量,%
4.6铁含量的测定邻菲啰啉分光光度法4.6.1方法提要
绝对差值,%
试样中的铁用盐酸溶解后,以抗坏血酸将三价铁还原为二价铁,在缓冲介质(pH2~9)中,二价铁与邻菲啰啉生成橙红色配合物,在最大吸收波长510nm处,用分光光度计测定其吸光度。本方法适用于测定铁含量在 10~100 μg 范围内的试液。4.6.2试剂和材料
采用说明:
1]ISO2993--74采用甲基紫(pH5.25.6)或其他相同pH值范围的指示剂,本标准采用甲基红-亚甲基蓝混合指示剂(变色点pH5.4)。
GB 535--1995
盐酸(GB/T 622)溶液,c(HC1)一1 mol/L;4.6.2.1
4.6.2.2硫酸(GB/T625);
4.6.2.3氨水(GB/T631),1+2溶液;4.6.2.4抗坏血酸溶液,100g/L,该溶液一周内稳定;4.6.2.5乙酸(GB/T676)-乙酸钠(GB/T693)缓冲溶液,pH=4.5;4.6.2.6邻菲啰啉(GB/T1293)溶液,1g/L;该溶液避光保存,仅能使用无色溶液。4.6.2.7铁标准溶液,0.100g/L;称取0.863g硫酸铁铵(GB/T1279),精确至0.001g,溶于200mL水中,加10mL硫酸(4.6.2.2),定量转移到1000mL量瓶中,稀释至刻度,混匀。此溶液1mL含0.100mg铁。4.6.2.8铁标准溶液,0.010g/L;吸取50.0mL铁标准溶液(4.6.2.7)于500mL量瓶中,稀释至刻度,混匀。此溶液1mL含10μg铁,使用时制备。
4.6.3仪器、设备
一般实验室仪器和:
4.6.3.1分光光度计,带有3cm光路长度的吸收池;4.6.3.2广范pH试纸或pH计。
4.6.4分析步骤
4.6.4.1标准曲线的绘制
a.标准比色溶液的制备
按表2所示,在一系列100mL烧杯中,分别加入给定体积的铁标准溶液(4.6.2.8。表2
铁标准溶液(4.6.2.8)
相应的铁含量
每个烧杯都按下述规定同时同样处理:铁标准溶液(4.6.2.8)
相应的铁含量
加水至30mL,用盐酸溶液(4.6.2.1)或氨水溶液(4.6.2.3)调节溶液的pH值接近2,定量地将溶液转移到100mL量瓶中,加1mL抗坏血酸溶液,20mL缓冲溶液和10.0mL邻菲啰啉溶液,用水稀释至刻度,混匀,放置15~30min。b.光度测定
用3cm吸收池,以铁含量为零的溶液作为参比溶液,在波长510nm处,用分光光度计测定标准比色溶液(4.6.4.1a.)的吸光度。c.绘制标准曲线
以100 mL标准比色溶液中所含铁的微克数为横坐标,相应的吸光度为纵坐标,作图。4.6.4.2测定
a.试样溶液的制备
称取10g试样,精确至0.01g,置于100mL烧杯中,加少量水溶解后,加入10mL盐酸溶液(4.6.2.1),加热煮沸2min,冷却后定量转移到100mL量瓶中,稀释至刻度,混匀。b.显色
GB535-1995
吸取10.0mL试液(4.6.4.2a.)于100mL烧杯中,按4.6.4.la.规定的,从\加水至30mL”开始,至“放置15~30min”止,进行显色。c.光度测定
与4.6.4.1b.规定的步骤相同,测定试液的吸光度。从标准曲线(4.6.4.1c.)查出试液吸光度对应的铁质量(μg)。4.6.5铁(Fe)含量(zs),以质量百分数(%)表示,按式(5)计算:αs
× 100 =
m×100
式中:mo--
所取试液中测得的铁(Fe)质量,μg;-试样的质量,g。
4.6.6允许差
m × 103
取平行测定结果的算术平均值为测定结果,平行测定结果的绝对差值不大于0.0005%;不同实验室测定结果的绝对差值不大于0.0010%。·(5)
4.7砷含量的测定二乙基二硫代氨基甲酸银分光光度法(仲裁法)本方法等效采用ISO5786一78《工业用硫酸铵一砷含量的测定二乙基二硫代氨基甲酸银分光光度法》。
4.7.1方法提要
在酸性介质中,碘化钾、氯化亚锡和金属锌将砷还原为砷化氢,与二乙基二硫代氨基甲酸银的吡啶溶液生成紫红色胶态银,在最大吸收波长540nm处,测定其吸光度。本方法适用于测定砷含量在1~20ug 范围内的试液。
4.7.2试剂和材料
4.7.2、1盐酸(GB/T622);
4.7.2.2无砷金属锌粒(GB/T2304);4.7.2.3碘化钾(GB/T1272)溶液,150g/L;4.7.2.4氯化亚锡(GB/T638),400g/L盐酸溶液;溶解40g氯化亚锡在25mL水和75mL盐酸(4.7.2.1)的混合液中。4.7.2.5二乙基二硫代氨基甲酸银简称Ag(DDTC)J-吡啶(GB/T689)溶液,5g/L;溶解1g Ag(DDTC)于吡啶中,并用同样吡啶稀释至200 mL。贮于棕色瓶内,该溶液在两周内稳定。
4.7.2.6砷标准溶液,0.100g/L;此溶液1ml.含砷100μg。
4.7.2.7砷标准溶液,0.0025g/1;吸取25.0mL砷标准溶液(4.7.2.6)于1000mL量瓶中,用水稀释至刻度,混匀。此溶液1ml含碑2.5ug,使用时制备。
4.7.2.8乙酸铅(HG/T3—974)棉花;4.7.3仪器、设备
测定砷所用玻璃容器,必须用浓硫酸-重铬酸钾洗液洗涤,再以水清洗干净,干燥备用。一般实验室仪器和:
4.7.3.1定砷仪
如图2所示,或其他经实验证明,在规定的检验条件下,能给出相同结果的定砷仪。锥形瓶(A):容积100mL,用于砷的释放;a.
连接管(B):使用前装入乙酸铅棉花;b.
GB 5351995
c.15球管吸收器(C):总高度约250mm,总体积14mL。4.7.3.2分光光度计,带有1cm光路长度的吸收池。d14
图2定砷仪
4.7.4分析步骤
由于吡啶具有恶臭,操作应在通风橱中进行。4.7.4.1标准曲线的绘制
a、标准比色溶液的制备
按表3所示,吸取砷标准溶液(4.7.2.7)分别置于6个锥形瓶(A)(4.7.3.1a.)中。28
砷标准溶液(4.7.2.7)
GB 535--1995
相应砷含量
砷标准溶液(4.7.2.7)
相应砷含量
各锥形瓶(A)用水稀释至50mL,加入15mL盐酸(4.7.2.1),然后依次加入2mL碘化钾溶液和2mL氯化亚锡溶液,混匀,放置15min。置少量乙酸铅棉花于连接管(B)(4.7.3.1b.)中,以吸收硫化氢。吸取5.0mLAg(DDTC)-吡啶溶液到15球管吸收器(C)(4.7.3.1c.)中,按图2连接仪器,磨口玻璃吻合处在反应过程中应保持密封。称量5g锌粒加入锥形瓶中,迅速连接好仪器,使反应进行约45min,移去吸收器,充分混匀溶液所生成的紫红色胶态银。
b.光度测定
以砷含量为零的溶液为参比溶液,用1cm吸收池,在波长540nm处,用分光光度计测定标准比色溶液(4.7.4.1a.)的吸光度。
c.绘制标准曲线
以5.0mL.Ag(DDTC)-吡啶溶液吸收液(4.7.2.5)中所含砷的微克数为横坐标,相应的吸光度为纵坐标,绘制标准曲线。
4.7.4.2测定
a.试样溶液的制备
称取20g试样,精确至0.001g,置于锥形瓶(A)中,加水50mL,混匀使其完全溶解,加15mL盐酸(4.7.2.1),使所得溶液盐酸的浓度约为c(HCI)=3mol/L,混匀。b.显色与光度测定
在试液(4.7.4.2a.)中,加入2mL碘化钾溶液和2mL氯化亚锡溶液,混匀后放置15min。以下按4.7.4.1a.和4.7.4.1b.规定的操作步骤,从“置少量乙酸铅棉花于连接管(B).….\开始,直至“…用分光光度计测定溶液的吸光度”为止,完成测定。从标准曲线(4.7.4.1c.)查出试液吸光度对应的碑质量(μg)。4.7.5砷(As)含量(),以质量百分数(%)表示,按式(6)计算:26
× 100
m X 106
式中:m。—试液中测得的砷(As)质量,μg;一试样的质量,g。
取平行测定结果的算术平均值为测定结果。4.8砷含量的测定砷斑法
4.8..1方法提要
m × 10%
在酸性介质中,碘化钾、氯化亚锡和金属锌将试液中的砷还原为化氢,再与溴化汞试纸接触反应,生成黄色色斑深浅与砷的一系列标准色斑比较,求出试样中砷含量。本方法适用于测定碑含量在0.5~5 μg范围内的试液。
4.8.2试剂和材料
4.8.2.1盐酸(GB/T622);
4.8.2.2无砷金属锌粒(GB/T2304);29
GB 535—1995
4.8.2.3碘化钾(GB/T1272)溶液,150g/L;4.8.2.4氯化亚锡(GB/T638),400g/L盐酸溶液;配制方法同4.7.2.4。
4.8.2.5砷标准溶液,0.100g/L;此溶液1mL含砷100μg。
4.8.2.6砷标准溶液,0.0025g/L;吸取25.0mL砷标准溶液(4.8.2.5)于1000mL量瓶中,用水稀释至刻度,混匀。此溶液1mL含砷2.5μg,使用时制备。
4.8.2.7乙酸铅(HG/T3-974)棉花;4.8.2.8溴化汞(GB/T1398)试纸;4.8.3仪器、设备
测定砷所用玻璃容器,必须用浓硫酸-重铬酸钾洗液洗涤,再以水清洗干净,干燥备用。一般实验室仪器和:
4.8.3.1定砷器
如图3所示,或其他经实验证明,在规定的检验条件下,能给出相同结果的定砷器。16.5
图3定器
广口瓶或磨口锥形瓶(1):容积200mL;b.胶塞或磨口塞(2);
c.玻璃管(3):长180mm,上部直径为6.5mm,管的末端有-直径约为2mm的孔,使用前玻璃管内装入乙酸铅棉花,高约60mm;d.玻璃管上端管口(4):上端管口表面磨平,下面有4个耳钩,供固定玻璃帽用;e.玻璃帽(5):下面磨平,中央有孔与玻璃管相通,孔直径6.5mm,上面有弯月形凹槽。使用时,将溴化汞试纸夹在玻璃管上端管口(4)与玻璃帽(5)中间,用橡皮圈将其固定。4.8.4分析步骤
4.8.4.1试样溶液的制备
GB535—1995
称取10g试样,精确至0.01g,置于锥形瓶(1)(4.8.3.1a.)中,加水50mL,混勾使其完全溶解,加15ml盐酸(4.8.2.1),混匀。
4.8.4.2标准色阶的制备
制备试液的同时,按表4所示,吸取砷标准溶液(4.8.2.6)分别置于5个锥形瓶(1)中,加水至50mL,加15mL盐酸(4.8.2.1),混匀。4.8.4.3测定
对各锥形瓶(1)依次加入2mL碘化钾溶液,2mL氯化亚锡溶液,混匀后放置15min。表4
砷标准溶液(4.8.2.6)
相应砷含量
砷标准溶液(4.8.2.6)
置乙酸铅棉花于玻璃管(3)(4.8.3.1c.)内,以吸收硫化氢。相应砷含量
将溴化汞试纸固定,称量5g锌粒置于锥形瓶(1)中,按图3装好仪器,使反应在暗处进行1~1.5h。取下溴化汞试纸,以试样的溴化汞试纸颜色与砷标准溶液系列色阶比较,求出试样中砷质量。4.8.5分析结果的表述
砷(As)含量(α),以质量百分数(%)表示,按式(7)计算:mo
×100=
m × 106
式中:mo—与标准色阶比较,测得的砷质量,ug;试样的质量,g。
4.9重金属含量的测定目视比浊法4.9.1方法提要
m × 104
·(7)
在弱酸性介质(pH3~4)中,硫化氢水溶液与试液中硫化氢组重金属生成硫化物,再与铅的标准色阶比较,以测定重金属(以Pb计)的含量。本方法适用于重金属(以Pb计)含量在15~100pg范围内的试液。
4.9.2试剂和材料
4.9.2.1乙酸(GB/T676)溶液,c(CH,COOH)=1mol/L;量取58mL乙酸,用水稀释至1000mL。4.9.2.2饱和硫化氢水溶液
4.9.2.3铅标准溶液,0.1g/L;
此溶液1ml含铅100μg。
4.9.2.4铅标准溶液,0.01g/L;吸取10.0ml铅标准溶液(4.9.2.3)于100mL量瓶中,稀释至刻度,混匀。此溶液1mL含铅10μg,使用时制备。
4.9.3仪器、设备
一般实验室仪器和:
4.9.3.1比色管:50mL,带有磨口玻璃盖。4.9.4分析步骤
4.9.4.1试样溶液的制备
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
Ammonium sulphate
主题内容与适用范围
代 07
本标准规定了硫酸铵的技术要求、试验方法、检验规则以及标志、包装、运输和贮存。本标准适用于由合成氨与硫酸中利所制得的硫酸铵、炼焦所制得的副产硫酸铵、本标准不适川于火电厂脱硫法或其它烟汽脱硫法生产的副产硫酸铵产品。分子式:(NH,),SO)
相对分子质量:132、141(根据1989年国际相对原子质量)2
引用标准
GB/T 601
GB/T 602
GB/T 603
GB/T 611
GB 1250
化学试剂滴定分析(容量分析)用标准溶液的制备化学试剂杂质测定用标准溶液的制备化学试剂试验方法中所用制剂及制品的制备化学试剂密度测定通用方法
极限数值的表示方法和判定方法分析实验室用水规格和试验方法GB/T 6682
G138569固体化学肥料包装
3技术要求
3.1硫酸铵质量应符合表1要求:表1
优等品
白色结晶,无可见机械杂质
氮()含基(以干基计)
水分(H.0)
游离酸(H2S())含量
铁(Fc)含量
砷(As)含量
重金属(以Pb计)含凰:
水不溶物含量
-等品
无可见机械杂质
注:1)硫酸铵作农业用时可不检验铁、砷、重金属和水不溶物含量等指标。国家技术监督局1995-12-20批准20
合格品
1996-08-01实施
4试验方法
GB 535--- 1995
分析中,除另有说明外,均使用分析纯试剂;所使用的水应符合GB/T6682中三级水(仅测定pH值范围和电导率)规格;所有滴定分析用标准溶液按GB/T601配制和标定;所有杂质测定用标准溶液按GB/T602配制;所有试验方法中所用制剂及制品按GB/T603配制。4.1外观
目测。
4.2氮含量的测定蒸馏后滴定法(仲裁法)。本方法等效采用ISO333275《工业用硫酸铵-~氮态氮含量的测定--蒸馏后滴定法》。4.2.1方法提要
硫酸铵在碱性溶液中蒸馏出的氨,用过量的硫酸标准滴定溶液吸收,在指示剂存在下,以氢氧化钠标准滴定溶液回滴过量的硫酸。4.2.2试剂和材料
4.2.2.1氢氧化钠(GB/T629),450g/L溶液;4.2.2.2硫酸(GB/T625)标准滴定溶液,c÷H,SO,)=0.5mol/L;4.2.2.3氢氧化钠标准滴定溶液,c(NaOH)=0.5mol/I.;4.2.2.4甲基红-亚甲基蓝混合指示剂;溶解0.1g甲基红(HG/T3-958)于50mL乙醇(GB/T679)中,再加入0.05g亚甲基蓝,溶解后,用相同的乙醇稀释至100mL。
4.2.2.5硅脂或其他不含氮的润滑脂。4.2.3仪器、设备
般实验室仪器和:
4.2.3.1蒸馏仪器
本方法使用的仪器如图1所示:
蒸馏瓶(A):容积为1L;
防溅球管(B):平行地插入滴液漏斗(C);滴液漏斗(C):容积为50mL;
直形冷凝管(D):有效长度约400mm;吸收瓶(E):容积为500mI、瓶侧连接双连球。21
GB535-1995
图1蒸馏装置
4.2.3.2防暴沸石或防暴沸装置,后者由根长100mm,直径5mm玻璃棒接上一根长25mm聚乙烯管。
4.2.4分析步骤
4.2.4.1试样溶液的制备
称取10g试样,精确至0.001g,溶于少量水中,转移至500mL量瓶中,用水稀释至刻度,混匀。4.2.4.2蒸馏
从量瓶(4.2.4.1)中吸取50.0mL试液于蒸馏瓶(A)中,加入约350mL水和几粒防暴沸石(或防暴装置:将聚乙烯管接触烧瓶底部)。用单标线吸管加入50mL硫酸标准滴定溶液于吸收瓶(E)中,并加入80mL水和5滴混合指示剂溶液。
用硅脂涂抹仪器接口,按图1安装蒸馏仪器,并确保仪器所有部分密封。通过滴液漏斗(C)往蒸馏瓶(A)中注入氢氧化钠溶液(4.2.2.1)20mL,注意滴液漏斗中至少留有几毫升溶液。
加热蒸馏,直至吸收瓶(E)中的收集量达到250~300mL时停止加热,打开滴液漏斗(C),拆下防溅球管(B),用水冲洗冷凝管(D),并将洗涤液收集在吸收瓶(E)中,拆下吸收瓶。4.2.4.3滴定
将吸收瓶(E)中溶液混匀,用氢氧化钠标准滴定溶液(4.2.2.3)回滴过量的硫酸标准滴定溶液,直至指示剂呈灰绿色为终点。
4.2.4.4空白试验
GB535-1995
在测定的同时,除不加试样外,按4.2.4.1~4.2.4.3完全相同的分析步骤、试剂和用量进行平行操作。
4.2.5分析结果的表述
氮(N)含量(ri,以干基计),以质量百分数(%)表示,按式(1)计算:T
(V - V1)c × 0. 014 01
100-H,0
(V2 - Vi)c × 1 401
m(100 -
式中:V,—一测定时使用氢氧化钠标准滴定溶液的体积,mL,V--—空白试验使用氢氧化钠标准滴定溶液的体积,mL;氢氧化钠标准滴定溶液实际浓度,mol/L;m—试样的质量,g;
H,O—试样中水的百分含量;
(1)
0.01401-—与1.00mL氢氧化钠标准滴定溶液Cc(NaOH)=1.000mol/LJ相当的以克表示的氮的质量。
4.2.6允许差
取平行测定结果的算术平均值为测定结果,平行测定的绝对差值不大于0.06%;不同实验室测定结果的绝对差值不大于0.12%。4.3氮含量的测定甲醛法
4.3.1方法提要
在中性溶液中,铵盐与甲醛作用生成六次甲基四胺和相当于铵盐含量的酸,在指示剂存在下,用氢氧化钠标准滴定溶液滴定。
4.3.2试剂和材料
4.3.2.1氢氧化钠(GB/T629),4g/L溶液;4.3.2.2氢氧化钠标准滴定溶液c(NaOH)=0.5mol/L;4.3.2.3甲醛,250g/L溶液;
按附录A配制和测定。
4.3.2.4甲基红(HG/T3—-958)指示液,1g/L乙醇(GB/T678)溶液;4.3.2.5酚酸(GB/T10729)指示液,10g/L乙醇(GB/T678)溶液。4.3.3分析步骤
4.3.3.1试样溶液的制备
称取1g试样,精确至0.001g,置于250mL锥形瓶中,加100~120mL水溶解,再加1滴甲基红指示剂溶液,用氢氧化钠溶液(4.3.2.1)调节至溶液呈橙色。4.3.3.2测定
加入15mL甲醛溶液至试液(4.3.3.1)中,再加入3滴酚酸指示剂溶液,混勾。放置5min,用氢氧化钠标准滴定溶液(4.3.2.2)滴定至浅红色,经1min不消失(或滴定至pH计指示pH8.5)为终点。4.3.3.3空白试验
在测定的同时,除不加试样外,按4.3.3.1和4.3.3.2完全相同的分析步骤,试剂和用量进行平行操作。
4.3.4分析结果的表述
氮(N)含量(2,以干基计),以质量百分数(%)表示,按式(2)计算:23
式中:V,-
GB535—1995
(V, -- V,) : c X 0. 014 01
× 100
100-X,0
(V1-V2) ·c X 140. 1
m(100 -- XH,0)
测定时使用氢氧化钠标准滴定溶液的体积,mL;V2—一空白试验使用氢氧化钠标准滴定溶液的体积,mL;氢氧化钠标准滴定溶液实际浓度,mol/I.;m-
---试样的质量,g;
TH,O—-试样中水的百分含量;
.(2)
与1.00ml.氢氧化钠标准滴定溶液Cc(NaOH)=1.000mol/L)相当的以克表示的氮的质量。
4.3.5允许差
取平行测定结果的算术平均值为测定结果,平行测定结果的绝对差值不大于0.06%;不同实验室测定结果的绝对差值不大于0.12%。4.4水分的测定重量法
4.4.1方法提要
在一定温度的电热恒温干燥箱内,将试样烘干至恒重,然后测定试样减少的质量。本方法适用于所取试样中水分质量不小于0.001g。4.4.2仪器、设备
-般实验室仪器和:
4.4.2.1带盖磨口称量瓶,直径50mm,高30mm;4.4.2.2电热恒温干燥箱,能维持温度105士2℃。4.4.3分析步骤
称取5g试样,精确至0.0002g,置于预先在105士2℃于燥至恒重的称量瓶(4.4.2.1)中,将称量瓶盖子稍微打开,置称量瓶于干燥箱中接近于温度计的水银球水平位置上,在105土2C的温度中干燥30min后,取出称量瓶,盖上盖子,在干燥器中冷却至室温称重,重复操作,直至恒重。取最后一次测量值作为测定结果。
4.4.4分析结果的表述
水分(H20)(:),以质量百分数(%)表示,按式(3)计算:3
ml - m2 × 100
式中:m1--称量瓶及试样在干燥前质量,g;m.称量瓶及试样在干燥后质量.
.--试样的质量.。免费标准bzxz.net
4.4.5允许差
取平行测定结果的算术平均值作为测定结果,平行测定结果的绝对差值不大于0.05%。4.5游离酸含量的测定·容量法
本方法等效采用ISO2993--74《工业用硫酸铵游离酸度的测定滴定法》。4.5.1方法提要
试样溶液中的游离酸,在指示剂存在下,用氢氧化钠标准滴定溶液滴定。4.5.2试剂和材料
4.5.2.1氢氧化钠(GB/T629)标准滴定溶液.c(Na()H)=0.1mol/L;24
(3)
GB 5351995
4.5.2.2盐酸(GB/T622)溶液,c(HC1)=0.1mol/I;4.5.2.3甲基红-亚甲基蓝混合指示剂配制方法同4.2.2.4。
4.5.2.4分析中用的水
在1000mL水中,加2~3滴指示剂溶液(4.5.2.3),如溶液不呈灰绿色,则用氢氧化钠溶液(4.5.2.1)或盐酸溶液(4.5.2.2),调节至溶液呈灰绿色(或酸度计指示在pH5.4~5.6)。4.5.3仪器、设备
一般实验室仪器和:
4.5.3.1微量滴定管,5mL,分度值0.02mL;4.5.3.2酸度计。
4.5.4分析步骤
称取10g试样,精确至0.01g,置于100ml烧杯中,加50ml水(4.5.2.4)溶解,如果溶液混浊,可用中速滤纸过滤,用水(4.5.2.4)洗涤烧杯和滤纸,收集滤液于250mL的锥形瓶中。加1~2滴指示剂溶液于滤液中,用氢氧化钠标准滴定溶液滴定至灰绿色为终点。若试液有色,终点难以观察,也可滴定至酸度计指示pH5.4~5.6为终点。4.5.5分析结果的表述
游离酸(H,SO)含量(x4),以质量百分数(%)表示,按式(4)计算:× 0. 049 0 × 100 = 9
一氢氧化钠标准滴定溶液实际浓度,mol/L;式中:c-
V—一测定时使用氢氧化钠标准滴定溶液体积,mL,m—试样的质量,g;
cV × 4. 90
0.0490——与1.00mL氢氧化钠标准滴定溶液Lc(NaOH)=1.000mol/L>相当的以克表示的硫酸的质量。
4.5.6允许差
取平行测定结果的算术平均值为测定结果,平行测定结果的绝对差值不大于:游离酸含量,%
绝对差值,%
不同实验室测定结果的绝对差值不大于:游离酸含量,%
4.6铁含量的测定邻菲啰啉分光光度法4.6.1方法提要
绝对差值,%
试样中的铁用盐酸溶解后,以抗坏血酸将三价铁还原为二价铁,在缓冲介质(pH2~9)中,二价铁与邻菲啰啉生成橙红色配合物,在最大吸收波长510nm处,用分光光度计测定其吸光度。本方法适用于测定铁含量在 10~100 μg 范围内的试液。4.6.2试剂和材料
采用说明:
1]ISO2993--74采用甲基紫(pH5.25.6)或其他相同pH值范围的指示剂,本标准采用甲基红-亚甲基蓝混合指示剂(变色点pH5.4)。
GB 535--1995
盐酸(GB/T 622)溶液,c(HC1)一1 mol/L;4.6.2.1
4.6.2.2硫酸(GB/T625);
4.6.2.3氨水(GB/T631),1+2溶液;4.6.2.4抗坏血酸溶液,100g/L,该溶液一周内稳定;4.6.2.5乙酸(GB/T676)-乙酸钠(GB/T693)缓冲溶液,pH=4.5;4.6.2.6邻菲啰啉(GB/T1293)溶液,1g/L;该溶液避光保存,仅能使用无色溶液。4.6.2.7铁标准溶液,0.100g/L;称取0.863g硫酸铁铵(GB/T1279),精确至0.001g,溶于200mL水中,加10mL硫酸(4.6.2.2),定量转移到1000mL量瓶中,稀释至刻度,混匀。此溶液1mL含0.100mg铁。4.6.2.8铁标准溶液,0.010g/L;吸取50.0mL铁标准溶液(4.6.2.7)于500mL量瓶中,稀释至刻度,混匀。此溶液1mL含10μg铁,使用时制备。
4.6.3仪器、设备
一般实验室仪器和:
4.6.3.1分光光度计,带有3cm光路长度的吸收池;4.6.3.2广范pH试纸或pH计。
4.6.4分析步骤
4.6.4.1标准曲线的绘制
a.标准比色溶液的制备
按表2所示,在一系列100mL烧杯中,分别加入给定体积的铁标准溶液(4.6.2.8。表2
铁标准溶液(4.6.2.8)
相应的铁含量
每个烧杯都按下述规定同时同样处理:铁标准溶液(4.6.2.8)
相应的铁含量
加水至30mL,用盐酸溶液(4.6.2.1)或氨水溶液(4.6.2.3)调节溶液的pH值接近2,定量地将溶液转移到100mL量瓶中,加1mL抗坏血酸溶液,20mL缓冲溶液和10.0mL邻菲啰啉溶液,用水稀释至刻度,混匀,放置15~30min。b.光度测定
用3cm吸收池,以铁含量为零的溶液作为参比溶液,在波长510nm处,用分光光度计测定标准比色溶液(4.6.4.1a.)的吸光度。c.绘制标准曲线
以100 mL标准比色溶液中所含铁的微克数为横坐标,相应的吸光度为纵坐标,作图。4.6.4.2测定
a.试样溶液的制备
称取10g试样,精确至0.01g,置于100mL烧杯中,加少量水溶解后,加入10mL盐酸溶液(4.6.2.1),加热煮沸2min,冷却后定量转移到100mL量瓶中,稀释至刻度,混匀。b.显色
GB535-1995
吸取10.0mL试液(4.6.4.2a.)于100mL烧杯中,按4.6.4.la.规定的,从\加水至30mL”开始,至“放置15~30min”止,进行显色。c.光度测定
与4.6.4.1b.规定的步骤相同,测定试液的吸光度。从标准曲线(4.6.4.1c.)查出试液吸光度对应的铁质量(μg)。4.6.5铁(Fe)含量(zs),以质量百分数(%)表示,按式(5)计算:αs
× 100 =
m×100
式中:mo--
所取试液中测得的铁(Fe)质量,μg;-试样的质量,g。
4.6.6允许差
m × 103
取平行测定结果的算术平均值为测定结果,平行测定结果的绝对差值不大于0.0005%;不同实验室测定结果的绝对差值不大于0.0010%。·(5)
4.7砷含量的测定二乙基二硫代氨基甲酸银分光光度法(仲裁法)本方法等效采用ISO5786一78《工业用硫酸铵一砷含量的测定二乙基二硫代氨基甲酸银分光光度法》。
4.7.1方法提要
在酸性介质中,碘化钾、氯化亚锡和金属锌将砷还原为砷化氢,与二乙基二硫代氨基甲酸银的吡啶溶液生成紫红色胶态银,在最大吸收波长540nm处,测定其吸光度。本方法适用于测定砷含量在1~20ug 范围内的试液。
4.7.2试剂和材料
4.7.2、1盐酸(GB/T622);
4.7.2.2无砷金属锌粒(GB/T2304);4.7.2.3碘化钾(GB/T1272)溶液,150g/L;4.7.2.4氯化亚锡(GB/T638),400g/L盐酸溶液;溶解40g氯化亚锡在25mL水和75mL盐酸(4.7.2.1)的混合液中。4.7.2.5二乙基二硫代氨基甲酸银简称Ag(DDTC)J-吡啶(GB/T689)溶液,5g/L;溶解1g Ag(DDTC)于吡啶中,并用同样吡啶稀释至200 mL。贮于棕色瓶内,该溶液在两周内稳定。
4.7.2.6砷标准溶液,0.100g/L;此溶液1ml.含砷100μg。
4.7.2.7砷标准溶液,0.0025g/1;吸取25.0mL砷标准溶液(4.7.2.6)于1000mL量瓶中,用水稀释至刻度,混匀。此溶液1ml含碑2.5ug,使用时制备。
4.7.2.8乙酸铅(HG/T3—974)棉花;4.7.3仪器、设备
测定砷所用玻璃容器,必须用浓硫酸-重铬酸钾洗液洗涤,再以水清洗干净,干燥备用。一般实验室仪器和:
4.7.3.1定砷仪
如图2所示,或其他经实验证明,在规定的检验条件下,能给出相同结果的定砷仪。锥形瓶(A):容积100mL,用于砷的释放;a.
连接管(B):使用前装入乙酸铅棉花;b.
GB 5351995
c.15球管吸收器(C):总高度约250mm,总体积14mL。4.7.3.2分光光度计,带有1cm光路长度的吸收池。d14
图2定砷仪
4.7.4分析步骤
由于吡啶具有恶臭,操作应在通风橱中进行。4.7.4.1标准曲线的绘制
a、标准比色溶液的制备
按表3所示,吸取砷标准溶液(4.7.2.7)分别置于6个锥形瓶(A)(4.7.3.1a.)中。28
砷标准溶液(4.7.2.7)
GB 535--1995
相应砷含量
砷标准溶液(4.7.2.7)
相应砷含量
各锥形瓶(A)用水稀释至50mL,加入15mL盐酸(4.7.2.1),然后依次加入2mL碘化钾溶液和2mL氯化亚锡溶液,混匀,放置15min。置少量乙酸铅棉花于连接管(B)(4.7.3.1b.)中,以吸收硫化氢。吸取5.0mLAg(DDTC)-吡啶溶液到15球管吸收器(C)(4.7.3.1c.)中,按图2连接仪器,磨口玻璃吻合处在反应过程中应保持密封。称量5g锌粒加入锥形瓶中,迅速连接好仪器,使反应进行约45min,移去吸收器,充分混匀溶液所生成的紫红色胶态银。
b.光度测定
以砷含量为零的溶液为参比溶液,用1cm吸收池,在波长540nm处,用分光光度计测定标准比色溶液(4.7.4.1a.)的吸光度。
c.绘制标准曲线
以5.0mL.Ag(DDTC)-吡啶溶液吸收液(4.7.2.5)中所含砷的微克数为横坐标,相应的吸光度为纵坐标,绘制标准曲线。
4.7.4.2测定
a.试样溶液的制备
称取20g试样,精确至0.001g,置于锥形瓶(A)中,加水50mL,混匀使其完全溶解,加15mL盐酸(4.7.2.1),使所得溶液盐酸的浓度约为c(HCI)=3mol/L,混匀。b.显色与光度测定
在试液(4.7.4.2a.)中,加入2mL碘化钾溶液和2mL氯化亚锡溶液,混匀后放置15min。以下按4.7.4.1a.和4.7.4.1b.规定的操作步骤,从“置少量乙酸铅棉花于连接管(B).….\开始,直至“…用分光光度计测定溶液的吸光度”为止,完成测定。从标准曲线(4.7.4.1c.)查出试液吸光度对应的碑质量(μg)。4.7.5砷(As)含量(),以质量百分数(%)表示,按式(6)计算:26
× 100
m X 106
式中:m。—试液中测得的砷(As)质量,μg;一试样的质量,g。
取平行测定结果的算术平均值为测定结果。4.8砷含量的测定砷斑法
4.8..1方法提要
m × 10%
在酸性介质中,碘化钾、氯化亚锡和金属锌将试液中的砷还原为化氢,再与溴化汞试纸接触反应,生成黄色色斑深浅与砷的一系列标准色斑比较,求出试样中砷含量。本方法适用于测定碑含量在0.5~5 μg范围内的试液。
4.8.2试剂和材料
4.8.2.1盐酸(GB/T622);
4.8.2.2无砷金属锌粒(GB/T2304);29
GB 535—1995
4.8.2.3碘化钾(GB/T1272)溶液,150g/L;4.8.2.4氯化亚锡(GB/T638),400g/L盐酸溶液;配制方法同4.7.2.4。
4.8.2.5砷标准溶液,0.100g/L;此溶液1mL含砷100μg。
4.8.2.6砷标准溶液,0.0025g/L;吸取25.0mL砷标准溶液(4.8.2.5)于1000mL量瓶中,用水稀释至刻度,混匀。此溶液1mL含砷2.5μg,使用时制备。
4.8.2.7乙酸铅(HG/T3-974)棉花;4.8.2.8溴化汞(GB/T1398)试纸;4.8.3仪器、设备
测定砷所用玻璃容器,必须用浓硫酸-重铬酸钾洗液洗涤,再以水清洗干净,干燥备用。一般实验室仪器和:
4.8.3.1定砷器
如图3所示,或其他经实验证明,在规定的检验条件下,能给出相同结果的定砷器。16.5
图3定器
广口瓶或磨口锥形瓶(1):容积200mL;b.胶塞或磨口塞(2);
c.玻璃管(3):长180mm,上部直径为6.5mm,管的末端有-直径约为2mm的孔,使用前玻璃管内装入乙酸铅棉花,高约60mm;d.玻璃管上端管口(4):上端管口表面磨平,下面有4个耳钩,供固定玻璃帽用;e.玻璃帽(5):下面磨平,中央有孔与玻璃管相通,孔直径6.5mm,上面有弯月形凹槽。使用时,将溴化汞试纸夹在玻璃管上端管口(4)与玻璃帽(5)中间,用橡皮圈将其固定。4.8.4分析步骤
4.8.4.1试样溶液的制备
GB535—1995
称取10g试样,精确至0.01g,置于锥形瓶(1)(4.8.3.1a.)中,加水50mL,混勾使其完全溶解,加15ml盐酸(4.8.2.1),混匀。
4.8.4.2标准色阶的制备
制备试液的同时,按表4所示,吸取砷标准溶液(4.8.2.6)分别置于5个锥形瓶(1)中,加水至50mL,加15mL盐酸(4.8.2.1),混匀。4.8.4.3测定
对各锥形瓶(1)依次加入2mL碘化钾溶液,2mL氯化亚锡溶液,混匀后放置15min。表4
砷标准溶液(4.8.2.6)
相应砷含量
砷标准溶液(4.8.2.6)
置乙酸铅棉花于玻璃管(3)(4.8.3.1c.)内,以吸收硫化氢。相应砷含量
将溴化汞试纸固定,称量5g锌粒置于锥形瓶(1)中,按图3装好仪器,使反应在暗处进行1~1.5h。取下溴化汞试纸,以试样的溴化汞试纸颜色与砷标准溶液系列色阶比较,求出试样中砷质量。4.8.5分析结果的表述
砷(As)含量(α),以质量百分数(%)表示,按式(7)计算:mo
×100=
m × 106
式中:mo—与标准色阶比较,测得的砷质量,ug;试样的质量,g。
4.9重金属含量的测定目视比浊法4.9.1方法提要
m × 104
·(7)
在弱酸性介质(pH3~4)中,硫化氢水溶液与试液中硫化氢组重金属生成硫化物,再与铅的标准色阶比较,以测定重金属(以Pb计)的含量。本方法适用于重金属(以Pb计)含量在15~100pg范围内的试液。
4.9.2试剂和材料
4.9.2.1乙酸(GB/T676)溶液,c(CH,COOH)=1mol/L;量取58mL乙酸,用水稀释至1000mL。4.9.2.2饱和硫化氢水溶液
4.9.2.3铅标准溶液,0.1g/L;
此溶液1ml含铅100μg。
4.9.2.4铅标准溶液,0.01g/L;吸取10.0ml铅标准溶液(4.9.2.3)于100mL量瓶中,稀释至刻度,混匀。此溶液1mL含铅10μg,使用时制备。
4.9.3仪器、设备
一般实验室仪器和:
4.9.3.1比色管:50mL,带有磨口玻璃盖。4.9.4分析步骤
4.9.4.1试样溶液的制备
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。