GB/T 22338-2008
基本信息
标准号: GB/T 22338-2008
中文名称:动物源性食品中氯霉素类药物残留量测定
标准类别:国家标准(GB)
标准状态:现行
发布日期:2008-09-01
实施日期:2008-12-01
出版语种:简体中文
下载格式:.rar.pdf
下载大小:757287

标准分类号
标准ICS号:食品技术>>67.120肉、肉制品和其他动物类食品
中标分类号:食品>>食品加工与制品>>X22肉类加工制品
关联标准
出版信息
出版社:中国标准出版社
页数:20页
标准价格:18.0 元
计划单号:20060033-T-424
出版日期:2008-12-01
相关单位信息
首发日期:2008-09-01
起草人:邱月明、林黎明、李鹏、张鸿伟、赵海香、董益阳、蔡慧霞、谢孟峡、汪丽萍、孔莹
起草单位:中国检验检疫科学研究院、山东出入境检验检疫局
归口单位:cnca 国家认证认可监督管理委员会
发布部门:国家质量监督检验检疫总局
主管部门:国家质量监督检验检疫总局
标准简介
本标准规定了动物源性食品中氯霉素类残留量的气相色谱?质谱和液相色谱?质谱/质谱测定方法。本标准适用于水产品、畜禽产品和畜禽副产品中氯霉素、氟甲砜霉素和甲砜霉素残留的定性确证和定量测定。 GB/T 22338-2008 动物源性食品中氯霉素类药物残留量测定 GB/T22338-2008 标准下载解压密码:www.bzxz.net
标准图片预览




标准内容
ICS 67.120
中华人民共和国国家标准
GB/T22338—2008
动物源性食品中氯霉素类药物
残留量测定
Determination of multi-residues of chlorarnphenicolsin animal-original food
2008-09-01发布
中华人民共和国国家质量监督检验检疫总局中国国家标准化管理委员会
放码防行
2008-12-01实施
本标准的附录 A,附录 B,附录 C.附录 D 和附录 E均为资料性附录。本标准由中华人民共和国质录监督检验检疫总局提出。本标准由国家认证认可监督管理委员会归口。GB/T22338--2008
本标准起草单位:中国检验检疫科学研究院、中华人民共和国山东出人境检验检疫局。本标准主要起草人:邱月明、林黎明、李鹏、张鸿伟、赵海香、董益阳、蔡慧霞、谢孟峡、江丽萍、孔莹。1范圃
动物源性食品中氯霉素类药物
残留量测定
GB/T22338—2008
本标准规定了动物源性食品中氯霉素类残留量的气相色谱-质谱和液相色谱-质谱/质谱测定方法。
本标准适用于水产品、畜禽产品和畜食副产品中氣霉素、氟甲砜索和甲砜霉紫残留的定性确证和定量测定。
2气相色谱-质谱法
2.1原理
样品用乙酸乙酯提取,4%氯化钠溶液和正已烷液-液分配净化,再经弗罗里硅土(Florisil)柱净化后,以甲苯为反应介质,用N,O双(三甲基硅盐)三氟乙酰胺-三甲基氯硅烷(BSTFA十TMCS,99+-1)丁70℃硅烷化,用气相色谱/负化学电离源质谱测定,内标工作曲线法定量。2.2试剂和材料
除非另有说明,在分析中仅使用确认为分析纯的试剂和二次去离子水或相当纯度的水。2.2.1甲醇:色谱纯:
甲萃:农残缎。
正已烧:农残级。
2.2.4 乙酸乙酯.
2.2.5 乙醚。
氟化钠。
氮霉素(CAP)、氟甲矾霉素(FF)、甲砜霉素(TAP)标准物质:纯度≥99%。2.2.7
2.2.8间硝基氯欲素(m-CAP)标准物质:纯度≥99%。2.2.9氮化钠溶液(1%):称取适量氮化钠用水配暨成4%的氮化钠溶液,常温保存,可使用1周。2.2.10氯霉素类标准储备溶液:准确称取适景氮霉素、氟甲砜霉素和甲砜需素标准物质(精确到0.1mg),以甲醉配制成浓度为100μg/mL的标准储备溶液。2.2.11间硝基氯霉素内标工作溶液:准确称取适量间硝基氮霉素标准物质(精确到0.1mg),用甲醇配制成10ng/mL的标推工作溶液。2.2.12氛素类基质标准工作溶液:选择不含氯素类的样品六份,分别添加1mL内标工作溶液(2.2.11),用这六份提取液分别配成氯霉素、氟甲砜需素和中砜零素浓度为0.1ng/mL、0.2ng/mL、1ng/mL,2ng/mL、4ng/mL、8ng/mL的溶液,按本方法提取(2.4.1),净化(2.4.2),制成样品提取液用氮气缓慢吹干,硅烷化(2.4.3)后,制成标准工作溶液。2.2.13衍生化试剂:N,O双(三甲基硅基)三氟乙酰胺-三甲基氮硅烷(BSTFA十TMCS,99+1)。2.2.14固相萃取柱:弗罗里硅土柱(6.0ml.,1.0g)。2.3仪器和设备
2.3.1气相色谱/质谱联用仪:配有化学电离源(CI)。2.3.2组织捣碎机。
GB/T 22338--2008
2.3.3固相萃取装置。
2.3.4振药器。
2.3.5旋转发仪。
2.3.6涡旋混合器。
2.3.7离心机。
2.3.8恒温箱。
2.4测定步骤
2.4.1提取
称取10 g(精确到0. 01g))粉碎的组织样品于 50ml.具密离心管中,加人1. 0 mL内标溶液2.2.11)利30mL乙酸乙酯,振荡30min,于4000r/min离心2min,上层清液转移至圆底烧瓶中,残渣用30mL乙酸乙脂再提取一次,合并提取液,35℃旋转蒸发至1mL~2ml,待净化。2.4.2净化
2.4.2.1液-液萃取
提取液浓缩物(2.4.1)加1mL甲醇溶解,用20mL氮化钠落液(2.2.9)和20mL正已烷液-液萃取,弃去正已烷层,水相用40mL乙酸乙分两次萃取,合并乙酸乙酯相于心形瓶中,35℃旋转蒸发至近干,用氮气缓慢吹干。
2.4.2.2弗罗里硅土柱净化
弗罗果硅柱依次用5mL甲醇5mL甲醇-乙醚(3+7)溶液和5mL乙醛琳洗备用。将残渣(2.4.2.1)用5.0mL乙醚溶解上样,用5.0mL乙醚淋洗Florisil柱,5.0mL中醇-乙避溶液(3十7)洗脱,洗脱液用氮气缓慢吹干,待硅烷化。2.4.3硅烷化
净化后的试样(2.4.2.2)用0.2mL甲苯溶解,加人0.1mL硅烷化试剂(2.2.13)混合,于70C衍生化60min。氮气缓慢吹干,用1.0mL正已烷定穿,待测定。2.4.4测定
2.4.4.1气相色谱-质谱条件
色谱柱:DB-5MS毛细管柱,30m×0.25mm(内径)×0.25μm,或与之相当者;a
色谱柱温度:50C保持1min,25℃/min升至280℃,保持5minb)
进样口温度:250℃;
进样方式:不分流进样,不分流时间0.75min;载气:高纯氮气,纯度≥99.999%;e)
流速:1.0mL/min;
进样量:1.0μL;Www.bzxZ.net
接口温度:280℃;
离子源:化学电离源负离子模式NCI;扫描方式:选择离子监测;
k)离子源温度:150℃;
四级杆温度:106℃;
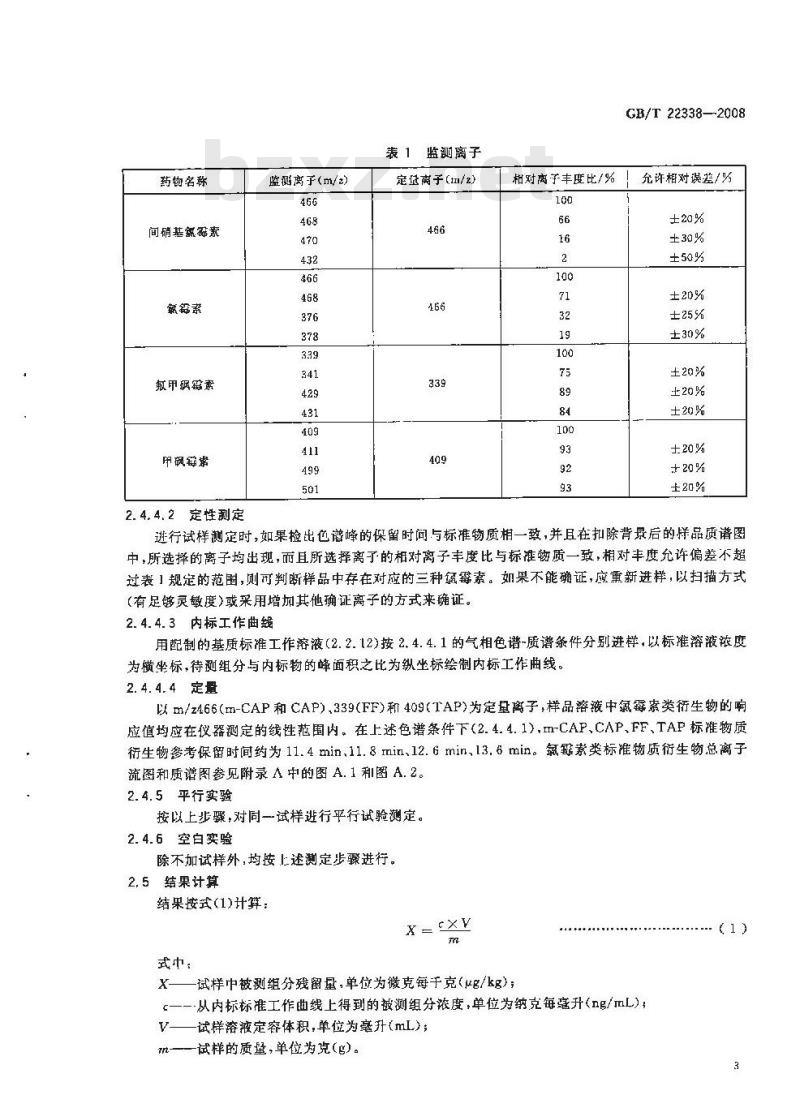
m)反应气:甲烷,纯度≥99.999%;选择监测离子参见表1。
药物名称
间硝基氮素
敏甲娲霉素
甲鲜常
2.4.4.2定性测定
监测离于(m/2)
表 1 监测离子
定适离子(/2)
GB/T 22338-2008
相对离子丰度比/%!充许相对误差/%100
进行试样测定时,如果检出色谱峰的保留时间与标谁物质相一致,并且在扣除背景后的样品质谱图中,所选择的离子均出现,而且所选择离了的相对离子丰度比与标准物质一致,相对丰度允许偏差不超过表1规定的范围,则可判断样品中存在对应的三种氮霉素。如果不能确证,应重新进样,以扫描方式(有足够灵敏度)或采用增加其他确证离子的方式来确证。2.4.4.3内标工作曲线
用配制的基质标准工作溶液(2.2.12)按2.4.4.1的气相色谱-质谱条件分别进样,以标准溶液浓度为横坐标,待测组分与内标物的峰面积之比为纵坐标绘制内标工作曲线。2. 4.4.4定量
以m/z466(m-CAP和CAP)、339(FF)和409(TAP)为定量离子,样品溶液中氮霉索类衍生物的响应值均应在仪器测定的线性范围内。在上述色谱条件下(2.4.4.1),m-CAP、CAP、FF、TAP标准物质衍生物参考保留时间约为11.4min、11.8min12.6min,13.6min。氮解素类标准物质衍生物总离子流图和质谱图参见附录A中的图A.1和图A.2。2.4.5平行实验
按以上步骤,对同一试样进行平行试验测定。2.4.6空白实验
除不加试样外,均按上述测定步骤进行。2.5结果计算
结果按式(1)计算:
式中:
试样中被测组分残留量,单位为微克每于克(μg/飞g);c一一·从内标标准工作曲线上得到的被测组分浓度,单位为纳克每毫升(ng/mL),试样溶液定容体积,单位为毫升(mL);一试样的质,单位为克(g)。
GB/T 22338--2008
2.6测定低限
气相色谱-质谱测定低限为:氯霉素0.1ug/kg,氧甲砜霉素和甲矾霉素0.5μg/kg。2.7回收率和精密度
参见附录B。
3夜相色谱-质谱/质谱法
3.1原理
针对不同动物源性食品中氛霉紊、甲砜每素和氟甲砜素残留,分别采用乙睛、乙酸乙酯-乙醛或乙酸乙酯提取,提取液用固相萃取柱进行净化,液相色谱-质谱/质谱仪测定,氛霉素采用内标法定量,甲氨霍素和氟甲砜霉素采用外标法定量。3,2试剂和材料
除非另有说明,在分析中仅使用确认为分析纯的试剂和二次去离子水或相当纯度的水。3.2.1甲醇:液相色谱级。
3.2.2乙腊:液相色谱级。
3.2.3丙酮:液相色谱级。
正丙醇:羧相色谱级。
正已烷:被相色谱级。
乙酸乙酯:液相色谱级。
乙醚。
乙酸钠。
乙酸铵。
3. 2. 10A
β葡萄糖醛酸酶:约40000活性单位。3.2.11乙睛饱和正己烷:取200ml.正已烷(3.2.5)于250mL分液漏斗中,加人少量乙睛(3.2.2),剧烈振摇,静置分层后,弃去下层乙腈层即得。3.2.12丙酮-正己烷(1+9):丙霸(3.2.3)、正已烷(3.2.5)按体积比1:9混勾。3.2、13酮-正已烷(6十4):丙酮(3.2.3)、正已烷(3.2.5)按体积比6:4混匀。3.2.14乙酸乙酯-乙醚(75+25):75mL乙酸乙酯(3.2.6)与25mL乙醛(3.2.7)溶液混勾。3.2.15乙酸钠缓冲液(0.1mol/L):称取乙酸钠(3.2.8)13.6g于1000mL容量瓶中,加人980mL水窃解并混勾,用乙酸调pH到5.0定容至刻度混勾。3.2.16乙酸铵溶液(10mmol/L):称取乙酸铵(3.2.9)0.77g于1000mL容量瓶中,用水定容至刻度混勾。
氧霉素,甲矾霉案和氟甲砜霖素标准物质:纯度299,0%。3. 2. 173
3.2.18氮露素氛代内标(氯霉素-Ds)物质:纯度≥99.9%。3.2.19标准储备溶液:分别准确称取适量的氯霉紊、甲霉素和氟甲需素标准物质(3.2.17)(精确到0.1mg),用乙睛配成500μg/mL的标准储备溶液(4C避光保存可使用6个月)。3.2.20氣素、甲砜霉素和氟甲冠素标准中间溶液:分别准确移取适量的氯霉素、甲砜霉案和氟甲硕霉素标准储备溶液(3.2.19),用乙稀释成50g/mL的氮等素、甲砜霉素和氟甲矾霉素标中间溶液(4℃避光保存可使用3个月)。3.2.21氮霉素、甲砜霉素和氟甲矾舜素混合标准工作液:分别准确移取适量的氯霉素,甲砜素和氟甲砜霉素标推中问溶液(3.2.20),用流动相稀释成合适的混合标准工作溶液(现用现配)。3.2.22氯霉素氛代内标(氯霉素-D)储备溶液:准确称取适量的氯需素-D标准物质(3.2.18)(精确到0.1mg),用乙腈配成100μg/mL的标准储备溶液(4℃避光保存可使用12个月)。3.2.23氯筹素氛代内标(氮素-D)中间溶液:确移取适量的氟霉素-Ds储备辫液(3.2.22),用乙4
睛配成1g/mL内标中间溶被(4℃避光保存可使用6个月)。GB/T 22338-—2008
3.2.24氯素氛代内标(氛霉素-D)工作溶液:准确移取适量的氮霉素-D。中间溶液(3.2.23),用乙腈配成0.1μg/mL内标工作溶液(4℃避光保存可使用2周)。3.2.25LC-si固相萃取柱或相当者200mg3mL。3.2.26EN固相萃取柱或相当者,200mg,3mL。3.2.27一次性注射式滤器:配有0.45μm微孔滤膜。3.3仪器和设备
3.3.1液相色谱-串联质谱仪:配有电喷雾离子源。3.3.2高速组织捣碎机。
3.3.3均质器。
3.3.4旋转蒸发仪。
3.3.5分析天平。
3.3.6移液枪:200 μL、1 mL。
3.3.7心形瓶;100 mL,棕色,
3.3.8分液溺斗:200 mL。
3.3.9聚四氟乙烯离心管:50mL。3.3.10离心机。
3.3.11涡旋混合器,
3.3.12固相萃取装置。
3.4试样制备与保存
3.4.1试样的制备
从原始样品中取出部分有代表性样品,经高速组织捣碎机均匀捣碎或混勾·用四分法缩分出适量试样,均分成两份,装人清洁容器内,加封后作出标记,一份作为试样,一份作为留样。3.4.2试样的保存
试样应在一20℃条件下保存。
3.5测定步骤
3.5.1提取
3.5.1.1动物组织(肝、肾除外)与水产品称取试样5g(精确至0.01g),置于50mL离心管中,加入100μL氯露素氛代内标(氯霉素-D,)工作溶液(3.2.24)和30mL乙睛,勾浆,离心5min。将上清液移人250ml分液漏斗中,加15mL乙睛饱和的正已烷(3.2.11),振荡5min,静置分层,转移乙层至100mL棕色心形瓶中。残渣中再加人30mL乙腈,振摇3min,离心5min,取上清液转移至同一分液漏斗,振荡5min,静置分层,转移乙腈层至同一棕色心形瓶中。向心形瓶中加入5mL正丙醇,于40℃水浴中旋转蒸发近干,用氮气吹干,加5ml丙酮-正己烷(3.2.12)溶解残渣。3.5.1.2动物肝、肾组织
称取试样5g(精确至0.0lg),置于50mL离心管中,加人30mL乙酸钠缓冲液(3.2.15),均质2min,加人300μLP-葡萄糖醛酸替酶(3.2.10),于37℃温育过夜。消解样品中加入100μ氛素氛代内标(氮案-D)工作溶液(3.2.24),20mL乙酸乙酯-乙醛(3.2.14),振摇2min,离心5min。取上层有机层入心形瓶中,在40℃水浴中旋转蒸发近于,用氮气吹干,加5mL丙酮-正已烷(3.2.12)溶解残渣。
3.5.1.3蜂蜜
称取蜂蜜试样5g(精确至0.01g),置于50mL离心管中,加人100μL氯露素氛代内标(氟需素-D,)工作溶液(3.2.24),5mL水,混勾,再加人20mL乙酸乙酯,振摇2min,离心5min,移取有机层到5
GB/r 22338—2008
100ml.棕色心形瓶中,于离心管中再加人20ml.乙乙酯,振摇2min,离心5min,合并有机层于棕色心形瓶中,40℃水浴中旋转蒸发至十.3mL水溶解残渣,混勾。3.5.2净化
3.5.2.1动物组织与水产品
用5mL丙酮-正已烷(3.2.12)淋洗LC-Si硅胶小柱,弃去淋洗液,将残渣溶解溶液(3.5.1.1、3.5.1.2)转移到固相苯取小柱上,弃去流出液,用5mL丙酮-正己烷(3.2.13)洗脱,收集洗脱液于心形瓶中,40C水裕中旋转蒸发至近干,氮气吹干,用1mL水定容,定容液过0.45m滤膜(3.2.27)至进样瓶,待测定。3.5.2.2蜂蜜
分别用5ml.甲醇,5mL水活化EN固相萃取柱,将提取液(3.5.1.3)转移上柱,用5mL水淋涤,用玻璃棒压干1rin,用3ml.乙酸乙酯洗脱,洗脱液用氮气吹干,用1mL水定容,定容液通过0.45μm滤膜(3.2.27)至进样瓶,待测定。3.5.3液相色谱-质谱/质谱测定
3.5.3.1液相色谱条件
色谱柱:ZorbaxSB-Ciz,5um,2.1mm×150mm,或与之相当者;a)
流动相:水-乙睛-10mmol/L乙酸铵溶液,梯度洗脱程序参见表2;b)
表 2 梯度洗脱程序
时间/min
流速:0.6 mL/min;
d)进样量:20 μL,
e)柱温:40 ℃。
3.5.3.2质谱/质谱条件
参见附录C。
3.5.3.3定性测定
乙酯/%
10 mmol/L乙酸链溶液/%
按照上述条件测定样品和建立标准工作曲线,如果样品中化合物质量色谐峰的保留时间与标准溶液的保留时间相比在允许偏差土2,5%之内;待测化合物定性离子对的重构离子色谱峰的信噪比大于或等于3(S/N≥3),定量离了对的重构离子色谱峰的信噪比大于或等于10(S/N≥10);定性离了对的相对丰度与浓度相当的标准溶液相比,相对丰度偏差不超过表3的规定,则可判断样品中存在相应的日标化合物。翁素甲砜霉素和氟甲砜霉素混合标准T.作溶液的液相色谱-质谱/质谱多反应监测(MRM)总离子流图和重构离子色谱图以及各目标化合物相对保留时问参见附录D中图D.1图D.5和表 D.1.
表3定性时相对离子丰度的最大允许偏差相对离子丰度/%
允许的相对偏差/%
3.5.3.4定量测定
>20~50
氯素使用内标法定量:甲零素和氟甲砜霉素使用外标法定量。3.6结果计算
>10~20
试样中目标化合物残留量使用仪器数据处理系统或氯舜素残留量按式(2)计算,甲霉素和氟甲砜6
震素按式(3)计算:
式中:
X-CXGXAXA:×V×1000
CXA.XA,XW
X_CXAXY×1000
X-试样中待测组分残留量,单位为微克每千克(rg/kg);—标推工作溶液的浓度,单位为纳克每亮升(ng/mL);C
标准工作溶液中内标物的浓度,单位为纳克每毫升(ng/mL);-样液中内标物的浓度,单位为纳克毫升(ng/mL);一标准工作溶液的峰面积;
样液中待测目标物的峰面积;
-标准工作溶液中内标物的峰面积;样液中内标物的峰面积;
试样定容体积,单位为毫升(mL);W一样品称样量,单位为克(g)。
注:计算结果应扣除空白值。
GB/T 22338—-2008
.(2))
测定低限
液相色谱-质谱/质谱法对氯霉素测定低限为0.1μg/kg;甲砜霉素和氟甲砜覆素为0.1μg/kg。3回收率和精密度
参见附录E,
GB/T 22338—2008
附录A
(资料性附录)
氧霉素类标准物质衍生物的气相色谱-质谱总离子流色谱图和质谱图CAP
氯霉素类标准物质衍生物的总离子流色谱图图A1
—CH—CH,O—TMS
NHCOCHCI
358366 380385 395404 41612143243944615245972 180150
0360370380390400410420430440450460470480m/2a)间硝基氧露素衍生物质谱图
CHsSOT
CH-CH-CI[F
NIICOCHCIe
298321
357m375795410 144
2402BD280300320840_360
7 380.400. 420 140
250270290310330350370390410430m/z
c)氛中霖景衍生物质谱图
-CHCH2O—IMS
NHCOCIICIa
.304.322
1385 404424 441
2843031332342 35836778394 416 4321 4505484
0 50 320 340 360 38 400 420 440 460 480350370390410430450470
310330
b)氛霖案衍生物质滋图
oaiebopo
CH-CH,O
NHCOCHC2
323 339 3551391427 447 1378. 519240 260 280 300 320340 360 380 400 420110 460 450 500m/z
d)甲矾霉素衔生物质谱图
图A.2氯素类药物衍生物结构式和质谱图8
药物名称
氟甲砜霉索
(资料性附录)
GB/T22338—2008
氯霉素类药物在不同基质中的平均回收率和精密度(GC/MS法)表B.1氯霉素类药物在不同基质中的平均回收率和精密度深加浓度/
(μg/kg)
求产品
回收率/%
同收率/%
畜食副产品
回收率/%
GB/T 22338—-2008
附 录 C
(资料性附录)
液相色谱-质谱/质谱测定参考条件\)液相色谱-质谱/质谱测定参考条件a)
离子源:电喷雾离子源;
扫描方式:负离子扫描;
检测方式:多重反应监测(MRM):d)
电喷雾电压:—4500V
雾化气压力:0.276MPa;
气帘气压力:0.172MPa;
辅助气流速:0.206MPa;
离子源温度:550℃;
定性离子对、定盘离子对、撞气能量和去簇电压,见表C,1。氛霉紊、甲砜霉素和氟甲砜霉素的定性离子对、定量离子对、碰撞气能盘和去簇电压表1
药物名称
甲碘舒素
氨甲霉素
氯霉-15
定性离子对(m/z)
(母离子/子离子)
320.9/151.9
320.9/256.9
353.9/289.9
353, 9/184.9
355.0/336.0
356.0/184.9
326.1/157.0
326.1/262.0
定盐离子对(m/2)
(母离子/子离子)
320.9/151.9
353.9/289,9
356.0/336.0
326.1/157.C
碰撞气能盘/ev
去綫电压/V
1)非商业性声明:附录A所列参数是在AP[4000串联质仪上完成的,此处列出的实验用型号仅是为了提供参考,并不涉及商业目的,鼓标准使用者尝试不同厂家和型号的仪器。10
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
中华人民共和国国家标准
GB/T22338—2008
动物源性食品中氯霉素类药物
残留量测定
Determination of multi-residues of chlorarnphenicolsin animal-original food
2008-09-01发布
中华人民共和国国家质量监督检验检疫总局中国国家标准化管理委员会
放码防行
2008-12-01实施
本标准的附录 A,附录 B,附录 C.附录 D 和附录 E均为资料性附录。本标准由中华人民共和国质录监督检验检疫总局提出。本标准由国家认证认可监督管理委员会归口。GB/T22338--2008
本标准起草单位:中国检验检疫科学研究院、中华人民共和国山东出人境检验检疫局。本标准主要起草人:邱月明、林黎明、李鹏、张鸿伟、赵海香、董益阳、蔡慧霞、谢孟峡、江丽萍、孔莹。1范圃
动物源性食品中氯霉素类药物
残留量测定
GB/T22338—2008
本标准规定了动物源性食品中氯霉素类残留量的气相色谱-质谱和液相色谱-质谱/质谱测定方法。
本标准适用于水产品、畜禽产品和畜食副产品中氣霉素、氟甲砜索和甲砜霉紫残留的定性确证和定量测定。
2气相色谱-质谱法
2.1原理
样品用乙酸乙酯提取,4%氯化钠溶液和正已烷液-液分配净化,再经弗罗里硅土(Florisil)柱净化后,以甲苯为反应介质,用N,O双(三甲基硅盐)三氟乙酰胺-三甲基氯硅烷(BSTFA十TMCS,99+-1)丁70℃硅烷化,用气相色谱/负化学电离源质谱测定,内标工作曲线法定量。2.2试剂和材料
除非另有说明,在分析中仅使用确认为分析纯的试剂和二次去离子水或相当纯度的水。2.2.1甲醇:色谱纯:
甲萃:农残缎。
正已烧:农残级。
2.2.4 乙酸乙酯.
2.2.5 乙醚。
氟化钠。
氮霉素(CAP)、氟甲矾霉素(FF)、甲砜霉素(TAP)标准物质:纯度≥99%。2.2.7
2.2.8间硝基氯欲素(m-CAP)标准物质:纯度≥99%。2.2.9氮化钠溶液(1%):称取适量氮化钠用水配暨成4%的氮化钠溶液,常温保存,可使用1周。2.2.10氯霉素类标准储备溶液:准确称取适景氮霉素、氟甲砜霉素和甲砜需素标准物质(精确到0.1mg),以甲醉配制成浓度为100μg/mL的标准储备溶液。2.2.11间硝基氯霉素内标工作溶液:准确称取适量间硝基氮霉素标准物质(精确到0.1mg),用甲醇配制成10ng/mL的标推工作溶液。2.2.12氛素类基质标准工作溶液:选择不含氯素类的样品六份,分别添加1mL内标工作溶液(2.2.11),用这六份提取液分别配成氯霉素、氟甲砜需素和中砜零素浓度为0.1ng/mL、0.2ng/mL、1ng/mL,2ng/mL、4ng/mL、8ng/mL的溶液,按本方法提取(2.4.1),净化(2.4.2),制成样品提取液用氮气缓慢吹干,硅烷化(2.4.3)后,制成标准工作溶液。2.2.13衍生化试剂:N,O双(三甲基硅基)三氟乙酰胺-三甲基氮硅烷(BSTFA十TMCS,99+1)。2.2.14固相萃取柱:弗罗里硅土柱(6.0ml.,1.0g)。2.3仪器和设备
2.3.1气相色谱/质谱联用仪:配有化学电离源(CI)。2.3.2组织捣碎机。
GB/T 22338--2008
2.3.3固相萃取装置。
2.3.4振药器。
2.3.5旋转发仪。
2.3.6涡旋混合器。
2.3.7离心机。
2.3.8恒温箱。
2.4测定步骤
2.4.1提取
称取10 g(精确到0. 01g))粉碎的组织样品于 50ml.具密离心管中,加人1. 0 mL内标溶液2.2.11)利30mL乙酸乙酯,振荡30min,于4000r/min离心2min,上层清液转移至圆底烧瓶中,残渣用30mL乙酸乙脂再提取一次,合并提取液,35℃旋转蒸发至1mL~2ml,待净化。2.4.2净化
2.4.2.1液-液萃取
提取液浓缩物(2.4.1)加1mL甲醇溶解,用20mL氮化钠落液(2.2.9)和20mL正已烷液-液萃取,弃去正已烷层,水相用40mL乙酸乙分两次萃取,合并乙酸乙酯相于心形瓶中,35℃旋转蒸发至近干,用氮气缓慢吹干。
2.4.2.2弗罗里硅土柱净化
弗罗果硅柱依次用5mL甲醇5mL甲醇-乙醚(3+7)溶液和5mL乙醛琳洗备用。将残渣(2.4.2.1)用5.0mL乙醚溶解上样,用5.0mL乙醚淋洗Florisil柱,5.0mL中醇-乙避溶液(3十7)洗脱,洗脱液用氮气缓慢吹干,待硅烷化。2.4.3硅烷化
净化后的试样(2.4.2.2)用0.2mL甲苯溶解,加人0.1mL硅烷化试剂(2.2.13)混合,于70C衍生化60min。氮气缓慢吹干,用1.0mL正已烷定穿,待测定。2.4.4测定
2.4.4.1气相色谱-质谱条件
色谱柱:DB-5MS毛细管柱,30m×0.25mm(内径)×0.25μm,或与之相当者;a
色谱柱温度:50C保持1min,25℃/min升至280℃,保持5minb)
进样口温度:250℃;
进样方式:不分流进样,不分流时间0.75min;载气:高纯氮气,纯度≥99.999%;e)
流速:1.0mL/min;
进样量:1.0μL;Www.bzxZ.net
接口温度:280℃;
离子源:化学电离源负离子模式NCI;扫描方式:选择离子监测;
k)离子源温度:150℃;
四级杆温度:106℃;
m)反应气:甲烷,纯度≥99.999%;选择监测离子参见表1。
药物名称
间硝基氮素
敏甲娲霉素
甲鲜常
2.4.4.2定性测定
监测离于(m/2)
表 1 监测离子
定适离子(/2)
GB/T 22338-2008
相对离子丰度比/%!充许相对误差/%100
进行试样测定时,如果检出色谱峰的保留时间与标谁物质相一致,并且在扣除背景后的样品质谱图中,所选择的离子均出现,而且所选择离了的相对离子丰度比与标准物质一致,相对丰度允许偏差不超过表1规定的范围,则可判断样品中存在对应的三种氮霉素。如果不能确证,应重新进样,以扫描方式(有足够灵敏度)或采用增加其他确证离子的方式来确证。2.4.4.3内标工作曲线
用配制的基质标准工作溶液(2.2.12)按2.4.4.1的气相色谱-质谱条件分别进样,以标准溶液浓度为横坐标,待测组分与内标物的峰面积之比为纵坐标绘制内标工作曲线。2. 4.4.4定量
以m/z466(m-CAP和CAP)、339(FF)和409(TAP)为定量离子,样品溶液中氮霉索类衍生物的响应值均应在仪器测定的线性范围内。在上述色谱条件下(2.4.4.1),m-CAP、CAP、FF、TAP标准物质衍生物参考保留时间约为11.4min、11.8min12.6min,13.6min。氮解素类标准物质衍生物总离子流图和质谱图参见附录A中的图A.1和图A.2。2.4.5平行实验
按以上步骤,对同一试样进行平行试验测定。2.4.6空白实验
除不加试样外,均按上述测定步骤进行。2.5结果计算
结果按式(1)计算:
式中:
试样中被测组分残留量,单位为微克每于克(μg/飞g);c一一·从内标标准工作曲线上得到的被测组分浓度,单位为纳克每毫升(ng/mL),试样溶液定容体积,单位为毫升(mL);一试样的质,单位为克(g)。
GB/T 22338--2008
2.6测定低限
气相色谱-质谱测定低限为:氯霉素0.1ug/kg,氧甲砜霉素和甲矾霉素0.5μg/kg。2.7回收率和精密度
参见附录B。
3夜相色谱-质谱/质谱法
3.1原理
针对不同动物源性食品中氛霉紊、甲砜每素和氟甲砜素残留,分别采用乙睛、乙酸乙酯-乙醛或乙酸乙酯提取,提取液用固相萃取柱进行净化,液相色谱-质谱/质谱仪测定,氛霉素采用内标法定量,甲氨霍素和氟甲砜霉素采用外标法定量。3,2试剂和材料
除非另有说明,在分析中仅使用确认为分析纯的试剂和二次去离子水或相当纯度的水。3.2.1甲醇:液相色谱级。
3.2.2乙腊:液相色谱级。
3.2.3丙酮:液相色谱级。
正丙醇:羧相色谱级。
正已烷:被相色谱级。
乙酸乙酯:液相色谱级。
乙醚。
乙酸钠。
乙酸铵。
3. 2. 10A
β葡萄糖醛酸酶:约40000活性单位。3.2.11乙睛饱和正己烷:取200ml.正已烷(3.2.5)于250mL分液漏斗中,加人少量乙睛(3.2.2),剧烈振摇,静置分层后,弃去下层乙腈层即得。3.2.12丙酮-正己烷(1+9):丙霸(3.2.3)、正已烷(3.2.5)按体积比1:9混勾。3.2、13酮-正已烷(6十4):丙酮(3.2.3)、正已烷(3.2.5)按体积比6:4混匀。3.2.14乙酸乙酯-乙醚(75+25):75mL乙酸乙酯(3.2.6)与25mL乙醛(3.2.7)溶液混勾。3.2.15乙酸钠缓冲液(0.1mol/L):称取乙酸钠(3.2.8)13.6g于1000mL容量瓶中,加人980mL水窃解并混勾,用乙酸调pH到5.0定容至刻度混勾。3.2.16乙酸铵溶液(10mmol/L):称取乙酸铵(3.2.9)0.77g于1000mL容量瓶中,用水定容至刻度混勾。
氧霉素,甲矾霉案和氟甲砜霖素标准物质:纯度299,0%。3. 2. 173
3.2.18氮露素氛代内标(氯霉素-Ds)物质:纯度≥99.9%。3.2.19标准储备溶液:分别准确称取适量的氯霉紊、甲霉素和氟甲需素标准物质(3.2.17)(精确到0.1mg),用乙睛配成500μg/mL的标准储备溶液(4C避光保存可使用6个月)。3.2.20氣素、甲砜霉素和氟甲冠素标准中间溶液:分别准确移取适量的氯霉素、甲砜霉案和氟甲硕霉素标准储备溶液(3.2.19),用乙稀释成50g/mL的氮等素、甲砜霉素和氟甲矾霉素标中间溶液(4℃避光保存可使用3个月)。3.2.21氮霉素、甲砜霉素和氟甲矾舜素混合标准工作液:分别准确移取适量的氯霉素,甲砜素和氟甲砜霉素标推中问溶液(3.2.20),用流动相稀释成合适的混合标准工作溶液(现用现配)。3.2.22氯霉素氛代内标(氯霉素-D)储备溶液:准确称取适量的氯需素-D标准物质(3.2.18)(精确到0.1mg),用乙腈配成100μg/mL的标准储备溶液(4℃避光保存可使用12个月)。3.2.23氯筹素氛代内标(氮素-D)中间溶液:确移取适量的氟霉素-Ds储备辫液(3.2.22),用乙4
睛配成1g/mL内标中间溶被(4℃避光保存可使用6个月)。GB/T 22338-—2008
3.2.24氯素氛代内标(氛霉素-D)工作溶液:准确移取适量的氮霉素-D。中间溶液(3.2.23),用乙腈配成0.1μg/mL内标工作溶液(4℃避光保存可使用2周)。3.2.25LC-si固相萃取柱或相当者200mg3mL。3.2.26EN固相萃取柱或相当者,200mg,3mL。3.2.27一次性注射式滤器:配有0.45μm微孔滤膜。3.3仪器和设备
3.3.1液相色谱-串联质谱仪:配有电喷雾离子源。3.3.2高速组织捣碎机。
3.3.3均质器。
3.3.4旋转蒸发仪。
3.3.5分析天平。
3.3.6移液枪:200 μL、1 mL。
3.3.7心形瓶;100 mL,棕色,
3.3.8分液溺斗:200 mL。
3.3.9聚四氟乙烯离心管:50mL。3.3.10离心机。
3.3.11涡旋混合器,
3.3.12固相萃取装置。
3.4试样制备与保存
3.4.1试样的制备
从原始样品中取出部分有代表性样品,经高速组织捣碎机均匀捣碎或混勾·用四分法缩分出适量试样,均分成两份,装人清洁容器内,加封后作出标记,一份作为试样,一份作为留样。3.4.2试样的保存
试样应在一20℃条件下保存。
3.5测定步骤
3.5.1提取
3.5.1.1动物组织(肝、肾除外)与水产品称取试样5g(精确至0.01g),置于50mL离心管中,加入100μL氯露素氛代内标(氯霉素-D,)工作溶液(3.2.24)和30mL乙睛,勾浆,离心5min。将上清液移人250ml分液漏斗中,加15mL乙睛饱和的正已烷(3.2.11),振荡5min,静置分层,转移乙层至100mL棕色心形瓶中。残渣中再加人30mL乙腈,振摇3min,离心5min,取上清液转移至同一分液漏斗,振荡5min,静置分层,转移乙腈层至同一棕色心形瓶中。向心形瓶中加入5mL正丙醇,于40℃水浴中旋转蒸发近干,用氮气吹干,加5ml丙酮-正己烷(3.2.12)溶解残渣。3.5.1.2动物肝、肾组织
称取试样5g(精确至0.0lg),置于50mL离心管中,加人30mL乙酸钠缓冲液(3.2.15),均质2min,加人300μLP-葡萄糖醛酸替酶(3.2.10),于37℃温育过夜。消解样品中加入100μ氛素氛代内标(氮案-D)工作溶液(3.2.24),20mL乙酸乙酯-乙醛(3.2.14),振摇2min,离心5min。取上层有机层入心形瓶中,在40℃水浴中旋转蒸发近于,用氮气吹干,加5mL丙酮-正已烷(3.2.12)溶解残渣。
3.5.1.3蜂蜜
称取蜂蜜试样5g(精确至0.01g),置于50mL离心管中,加人100μL氯露素氛代内标(氟需素-D,)工作溶液(3.2.24),5mL水,混勾,再加人20mL乙酸乙酯,振摇2min,离心5min,移取有机层到5
GB/r 22338—2008
100ml.棕色心形瓶中,于离心管中再加人20ml.乙乙酯,振摇2min,离心5min,合并有机层于棕色心形瓶中,40℃水浴中旋转蒸发至十.3mL水溶解残渣,混勾。3.5.2净化
3.5.2.1动物组织与水产品
用5mL丙酮-正已烷(3.2.12)淋洗LC-Si硅胶小柱,弃去淋洗液,将残渣溶解溶液(3.5.1.1、3.5.1.2)转移到固相苯取小柱上,弃去流出液,用5mL丙酮-正己烷(3.2.13)洗脱,收集洗脱液于心形瓶中,40C水裕中旋转蒸发至近干,氮气吹干,用1mL水定容,定容液过0.45m滤膜(3.2.27)至进样瓶,待测定。3.5.2.2蜂蜜
分别用5ml.甲醇,5mL水活化EN固相萃取柱,将提取液(3.5.1.3)转移上柱,用5mL水淋涤,用玻璃棒压干1rin,用3ml.乙酸乙酯洗脱,洗脱液用氮气吹干,用1mL水定容,定容液通过0.45μm滤膜(3.2.27)至进样瓶,待测定。3.5.3液相色谱-质谱/质谱测定
3.5.3.1液相色谱条件
色谱柱:ZorbaxSB-Ciz,5um,2.1mm×150mm,或与之相当者;a)
流动相:水-乙睛-10mmol/L乙酸铵溶液,梯度洗脱程序参见表2;b)
表 2 梯度洗脱程序
时间/min
流速:0.6 mL/min;
d)进样量:20 μL,
e)柱温:40 ℃。
3.5.3.2质谱/质谱条件
参见附录C。
3.5.3.3定性测定
乙酯/%
10 mmol/L乙酸链溶液/%
按照上述条件测定样品和建立标准工作曲线,如果样品中化合物质量色谐峰的保留时间与标准溶液的保留时间相比在允许偏差土2,5%之内;待测化合物定性离子对的重构离子色谱峰的信噪比大于或等于3(S/N≥3),定量离了对的重构离子色谱峰的信噪比大于或等于10(S/N≥10);定性离了对的相对丰度与浓度相当的标准溶液相比,相对丰度偏差不超过表3的规定,则可判断样品中存在相应的日标化合物。翁素甲砜霉素和氟甲砜霉素混合标准T.作溶液的液相色谱-质谱/质谱多反应监测(MRM)总离子流图和重构离子色谱图以及各目标化合物相对保留时问参见附录D中图D.1图D.5和表 D.1.
表3定性时相对离子丰度的最大允许偏差相对离子丰度/%
允许的相对偏差/%
3.5.3.4定量测定
>20~50
氯素使用内标法定量:甲零素和氟甲砜霉素使用外标法定量。3.6结果计算
>10~20
试样中目标化合物残留量使用仪器数据处理系统或氯舜素残留量按式(2)计算,甲霉素和氟甲砜6
震素按式(3)计算:
式中:
X-CXGXAXA:×V×1000
CXA.XA,XW
X_CXAXY×1000
X-试样中待测组分残留量,单位为微克每千克(rg/kg);—标推工作溶液的浓度,单位为纳克每亮升(ng/mL);C
标准工作溶液中内标物的浓度,单位为纳克每毫升(ng/mL);-样液中内标物的浓度,单位为纳克毫升(ng/mL);一标准工作溶液的峰面积;
样液中待测目标物的峰面积;
-标准工作溶液中内标物的峰面积;样液中内标物的峰面积;
试样定容体积,单位为毫升(mL);W一样品称样量,单位为克(g)。
注:计算结果应扣除空白值。
GB/T 22338—-2008
.(2))
测定低限
液相色谱-质谱/质谱法对氯霉素测定低限为0.1μg/kg;甲砜霉素和氟甲砜覆素为0.1μg/kg。3回收率和精密度
参见附录E,
GB/T 22338—2008
附录A
(资料性附录)
氧霉素类标准物质衍生物的气相色谱-质谱总离子流色谱图和质谱图CAP
氯霉素类标准物质衍生物的总离子流色谱图图A1
—CH—CH,O—TMS
NHCOCHCI
358366 380385 395404 41612143243944615245972 180150
0360370380390400410420430440450460470480m/2a)间硝基氧露素衍生物质谱图
CHsSOT
CH-CH-CI[F
NIICOCHCIe
298321
357m375795410 144
2402BD280300320840_360
7 380.400. 420 140
250270290310330350370390410430m/z
c)氛中霖景衍生物质谱图
-CHCH2O—IMS
NHCOCIICIa
.304.322
1385 404424 441
2843031332342 35836778394 416 4321 4505484
0 50 320 340 360 38 400 420 440 460 480350370390410430450470
310330
b)氛霖案衍生物质滋图
oaiebopo
CH-CH,O
NHCOCHC2
323 339 3551391427 447 1378. 519240 260 280 300 320340 360 380 400 420110 460 450 500m/z
d)甲矾霉素衔生物质谱图
图A.2氯素类药物衍生物结构式和质谱图8
药物名称
氟甲砜霉索
(资料性附录)
GB/T22338—2008
氯霉素类药物在不同基质中的平均回收率和精密度(GC/MS法)表B.1氯霉素类药物在不同基质中的平均回收率和精密度深加浓度/
(μg/kg)
求产品
回收率/%
同收率/%
畜食副产品
回收率/%
GB/T 22338—-2008
附 录 C
(资料性附录)
液相色谱-质谱/质谱测定参考条件\)液相色谱-质谱/质谱测定参考条件a)
离子源:电喷雾离子源;
扫描方式:负离子扫描;
检测方式:多重反应监测(MRM):d)
电喷雾电压:—4500V
雾化气压力:0.276MPa;
气帘气压力:0.172MPa;
辅助气流速:0.206MPa;
离子源温度:550℃;
定性离子对、定盘离子对、撞气能量和去簇电压,见表C,1。氛霉紊、甲砜霉素和氟甲砜霉素的定性离子对、定量离子对、碰撞气能盘和去簇电压表1
药物名称
甲碘舒素
氨甲霉素
氯霉-15
定性离子对(m/z)
(母离子/子离子)
320.9/151.9
320.9/256.9
353.9/289.9
353, 9/184.9
355.0/336.0
356.0/184.9
326.1/157.0
326.1/262.0
定盐离子对(m/2)
(母离子/子离子)
320.9/151.9
353.9/289,9
356.0/336.0
326.1/157.C
碰撞气能盘/ev
去綫电压/V
1)非商业性声明:附录A所列参数是在AP[4000串联质仪上完成的,此处列出的实验用型号仅是为了提供参考,并不涉及商业目的,鼓标准使用者尝试不同厂家和型号的仪器。10
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。