GB/T 38505-2020
基本信息
标准号: GB/T 38505-2020
中文名称:转基因产品通用检测方法
标准类别:国家标准(GB)
英文名称:General detection methods of genetically modified products
标准状态:现行
发布日期:2020-03-06
实施日期:2020-03-06
出版语种:简体中文
下载格式:.zip .pdf
下载大小:470475

标准分类号
标准ICS号: 数学、自然科学>>07.080生物学、植物学、动物学
中标分类号:综合>>基础学科>>A40基础学科综合
关联标准
出版信息
出版社:中国标准出版社
页数:16页
标准价格:31.0
相关单位信息
起草人:付伟、王晨光、朱鹏宇、杜智欣、魏霜、朱海、洪霞、郑秋月、付辉、何海宁、李飞武、金虹、安小苹、朱水芳、马涛、刘刚、杨光瑞、曹际娟、袁顺捷、黄文胜
起草单位:中国检验检疫科学研究院、深圳市易瑞生物技术股份有限公司、辽宁出入境检验检疫局检验检疫技术中心、甘肃中商食品质量检验检测有限公司、广西出入境检验检疫局检验检疫技术中心、吉林省农业科学院、上海市计量测试技术研究院、甘肃省商业科技研究所有限公司
提出单位:全国生化检测标准化技术委员会(SAC/TC 387)
发布部门:国家市场监督管理总局 国家标准化管理委员会
标准简介
标准号:GB/T 38505-2020
标准名称:转基因产品通用检测方法
英文名称:General detection methods of genetically modified products
标准格式:PDF
发布时间:2020-03-06
实施时间:2020-03-06
标准大小:513K
标准介绍:1范围
本标准规定了转基因产品的定性检测方法。
本标准适用于水稻、玉米、大豆、油菜、马铃薯、甜菜、苜蓿等及其加工产品中转基因成分的实时荧光PCR通用检测。
本标准方法的最低检出限为0.1%(质量分数)。
本标准规定了转基因产品的定性检测方法。 本标准适用于水稻、玉米、大豆、油菜、马铃薯、甜菜、苜蓿等及其加工产品中转基因成分的实时荧光PCR通用检测。 本标准方法的最低检出限为0.1%(质量分数)。
标准名称:转基因产品通用检测方法
英文名称:General detection methods of genetically modified products
标准格式:PDF
发布时间:2020-03-06
实施时间:2020-03-06
标准大小:513K
标准介绍:1范围
本标准规定了转基因产品的定性检测方法。
本标准适用于水稻、玉米、大豆、油菜、马铃薯、甜菜、苜蓿等及其加工产品中转基因成分的实时荧光PCR通用检测。
本标准方法的最低检出限为0.1%(质量分数)。
本标准规定了转基因产品的定性检测方法。 本标准适用于水稻、玉米、大豆、油菜、马铃薯、甜菜、苜蓿等及其加工产品中转基因成分的实时荧光PCR通用检测。 本标准方法的最低检出限为0.1%(质量分数)。
标准图片预览




标准内容
ICS07.080
iiiKAacJouaKAa
中华人民共和国国家标准
GB/T38505—2020
转基因产品通用检测方法
General detection methods of genetically modified products2020-03-06发布
国家市场监督管理总局
国家标准化管理委员会
2020-03-06实施
本标准按照GB/T1.1一2009给出的规则起草,本标准由全国生化检测标准化技术委员会(SAC/TC387)提出并归口。iiiKAa~cJouaKAa
GB/T38505—2020
本标准起草单位:中国检验检疫科学研究院、深圳市易瑞生物技术股份有限公司、辽宁出人境检验检疫局检验检疫技术中心,甘肃中商食品质量检验检测有限公司,广西出人境检验检疫局检验检疫技术中心、吉林省农业科学院、上海市计量测试技术研究院甘肃省商业科技研究所有限公司。本标准主要起草人:付伟、王晨光、朱鹏宇、杜智欣,魏霜,朱海、洪霞、郑秋月、付释、何海宁,李飞武金虹、安小苹、朱水芳、马涛、刘刚、杨光瑞、曹际娟、袁顺捷、黄文胜1
1范围
转基因产品通用检测方法
本标准规定了转基固产品的定性检测方法。iiiKAa~cJouaKAa
GB/T38505—2020
本标准适用于水霜,玉米、大豆、油菜、马铃薯、甜菜、首蒲等及其加工产品中转基固成分的实时荧光PCR通用检测。
本标准方法的最低检出限为0.1%(质量分教)2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。GB/T6682分析实验室用本航格和试验方法GB/T19495.1转基因产品检测
通用要求和定义
GB/T 19495.3
GB/T19495.7
3术语和定义
转基固产品检测
核酸摄取纯化方法
转基因产品检测
抽样和制样方法
下列术语和定义适用于本文件。3.1
18SrRNAgene
18SrRNA基固
转录自18STDNA,细胞核糖体的组分之一,作为植物内源基因。3.2
CaMV 35S启动子35Spromater from Cauliflower mosaie virus来自花椰菜花叶病毒(Caulifloermnsaicwirus+CaMV)的35S启动子。3.3
CaMv35S终止子35Sterminator fromCamliflowermosaicvirus来自花椰菜花叶病毒(Cauliflouermosatcwirus,CaMV)的35S终止子。3.4
NOs络止子terminatorof nopalinesynthasegene来自聯脂碱合成醇基因的终止子。3.5
E9 终止子terminator of ribulose-1.5-biphosphate carboxylase small subunit来自碗豆核雨糖1,5-二磷酸胶化静小亚基(ribulose-1,5-biphosphatecarboxylasesmallsubunit)基固的3'端终止序列。
par基固
phosphinothricin acetyltransderase gene来自练产色链莓菌(Strebtonceuiridochromogene,缇码腾丝国素之酰转移醇(phosphinothricin1
GB/T38505—2020
acetyltransderase.PAT).
注,pa基因对除草剂草甘胖(glufosinate)具有耐受性。3.7
Pin I 终止子 terminator of proteinase inhibitor Ⅱ来自马铃薯蛋白酶抑制剂Ⅱ(proteinaseinhibitorⅡ,PinID)的终止子。3.8
RbeS4 启动子promoter of ribulose-1.5-biphosphate carboxylase small subunit 1ATiiKAa~cJouaKAa
来自拟南芥核削糖-1.5-二磷酸骏化酶/加氧酶小亚基1A(ribulose-1,5-biphosphatecarboxylasesmallsubunit1A,RbcS4)编码基因的启动子。3.9
DAS402785边界序列5-endevent-specificsequenceof DAS40278DAS40278转化体外源插人片断5°端与玉米基因组的连接区序列。注:该序列包括外源暂人片段的部分载体序列和玉来基因红的部分库列,3.10
DP3054233边界序列3-endevent-specificsequenceofDP305423DP305423转化体外源插人片断3端与大豆基因组的连接区序列,注:该序列包括外源斯人片段的部分载体序列和大互基因组的部分序列。3.11
Cv1275'边界序列 5'-end event-specific sequence of Cv127CV127转化体外源插人片断5端与大豆基因组的连接区序列。注:该序列包括外源暂人片段的部分载体序列和大豆基因组的部分序列,3.12
cyclethreshold
反应管内的荧光信号达到设定的阅值时所经历的循环数。4试剂与材料
除另有规定外·所有试剂均为分析纯或生化试剂。试验用水符合GB/T6682中一级水的规格。4.1实时荧光PCR预混液
采用经验证符合实时荧光PCR要求的实时荧光PCR预混液。4.2500mmol/L乙二胺四乙酸二钠溶液(pH8.0)称取18.6g乙二胺四乙酸二钠.加人70mL水中,并用NaOH溶液调pH值至8.0,加水定容至100mL在103.4kPa(121C)条件下灭菌20min。4.31mol/L三羟甲基氢基甲烷-盐溶液(pH8.9称取121.1g三羟甲基氮基甲烷溶解于800mL水中.用盐酸调pH值至8.0.加水定容至1000mL在103.4kPa(121C)条件下天菌20min4.4TE缓冲液(pH8.0)
分别量取10mL1mol/L三羟甲基氨基甲烷-盐溶液(4.3)和2ml.500mmol/l乙二胺四乙酸二钠溶液(4.2).加水定容至1000mL。在103.4kPa(121C)条件下灭菌20min2
引物和探针
TiiKAa~cJouaKAa
GB/T38505—2020
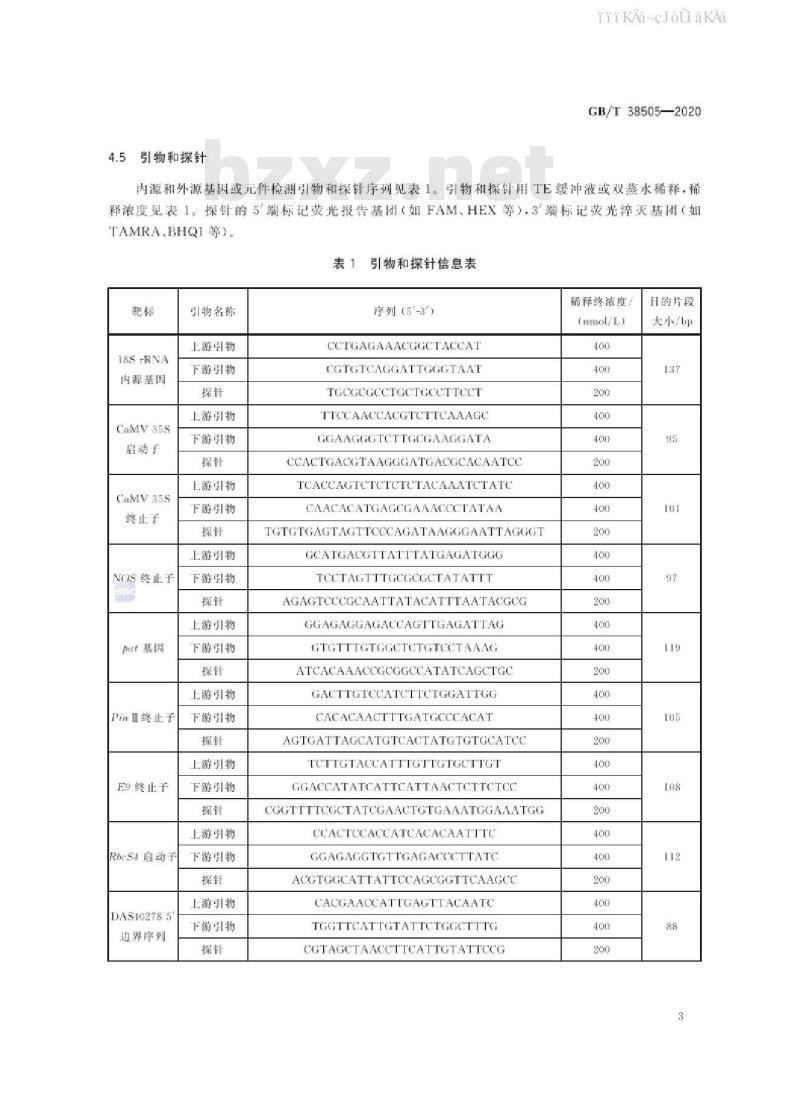
内源和外源基因或元件检测引物和探针序列见表1。引物和探针用TE缓冲液或双蒸水稀释,稀释浓度见表1。
探针的5端标记荧光报告基团(如FAM、HEX等),3端标记荧光摔灭基团(如TAMRA.BHQI等)
引物和探针信息表
18SFRNA
内源基固
CaMV35S
启动子
CaMV35s
终止子
NOS终正子
pat基
Piar终止子
E9终止于
RacS4启动子
DAS402785
边界序列
引物名称
上游引物
下游引物
上游引物
下游引物
上游引物
下游引物
上游引物
下静引物
上游引物
下游引物
上游引物
下游引物
上游引物
下游引物
上游引物
下游引物
上游引物
下游引物
序列(6'-3\)
CCTGAGAAACGGCTACCAT
CGTGTCAGGATTGGGTAAT
TGCGCGCCTGCTGCCTTCCT
TTCCAACCACGTCTTCAAAGC
GGAAGGGTCTTGCGAAGGATA
CCACTGACGTAAGGGATGACGCACAATCCTCACCAGTCTCTCTCTACAAATCTATO
CAACACATGAGCGAAACCCTATAA
TGTGTGAGTAGTTCCCAGATAAGGGAATTAGGGTGCATGACGTTATTTATGAGATGGG
TCCTAGTTTGCGCGCTATATTT
AGAGTCCCGCAATTATACATTTAATACGCGGGAGAGGAGACCAGTTGAGATTAG
GTGTTTGTGGCTCTGTCCTAAAG
ATCACAAACCGCGGCCATATCAGCTGC
GACTTGTCCATCTTCTGGATTGG
CACACAACTTTGATGCCCACAT
AGTGATTAGCATGTCACTATGTGTGCATCCTCTTGTACCATTTGTTGTGCTTGT
GGACCATATCATTCATTAACTCTTCTCCCGGTTTTCGCTATCGAACTGTGAAATGGAAATGGCCACTCCACCATCACACAATTTC
GGAGAGGTGTTGAGACCCTTATC
ACGTGGCATTATTCCAGCGGTTCAAGCCCACGAACCATTGAGTTACAATO
TGGTTCATTGTATTCTGGCTTTG
CGTAGCTAACCTTCATTGTATTCCG
稀释终液度:
(mmol/L)
目的片段
大小/bp
GB/T38505—2020
DP3054233
边界序列
CV1275\
近界序列
引物名称
上游引物
下游引物
上游引物
下游引物
表1(续)
序列(5'-3\)
CGTGTTCTCTTTTTGGCTAGC
GTGACCAATGAATACATAACACAAACTATGACACAAATGATTTTCATACAAAAGTCGAGAAACAGAAGTTTCCGTTGAGCTTTAAGACCATTCGTAGCTCGGATCGTGTAC
TTTGGGGAAGCTGTCCCATGCCC
iiiKAa~cJouaKAa
稀释终浓度
(nmol/L)
目的片段
大小/bp
对于确定物种
对于不期确是否为转基因产品的样品,应选用王还所有内源和外源基因进行检测。空的转基因样品,应根据表2选用基因或元件进行检测。确定物种选用基固或元件
大豆及其加工产品
宝米及其加工产品
油及其加工产品
水稽及其加工产品
马铃薯及其加工产品
首猎及其加工产品
甜菜及其加工产品
仪器与设备
分析天平:感量0.1mg。
生物安全柜。Www.bzxZ.net
实时荧光PCR仪。
纯水仪。
涡旋振菌仪。
微量移液器。
操作步骤
选用基因/元件
内源基固,CaMV35S启动子,NOS终止子,pa基固,PinI终止子E9整止子,RbeS4启动子.DP3054233边界序列.CV1275边界序列内源基固.CaMV35S启动子.CaMV35S终止子,NOS终止子、paI基固、Pi#终止子DAS402785\边界序列内源基固、CaMV35S启动子.CaMV35S终止子NOS终止子、E9终止子.PinaⅡ终止子
内源基固.CaMV35S启动子,CaMV35S终止子,NOS终止子内源基国,NOS终止子,RkS4启动子内源基因、NOS降止子、E9终止子内源基因、E9终止子
按照GB/T19495.1和GB/T19495.7的规定执行。6.2制样
按照GB/T19495.1和GB/T19495.7的规定执行6.3试样预处理
按照GB/T19495.1和GB/T19495.3的规定执行。DNA模板制备
iiKAa~cJouaKAa
GB/T38505—2020
按照GB/T19495.1和GB/T19495.3的规定执行。或可采用具有相同效果的植物基固组DNA提取试剂盒进行DNA模板制备。
SDNA浓度测定
采用紫外分光光度法测定DNA浓度,将DNA溶液做适当的稀释,于260m处测定其吸光度,根据测定的OD值计算DNA浓度(260nm处1OD=50pg/mL双链DNA).OD值应该在0.2--0.8的范围内。于280nm处测定其吸光度,根据测定的OD值计算DNA溶液的ODzmam/ODmm比值,比值应在1.8-~2.0
6.6实时荧光PCR检测
6.6.1阴性对照、阳性对照和空白对照的设置以非转基因样品为阴性对照。以对应的转基因植物样品品系或含有相应外源基因的转基因植物样品基因组DNA,或含有上述片段的质粒标准分子DNA为阳性对照,以水或TE缓冲液为空白对照。6.6.2
实时荧光PCR反应体系
PCR反应体系见表3或按照经验证待合要求的试剂盒推荐体系进行配制。每个DNA样品做2个平行管。加样时应使样品DNA落液完全加人反应液中不要黏于管壁上,加样后应尽快盖紧管盖。表3
实时荧光PCR反应体系
试剂名称
实时荧光PCR预混液
上游引物(10pmot/L)
下游引物(0μmel/L
探针(10pmol/L)
DNA模板(50ng/μL)
补水至
0.4 μmol/1
0.4 μmol/L
0.2 pmol/L
4.0 ng/μl
反应体系中各试剂的量可报据反应体系的总体积进行适当调整仪器设置
加样体积/nt
设PCR反应管荧光信号收集条件,应与探针标记的报告基团一致,具体设置方法可参照仪器使用说明书。
GB/T385052020
PCR反应参数
iiiKAa~cJouaKAa
实时荧光PCR增反虚参数:50C/2min:95C/10min:95C/15s.60C/60s,大于或等于40个循环。
注:95C/10min专门适用于化学变构的热启动Ta酶。以上参数可根据不同型号实时荧光PCR仪和所选PCR扩增试剂体系不周做调整
SPCR反应运行
将PCR反成管依次摆放至实时荧光PCR仪上上机前注意检查各反应管是否盖紧,以免费光物质泄漏污染仪器),开始运行仪器进行实时荧光PCR反应7结果分析
7.1闽值设定
实时荧光PCR友应结束后,设置荧光信号阅值,国值设定原则根据仅器噪声情况进行调整,以阅值线刚好超过正常阴性样品扩增曲线的最高点为准。7.2质量控制
空白对照:内参基因检测未出现典型扩增曲线,所有外源基因检测未出现典型扩增曲线,或值大于或等于40。
明性对照:内参基因检测出现典型扩增由线,且值小于或等于,所有外源基固检测未出现典型扩增曲线,或心t值大于或等于40。阳性对照:内参基因检测出现典型扩增曲线,耳Ct值小于或等于30,所有外源基因检测出现典型扩增曲线,且Ct值小于或等于34。8结果判定与表述
8.1结果判定
测试样品全部平行反应外源基固检测未出现典型扩增曲线或C值大于或等于0:内源基固检测出现典型扩增曲线,且Ct值小于或等于30,则可判定该样品不含所检的外源基因测试样品全部平行反应外源基因检测出现典型扩增由线,Ct值小于或等于36.内源基因检测出现典型扩增曲线,值小于或等于30,判定该样品含有对应的外源基因。测试样品全部平行反应外源基固检测出现典型扩增曲线,但Ct值在36一40之间,内源基因检测Ct值出现典型扩增曲线·且小于或等于30,应在排除污染的情况下重新处理样品上机检测。再次扩增后的内源基因检测出现典型扩增曲线,耳C直小于或等于,外源基固检测出现典型扩增曲线,且t值仍小于40,则可判定为该样品含有所检的外源基因。再次扩增后的内源基围检测出现典型扩增曲线,且Ct值小于或等于30,外源基因检测未出现典型扩增曲线,或Ct值大于或等于40,则可判定为该样品不會所检的外源基因
8.2结果表述
如下所示:
样品未检出文文外源基因。
样品检出文×外源基因。
存查样品保存期限
存查样品保存期限按照GB/T19495.1中的规定执行。转化体信息
本标准覆盖的转化体信息参见附录A。iiKAa~cJouaKAa
GB/T38505—2020
GB/T38505—2020
标唯覆盖转化体信息见表A.1
编号勘种
MON810
MON89034
MON88017
MON87460
MON87427
MON863
MIR604
MIR162
TC1507
VCO-01981-5
DAS40278
GTS40-3-2
MON89788
MON87701
MON87705
MON87708
MON87769
MON87751
DP305423
DP356043
启动子
附录A
(资料性附录)
标准覆盖转化体信息
表A.1标准覆盖转化体信息
终止子
整止子
蜂止于
启动子
pat基因
蜂止子
TiiKAacJouaKA
DAS40278
DP305423CV122
A5547-127
A2704-12
SYHTOH2
DAS44406-6
DAS68416-4
DAS81419
RT73(GT73
MON88302
Topas19/2
OXY-235
LLRICE62
TT51-1
AM04-1026
EH92-527-1
PH05-026-0048
AV-42-6-G7
启动子
路止子
路止子
表A.1(续)
终止子
RibeS4
启动子
par基国
终止子
TiiKAacJouaKA
GB/T38505—2020
D/AS10278 DP305423CV12
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
iiiKAacJouaKAa
中华人民共和国国家标准
GB/T38505—2020
转基因产品通用检测方法
General detection methods of genetically modified products2020-03-06发布
国家市场监督管理总局
国家标准化管理委员会
2020-03-06实施
本标准按照GB/T1.1一2009给出的规则起草,本标准由全国生化检测标准化技术委员会(SAC/TC387)提出并归口。iiiKAa~cJouaKAa
GB/T38505—2020
本标准起草单位:中国检验检疫科学研究院、深圳市易瑞生物技术股份有限公司、辽宁出人境检验检疫局检验检疫技术中心,甘肃中商食品质量检验检测有限公司,广西出人境检验检疫局检验检疫技术中心、吉林省农业科学院、上海市计量测试技术研究院甘肃省商业科技研究所有限公司。本标准主要起草人:付伟、王晨光、朱鹏宇、杜智欣,魏霜,朱海、洪霞、郑秋月、付释、何海宁,李飞武金虹、安小苹、朱水芳、马涛、刘刚、杨光瑞、曹际娟、袁顺捷、黄文胜1
1范围
转基因产品通用检测方法
本标准规定了转基固产品的定性检测方法。iiiKAa~cJouaKAa
GB/T38505—2020
本标准适用于水霜,玉米、大豆、油菜、马铃薯、甜菜、首蒲等及其加工产品中转基固成分的实时荧光PCR通用检测。
本标准方法的最低检出限为0.1%(质量分教)2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。GB/T6682分析实验室用本航格和试验方法GB/T19495.1转基因产品检测
通用要求和定义
GB/T 19495.3
GB/T19495.7
3术语和定义
转基固产品检测
核酸摄取纯化方法
转基因产品检测
抽样和制样方法
下列术语和定义适用于本文件。3.1
18SrRNAgene
18SrRNA基固
转录自18STDNA,细胞核糖体的组分之一,作为植物内源基因。3.2
CaMV 35S启动子35Spromater from Cauliflower mosaie virus来自花椰菜花叶病毒(Caulifloermnsaicwirus+CaMV)的35S启动子。3.3
CaMv35S终止子35Sterminator fromCamliflowermosaicvirus来自花椰菜花叶病毒(Cauliflouermosatcwirus,CaMV)的35S终止子。3.4
NOs络止子terminatorof nopalinesynthasegene来自聯脂碱合成醇基因的终止子。3.5
E9 终止子terminator of ribulose-1.5-biphosphate carboxylase small subunit来自碗豆核雨糖1,5-二磷酸胶化静小亚基(ribulose-1,5-biphosphatecarboxylasesmallsubunit)基固的3'端终止序列。
par基固
phosphinothricin acetyltransderase gene来自练产色链莓菌(Strebtonceuiridochromogene,缇码腾丝国素之酰转移醇(phosphinothricin1
GB/T38505—2020
acetyltransderase.PAT).
注,pa基因对除草剂草甘胖(glufosinate)具有耐受性。3.7
Pin I 终止子 terminator of proteinase inhibitor Ⅱ来自马铃薯蛋白酶抑制剂Ⅱ(proteinaseinhibitorⅡ,PinID)的终止子。3.8
RbeS4 启动子promoter of ribulose-1.5-biphosphate carboxylase small subunit 1ATiiKAa~cJouaKAa
来自拟南芥核削糖-1.5-二磷酸骏化酶/加氧酶小亚基1A(ribulose-1,5-biphosphatecarboxylasesmallsubunit1A,RbcS4)编码基因的启动子。3.9
DAS402785边界序列5-endevent-specificsequenceof DAS40278DAS40278转化体外源插人片断5°端与玉米基因组的连接区序列。注:该序列包括外源暂人片段的部分载体序列和玉来基因红的部分库列,3.10
DP3054233边界序列3-endevent-specificsequenceofDP305423DP305423转化体外源插人片断3端与大豆基因组的连接区序列,注:该序列包括外源斯人片段的部分载体序列和大互基因组的部分序列。3.11
Cv1275'边界序列 5'-end event-specific sequence of Cv127CV127转化体外源插人片断5端与大豆基因组的连接区序列。注:该序列包括外源暂人片段的部分载体序列和大豆基因组的部分序列,3.12
cyclethreshold
反应管内的荧光信号达到设定的阅值时所经历的循环数。4试剂与材料
除另有规定外·所有试剂均为分析纯或生化试剂。试验用水符合GB/T6682中一级水的规格。4.1实时荧光PCR预混液
采用经验证符合实时荧光PCR要求的实时荧光PCR预混液。4.2500mmol/L乙二胺四乙酸二钠溶液(pH8.0)称取18.6g乙二胺四乙酸二钠.加人70mL水中,并用NaOH溶液调pH值至8.0,加水定容至100mL在103.4kPa(121C)条件下灭菌20min。4.31mol/L三羟甲基氢基甲烷-盐溶液(pH8.9称取121.1g三羟甲基氮基甲烷溶解于800mL水中.用盐酸调pH值至8.0.加水定容至1000mL在103.4kPa(121C)条件下天菌20min4.4TE缓冲液(pH8.0)
分别量取10mL1mol/L三羟甲基氨基甲烷-盐溶液(4.3)和2ml.500mmol/l乙二胺四乙酸二钠溶液(4.2).加水定容至1000mL。在103.4kPa(121C)条件下灭菌20min2
引物和探针
TiiKAa~cJouaKAa
GB/T38505—2020
内源和外源基因或元件检测引物和探针序列见表1。引物和探针用TE缓冲液或双蒸水稀释,稀释浓度见表1。
探针的5端标记荧光报告基团(如FAM、HEX等),3端标记荧光摔灭基团(如TAMRA.BHQI等)
引物和探针信息表
18SFRNA
内源基固
CaMV35S
启动子
CaMV35s
终止子
NOS终正子
pat基
Piar终止子
E9终止于
RacS4启动子
DAS402785
边界序列
引物名称
上游引物
下游引物
上游引物
下游引物
上游引物
下游引物
上游引物
下静引物
上游引物
下游引物
上游引物
下游引物
上游引物
下游引物
上游引物
下游引物
上游引物
下游引物
序列(6'-3\)
CCTGAGAAACGGCTACCAT
CGTGTCAGGATTGGGTAAT
TGCGCGCCTGCTGCCTTCCT
TTCCAACCACGTCTTCAAAGC
GGAAGGGTCTTGCGAAGGATA
CCACTGACGTAAGGGATGACGCACAATCCTCACCAGTCTCTCTCTACAAATCTATO
CAACACATGAGCGAAACCCTATAA
TGTGTGAGTAGTTCCCAGATAAGGGAATTAGGGTGCATGACGTTATTTATGAGATGGG
TCCTAGTTTGCGCGCTATATTT
AGAGTCCCGCAATTATACATTTAATACGCGGGAGAGGAGACCAGTTGAGATTAG
GTGTTTGTGGCTCTGTCCTAAAG
ATCACAAACCGCGGCCATATCAGCTGC
GACTTGTCCATCTTCTGGATTGG
CACACAACTTTGATGCCCACAT
AGTGATTAGCATGTCACTATGTGTGCATCCTCTTGTACCATTTGTTGTGCTTGT
GGACCATATCATTCATTAACTCTTCTCCCGGTTTTCGCTATCGAACTGTGAAATGGAAATGGCCACTCCACCATCACACAATTTC
GGAGAGGTGTTGAGACCCTTATC
ACGTGGCATTATTCCAGCGGTTCAAGCCCACGAACCATTGAGTTACAATO
TGGTTCATTGTATTCTGGCTTTG
CGTAGCTAACCTTCATTGTATTCCG
稀释终液度:
(mmol/L)
目的片段
大小/bp
GB/T38505—2020
DP3054233
边界序列
CV1275\
近界序列
引物名称
上游引物
下游引物
上游引物
下游引物
表1(续)
序列(5'-3\)
CGTGTTCTCTTTTTGGCTAGC
GTGACCAATGAATACATAACACAAACTATGACACAAATGATTTTCATACAAAAGTCGAGAAACAGAAGTTTCCGTTGAGCTTTAAGACCATTCGTAGCTCGGATCGTGTAC
TTTGGGGAAGCTGTCCCATGCCC
iiiKAa~cJouaKAa
稀释终浓度
(nmol/L)
目的片段
大小/bp
对于确定物种
对于不期确是否为转基因产品的样品,应选用王还所有内源和外源基因进行检测。空的转基因样品,应根据表2选用基因或元件进行检测。确定物种选用基固或元件
大豆及其加工产品
宝米及其加工产品
油及其加工产品
水稽及其加工产品
马铃薯及其加工产品
首猎及其加工产品
甜菜及其加工产品
仪器与设备
分析天平:感量0.1mg。
生物安全柜。Www.bzxZ.net
实时荧光PCR仪。
纯水仪。
涡旋振菌仪。
微量移液器。
操作步骤
选用基因/元件
内源基固,CaMV35S启动子,NOS终止子,pa基固,PinI终止子E9整止子,RbeS4启动子.DP3054233边界序列.CV1275边界序列内源基固.CaMV35S启动子.CaMV35S终止子,NOS终止子、paI基固、Pi#终止子DAS402785\边界序列内源基固、CaMV35S启动子.CaMV35S终止子NOS终止子、E9终止子.PinaⅡ终止子
内源基固.CaMV35S启动子,CaMV35S终止子,NOS终止子内源基国,NOS终止子,RkS4启动子内源基因、NOS降止子、E9终止子内源基因、E9终止子
按照GB/T19495.1和GB/T19495.7的规定执行。6.2制样
按照GB/T19495.1和GB/T19495.7的规定执行6.3试样预处理
按照GB/T19495.1和GB/T19495.3的规定执行。DNA模板制备
iiKAa~cJouaKAa
GB/T38505—2020
按照GB/T19495.1和GB/T19495.3的规定执行。或可采用具有相同效果的植物基固组DNA提取试剂盒进行DNA模板制备。
SDNA浓度测定
采用紫外分光光度法测定DNA浓度,将DNA溶液做适当的稀释,于260m处测定其吸光度,根据测定的OD值计算DNA浓度(260nm处1OD=50pg/mL双链DNA).OD值应该在0.2--0.8的范围内。于280nm处测定其吸光度,根据测定的OD值计算DNA溶液的ODzmam/ODmm比值,比值应在1.8-~2.0
6.6实时荧光PCR检测
6.6.1阴性对照、阳性对照和空白对照的设置以非转基因样品为阴性对照。以对应的转基因植物样品品系或含有相应外源基因的转基因植物样品基因组DNA,或含有上述片段的质粒标准分子DNA为阳性对照,以水或TE缓冲液为空白对照。6.6.2
实时荧光PCR反应体系
PCR反应体系见表3或按照经验证待合要求的试剂盒推荐体系进行配制。每个DNA样品做2个平行管。加样时应使样品DNA落液完全加人反应液中不要黏于管壁上,加样后应尽快盖紧管盖。表3
实时荧光PCR反应体系
试剂名称
实时荧光PCR预混液
上游引物(10pmot/L)
下游引物(0μmel/L
探针(10pmol/L)
DNA模板(50ng/μL)
补水至
0.4 μmol/1
0.4 μmol/L
0.2 pmol/L
4.0 ng/μl
反应体系中各试剂的量可报据反应体系的总体积进行适当调整仪器设置
加样体积/nt
设PCR反应管荧光信号收集条件,应与探针标记的报告基团一致,具体设置方法可参照仪器使用说明书。
GB/T385052020
PCR反应参数
iiiKAa~cJouaKAa
实时荧光PCR增反虚参数:50C/2min:95C/10min:95C/15s.60C/60s,大于或等于40个循环。
注:95C/10min专门适用于化学变构的热启动Ta酶。以上参数可根据不同型号实时荧光PCR仪和所选PCR扩增试剂体系不周做调整
SPCR反应运行
将PCR反成管依次摆放至实时荧光PCR仪上上机前注意检查各反应管是否盖紧,以免费光物质泄漏污染仪器),开始运行仪器进行实时荧光PCR反应7结果分析
7.1闽值设定
实时荧光PCR友应结束后,设置荧光信号阅值,国值设定原则根据仅器噪声情况进行调整,以阅值线刚好超过正常阴性样品扩增曲线的最高点为准。7.2质量控制
空白对照:内参基因检测未出现典型扩增曲线,所有外源基因检测未出现典型扩增曲线,或值大于或等于40。
明性对照:内参基因检测出现典型扩增由线,且值小于或等于,所有外源基固检测未出现典型扩增曲线,或心t值大于或等于40。阳性对照:内参基因检测出现典型扩增曲线,耳Ct值小于或等于30,所有外源基因检测出现典型扩增曲线,且Ct值小于或等于34。8结果判定与表述
8.1结果判定
测试样品全部平行反应外源基固检测未出现典型扩增曲线或C值大于或等于0:内源基固检测出现典型扩增曲线,且Ct值小于或等于30,则可判定该样品不含所检的外源基因测试样品全部平行反应外源基因检测出现典型扩增由线,Ct值小于或等于36.内源基因检测出现典型扩增曲线,值小于或等于30,判定该样品含有对应的外源基因。测试样品全部平行反应外源基固检测出现典型扩增曲线,但Ct值在36一40之间,内源基因检测Ct值出现典型扩增曲线·且小于或等于30,应在排除污染的情况下重新处理样品上机检测。再次扩增后的内源基因检测出现典型扩增曲线,耳C直小于或等于,外源基固检测出现典型扩增曲线,且t值仍小于40,则可判定为该样品含有所检的外源基因。再次扩增后的内源基围检测出现典型扩增曲线,且Ct值小于或等于30,外源基因检测未出现典型扩增曲线,或Ct值大于或等于40,则可判定为该样品不會所检的外源基因
8.2结果表述
如下所示:
样品未检出文文外源基因。
样品检出文×外源基因。
存查样品保存期限
存查样品保存期限按照GB/T19495.1中的规定执行。转化体信息
本标准覆盖的转化体信息参见附录A。iiKAa~cJouaKAa
GB/T38505—2020
GB/T38505—2020
标唯覆盖转化体信息见表A.1
编号勘种
MON810
MON89034
MON88017
MON87460
MON87427
MON863
MIR604
MIR162
TC1507
VCO-01981-5
DAS40278
GTS40-3-2
MON89788
MON87701
MON87705
MON87708
MON87769
MON87751
DP305423
DP356043
启动子
附录A
(资料性附录)
标准覆盖转化体信息
表A.1标准覆盖转化体信息
终止子
整止子
蜂止于
启动子
pat基因
蜂止子
TiiKAacJouaKA
DAS40278
DP305423CV122
A5547-127
A2704-12
SYHTOH2
DAS44406-6
DAS68416-4
DAS81419
RT73(GT73
MON88302
Topas19/2
OXY-235
LLRICE62
TT51-1
AM04-1026
EH92-527-1
PH05-026-0048
AV-42-6-G7
启动子
路止子
路止子
表A.1(续)
终止子
RibeS4
启动子
par基国
终止子
TiiKAacJouaKA
GB/T38505—2020
D/AS10278 DP305423CV12
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。