HG 2321-1992
基本信息
标准号: HG 2321-1992
中文名称:磷酸二氢钾
标准类别:化工行业标准(HG)
英文名称: Potassium dihydrogen phosphate
标准状态:现行
发布日期:1992-06-01
实施日期:1992-09-01
出版语种:简体中文
下载格式:.rar.pdf
下载大小:563339
相关标签: 磷酸二氢钾

标准分类号
标准ICS号:化工技术>>分析化学>>71.040.30化学试剂
中标分类号:化工>>化肥、农药>>G21化肥、化学土壤调理剂
关联标准
替代情况:原标准号GB 1963-1980
出版信息
页数:15页
标准价格:17.0 元
相关单位信息
标准简介
HG 2321-1992 磷酸二氢钾 HG2321-1992 标准下载解压密码:www.bzxz.net
标准图片预览



标准内容
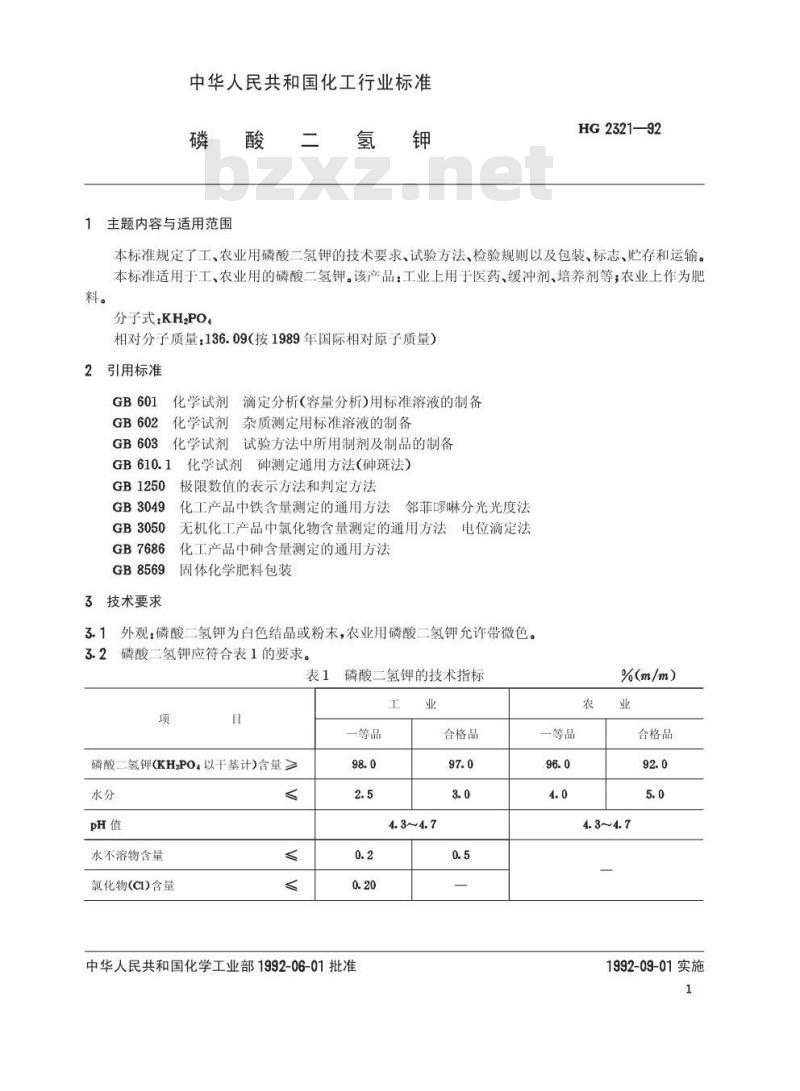
中华人民共和国化工行业标准
HG2321—92
磷酸二氢钾
1992-06-01发布
中华人民共和国化学工业部
1992-09-01实施
中华人民共和国化工行业标准
1主题内容与适用范围
HG2321—92
本标准规定了工、农业用磷酸二氢钾的技术要求、试验方法、检验规则以及包装、标志、贮存和运输。本标准适用于工、农业用的磷酸二氢钾。该产品:工业上用于医药、缓冲剂、培养剂等;农业上作为肥料。
分子式:KH2PO
相对分子质量:136.09(按1989年国际相对原子质量)引用标准
化学试剂滴定分析(容量分析)用标准溶液的制备化学试剂杂质测定用标准溶液的制备化学试剂试验方法中所用制剂及制品的制备GB610.1
GB1250
GB3049
GB3050
GB7686
GB8569
3技术要求
化学试剂砷测定通用方法(砷斑法)极限数值的表示方法和判定方法化工产品中铁含量测定的通用方法邻菲啰啉分光光度法无机化工产品中氯化物含量测定的通用方法电位滴定法化工产品中砷含量测定的通用方法固体化学肥料包装
3.1外观:磷酸二氢钾为白色结品或粉末,农业用磷酸二氢钾允许带微色。3.2磷酸二氢钾应符合表1的要求。表1
磷酸二氢钾(KH2PO以干基计)含量≥水分
水不溶物含量
氯化物(CI)含量
磷酸二氢钾的技术指标
一等品
合格品
中华人民共和国化学工业部1992-06-01批准0.5
%(m/m)
合格品
1992-09-01实施
铁(Fe)含量
砷(As)含量
重金属(以Pb计)含量
氧化钾(K20以干基计)含量
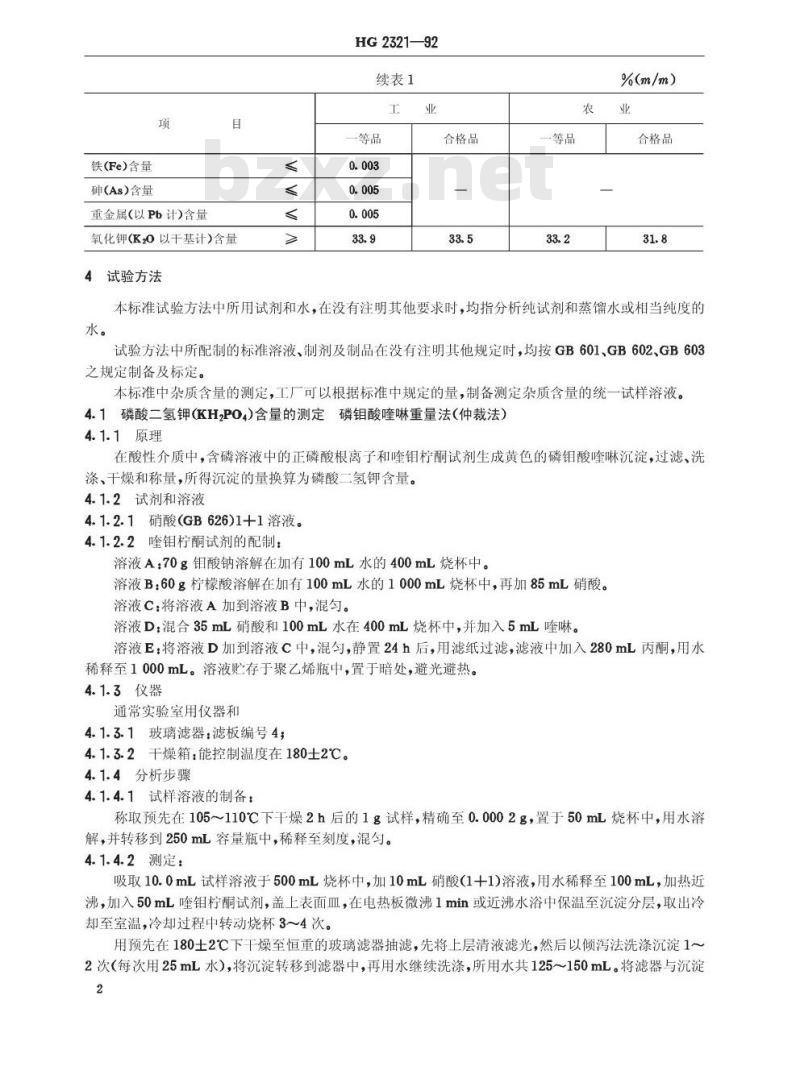
4试验方法
HG2321—92
续表1
一等品
合格品
%(m/m)
合格品
本标准试验方法中所用试剂和水,在没有注明其他要求时,均指分析纯试剂和蒸馏水或相当纯度的水。
试验方法中所配制的标准溶液、制剂及制品在没有注明其他规定时,均按GB601、GB602、GB603之规定制备及标定。
本标准中杂质含量的测定,工厂可以根据标准中规定的量,制备测定杂质含量的统一试样溶液。4.1磷酸二氢钾(KH2PO4)含量的测定磷钼酸喹啉重量法(仲裁法)4.1.1原理
在酸性介质中,含磷溶液中的正磷酸根离子和喹钼柠酮试剂生成黄色的磷钼酸喹啉沉淀,过滤、洗涤、干燥和称量,所得沉淀的量换算为磷酸二氢钾含量。4.1.2试剂和溶液
4.1.2.1硝酸(GB626)1+1溶液。
4.1.2.2喹钼柠酮试剂的配制:
溶液A:70g钼酸钠溶解在加有100mL水的400mL烧杯中。溶液B:60g柠檬酸溶解在加有100mL水的1000mL烧杯中,再加85mL硝酸。溶液C:将溶液A加到溶液B中,混匀。溶液D:混合35mL硝酸和100mL水在400mL烧杯中,并加入5mL喹啉。溶液E:将溶液D加到溶液C中,混勾,静置24h后,用滤纸过滤,滤液中加入280mL丙酮,用水稀释至1000mL。溶液贮存于聚乙烯瓶中,置于暗处,避光避热。4.1.3仪器
通常实验室用仪器和
4.1.3.1玻璃滤器:滤板编号4;4.1.3.2干燥箱:能控制温度在180士2℃。4.1.4分析步骤
4.1.4.1试样溶液的制备:
称取预先在105~110℃下干燥2h后的1g试样,精确至0.0002g,置于50mL烧杯中,用水溶解,并转移到250mL容量瓶中,稀释至刻度,混匀。4.1.4.2测定:
吸取10.0mL试样溶液于500mL烧杯中,加10mL硝酸(1+1)溶液,用水稀释至100mL,加热近沸,加入50mL喹钼柠酮试剂,盖上表面血,在电热板微沸1min或近沸水浴中保温至沉淀分层,取出冷却至室温,冷却过程中转动烧杯3~4次。用预先在180士2℃下干燥至恒重的玻璃滤器抽滤,先将上层清液滤光,然后以倾泻法洗涤沉淀1~2次(每次用25mL水),将沉淀转移到滤器中,再用水继续洗涤,所用水共125~150mL。将滤器与沉淀2
HG2321—92
置于180士2℃的干燥箱内,待温度达到后干燥45min,移入干燥器中冷却至室温,称量。4.1.4.3空白试验:
在测定的同时,按同样的操作步骤,同样试剂、用量、但不含试样进行空白试验。取平行测定结果的算术平均值为空白试验值。
4.1.5分析结果的表述
磷酸二氢钾(KH,PO,)含量X1,以磷酸二氢钾质量百分数表示,按式(1)计算:X; (mm) X0. 061 5 ×100
m×250
式中:m1——磷酸喹啉沉淀的质量,g;m2
-空白试验所测得的磷钼酸喹啉沉淀的质量,名;一试样的质量,g;
0.0615一一磷钼酸喹啉沉淀的质量换算为磷酸二氢钾质量的系数。4.1.6允许差
取平行测定结果的算术平均值为测定结果:平行测定结果的绝对差值不大于0.30%:不同实验室测定结果的绝对差值不大于0.60%。4.2磷酸二氢钾(KH,PO)含量的测定容量法4.2.1原理
磷酸二氢钾水溶液,在百里香酚蓝指示液存在下,用氢氧化钠标准滴定溶液滴定至溶液由黄绿色变为蓝色,计算磷酸二氢钾含量。4.2.2试剂和溶液
4.2.2.1氯化钠(GB1266);
4.2.2.2邻苯二甲酸氢钾(GB1257):基准试剂;4.2.2.3氢氧化钠(GB629)标准滴定溶液:c(NaOH)=1.000mol/L溶液,按GB601配制与标定;4.2.2.4百里香酚蓝(GB629)指示液:1.0g/L,溶解1.0g百里香酚蓝于22mL0.1mol/L氢氧化钠溶液中,用50%乙醇溶液稀释至1000mL。4.2.3仪器
通常实验室用仪器。
4.2.4分析步骤
4.2.4.1测定:
称取预先于105~110℃干燥2h后的3g试样,精确到0.001g,置于250mL锥形瓶中,加80mL水溶解,加5g氯化钠,8~10滴(约3mL)百里香酚蓝指示液(或用酸度计),用氢氧化钠标准滴定溶液滴定至蓝色或pH值9.1为终点。
4.2.4.2空白试验:
在测定的同时,按同样的操作步骤,同样试剂和用量,但不含试样进行空白试验。取平行测定结果的算术平均值为空白试验值。
4.2.5分析结果的表述
磷酸二氢钾(KH2PO4)含量X2,以磷酸二氢钾质量百分数表示,按式(2)计算:c(V_ V) X 0. 136 1 >
式中:c——氢氧化钠标准滴定溶液的浓度,mol/L;一测定时消耗氢氧化钠标准滴定溶液的体积,mL;V
V1一一空白试验时消耗氢氧化钠标准滴定溶液的体积,mL;m—试样的质量,g;
HG2321—92
0.1361一—与1.00mL氢氧化钠标准滴定溶液[c(Na0H)=1.000mol/L]相当的,以克表示的磷酸二氢钾的质量。
4.2.6允许差
取平行测定结果的算术平均值为测定结果平行测定结果的绝对差值不大于0.30%;不同实验室测定结果的绝对差值不大于0.40%。4.3水分的测定干燥失重法
4.3.1方法提要
在105~110℃下试样干燥2h,由失重量求得水分。4.3.2仪器
通常实验室用仪器和
4.3.2.1称量瓶:具有磨口盖,直径50mm,高30mm扁形瓶;4.3.2.2干燥箱:能控制温度在105~110℃。4.3.3分析步骤
称取10g试样,精确到0.001g,置于预先在105110℃下干燥至恒重的称量瓶中,摊平试样,放入105~110℃的干燥箱中,干燥2h,取出置于干燥器中冷却至室温,称量。4.3.4分析结果的表述
水分X:,以水的质量百分数表示,按式(3)计算:Xs=\=㎡ ×100
式中:mi—干燥后试样的质量,g;m—试样的质量,g。
4.3.5允许差
取平行测定结果的算术平均值为测定结果;平行测定结果的绝对差值不大于0.20%;不同实验室测定结果的绝对差值不大于0.30%。4.4pH值的测定电位测定法
4.4.1方法提要
使用带有玻璃电极与甘汞电极的酸度计,测定磷酸二氢钾浓度为3g/L溶液的pH值。4.4.2试剂和溶液
4.4.2.1所用试剂均指基准试剂或优级纯以上试剂。所用水指不含二氧化碳的蒸馏水,4.4.2.2磷酸二氢钾Cc(KH2PO)=0.025mol/L)和磷酸氢二钠Lc(Na2HPO4)=0.025mol/LJ缓冲溶液:称取3.40g磷酸二氢钾溶于大约400mL水中;另称取3.55g磷酸氢二钠溶于约400mL水中;将这两种溶液转移到1000mL容量瓶中,用水稀释至刻度,混匀。此溶液贮放在密闭容器内,在25℃下此缓冲溶液的pH值为6.86。磷酸二氢钾和磷酸氢二钠需在120士10℃下干燥2h。4.4.2.3苯二甲酸氢钾[c(CHg0,K)=0.05mol/)缓冲溶液:称取10.21g于110℃下干燥1h的苯二甲酸氢钾,溶于水并转移到1000mL容量瓶中,用水稀释至刻度,混勾。此溶液贮存在密闭容器内,此溶液的浓度c(CgH,cOzHCOzK)为0.05mol/L,在25℃下pH值为4.01。4.4.3仪器
通常实验室用仪器和带有玻璃电极、甘汞电极的酸度计,灵敏度为0.1pH单位。4.4.4分析步骤
4.4.4.1试样溶液的制备:
称取3g试样、精确到0.01g,置于合适的烧杯中,加水至100mL溶解后待用。4.4.4.2酸度计的校正:
用缓冲溶液(4.4.2.2与4.4.2.3),按酸度计使用说明书校正酸度计。4
4.4.4.3测定:
HG2321—92
在试样溶液中插入酸度计的两支电极,在与校正时相同的条件下进行测量。4.4.5分析结果的表述
磷酸二氢钾溶液的pH值,以pH表示。4.5水不溶物含量的测定重量法
4.5.1方法提要
用水溶解试样,经玻璃滤器抽滤、洗涤、干煤、称量,计算水不溶物含量。4.5.2仪器
通常实验室用仪器和
4.5.2.1玻璃滤器:滤板编号4;4.5.2.2干燥箱:能控制温度在105~110℃。4.5.3分析步骤
称取10g试样,精确到0.001g,置于400mL烧杯中,加100mL80℃的蒸馏水溶解,用预先在105~110℃下恒重的玻璃滤器趁热抽滤,以水洗涤烧杯及玻璃滤器68次,将滤器与水不溶物置于105~110℃干燥箱内干燥至恒重。
4.5.4分析结果的表述
水不溶物的含量X,以水不溶物的质量百分数表示,按式(4)计算:Xx=mi=m2× 100
式中:m1—水不溶物加玻璃滤器的质量,g,m2——玻璃滤器的质量,g;
m—试样的质量,g。
4.5.5允许差
取平行测定结果的算术平均值为测定结果:平行测定结果的绝对差值不大于0.05%;不同实验室测定结果的绝对差值不大于0.10%。4.6氯化物含量的测定电位滴定法(仲裁法)4.6.1原理
同GB3050第2章。
4.6.2试剂和溶液
同GB3050第4章。
4.6.3仪器
同GB3050。
4.6.4分析步骤
4.6.4.1硝酸银标准滴定溶液的标定:准确吸取5.0mL0.01mol/L氯化钾标准溶液于100mL烧杯中,加5mL硝酸溶液(1+1),用水稀释至50mL放入铁芯搅拌棒,将烧杯放在电磁搅拌器上,控制溶液温度在20℃下。将银电极及甘汞电极插入溶液中,接好电极和电位计之间线路,校正仪器零点。用微量滴定管加入4mL0.01mol硝酸银标准滴定溶液,并继续分次加入硝酸银标准滴定溶液,每次0.10mL,待电位值稳定后,记下硝酸银标准滴定溶液的体积及相应的电位值,同时计算电位值的连续增量(E1)及二次△E1的差值(△E2正值或负值)。滴定至终点所需硝酸银标准滴定溶液给出最大么E1值所消耗的硝酸银标准滴定溶液。再取10.0mL0.01mol/L氯化钾标准溶液进行滴定,除开始加入硝酸银标准滴定溶液数量由4mL改为9mL外,其他操作与滴定5.0mL氯化钾标准溶液相同。滴定至终点所消耗硝酸银标准滴定溶液的体积(V),按式(5)计算:5
HG2321—92
V=Vo+VB
式中,V。—得到最大△E,的前一点硝酸银标准滴定溶液的体积,mL;V1一一相当于最后(终点)加入部分的硝酸银标准滴定溶液的体积,0.10mL;5——AE,最后—次正值;
一△E最后一次正值和第一次负值的绝对值之和。试验记录格式举例见GB3050中的附录C。硝酸银标准滴定溶液的浓度(mol/L)按式(6)计算:5
式中:cr-
氯化钾标准溶液的浓度,mol/L;一相当于10mL氯化钾标准溶液的体积,mL;V
Vs—相当于5mL氯化钾标准溶液的体积,mL,5—两次氯化钾标准溶液体积之间的差值,mL。4.6.4.2测定:
(5)
(6)
称取约1g试样(氯含量不超过1.5mg),精确到0.0002g,于100mL烧杯中,加50mL水溶解,加5mL硝酸溶液1十1),放入铁芯搅拌棒,以下按4.6.4.1”中“将烧杯放在电磁搅拌器上..”至“所消耗的硝酸银标准滴定溶液”进行操作。4.6.4.3空白试验:
在测定的同时,按同样的操作步骤,同样的试剂、用量,但不含试样进行空白试验。取平行测定结果的算术平均值为空白试验值。
空白试验所消耗的硝酸银标准滴定溶液的体积V6(mL),按式(7)计算:Ve-2V:-V2
式中:V和V:—
与4.6.4.1中叙述相同。
4.6.5分析结果的表述
氯化物含量X6,以氯(CI)的质量百分数表示,按式(8)计算:X -V) :× 0. 035 45 × 100
c(V,-V)X3.545
式中:o-
一硝酸银标准滴定溶液的浓度,mol/L;一测定时所消耗的硝酸银标准滴定溶液的体积,mL;一空白试验时所消耗的硝酸银标准滴定溶液的体积,mL;试样的质量,8;
(8)
0.03545——与1.00mL硝酸银标准滴定溶液[c(AgNOs)=1.000mol/L]相当的,以克表示的氯的质量。
4.6.6允许差
取平行测定结果的算术平均值为测定结果;平行测定结果的绝对差值不大于0.01%。4.7氯化物含量的测定目视比浊法4.7.1原理
在酸性介质中,试样中的氯化物与硝酸银作用,生成难溶的氯化银。当氯离子含量较低时,在一定时间内氯化银呈悬浮体,使溶液混浊,再与氯化银标准浊度比较,确定试样中氯化物含量。编者注:原版为1.5×10°mg,本版改为1.5mg。6
4.7.2试剂和溶液
4.7.2.1硝酸(GB626)溶液:5mol/L;HG2321—92
4.7.2.2硝酸银(GB670)溶液:0.1mol/L;4.7.2.3氯化钾(GB646)(优级纯)标准溶液:0.01mg/mL氯的溶液:准确称取预先在130℃下干燥1h的0.4206g氯化钟,精确到0.0002g,溶于少量水中,转移到1000mL容量瓶中,并稀释至刻度,混匀。吸取25.0mL上述氯化钾溶液,注入500mL容量瓶中,用水稀释至刻度,混匀。4.7.3仪器
通常实验室用仪器和
4.7.3.125mL比色管;
4.7.3.22.0和10.0mL移液管。
4.7.4分析步骤
4.7.4.1标准浊度的制备:
取2.0mL氯的标准溶液注于25mL比色管中,加入2.0mL硝酸溶液(4.7.2.1),1mL硝酸银溶液(4.7.2.2),用水稀释至刻度,混匀。4.7.4.2测定:
称取0.1g试样,精确到0.0002g,置于烧杯中,加50mL水使之溶解,加20mL硝酸溶液(4.7.2.1)转移到100mL容量瓶中,用水稀释至刻度,混匀。溶液浑浊,进行干过滤。吸取10.0mL试样溶液,于25mL比色管中,加1mL硝酸银标准溶液(4.7.2.2),用水稀释至刻度,混匀。放置10min后,所呈浊度与标准比较。
4.8铁含量的测定邻菲啰啉分光光度法4.8.1原理
同GB3049中的第2章。
4.8.2试剂和溶液Www.bzxZ.net
同GB3049中的第3章。
4.8.3仪器
同GB3049中的第4章。
4.8.4分析步骤
4.8.4.1试样溶液的制备:
称取5g试样,精确到0.001g,于50mL烧杯中,用水溶解,并转移到50mL容量瓶中,稀释至刻度,混匀。溶液浑浊需干过滤。4.8.4.2试剂空白试验:
同GB3049中5.2条。
4.8.4.3标准曲线的绘制:
分别取0、10.0、20.0、30.0、40.0mL铁标准溶液(相当于铁含量100、200、300、400μg)于5只100mL容量瓶中。以下步骤按GB3049从5.3.2显色”一条开始,进行操作,直至“绘制标准曲线”为止。4.8.4.4测定:
取20.0mL试液(4.8.4.1),置于100mL烧杯中,以下操作,按GB3049中5.4.1,从“必要时,加水至……….”开始,进行操作。以水为参比,测量试液和试剂空白溶液的吸光度。4.8.5分析结果的表述
铁含量Xe,以铁(Fe)的质量百分数表示,按式(9)计算:Xg= mi X10-8
HG2321—92
式中:mi——从标准曲线上查得的试液中铁含量,mg;m——试样的质量,g。
4.8.6允许差
取平行测定结果的算术平均值为测定结果,平行测定结果的绝对差值不大于0.0003%,不同实验室测定结果的绝对差值不大于0.0005%。4.9铁含量的测定邻菲啰啉目视比色法4.9.1原理
用抗环血酸将试样溶液中的三价铁离子还原成二价铁离子,在H4.5条件下,二价铁离子与邻菲罗琳生成橙红色络合物,与铁标准色比较。4.9.2试剂和溶液
所用试剂和溶液配制同4.8.2。
4.9.3仪器
通常实验室用仪器和25mL比色管。4.9.4分析步骤
4.9.4.1标准色的制备
吸取3.0mL0.010mg/mL铁标准溶液于比色管中,加约5mL水,用盐酸溶液调节溶液pH接近2(用精密pH试纸),加2.5mL抗坏血酸,5mL缓冲溶液,5.0mL邻菲啰啉溶液,用水稀释至刻度,混匀。
4.9.4.2测定
称取1g试样,精确到0.0002g,加10mL水使之溶解,用盐酸溶液调节溶液pH接近2(用精密pH试纸),加2.5mL抗坏血酸,5mL缓冲溶液,5.0mL邻菲啰琳溶液,用水稀释至刻度,混匀。所呈颜色与标准色比较。
二乙基二硫代氨基甲酸银分光光度法(仲裁法)4.10砷含量的测定
4.10.1原理
同GB7686第2章。
4.10.2试剂和溶液
同GB7686第3章。
4.10.3仪器和装置
同GB7686第4章。
4.10.4分析步骤
4.10.4.1试样溶液的制备
称取0.5g试样于砷发生器中,用少量水溶解,加20mL盐酸溶液(1十1),加水至体积约40mL,加2mL碘化钾溶液和2mL氯化亚锡溶液,搅拌后放置15min。4.10.4.2试剂空白试验
同GB7686中5.2条。
4.10.4.3标准曲线的绘制
分别吸取0、1.0、2.0、4.0、6.0、8.0、10.0mL2.5μg/mL标准溶液,于六只砷发生器中。以下步骤,按GB7686中5.3.1条从“·依次加入下列溶液”开始,至“拆下吸收器,溶液完全混合”为止。以砷含量为横坐标,对应的吸光度为纵坐标,绘制标准曲线。4.10.4.4测定
取5.0mLDDTC-Ag吡啶溶液于15球管吸收器内,连接仪器的各部分,静置15min。加入5g无砷金属锌于试样溶液的发生器中,立即盖好盖和吸收器,反应约45min。移去吸收器,混匀吸收溶液。用分光光度计,在波长540nm处,以空白溶液作参比,测定其吸光度。8
4.10.5分析结果的表述
HG2321—92
砷含量X7,以砷(As)的质量百分数表示,按式(10)计算:m×100
式中:m1一一从标准曲线上查得的试样溶液中碑的含量,mg;m
一试样的质量,。
所得结果应表示至四位小数。
4.10.6允许差
(10)
取平行测定结果的算术平均值为测定结果,平行测定结果的绝对差值不大于0.0003%;不同实验室测定结果的绝对差值不大于0.0005%。4.11砷含量的测定砷斑法
4.11.1原理
同GB610.1—88中的第3章。
4.11.2试剂和溶液
同GB610.1—88中的4试剂”。
4.11.3仪器和装置
同GB610.1—88中的“5仪器和装置”。4.11.4分析步骤
称取0.5g试样于定砷器的广口瓶中,加水溶解并稀释至约70mL,以下操作按照GB610.1中的第6章,从“加入6mL盐酸”进行操作。4.12重金属含量的测定目视比浊法4.12.1原理
在弱酸性介质中,硫化氢与试样溶液中的硫化氢组重金属生成硫化物沉淀,重金属含量低时,形成稳定的暗色悬浮液,用目视比浊法测定。4.12.2试剂和溶液
4.12.2.1冰乙酸(GB676)
4.12.2.2硝酸铅(HG3—1070);4.12.2.3乙酸溶液:c(CHgCOOH)=1mol/L,取57.5mL冰乙酸溶于水,稀释至1000mL;4.12.2.4硝酸(GB626);
4.12.2.5饱和硫化氢水溶液:将硫化氢气体通入不含二氧化碳的水中至饱和为止(此溶液在使用前配制);
铅标准溶液:0.01mg/mL。称取0.160g硝酸铅,溶于少量水中,加1mL硝酸,移入4.12.2.6
1000mL容量瓶中,稀释至刻度,混匀。吸取10.0mL上述溶液,置于100mL容量瓶中,用水稀释至刻度,混匀。即为0.01mg/mL铅标准溶液。4.12.3仪器
通常实验室用仪器和50mL比色管。4.12.4分析步骤
4.12.4.1试样溶液的制备
称取10g试样,精确到0.001g,用水溶解,转移到500mL容量瓶中,稀释至刻度,混勾,干过滤。4.12.4.2标准浊度的制备
取2.5mL铅标准溶液于50mL比色管中,用水稀释至30mL,加试样溶液5.0mL,加1mL乙酸溶液及10mL新制备的饱和硫化氢水溶液,用水稀释至刻度,混匀,放置10min,所呈标准浊度。4.12.4.3测定
HG2321—92
吸取25.0mL试样溶液,于50mL比色管中,另加5.0mL试样溶液,以下按4.12.4.2中*加1mL乙酸溶液至放置10min”进行操作,所呈浊度与标准比较。4.13氧化钾含量的测定四苯基合硼酸钾重量法4.13.1原理
在弱碱性介质中,以四苯基合硼酸钠溶液沉淀试样溶液中的钾离子。为了防止铵离子和其他阳离子干扰,可预先加入适量的甲醛溶液及乙二胺四乙酸二钠盐(EDTA)使铵离子与甲醛反应生成六亚甲基四胺,其他阳离子与乙二胺四乙酸二钠络合。将沉淀过滤、干燥及称重。
4.13.2试剂和溶液
4.13.2.1四苯基合硼酸钠(HG3—1164):15g/L,取15g四苯基合硼酸钠溶解于约960mL水中,加4mL氢氧化钠溶液(4.13.2.5)和100g/L六水氯化镁(GB672)溶液20mL,搅拌15min,静置后用滤纸过滤;该溶液贮存在棕色瓶或塑料瓶中,一般不超过一个月。如发现浑浊,使用前应过滤。4.13.2.2四苯基合硼酸钠洗涤液:用十体积的水稀释一体积的四苯基合硼酸钠(4.3.2.1);4.13.2.3乙二胺四乙酸二钠盐(GB1401)溶液:40g/L;4.13.2.4甲醛(GB685)溶液:约30%或37%(m/m)4.13.2.5氢氧化钠(GB629)溶液:400g/L;4.13.2.6酚酰(GB10729):5g/L乙醇溶液,0.5g酚酞溶解于95%(V/V)100mL乙醇中。4.13.3仪器
通常实验室用仪器和
4.13.3.1玻璃滤器:滤板编号4;4.13.3.2干燥箱:能控制温度在120士5℃;4.13.4分析步骤
4.13.4.1试样溶液的制备
称取预先在105110℃下干燥2h后的约1.2g试样,精确到0.0002g,置于250mL锥形瓶中,加约150mL水,加热煮沸30min,冷却,定量转移到250mL容量瓶中,用水稀释至刻度,混匀。4.13.4.2测定
吸取上述试液(4.3.4.1)25.0mL,置入200mL烧杯中,加EDTA溶液20mL(含阳离子较多时可加40mL),加23滴酚酥溶液,滴加氢氧化钠溶液,至溶液红色出现时,再过量1mL,加甲醛溶液(按1mg氮加约60mg甲醛计算,即37%甲醛溶液加0.15mL),若红色消失,用氢氧化钠溶液调至红色,在通风柜内加热煮沸15min,然后冷却或用流水冷却,若红色消失,再用氢氧化钠溶液调至红色。在不断搅拌下,将四苯基合硼酸钠溶液(4.3.2.1)逐滴加入试样液中,加入量为每含1mg氧化钾加四苯基合硼酸钠溶液0.5mL,并过量约7mL,继续搅拌1min,静置15min,用倾滤法将沉淀过滤于120℃下预先恒重的4号玻璃滤器内,用洗涤溶液洗涤沉淀和烧杯5~7次,每次用量约5mL,先后总量不超过40mL。最后用水洗涤沉淀2次,每次用量为5mL。将盛有沉淀的玻璃滤器置入120士5℃干燥箱中,干燥1.5h,然后取出,放入干燥器内冷却至室温,称量。
4.13.4.3空白试验
在测定的同时,按同样的操作步骤,同样试剂、用量、但不含试样进行空白试验。取平行测定结果的算术平均值为空白试验值。
4.13.5分析结果的表述
氧化钾(以K20计)的含量Xs,以氧化钾质量百分数表示,按式(11)计算:[(m2- m1) - (mm)× 0. 131 4 × 100X.=
m×250
式中,m-
-试样质量,8;
滤器质量,8;
HG2321—92
[(mz—mi)—(m4-ms)J×131.4
盛有沉淀的滤器的质量,g;
空白试验用滤器的质量,名;
空白试验时过滤后滤器的质量,;一四苯基合硼酸钾质量换算为氧化钾质量的系数。4.13.6允许差
4.13.6.1取平行测定结果的算术平均值为测定结果;平行测定结果的绝对差值不大于0.40%;4.13.6.2
4.13.6.3不同实验室测定结果的绝对差值不大于0.80%。注:玻璃滤器洗涤时,若沉淀不易洗去,可用丙酮进一步清洗。5检验规则
P.oi.P.o.
5.1磷酸二氢钾应由生产厂的质量检验部门检验,生产厂应保证所有出厂的磷酸二氢钾均符合本标准的要求。本标准中质量合格与否,判断采用GB1250国家标准中修约值比较法。每批出厂的磷酸二氢钾都应附有质量证明书。
5.2使用单位有权按照本标准规定的检验规则和检验方法对所收到的磷酸二氢钾质量进行检查,检验其指标是否符合本标准的要求。5.3磷酸二氢钾按批检验,生产厂以每天生产的产量为一批,用户以接收产品量为一批。5.4袋装磷酸二氢钾应按表2随机采样:表2磷酸二氢钾袋装采样量
总袋数
82~101
102~125
126~151
152~181
采样袋数
全部袋数
超过512袋,按式(12)计算采样袋数:采样袋数=3×√
式中:n-
一每批磷酸数二氢钾总袋数。
总袋数
182~216
217~254
255~296
297~343
344~394
395~450
451~512
采样袋数
按表2(或式(12)计算)抽出的样品袋数,置于平放位置。从每袋最长对角线插入取样针至袋深3/4处,采取代表性的不少于0.1kg样品,每批采样总量不少于1.0kg。5.5农用小包装应按表3随机采样:11
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
HG2321—92
磷酸二氢钾
1992-06-01发布
中华人民共和国化学工业部
1992-09-01实施
中华人民共和国化工行业标准
1主题内容与适用范围
HG2321—92
本标准规定了工、农业用磷酸二氢钾的技术要求、试验方法、检验规则以及包装、标志、贮存和运输。本标准适用于工、农业用的磷酸二氢钾。该产品:工业上用于医药、缓冲剂、培养剂等;农业上作为肥料。
分子式:KH2PO
相对分子质量:136.09(按1989年国际相对原子质量)引用标准
化学试剂滴定分析(容量分析)用标准溶液的制备化学试剂杂质测定用标准溶液的制备化学试剂试验方法中所用制剂及制品的制备GB610.1
GB1250
GB3049
GB3050
GB7686
GB8569
3技术要求
化学试剂砷测定通用方法(砷斑法)极限数值的表示方法和判定方法化工产品中铁含量测定的通用方法邻菲啰啉分光光度法无机化工产品中氯化物含量测定的通用方法电位滴定法化工产品中砷含量测定的通用方法固体化学肥料包装
3.1外观:磷酸二氢钾为白色结品或粉末,农业用磷酸二氢钾允许带微色。3.2磷酸二氢钾应符合表1的要求。表1
磷酸二氢钾(KH2PO以干基计)含量≥水分
水不溶物含量
氯化物(CI)含量
磷酸二氢钾的技术指标
一等品
合格品
中华人民共和国化学工业部1992-06-01批准0.5
%(m/m)
合格品
1992-09-01实施
铁(Fe)含量
砷(As)含量
重金属(以Pb计)含量
氧化钾(K20以干基计)含量
4试验方法
HG2321—92
续表1
一等品
合格品
%(m/m)
合格品
本标准试验方法中所用试剂和水,在没有注明其他要求时,均指分析纯试剂和蒸馏水或相当纯度的水。
试验方法中所配制的标准溶液、制剂及制品在没有注明其他规定时,均按GB601、GB602、GB603之规定制备及标定。
本标准中杂质含量的测定,工厂可以根据标准中规定的量,制备测定杂质含量的统一试样溶液。4.1磷酸二氢钾(KH2PO4)含量的测定磷钼酸喹啉重量法(仲裁法)4.1.1原理
在酸性介质中,含磷溶液中的正磷酸根离子和喹钼柠酮试剂生成黄色的磷钼酸喹啉沉淀,过滤、洗涤、干燥和称量,所得沉淀的量换算为磷酸二氢钾含量。4.1.2试剂和溶液
4.1.2.1硝酸(GB626)1+1溶液。
4.1.2.2喹钼柠酮试剂的配制:
溶液A:70g钼酸钠溶解在加有100mL水的400mL烧杯中。溶液B:60g柠檬酸溶解在加有100mL水的1000mL烧杯中,再加85mL硝酸。溶液C:将溶液A加到溶液B中,混匀。溶液D:混合35mL硝酸和100mL水在400mL烧杯中,并加入5mL喹啉。溶液E:将溶液D加到溶液C中,混勾,静置24h后,用滤纸过滤,滤液中加入280mL丙酮,用水稀释至1000mL。溶液贮存于聚乙烯瓶中,置于暗处,避光避热。4.1.3仪器
通常实验室用仪器和
4.1.3.1玻璃滤器:滤板编号4;4.1.3.2干燥箱:能控制温度在180士2℃。4.1.4分析步骤
4.1.4.1试样溶液的制备:
称取预先在105~110℃下干燥2h后的1g试样,精确至0.0002g,置于50mL烧杯中,用水溶解,并转移到250mL容量瓶中,稀释至刻度,混匀。4.1.4.2测定:
吸取10.0mL试样溶液于500mL烧杯中,加10mL硝酸(1+1)溶液,用水稀释至100mL,加热近沸,加入50mL喹钼柠酮试剂,盖上表面血,在电热板微沸1min或近沸水浴中保温至沉淀分层,取出冷却至室温,冷却过程中转动烧杯3~4次。用预先在180士2℃下干燥至恒重的玻璃滤器抽滤,先将上层清液滤光,然后以倾泻法洗涤沉淀1~2次(每次用25mL水),将沉淀转移到滤器中,再用水继续洗涤,所用水共125~150mL。将滤器与沉淀2
HG2321—92
置于180士2℃的干燥箱内,待温度达到后干燥45min,移入干燥器中冷却至室温,称量。4.1.4.3空白试验:
在测定的同时,按同样的操作步骤,同样试剂、用量、但不含试样进行空白试验。取平行测定结果的算术平均值为空白试验值。
4.1.5分析结果的表述
磷酸二氢钾(KH,PO,)含量X1,以磷酸二氢钾质量百分数表示,按式(1)计算:X; (mm) X0. 061 5 ×100
m×250
式中:m1——磷酸喹啉沉淀的质量,g;m2
-空白试验所测得的磷钼酸喹啉沉淀的质量,名;一试样的质量,g;
0.0615一一磷钼酸喹啉沉淀的质量换算为磷酸二氢钾质量的系数。4.1.6允许差
取平行测定结果的算术平均值为测定结果:平行测定结果的绝对差值不大于0.30%:不同实验室测定结果的绝对差值不大于0.60%。4.2磷酸二氢钾(KH,PO)含量的测定容量法4.2.1原理
磷酸二氢钾水溶液,在百里香酚蓝指示液存在下,用氢氧化钠标准滴定溶液滴定至溶液由黄绿色变为蓝色,计算磷酸二氢钾含量。4.2.2试剂和溶液
4.2.2.1氯化钠(GB1266);
4.2.2.2邻苯二甲酸氢钾(GB1257):基准试剂;4.2.2.3氢氧化钠(GB629)标准滴定溶液:c(NaOH)=1.000mol/L溶液,按GB601配制与标定;4.2.2.4百里香酚蓝(GB629)指示液:1.0g/L,溶解1.0g百里香酚蓝于22mL0.1mol/L氢氧化钠溶液中,用50%乙醇溶液稀释至1000mL。4.2.3仪器
通常实验室用仪器。
4.2.4分析步骤
4.2.4.1测定:
称取预先于105~110℃干燥2h后的3g试样,精确到0.001g,置于250mL锥形瓶中,加80mL水溶解,加5g氯化钠,8~10滴(约3mL)百里香酚蓝指示液(或用酸度计),用氢氧化钠标准滴定溶液滴定至蓝色或pH值9.1为终点。
4.2.4.2空白试验:
在测定的同时,按同样的操作步骤,同样试剂和用量,但不含试样进行空白试验。取平行测定结果的算术平均值为空白试验值。
4.2.5分析结果的表述
磷酸二氢钾(KH2PO4)含量X2,以磷酸二氢钾质量百分数表示,按式(2)计算:c(V_ V) X 0. 136 1 >
式中:c——氢氧化钠标准滴定溶液的浓度,mol/L;一测定时消耗氢氧化钠标准滴定溶液的体积,mL;V
V1一一空白试验时消耗氢氧化钠标准滴定溶液的体积,mL;m—试样的质量,g;
HG2321—92
0.1361一—与1.00mL氢氧化钠标准滴定溶液[c(Na0H)=1.000mol/L]相当的,以克表示的磷酸二氢钾的质量。
4.2.6允许差
取平行测定结果的算术平均值为测定结果平行测定结果的绝对差值不大于0.30%;不同实验室测定结果的绝对差值不大于0.40%。4.3水分的测定干燥失重法
4.3.1方法提要
在105~110℃下试样干燥2h,由失重量求得水分。4.3.2仪器
通常实验室用仪器和
4.3.2.1称量瓶:具有磨口盖,直径50mm,高30mm扁形瓶;4.3.2.2干燥箱:能控制温度在105~110℃。4.3.3分析步骤
称取10g试样,精确到0.001g,置于预先在105110℃下干燥至恒重的称量瓶中,摊平试样,放入105~110℃的干燥箱中,干燥2h,取出置于干燥器中冷却至室温,称量。4.3.4分析结果的表述
水分X:,以水的质量百分数表示,按式(3)计算:Xs=\=㎡ ×100
式中:mi—干燥后试样的质量,g;m—试样的质量,g。
4.3.5允许差
取平行测定结果的算术平均值为测定结果;平行测定结果的绝对差值不大于0.20%;不同实验室测定结果的绝对差值不大于0.30%。4.4pH值的测定电位测定法
4.4.1方法提要
使用带有玻璃电极与甘汞电极的酸度计,测定磷酸二氢钾浓度为3g/L溶液的pH值。4.4.2试剂和溶液
4.4.2.1所用试剂均指基准试剂或优级纯以上试剂。所用水指不含二氧化碳的蒸馏水,4.4.2.2磷酸二氢钾Cc(KH2PO)=0.025mol/L)和磷酸氢二钠Lc(Na2HPO4)=0.025mol/LJ缓冲溶液:称取3.40g磷酸二氢钾溶于大约400mL水中;另称取3.55g磷酸氢二钠溶于约400mL水中;将这两种溶液转移到1000mL容量瓶中,用水稀释至刻度,混匀。此溶液贮放在密闭容器内,在25℃下此缓冲溶液的pH值为6.86。磷酸二氢钾和磷酸氢二钠需在120士10℃下干燥2h。4.4.2.3苯二甲酸氢钾[c(CHg0,K)=0.05mol/)缓冲溶液:称取10.21g于110℃下干燥1h的苯二甲酸氢钾,溶于水并转移到1000mL容量瓶中,用水稀释至刻度,混勾。此溶液贮存在密闭容器内,此溶液的浓度c(CgH,cOzHCOzK)为0.05mol/L,在25℃下pH值为4.01。4.4.3仪器
通常实验室用仪器和带有玻璃电极、甘汞电极的酸度计,灵敏度为0.1pH单位。4.4.4分析步骤
4.4.4.1试样溶液的制备:
称取3g试样、精确到0.01g,置于合适的烧杯中,加水至100mL溶解后待用。4.4.4.2酸度计的校正:
用缓冲溶液(4.4.2.2与4.4.2.3),按酸度计使用说明书校正酸度计。4
4.4.4.3测定:
HG2321—92
在试样溶液中插入酸度计的两支电极,在与校正时相同的条件下进行测量。4.4.5分析结果的表述
磷酸二氢钾溶液的pH值,以pH表示。4.5水不溶物含量的测定重量法
4.5.1方法提要
用水溶解试样,经玻璃滤器抽滤、洗涤、干煤、称量,计算水不溶物含量。4.5.2仪器
通常实验室用仪器和
4.5.2.1玻璃滤器:滤板编号4;4.5.2.2干燥箱:能控制温度在105~110℃。4.5.3分析步骤
称取10g试样,精确到0.001g,置于400mL烧杯中,加100mL80℃的蒸馏水溶解,用预先在105~110℃下恒重的玻璃滤器趁热抽滤,以水洗涤烧杯及玻璃滤器68次,将滤器与水不溶物置于105~110℃干燥箱内干燥至恒重。
4.5.4分析结果的表述
水不溶物的含量X,以水不溶物的质量百分数表示,按式(4)计算:Xx=mi=m2× 100
式中:m1—水不溶物加玻璃滤器的质量,g,m2——玻璃滤器的质量,g;
m—试样的质量,g。
4.5.5允许差
取平行测定结果的算术平均值为测定结果:平行测定结果的绝对差值不大于0.05%;不同实验室测定结果的绝对差值不大于0.10%。4.6氯化物含量的测定电位滴定法(仲裁法)4.6.1原理
同GB3050第2章。
4.6.2试剂和溶液
同GB3050第4章。
4.6.3仪器
同GB3050。
4.6.4分析步骤
4.6.4.1硝酸银标准滴定溶液的标定:准确吸取5.0mL0.01mol/L氯化钾标准溶液于100mL烧杯中,加5mL硝酸溶液(1+1),用水稀释至50mL放入铁芯搅拌棒,将烧杯放在电磁搅拌器上,控制溶液温度在20℃下。将银电极及甘汞电极插入溶液中,接好电极和电位计之间线路,校正仪器零点。用微量滴定管加入4mL0.01mol硝酸银标准滴定溶液,并继续分次加入硝酸银标准滴定溶液,每次0.10mL,待电位值稳定后,记下硝酸银标准滴定溶液的体积及相应的电位值,同时计算电位值的连续增量(E1)及二次△E1的差值(△E2正值或负值)。滴定至终点所需硝酸银标准滴定溶液给出最大么E1值所消耗的硝酸银标准滴定溶液。再取10.0mL0.01mol/L氯化钾标准溶液进行滴定,除开始加入硝酸银标准滴定溶液数量由4mL改为9mL外,其他操作与滴定5.0mL氯化钾标准溶液相同。滴定至终点所消耗硝酸银标准滴定溶液的体积(V),按式(5)计算:5
HG2321—92
V=Vo+VB
式中,V。—得到最大△E,的前一点硝酸银标准滴定溶液的体积,mL;V1一一相当于最后(终点)加入部分的硝酸银标准滴定溶液的体积,0.10mL;5——AE,最后—次正值;
一△E最后一次正值和第一次负值的绝对值之和。试验记录格式举例见GB3050中的附录C。硝酸银标准滴定溶液的浓度(mol/L)按式(6)计算:5
式中:cr-
氯化钾标准溶液的浓度,mol/L;一相当于10mL氯化钾标准溶液的体积,mL;V
Vs—相当于5mL氯化钾标准溶液的体积,mL,5—两次氯化钾标准溶液体积之间的差值,mL。4.6.4.2测定:
(5)
(6)
称取约1g试样(氯含量不超过1.5mg),精确到0.0002g,于100mL烧杯中,加50mL水溶解,加5mL硝酸溶液1十1),放入铁芯搅拌棒,以下按4.6.4.1”中“将烧杯放在电磁搅拌器上..”至“所消耗的硝酸银标准滴定溶液”进行操作。4.6.4.3空白试验:
在测定的同时,按同样的操作步骤,同样的试剂、用量,但不含试样进行空白试验。取平行测定结果的算术平均值为空白试验值。
空白试验所消耗的硝酸银标准滴定溶液的体积V6(mL),按式(7)计算:Ve-2V:-V2
式中:V和V:—
与4.6.4.1中叙述相同。
4.6.5分析结果的表述
氯化物含量X6,以氯(CI)的质量百分数表示,按式(8)计算:X -V) :× 0. 035 45 × 100
c(V,-V)X3.545
式中:o-
一硝酸银标准滴定溶液的浓度,mol/L;一测定时所消耗的硝酸银标准滴定溶液的体积,mL;一空白试验时所消耗的硝酸银标准滴定溶液的体积,mL;试样的质量,8;
(8)
0.03545——与1.00mL硝酸银标准滴定溶液[c(AgNOs)=1.000mol/L]相当的,以克表示的氯的质量。
4.6.6允许差
取平行测定结果的算术平均值为测定结果;平行测定结果的绝对差值不大于0.01%。4.7氯化物含量的测定目视比浊法4.7.1原理
在酸性介质中,试样中的氯化物与硝酸银作用,生成难溶的氯化银。当氯离子含量较低时,在一定时间内氯化银呈悬浮体,使溶液混浊,再与氯化银标准浊度比较,确定试样中氯化物含量。编者注:原版为1.5×10°mg,本版改为1.5mg。6
4.7.2试剂和溶液
4.7.2.1硝酸(GB626)溶液:5mol/L;HG2321—92
4.7.2.2硝酸银(GB670)溶液:0.1mol/L;4.7.2.3氯化钾(GB646)(优级纯)标准溶液:0.01mg/mL氯的溶液:准确称取预先在130℃下干燥1h的0.4206g氯化钟,精确到0.0002g,溶于少量水中,转移到1000mL容量瓶中,并稀释至刻度,混匀。吸取25.0mL上述氯化钾溶液,注入500mL容量瓶中,用水稀释至刻度,混匀。4.7.3仪器
通常实验室用仪器和
4.7.3.125mL比色管;
4.7.3.22.0和10.0mL移液管。
4.7.4分析步骤
4.7.4.1标准浊度的制备:
取2.0mL氯的标准溶液注于25mL比色管中,加入2.0mL硝酸溶液(4.7.2.1),1mL硝酸银溶液(4.7.2.2),用水稀释至刻度,混匀。4.7.4.2测定:
称取0.1g试样,精确到0.0002g,置于烧杯中,加50mL水使之溶解,加20mL硝酸溶液(4.7.2.1)转移到100mL容量瓶中,用水稀释至刻度,混匀。溶液浑浊,进行干过滤。吸取10.0mL试样溶液,于25mL比色管中,加1mL硝酸银标准溶液(4.7.2.2),用水稀释至刻度,混匀。放置10min后,所呈浊度与标准比较。
4.8铁含量的测定邻菲啰啉分光光度法4.8.1原理
同GB3049中的第2章。
4.8.2试剂和溶液Www.bzxZ.net
同GB3049中的第3章。
4.8.3仪器
同GB3049中的第4章。
4.8.4分析步骤
4.8.4.1试样溶液的制备:
称取5g试样,精确到0.001g,于50mL烧杯中,用水溶解,并转移到50mL容量瓶中,稀释至刻度,混匀。溶液浑浊需干过滤。4.8.4.2试剂空白试验:
同GB3049中5.2条。
4.8.4.3标准曲线的绘制:
分别取0、10.0、20.0、30.0、40.0mL铁标准溶液(相当于铁含量100、200、300、400μg)于5只100mL容量瓶中。以下步骤按GB3049从5.3.2显色”一条开始,进行操作,直至“绘制标准曲线”为止。4.8.4.4测定:
取20.0mL试液(4.8.4.1),置于100mL烧杯中,以下操作,按GB3049中5.4.1,从“必要时,加水至……….”开始,进行操作。以水为参比,测量试液和试剂空白溶液的吸光度。4.8.5分析结果的表述
铁含量Xe,以铁(Fe)的质量百分数表示,按式(9)计算:Xg= mi X10-8
HG2321—92
式中:mi——从标准曲线上查得的试液中铁含量,mg;m——试样的质量,g。
4.8.6允许差
取平行测定结果的算术平均值为测定结果,平行测定结果的绝对差值不大于0.0003%,不同实验室测定结果的绝对差值不大于0.0005%。4.9铁含量的测定邻菲啰啉目视比色法4.9.1原理
用抗环血酸将试样溶液中的三价铁离子还原成二价铁离子,在H4.5条件下,二价铁离子与邻菲罗琳生成橙红色络合物,与铁标准色比较。4.9.2试剂和溶液
所用试剂和溶液配制同4.8.2。
4.9.3仪器
通常实验室用仪器和25mL比色管。4.9.4分析步骤
4.9.4.1标准色的制备
吸取3.0mL0.010mg/mL铁标准溶液于比色管中,加约5mL水,用盐酸溶液调节溶液pH接近2(用精密pH试纸),加2.5mL抗坏血酸,5mL缓冲溶液,5.0mL邻菲啰啉溶液,用水稀释至刻度,混匀。
4.9.4.2测定
称取1g试样,精确到0.0002g,加10mL水使之溶解,用盐酸溶液调节溶液pH接近2(用精密pH试纸),加2.5mL抗坏血酸,5mL缓冲溶液,5.0mL邻菲啰琳溶液,用水稀释至刻度,混匀。所呈颜色与标准色比较。
二乙基二硫代氨基甲酸银分光光度法(仲裁法)4.10砷含量的测定
4.10.1原理
同GB7686第2章。
4.10.2试剂和溶液
同GB7686第3章。
4.10.3仪器和装置
同GB7686第4章。
4.10.4分析步骤
4.10.4.1试样溶液的制备
称取0.5g试样于砷发生器中,用少量水溶解,加20mL盐酸溶液(1十1),加水至体积约40mL,加2mL碘化钾溶液和2mL氯化亚锡溶液,搅拌后放置15min。4.10.4.2试剂空白试验
同GB7686中5.2条。
4.10.4.3标准曲线的绘制
分别吸取0、1.0、2.0、4.0、6.0、8.0、10.0mL2.5μg/mL标准溶液,于六只砷发生器中。以下步骤,按GB7686中5.3.1条从“·依次加入下列溶液”开始,至“拆下吸收器,溶液完全混合”为止。以砷含量为横坐标,对应的吸光度为纵坐标,绘制标准曲线。4.10.4.4测定
取5.0mLDDTC-Ag吡啶溶液于15球管吸收器内,连接仪器的各部分,静置15min。加入5g无砷金属锌于试样溶液的发生器中,立即盖好盖和吸收器,反应约45min。移去吸收器,混匀吸收溶液。用分光光度计,在波长540nm处,以空白溶液作参比,测定其吸光度。8
4.10.5分析结果的表述
HG2321—92
砷含量X7,以砷(As)的质量百分数表示,按式(10)计算:m×100
式中:m1一一从标准曲线上查得的试样溶液中碑的含量,mg;m
一试样的质量,。
所得结果应表示至四位小数。
4.10.6允许差
(10)
取平行测定结果的算术平均值为测定结果,平行测定结果的绝对差值不大于0.0003%;不同实验室测定结果的绝对差值不大于0.0005%。4.11砷含量的测定砷斑法
4.11.1原理
同GB610.1—88中的第3章。
4.11.2试剂和溶液
同GB610.1—88中的4试剂”。
4.11.3仪器和装置
同GB610.1—88中的“5仪器和装置”。4.11.4分析步骤
称取0.5g试样于定砷器的广口瓶中,加水溶解并稀释至约70mL,以下操作按照GB610.1中的第6章,从“加入6mL盐酸”进行操作。4.12重金属含量的测定目视比浊法4.12.1原理
在弱酸性介质中,硫化氢与试样溶液中的硫化氢组重金属生成硫化物沉淀,重金属含量低时,形成稳定的暗色悬浮液,用目视比浊法测定。4.12.2试剂和溶液
4.12.2.1冰乙酸(GB676)
4.12.2.2硝酸铅(HG3—1070);4.12.2.3乙酸溶液:c(CHgCOOH)=1mol/L,取57.5mL冰乙酸溶于水,稀释至1000mL;4.12.2.4硝酸(GB626);
4.12.2.5饱和硫化氢水溶液:将硫化氢气体通入不含二氧化碳的水中至饱和为止(此溶液在使用前配制);
铅标准溶液:0.01mg/mL。称取0.160g硝酸铅,溶于少量水中,加1mL硝酸,移入4.12.2.6
1000mL容量瓶中,稀释至刻度,混匀。吸取10.0mL上述溶液,置于100mL容量瓶中,用水稀释至刻度,混匀。即为0.01mg/mL铅标准溶液。4.12.3仪器
通常实验室用仪器和50mL比色管。4.12.4分析步骤
4.12.4.1试样溶液的制备
称取10g试样,精确到0.001g,用水溶解,转移到500mL容量瓶中,稀释至刻度,混勾,干过滤。4.12.4.2标准浊度的制备
取2.5mL铅标准溶液于50mL比色管中,用水稀释至30mL,加试样溶液5.0mL,加1mL乙酸溶液及10mL新制备的饱和硫化氢水溶液,用水稀释至刻度,混匀,放置10min,所呈标准浊度。4.12.4.3测定
HG2321—92
吸取25.0mL试样溶液,于50mL比色管中,另加5.0mL试样溶液,以下按4.12.4.2中*加1mL乙酸溶液至放置10min”进行操作,所呈浊度与标准比较。4.13氧化钾含量的测定四苯基合硼酸钾重量法4.13.1原理
在弱碱性介质中,以四苯基合硼酸钠溶液沉淀试样溶液中的钾离子。为了防止铵离子和其他阳离子干扰,可预先加入适量的甲醛溶液及乙二胺四乙酸二钠盐(EDTA)使铵离子与甲醛反应生成六亚甲基四胺,其他阳离子与乙二胺四乙酸二钠络合。将沉淀过滤、干燥及称重。
4.13.2试剂和溶液
4.13.2.1四苯基合硼酸钠(HG3—1164):15g/L,取15g四苯基合硼酸钠溶解于约960mL水中,加4mL氢氧化钠溶液(4.13.2.5)和100g/L六水氯化镁(GB672)溶液20mL,搅拌15min,静置后用滤纸过滤;该溶液贮存在棕色瓶或塑料瓶中,一般不超过一个月。如发现浑浊,使用前应过滤。4.13.2.2四苯基合硼酸钠洗涤液:用十体积的水稀释一体积的四苯基合硼酸钠(4.3.2.1);4.13.2.3乙二胺四乙酸二钠盐(GB1401)溶液:40g/L;4.13.2.4甲醛(GB685)溶液:约30%或37%(m/m)4.13.2.5氢氧化钠(GB629)溶液:400g/L;4.13.2.6酚酰(GB10729):5g/L乙醇溶液,0.5g酚酞溶解于95%(V/V)100mL乙醇中。4.13.3仪器
通常实验室用仪器和
4.13.3.1玻璃滤器:滤板编号4;4.13.3.2干燥箱:能控制温度在120士5℃;4.13.4分析步骤
4.13.4.1试样溶液的制备
称取预先在105110℃下干燥2h后的约1.2g试样,精确到0.0002g,置于250mL锥形瓶中,加约150mL水,加热煮沸30min,冷却,定量转移到250mL容量瓶中,用水稀释至刻度,混匀。4.13.4.2测定
吸取上述试液(4.3.4.1)25.0mL,置入200mL烧杯中,加EDTA溶液20mL(含阳离子较多时可加40mL),加23滴酚酥溶液,滴加氢氧化钠溶液,至溶液红色出现时,再过量1mL,加甲醛溶液(按1mg氮加约60mg甲醛计算,即37%甲醛溶液加0.15mL),若红色消失,用氢氧化钠溶液调至红色,在通风柜内加热煮沸15min,然后冷却或用流水冷却,若红色消失,再用氢氧化钠溶液调至红色。在不断搅拌下,将四苯基合硼酸钠溶液(4.3.2.1)逐滴加入试样液中,加入量为每含1mg氧化钾加四苯基合硼酸钠溶液0.5mL,并过量约7mL,继续搅拌1min,静置15min,用倾滤法将沉淀过滤于120℃下预先恒重的4号玻璃滤器内,用洗涤溶液洗涤沉淀和烧杯5~7次,每次用量约5mL,先后总量不超过40mL。最后用水洗涤沉淀2次,每次用量为5mL。将盛有沉淀的玻璃滤器置入120士5℃干燥箱中,干燥1.5h,然后取出,放入干燥器内冷却至室温,称量。
4.13.4.3空白试验
在测定的同时,按同样的操作步骤,同样试剂、用量、但不含试样进行空白试验。取平行测定结果的算术平均值为空白试验值。
4.13.5分析结果的表述
氧化钾(以K20计)的含量Xs,以氧化钾质量百分数表示,按式(11)计算:[(m2- m1) - (mm)× 0. 131 4 × 100X.=
m×250
式中,m-
-试样质量,8;
滤器质量,8;
HG2321—92
[(mz—mi)—(m4-ms)J×131.4
盛有沉淀的滤器的质量,g;
空白试验用滤器的质量,名;
空白试验时过滤后滤器的质量,;一四苯基合硼酸钾质量换算为氧化钾质量的系数。4.13.6允许差
4.13.6.1取平行测定结果的算术平均值为测定结果;平行测定结果的绝对差值不大于0.40%;4.13.6.2
4.13.6.3不同实验室测定结果的绝对差值不大于0.80%。注:玻璃滤器洗涤时,若沉淀不易洗去,可用丙酮进一步清洗。5检验规则
P.oi.P.o.
5.1磷酸二氢钾应由生产厂的质量检验部门检验,生产厂应保证所有出厂的磷酸二氢钾均符合本标准的要求。本标准中质量合格与否,判断采用GB1250国家标准中修约值比较法。每批出厂的磷酸二氢钾都应附有质量证明书。
5.2使用单位有权按照本标准规定的检验规则和检验方法对所收到的磷酸二氢钾质量进行检查,检验其指标是否符合本标准的要求。5.3磷酸二氢钾按批检验,生产厂以每天生产的产量为一批,用户以接收产品量为一批。5.4袋装磷酸二氢钾应按表2随机采样:表2磷酸二氢钾袋装采样量
总袋数
82~101
102~125
126~151
152~181
采样袋数
全部袋数
超过512袋,按式(12)计算采样袋数:采样袋数=3×√
式中:n-
一每批磷酸数二氢钾总袋数。
总袋数
182~216
217~254
255~296
297~343
344~394
395~450
451~512
采样袋数
按表2(或式(12)计算)抽出的样品袋数,置于平放位置。从每袋最长对角线插入取样针至袋深3/4处,采取代表性的不少于0.1kg样品,每批采样总量不少于1.0kg。5.5农用小包装应按表3随机采样:11
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。