GB/T 16175-1996
基本信息
标准号: GB/T 16175-1996
中文名称:医用有机硅材料生物学评价试验方法
标准类别:国家标准(GB)
标准状态:已作废
发布日期:1996-03-07
实施日期:1996-10-01
作废日期:2008-09-01
出版语种:简体中文
下载格式:.rar.pdf
下载大小:633234

标准分类号
标准ICS号:数学、自然科学>>微生物学>>07.100.10医学微生物学
中标分类号:医药、卫生、劳动保护>>医疗器械>>C48医用卫生用品
出版信息
出版社:中国标准出版社
页数:平装16开, 页数:21, 字数:37千字
标准价格:14.0 元
出版日期:1996-10-01
相关单位信息
首发日期:1996-03-07
复审日期:2004-10-14
起草人:由少华、薛淼、刘秦玉、孙皎、王昕、顾国珍
起草单位:国家医院管理局医用高分子产品质量检测中心
提出单位:国家医院管理局
发布部门:国家技术监督局
主管部门:国家食品药品监督管理局
标准简介
本标准规定了医用有机硅材料的生物学评价试验方法。本标准适用于医用有机硅材料的生物学评价。 GB/T 16175-1996 医用有机硅材料生物学评价试验方法 GB/T16175-1996 标准下载解压密码:www.bzxz.net
标准图片预览



标准内容
GB/T16175-1996
本标准在制订过程中参考借鉴有关国际标准和国内外先进标准,对多种医用有机硅材料进行了实验验证。本标准第2、3、5、6.7、8、9章参照采用ISO10993医疗器械生物学评价》系列标准,其余部分参考国内外先进标准综合制定而成。这些试验方法基本可以满足对医用有机硅材料的生物学评价需求。对于特殊用途材料的生物学评价,可参考本标准在选择指南中规定的补充生物学评价试验项目及试验基本要求,按照有关国内外标准进行评价。本标准由国家医药管理局提出。本标准由国家医药管理局医用高分子产品质量检测中心归口。本标准起草单位:国家医药管理局医用高分子产品质量检测中心、上海生物材料研究测试中心。本标准主要起草人:由少华、薛森、刘秦玉、孙皎、王昕、顾国珍。1范围
中华人民共和国国家标准
医用有机硅材料生物学评价试验方法Organic sil icon material for medical use-Blological eval uation test methods本标准规定了医用有机硅材料的生物学评价试验方法。GB/T 16175—1996
本标准适用于医用有机硅材料的生物学评价。其他医用材料亦可参照采用。2试验选择指南
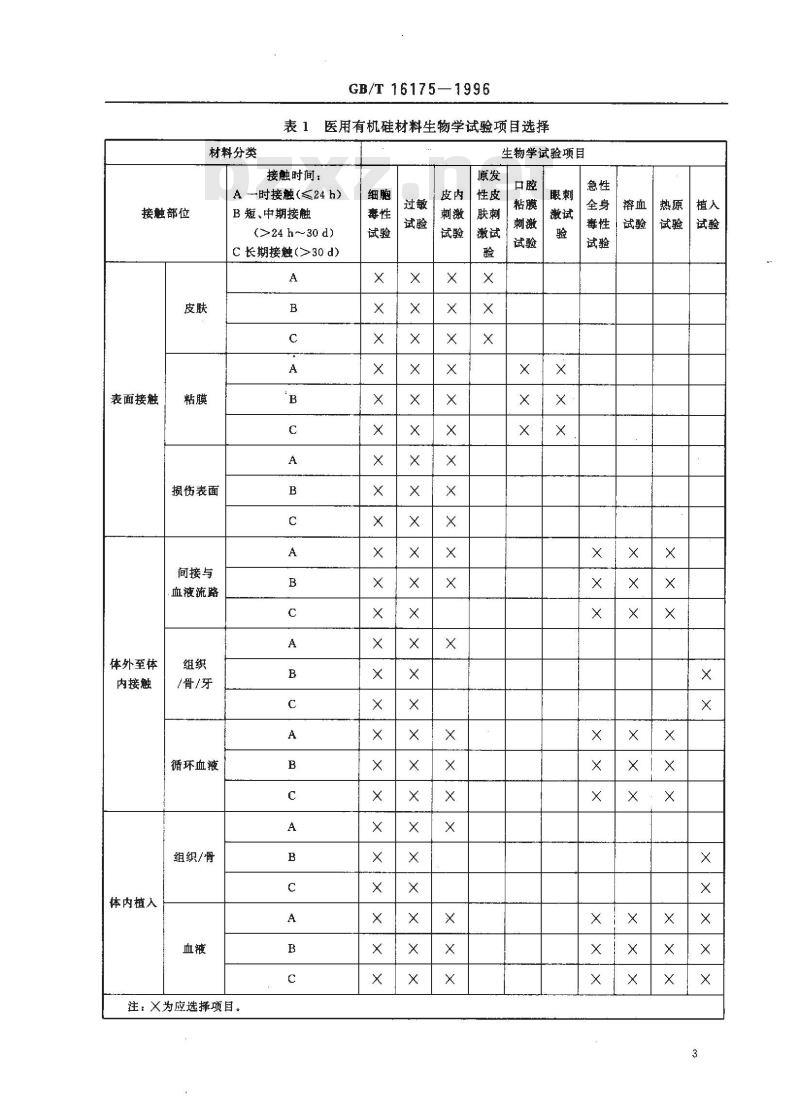
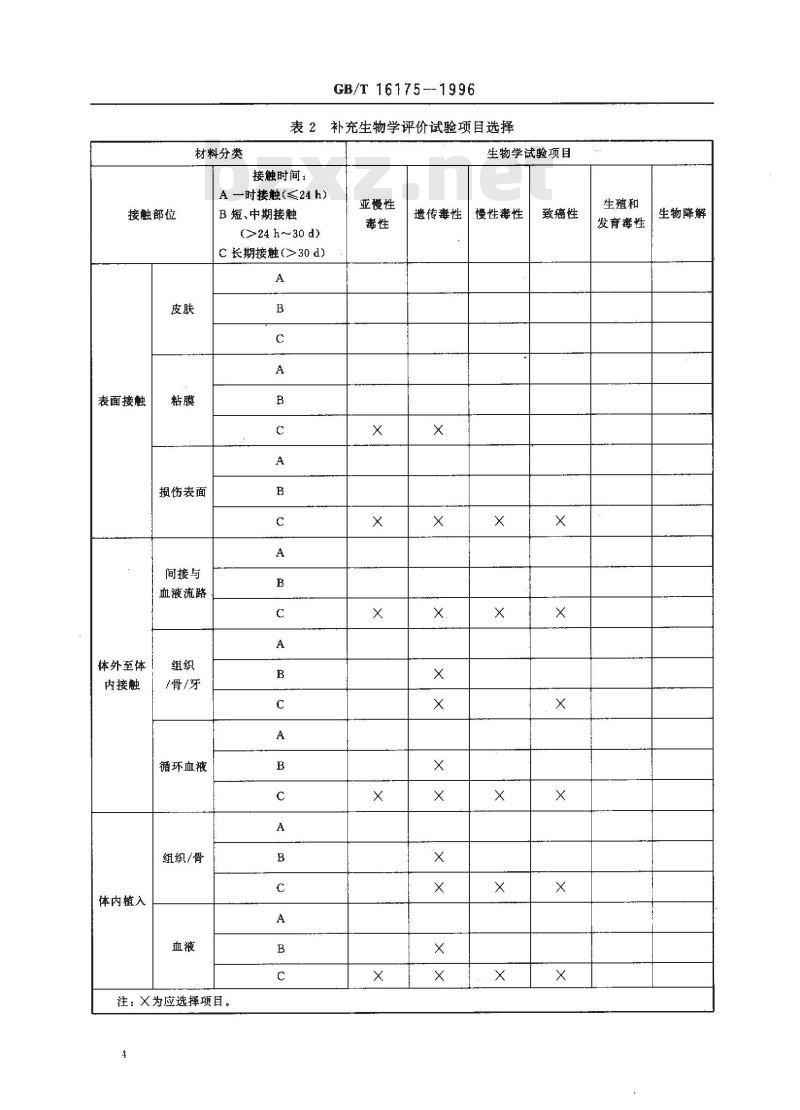
2.1医用有机硅材料按其在临床使用部位和接触时间分类,按表1选择生物学试验项目。2.2表1所列生物学试验不能满足材料生物学评价需求时,按表2选择补充评价试验项目。对于可能影响机体生殖功能的材料,应补充做生殖和发育毒性;对可能在体内降解的材料应做生物降解试验。注:表2所列补充评价试验项目本标准未规定试验方法,可参照有关国际标准或国外标准进行评价。2.2.1亚慢性毒性:该试验测定在大于24h但不超过试验动物寿命的10%的时间内,试验材料或浸提液一软或多次作用的影响。试验应与实际使用情况相一致,2.2.2遗传毒性:该试验用哺乳或非哺乳动物细胞培养技术测定材料或浸提液引起的基因突变、染色体结构和数量的变化,以及对DNA(脱氧核糖核酸)的影响或其他遗传毒性,2.2.3慢性毒性:该试验是在不少于试验动物寿命的10%的时间内,一次或多软将材料漫提液作用于试验动物,测定对动物的影响。试验应与实际使用情况相一致。2.2.4致癌性:该试验是在试验动物的寿命期内,一饮或多次将材料或浸提液作用于动物,测定其致肿瘤性。试验应与实际使用情况相一致。2.2.5生殖和发育毒性:该试验评价材料或浸提液对生殖功能,胚胎发育及胎儿和早期婴儿发育的潜在影响。
2.2.6生物降解:该试验测定材料或浸提液的滤出物或降解物的吸收、分布、生物转化和消除过程。国家技术监督局1996-03-07批准2
1996-10-01实施
接触部位
材料分类
GB/T16175—1996
表1医用有机硅材料生物学试验项目选择生物学试验项目
接触时间:
A -时接触(≤24 h)
B短、中期接触
(>24 h~30 d)
C长期接触(>30 d)
表面接触
体外至体
内接触
体内植入
损伤表面
间接与
血液流路
/骨/牙
循环血液
组织/骨
注:X为应选择项目。
毒性试验
GB/T16175-1996
表2补充生物学评价试验项目选择生物学试验项目
材料分类
接触时间:
生物降解
生殖和
发育毒性
致癌性
慢性毒性
遗传毒性
亚慢性
A一时接触(≤24h)
B短、中期接触
接触部位
(>24 h~30 d)
C长期接触(>30d)
表面接触
损伤表面
间接与
血液流路
体外至体
/骨/牙
内接触
循环血液
组织/骨
体内植入
注:X为应选择项目。
3材料漫提液制备方法
3.1浸提容器
GB/T16175—1996
3.1.1浸提应在一洁净、化学情性的封闭容器中进行,容器内顶部空间尽量小并保证安全性。3.1.2浸提应在防止供试品污染的条件下进行。3.2漫提条件
3.2.1浸提温度、时间和设备按实际使用情况选择表3所列条件的一种。表3浸提条件
浸提温度,C
121±2
没提时间,h
3.2.2供试品表面积或重量与浸提介质比例按表4规定。表4供试品表面积或重量与浸提介质的比例供试品厚度,mm
>0. 5~1. 0
不规则形状
3.2.3根据试验的不同需求选择下列浸提介质:a)极性液体:水,生理盐水,无血清液体培养基;浸提设备
电热恒温培养箱
电热恒温培养箱
电热恒温培养箱
电热恒温干燥箱
电热蒸汽灭蕾器
表面积或重量与浸提介质体积比例6 em2/ml.
3 cm\/mL
1.25 cm/mL
b)非极性液体:新鲜提纯的植物油(如棉籽油或芝麻油),c)其他浸提液体:5%V/V)乙醇水溶液,5%(V/V)乙醇生理盐水溶液,聚乙二醇400(稀释至生理渗透压),二甲亚矾和含血清液体培养基。3.2.4将供试品用自来水、蒸馏水依次冲洗干净后滤纸吸干,切成5mm×30mm条状,置浸提容器内,按规定量加入漫提介质,使液体没没供试品。3.2.5浸提液制备后存放应不超过24h。4细胞毒性试验(细胞增殖度法)4.1方法提要
本试验是将一定量的材料或浸提液加入细胞培养液中培养细胞,通过对细胞生长和增殖的影响来评价材料对细胞的潜在毒性作用。4.2试验样品的制备和要求
4.2.1将材料薄片(厚度≤1mm)用肥皂水清洗,重蒸馏水洗涤,滤纸吸干,医用不锈钢丝悬吊,高压蒸汽灭菌或用紫外线灯照射灭菌3h(正反两面各1.5h)。4.2.2阳性对照:64g/L苯酚溶液。GB/T 16175-1996
4.2.3阴性对照:含医用不锈钢丝的空白管。4.3细胞株
推荐使用L-929细胞(小鼠成纤维细胞),试验用细胞为传代48~72h生长旺盛的细胞。4.4培养基与试剂
4.4.1Eagle'sMEM加人10%(V/V)小牛血清。4.4.2磷酸盐缓冲液(P.B.S)
无钙镁的磷酸盐缓冲液
酚红溶液
200g/L氯化镁溶液
100g/L氯化钙溶液
4.5试验步骤
加至 1 000 mL
4.5.1细胞悬液制备:用细胞培养基配制4万个/mL细胞悬液分注于试管内(1mL/管),阴性对照组13管(1管备用),材料组10管(1管备用),必要时设阳性对照组3管,置37℃恒温培养箱中培养24h。4.5.2材料浸提液制备:将细胞培养基按1cm试样表面积10mL的比例加入放有试样的试管中,37℃下浸提24h。
4.5.3浸提液交换:24h后,每管舍弃原培养液,阴性对照组9管用新鲜培养液交换,阳性对照组用含64g/L苯酚的细胞培养液交换,材料组用含50%(V/V)浸提液的新鲜培养液进行交换,并对三支阴性对照管进行细胞计数,其余置37℃继续培养。4.5.4细胞计数与吸光度测定
4.5.4.1分别于2、4、7d将对照组和材料组各3管进行细胞计数或吸光度测定,以判断细胞的增殖度。
4.5.4.2细胞计数法:用含构酸的结晶紫罗兰染色,血球计数板在显微镜下计数,上下限不得超过10%,否则重新计数。
4.5.4.3分光光度计测定吸光度法(仲裁法):弃去原细胞培养液,用P.B.S洗涤,10%(V/V)甲醛溶液固定10min,水洗2~3次,加5g/L结晶紫罗兰1.5mL染色3min,水洗23次,加10g/L十二烷基硫酸钠3.5mL,用分光光度计在波长588nm下测定吸光度。4.6结果计算
4.6.1细胞计数法:细胞计数经95%可信度的数理统计,得上限、平均数、下限,通过细胞计数计算相对增殖度(RGR),见式(1)。
材料组平均值
RGR(%)=丽鞋摄量翠岛值×100
4.6.2吸光度测定法:相对增殖度计算见式(2)。材料组吸光度空白对照吸光度下载标准就来标准下载网
阴性对照组吸光度一墨智照荧宪度×100RGR(%) =
4.6.3毒性评定:按表5规定把RGR值转换成六级反应以评定材料毒性程度。(1)
(2)
4.7结果评价
GB/T 16175—1996
表5反应分级标准
4.7.1试验结果为0或1级反应为合格。4.7.2试验结果为2级反应的,应结合细胞形态分析,综合评价。4.7.3试验结果为3~5级反应为不合格。4.8试验报告
相对增殖度
1~24
4.8.1试验材料、阴、阳性对照材料的化学名称,商品名称,产品批号,生产厂家以及材料试样尺寸规格,灭菌方式,
4.8.2试验用细胞名称、来源、培养基种类。4.8.3试验方法和步骤。
4.8.4计算细胞相对增殖度。
4.8.5对试验材料进行评价。
5过敏试验
5.1方法提要
本试验是将一定量的材料或材料浸提液与豚鼠皮肤相接触,以评价材料对生物体的潜在致敏性。5.2试验动物
5.2.1白色豚鼠体重300~500g,1~3月龄,雌雄均可,试验样品组每组至少10只,对照组每组至少5只。
5.2.2试验前24h,剃除豚鼠背部4cm×6cm区域毛发。5.3试验样品的制备和要求
5.3.1供皮内注射的试样的制备
5.3.1.1可溶性材料:不超过100g/L的水溶液或油溶液。5.3.1.2不溶性材料:按第3章制备材料生理盐水或植物油浸提液。5.3.1.3含漫浸提介质或试验材料的完全弗氏佐剂的制备:将上述漫提介质、材料溶液或材料浸提液与完全弗氏佐剂等容积混合,用力搅拌数分钟至乳化完全为止。5.3.2供局部应用的试样的制备
5.3.2.1液体材料:按皮内注射要求制备。5.3.2.2固体材料:按第3章制备材料生理盐水或植物油漫提液。5.3.3对照材料的制备
5.3.3.1阳性对照:5%(V/V)甲醛溶液。5.3.3.2阴性对照:同批材料浸提介质或材料赋形剂。5.3.4经预试后,试验液体的最终浓度若导致局部溃疡、坏死或全身反应则将浓度降低到最大耐受剂了
5.4试验步骤
5.4.1诱导
GB/T 16175-1996
5.4.1.1皮内注射:70%(V/V)乙醇清洁豚鼠去毛区,在每只豚鼠背脊柱两侧6点对称皮内注射.各点相距1~~2 cm,每点注射剂量为0.1mL。注射剂型和位置见图1。头
完全弗氏佐剂与生理盐水或新鲜精制植物油的乳化物材料溶液或材料浸提液阴性或阳性对照液材料溶液、材料漫提液或阴阳性对照液与完全弗氏佐剂的乳化物图1注射剂型和位置
5.4.1.2局部斑贴:皮内注射后1周,在豚鼠去毛区再度剃毛,70%(V/V)乙醇清洁,如未产生刺激症状,各注射部位以100g/L十二烷基硫酸钠石蜡液(SLS)涂布,24h后贴敷于材料溶液、浸提液或阴阳性对照液中浸泡至饱和的2cm×4cm滤纸片,固定并留置48h土2h。5.4.2激发
局部斑贴后至少14d,将豚鼠腹部一侧毛发剃除,用70%(V/V)乙醇清洁,在腹侧去毛区贴敷同5.4.1.2处置的滤纸片,固定并留置24h土2h。5.5结果观察
除去贴敷物后24h.48h、72h观察激发部位反应,按表6记录每一观察时间和每一激发部位红斑和水肿反应分级。
表 6皮肤反应分级标准
红斑反应
无红斑
极轻微的红斑(刚可察出)
局限性红斑(淡红色)
中度红斑(鲜红色,区域清蜥)严重红斑(紫红色,形成轻微焦痴)5.6结果评价
水肿反应
无水肿
极轻微水肿(刚可察出)
轻微水肿(边缘和高度均局限)中度水肿(边缘升高近1mm)
严重水肿(商度超过1 mm,边界超过接触区》
5.6.1阴性对照组动物皮肤反应分级小于1时,试验样品组动物反应分级为1或大于1时认为致敏;阴性对照组动物反应分级为1或大于1时,试验样品组动物反应超过对照组中最严重的反应则认为致敏。
5.6.260%的阳性对照动物的皮肤反应应为2或大于2,否则应重复试验。5.6.3封闭性包扎可能使动物产生皮肤反应,可与阴性对照组动物比较,如需再次激发,应在首次激发后7d进行,贴敷于动物另一侧腹部。5.7试验报告
5.7.1试验材料的化学名称、商品名称、产品批号和生产厂家;浸提介质和浸提条件。5.7.2使用动物的品系、性别、体重和健康状况。5.7.3描述每次观察期试验材料组和对照组动物的皮肤反应分级情况。8
5.7.4对试验材料进行评价。
6皮内刺激试验
6.1方法提要
GB/T 16175—1996
本试验是一种非特异性的急性毒性试验。通过动物皮内注射材料浸提液,以评价材料是否对组织有毒性作用。
6.2试验动物
6.2.1健康白色家兔,同一品系,雌雄均可,体重不低于2kg。6.2.2每种材料至少需用3只家兔,若试验结果可疑,应重复试验。6.2.3试验前24h在兔脊柱两侧各剪剃5cm×25cm区域兔毛,应避免损皮肤。6.3按第3章规定制备材料生理盐水和植物油浸提液。6.4试验步骤
6.4.170%(V/V)乙醇消毒暴露的皮肤。6.4.2在兔脊柱两侧各选择10个点,每点间隔2cm,每点皮内注射剂量0.2mL。一侧前5点注射材料生理盐水浸提液,后5点注射同批阴性对照生理盐水;另一侧前后5点分别注射材料植物油浸提液和阴性对照植物油。注射部位图示见图2。头
每点注射0. 2mL材料
生理盐水浸提液
每点注射0.2mL阴性
对照生理盐水
6.5结果观察
图2注射部位图示
每点注射 0. 2 mL材料
植物油浸提液
每点注射0.2mL阴性
对照植物油
注射后24h、48h、72h观察注射局部及周围皮肤组织反应,包括红斑、水肿和坏死等。注意与植物油皮内注射产生的炎症反应相区别,按表7规定进行记分。表7皮肤反应记分标准
红斑反应
无红斑现象
轻度红斑(勉强可见)
明显红斑(淡红色)
中度红斑(鲜红色)
重度红斑(紫红色伴有轻微焦痴形成)记分
无永肿现象
水肿反应
轻度水肿(勉强可见皮肤增厚)
明显水肿(隆起而轮清楚)
中度水肿(隆起近1mm)
重度水肿(隆起大于1mm)
6.6结果评价
GB/T 16175 --- 1996
6.6.1按表7记分标准,分别计算每一动物材料浸提液和阴性对照液注射部位红斑、水肿平均记分,材料浸提液记分减去阴性对照液记分为每一动物原发性刺激记分。6.6.2每一动物原发性刺激记分相加再除以动物总数为原发性刺激指数(PI)。6.6.3按表8划分反应等级。
表8皮肤反应分级标准
反应分级
6.7试验报告
原发性刺激指数(PII)
0. 0~0. 4
0. 5 ~~1. 9
2. 0~4. 9
5. 0~8. 0
6.7.1试验材料的化学名称、商品名称、产品批号、生产厂家、浸提介质和浸提条件。使用动物的品系、性别、体重和健康状况。6.7.21
描述每次观察期间试验部位和对照部位皮肤反应记分分级情况。6.7.4
对试验材料进行评价。
7原发性皮肤刺激试验
7.1方法提要
本试验是将材料或材料浸提液与动物皮肤在规定时间内接触,通过动物皮肤的局部反应情况来评价材料对皮肤的原发性刺激作用。7.2试验动物
7.2.1采用白色家兔,体重不低于2kg,堆雄均可,同-样品同一品系,每种材料至少需3只家兔,7.2.2试验前24h动物背部去毛,脊柱两侧各选两个3cm×3cm面积的去毛区,间距10cm。7.3试验样品的制备和要求
7.3.1液体材料0.5mL。
7.3.2粉末状材料或半固体材料0.5g制成一定浓度软膏或其他更接近实际使用的剂型。7.3.3薄膜材料制成2.5cm×2.5cm试片。7.3.4材料浸提液制备按第3章进行。7.3.5阴性对照:同批号浸提介质或材料赋形剂。7.4试验步骤
7.4.170%(V/V)乙醇消毒动物背部去毛区。7.4.2将适量材料置于图3所示试验部位,或用2.5cm×2.5cm滤纸块浸泡于试液中至饱和,贴敷于试验部位。
GB/T 16175--1996
“试验材料贴敷部位
阴性对照品贴敷部位
图3试验部位图示
7.4.3材料贴数于皮肤后,立即用3cm×3cm纱布块覆盖,最外层用胶布固定。7.5结果观察
7.5.1贴敷固定24h后,除去贴敷物,用温水清洁试验部位。7.5.2按表9所规定的记分标准,在除去贴敷物后1h、24h、48h,72h对试验部位的红斑和水肿反应记分。注意与由于皮肤温度的改变或皮肤的破损造成的感染所引起的红斑和水肿和材料所引起的刺激反应相区别。
表9皮反应记分标准
7.6结果评价
无红斑
极轻微的红斑(几乎着不到)
边界清蜥的红斑(淡红色)
中等到严重的红斑(鲜红色,界限分明)极严重的红斑(呈紫红色)并有轻微焦痴出现无水肿
极轻微的水肿(刚可察出)
轻度水肿(边缘明显高出周围皮面)中等水肿(水肿区高出周围皮面约1mm)严重水肿(水肿高出表皮面在1 mm以上,面积超出斑贴区)记分
7.6.7按表9记分标准,分别计算每一动物材料试验部位和对照试验部位红斑、水肿平均记分,材料部位记分减去对照部位记分为每一动物原发性刺撤记分。7.6.2每一动物原发性刺激记分相加再除以动物总数为原发性刺激指数(PII)。7.6.3除去贴敷物后24h、48h、72h观察记分用于结果计算。按表10规定划分反应等级。表10皮肤反应分级标准
反应分级
7.7试验报告
原发性刺激指数(PII)
0. 0~0. 4
0. 5~1. 9
5. 0~8. 0
7.7.1试验材料的化学名称、商品名称、产品批号和生产厂家;浸提介质和浸提条件。11
GB/T16175-1996
使用动物的品系、性别、体重和健康状况7.7.2
7.7.3描述每次观察期间试验部位和对照部位皮肤反应记分分级情况。7.7.4对试验材料进行评价。
8口腔粘膜刺激试验
8.1方法提要
本试验将材料或材料浸提液与动物口腔粘膜接触,观察局部组织反应程度,以评价材料对生物体口腔粘膜的刺激作用。
8.2试验动物
8.2.1健康成年仓鼠,雌鼠应无孕,口腔双侧颊囊应无病变,每种材料至少需3只动物。8.2.2每只动物套上3~4mm宽的项圈,使动物能维持正常进食和呼吸,但又能防止动物口腔内棉球移出。动物每天称重,连续7d,检查动物体重变化情况以调整好项圈。8.3试验样品的制备和要求
8.3.1材料浸提液制备按第3章规定进行。8.3.2液体材料,材料浸提液或材料浸提介质浸湿直径不大于5mm的灭菌脱脂棉球。8.4试验步骤
8.4.1除掉动物项圈,采用10g/L戊巴比妥钠水溶液腹腔注射麻醉动物,注射剂量3~~6mL/kg。8.4.2翻转动物颊囊用生理盐水冲洗后,检查有无异常。8.4.3将材料或材料浸提液漫湿的棉球放入动物一侧颊囊内,液体材料另一侧作为空白对照,材料浸提液另一侧放置浸提介质棉球作为试剂对照。重新给动物带上项圈。8.4.4每次接触时间根据材料预期实际使用时间而定,但不能少于5min。每次接触后取下项圈和棉球,用生理盐水冲洗颊囊。
8.4.5急性接触:重复上述步骤,每小时1次,共4次。8.4.6重复接触:根据材料预期临床使用情况决定试验用量、试验周期和间隔期。8.5结果观察
8.5.1每次接触后取出棉球肉眼观察比较动物颊囊试验侧和对照侧组织反应情况,检查有无糜烂、溃疡、充血及肿胀。
8.5.2最后一次接触后24h,肉眼观察动物颊囊后麻醉处死动物,取与棉球接触的颊部组织,10%(V/V)甲醛溶液固定后常规切片,伊红-苏木紊染色,每块组织至少做两张组织切片,显微镜下观察。8.5.3镜下观察试验侧和对照侧组织反应记分标准按表11规定。试验组或对照组平均记分为该组全部动物记分相加除以观察数;刺激指数为试验组平均记分减去对照组平均记分所得。表11口腔粘膜组织反应记分标准反应
细胞变性或变平
组织变形
局部糜烂
广泛糜烂
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
本标准在制订过程中参考借鉴有关国际标准和国内外先进标准,对多种医用有机硅材料进行了实验验证。本标准第2、3、5、6.7、8、9章参照采用ISO10993医疗器械生物学评价》系列标准,其余部分参考国内外先进标准综合制定而成。这些试验方法基本可以满足对医用有机硅材料的生物学评价需求。对于特殊用途材料的生物学评价,可参考本标准在选择指南中规定的补充生物学评价试验项目及试验基本要求,按照有关国内外标准进行评价。本标准由国家医药管理局提出。本标准由国家医药管理局医用高分子产品质量检测中心归口。本标准起草单位:国家医药管理局医用高分子产品质量检测中心、上海生物材料研究测试中心。本标准主要起草人:由少华、薛森、刘秦玉、孙皎、王昕、顾国珍。1范围
中华人民共和国国家标准
医用有机硅材料生物学评价试验方法Organic sil icon material for medical use-Blological eval uation test methods本标准规定了医用有机硅材料的生物学评价试验方法。GB/T 16175—1996
本标准适用于医用有机硅材料的生物学评价。其他医用材料亦可参照采用。2试验选择指南
2.1医用有机硅材料按其在临床使用部位和接触时间分类,按表1选择生物学试验项目。2.2表1所列生物学试验不能满足材料生物学评价需求时,按表2选择补充评价试验项目。对于可能影响机体生殖功能的材料,应补充做生殖和发育毒性;对可能在体内降解的材料应做生物降解试验。注:表2所列补充评价试验项目本标准未规定试验方法,可参照有关国际标准或国外标准进行评价。2.2.1亚慢性毒性:该试验测定在大于24h但不超过试验动物寿命的10%的时间内,试验材料或浸提液一软或多次作用的影响。试验应与实际使用情况相一致,2.2.2遗传毒性:该试验用哺乳或非哺乳动物细胞培养技术测定材料或浸提液引起的基因突变、染色体结构和数量的变化,以及对DNA(脱氧核糖核酸)的影响或其他遗传毒性,2.2.3慢性毒性:该试验是在不少于试验动物寿命的10%的时间内,一次或多软将材料漫提液作用于试验动物,测定对动物的影响。试验应与实际使用情况相一致。2.2.4致癌性:该试验是在试验动物的寿命期内,一饮或多次将材料或浸提液作用于动物,测定其致肿瘤性。试验应与实际使用情况相一致。2.2.5生殖和发育毒性:该试验评价材料或浸提液对生殖功能,胚胎发育及胎儿和早期婴儿发育的潜在影响。
2.2.6生物降解:该试验测定材料或浸提液的滤出物或降解物的吸收、分布、生物转化和消除过程。国家技术监督局1996-03-07批准2
1996-10-01实施
接触部位
材料分类
GB/T16175—1996
表1医用有机硅材料生物学试验项目选择生物学试验项目
接触时间:
A -时接触(≤24 h)
B短、中期接触
(>24 h~30 d)
C长期接触(>30 d)
表面接触
体外至体
内接触
体内植入
损伤表面
间接与
血液流路
/骨/牙
循环血液
组织/骨
注:X为应选择项目。
毒性试验
GB/T16175-1996
表2补充生物学评价试验项目选择生物学试验项目
材料分类
接触时间:
生物降解
生殖和
发育毒性
致癌性
慢性毒性
遗传毒性
亚慢性
A一时接触(≤24h)
B短、中期接触
接触部位
(>24 h~30 d)
C长期接触(>30d)
表面接触
损伤表面
间接与
血液流路
体外至体
/骨/牙
内接触
循环血液
组织/骨
体内植入
注:X为应选择项目。
3材料漫提液制备方法
3.1浸提容器
GB/T16175—1996
3.1.1浸提应在一洁净、化学情性的封闭容器中进行,容器内顶部空间尽量小并保证安全性。3.1.2浸提应在防止供试品污染的条件下进行。3.2漫提条件
3.2.1浸提温度、时间和设备按实际使用情况选择表3所列条件的一种。表3浸提条件
浸提温度,C
121±2
没提时间,h
3.2.2供试品表面积或重量与浸提介质比例按表4规定。表4供试品表面积或重量与浸提介质的比例供试品厚度,mm
>0. 5~1. 0
不规则形状
3.2.3根据试验的不同需求选择下列浸提介质:a)极性液体:水,生理盐水,无血清液体培养基;浸提设备
电热恒温培养箱
电热恒温培养箱
电热恒温培养箱
电热恒温干燥箱
电热蒸汽灭蕾器
表面积或重量与浸提介质体积比例6 em2/ml.
3 cm\/mL
1.25 cm/mL
b)非极性液体:新鲜提纯的植物油(如棉籽油或芝麻油),c)其他浸提液体:5%V/V)乙醇水溶液,5%(V/V)乙醇生理盐水溶液,聚乙二醇400(稀释至生理渗透压),二甲亚矾和含血清液体培养基。3.2.4将供试品用自来水、蒸馏水依次冲洗干净后滤纸吸干,切成5mm×30mm条状,置浸提容器内,按规定量加入漫提介质,使液体没没供试品。3.2.5浸提液制备后存放应不超过24h。4细胞毒性试验(细胞增殖度法)4.1方法提要
本试验是将一定量的材料或浸提液加入细胞培养液中培养细胞,通过对细胞生长和增殖的影响来评价材料对细胞的潜在毒性作用。4.2试验样品的制备和要求
4.2.1将材料薄片(厚度≤1mm)用肥皂水清洗,重蒸馏水洗涤,滤纸吸干,医用不锈钢丝悬吊,高压蒸汽灭菌或用紫外线灯照射灭菌3h(正反两面各1.5h)。4.2.2阳性对照:64g/L苯酚溶液。GB/T 16175-1996
4.2.3阴性对照:含医用不锈钢丝的空白管。4.3细胞株
推荐使用L-929细胞(小鼠成纤维细胞),试验用细胞为传代48~72h生长旺盛的细胞。4.4培养基与试剂
4.4.1Eagle'sMEM加人10%(V/V)小牛血清。4.4.2磷酸盐缓冲液(P.B.S)
无钙镁的磷酸盐缓冲液
酚红溶液
200g/L氯化镁溶液
100g/L氯化钙溶液
4.5试验步骤
加至 1 000 mL
4.5.1细胞悬液制备:用细胞培养基配制4万个/mL细胞悬液分注于试管内(1mL/管),阴性对照组13管(1管备用),材料组10管(1管备用),必要时设阳性对照组3管,置37℃恒温培养箱中培养24h。4.5.2材料浸提液制备:将细胞培养基按1cm试样表面积10mL的比例加入放有试样的试管中,37℃下浸提24h。
4.5.3浸提液交换:24h后,每管舍弃原培养液,阴性对照组9管用新鲜培养液交换,阳性对照组用含64g/L苯酚的细胞培养液交换,材料组用含50%(V/V)浸提液的新鲜培养液进行交换,并对三支阴性对照管进行细胞计数,其余置37℃继续培养。4.5.4细胞计数与吸光度测定
4.5.4.1分别于2、4、7d将对照组和材料组各3管进行细胞计数或吸光度测定,以判断细胞的增殖度。
4.5.4.2细胞计数法:用含构酸的结晶紫罗兰染色,血球计数板在显微镜下计数,上下限不得超过10%,否则重新计数。
4.5.4.3分光光度计测定吸光度法(仲裁法):弃去原细胞培养液,用P.B.S洗涤,10%(V/V)甲醛溶液固定10min,水洗2~3次,加5g/L结晶紫罗兰1.5mL染色3min,水洗23次,加10g/L十二烷基硫酸钠3.5mL,用分光光度计在波长588nm下测定吸光度。4.6结果计算
4.6.1细胞计数法:细胞计数经95%可信度的数理统计,得上限、平均数、下限,通过细胞计数计算相对增殖度(RGR),见式(1)。
材料组平均值
RGR(%)=丽鞋摄量翠岛值×100
4.6.2吸光度测定法:相对增殖度计算见式(2)。材料组吸光度空白对照吸光度下载标准就来标准下载网
阴性对照组吸光度一墨智照荧宪度×100RGR(%) =
4.6.3毒性评定:按表5规定把RGR值转换成六级反应以评定材料毒性程度。(1)
(2)
4.7结果评价
GB/T 16175—1996
表5反应分级标准
4.7.1试验结果为0或1级反应为合格。4.7.2试验结果为2级反应的,应结合细胞形态分析,综合评价。4.7.3试验结果为3~5级反应为不合格。4.8试验报告
相对增殖度
1~24
4.8.1试验材料、阴、阳性对照材料的化学名称,商品名称,产品批号,生产厂家以及材料试样尺寸规格,灭菌方式,
4.8.2试验用细胞名称、来源、培养基种类。4.8.3试验方法和步骤。
4.8.4计算细胞相对增殖度。
4.8.5对试验材料进行评价。
5过敏试验
5.1方法提要
本试验是将一定量的材料或材料浸提液与豚鼠皮肤相接触,以评价材料对生物体的潜在致敏性。5.2试验动物
5.2.1白色豚鼠体重300~500g,1~3月龄,雌雄均可,试验样品组每组至少10只,对照组每组至少5只。
5.2.2试验前24h,剃除豚鼠背部4cm×6cm区域毛发。5.3试验样品的制备和要求
5.3.1供皮内注射的试样的制备
5.3.1.1可溶性材料:不超过100g/L的水溶液或油溶液。5.3.1.2不溶性材料:按第3章制备材料生理盐水或植物油浸提液。5.3.1.3含漫浸提介质或试验材料的完全弗氏佐剂的制备:将上述漫提介质、材料溶液或材料浸提液与完全弗氏佐剂等容积混合,用力搅拌数分钟至乳化完全为止。5.3.2供局部应用的试样的制备
5.3.2.1液体材料:按皮内注射要求制备。5.3.2.2固体材料:按第3章制备材料生理盐水或植物油漫提液。5.3.3对照材料的制备
5.3.3.1阳性对照:5%(V/V)甲醛溶液。5.3.3.2阴性对照:同批材料浸提介质或材料赋形剂。5.3.4经预试后,试验液体的最终浓度若导致局部溃疡、坏死或全身反应则将浓度降低到最大耐受剂了
5.4试验步骤
5.4.1诱导
GB/T 16175-1996
5.4.1.1皮内注射:70%(V/V)乙醇清洁豚鼠去毛区,在每只豚鼠背脊柱两侧6点对称皮内注射.各点相距1~~2 cm,每点注射剂量为0.1mL。注射剂型和位置见图1。头
完全弗氏佐剂与生理盐水或新鲜精制植物油的乳化物材料溶液或材料浸提液阴性或阳性对照液材料溶液、材料漫提液或阴阳性对照液与完全弗氏佐剂的乳化物图1注射剂型和位置
5.4.1.2局部斑贴:皮内注射后1周,在豚鼠去毛区再度剃毛,70%(V/V)乙醇清洁,如未产生刺激症状,各注射部位以100g/L十二烷基硫酸钠石蜡液(SLS)涂布,24h后贴敷于材料溶液、浸提液或阴阳性对照液中浸泡至饱和的2cm×4cm滤纸片,固定并留置48h土2h。5.4.2激发
局部斑贴后至少14d,将豚鼠腹部一侧毛发剃除,用70%(V/V)乙醇清洁,在腹侧去毛区贴敷同5.4.1.2处置的滤纸片,固定并留置24h土2h。5.5结果观察
除去贴敷物后24h.48h、72h观察激发部位反应,按表6记录每一观察时间和每一激发部位红斑和水肿反应分级。
表 6皮肤反应分级标准
红斑反应
无红斑
极轻微的红斑(刚可察出)
局限性红斑(淡红色)
中度红斑(鲜红色,区域清蜥)严重红斑(紫红色,形成轻微焦痴)5.6结果评价
水肿反应
无水肿
极轻微水肿(刚可察出)
轻微水肿(边缘和高度均局限)中度水肿(边缘升高近1mm)
严重水肿(商度超过1 mm,边界超过接触区》
5.6.1阴性对照组动物皮肤反应分级小于1时,试验样品组动物反应分级为1或大于1时认为致敏;阴性对照组动物反应分级为1或大于1时,试验样品组动物反应超过对照组中最严重的反应则认为致敏。
5.6.260%的阳性对照动物的皮肤反应应为2或大于2,否则应重复试验。5.6.3封闭性包扎可能使动物产生皮肤反应,可与阴性对照组动物比较,如需再次激发,应在首次激发后7d进行,贴敷于动物另一侧腹部。5.7试验报告
5.7.1试验材料的化学名称、商品名称、产品批号和生产厂家;浸提介质和浸提条件。5.7.2使用动物的品系、性别、体重和健康状况。5.7.3描述每次观察期试验材料组和对照组动物的皮肤反应分级情况。8
5.7.4对试验材料进行评价。
6皮内刺激试验
6.1方法提要
GB/T 16175—1996
本试验是一种非特异性的急性毒性试验。通过动物皮内注射材料浸提液,以评价材料是否对组织有毒性作用。
6.2试验动物
6.2.1健康白色家兔,同一品系,雌雄均可,体重不低于2kg。6.2.2每种材料至少需用3只家兔,若试验结果可疑,应重复试验。6.2.3试验前24h在兔脊柱两侧各剪剃5cm×25cm区域兔毛,应避免损皮肤。6.3按第3章规定制备材料生理盐水和植物油浸提液。6.4试验步骤
6.4.170%(V/V)乙醇消毒暴露的皮肤。6.4.2在兔脊柱两侧各选择10个点,每点间隔2cm,每点皮内注射剂量0.2mL。一侧前5点注射材料生理盐水浸提液,后5点注射同批阴性对照生理盐水;另一侧前后5点分别注射材料植物油浸提液和阴性对照植物油。注射部位图示见图2。头
每点注射0. 2mL材料
生理盐水浸提液
每点注射0.2mL阴性
对照生理盐水
6.5结果观察
图2注射部位图示
每点注射 0. 2 mL材料
植物油浸提液
每点注射0.2mL阴性
对照植物油
注射后24h、48h、72h观察注射局部及周围皮肤组织反应,包括红斑、水肿和坏死等。注意与植物油皮内注射产生的炎症反应相区别,按表7规定进行记分。表7皮肤反应记分标准
红斑反应
无红斑现象
轻度红斑(勉强可见)
明显红斑(淡红色)
中度红斑(鲜红色)
重度红斑(紫红色伴有轻微焦痴形成)记分
无永肿现象
水肿反应
轻度水肿(勉强可见皮肤增厚)
明显水肿(隆起而轮清楚)
中度水肿(隆起近1mm)
重度水肿(隆起大于1mm)
6.6结果评价
GB/T 16175 --- 1996
6.6.1按表7记分标准,分别计算每一动物材料浸提液和阴性对照液注射部位红斑、水肿平均记分,材料浸提液记分减去阴性对照液记分为每一动物原发性刺激记分。6.6.2每一动物原发性刺激记分相加再除以动物总数为原发性刺激指数(PI)。6.6.3按表8划分反应等级。
表8皮肤反应分级标准
反应分级
6.7试验报告
原发性刺激指数(PII)
0. 0~0. 4
0. 5 ~~1. 9
2. 0~4. 9
5. 0~8. 0
6.7.1试验材料的化学名称、商品名称、产品批号、生产厂家、浸提介质和浸提条件。使用动物的品系、性别、体重和健康状况。6.7.21
描述每次观察期间试验部位和对照部位皮肤反应记分分级情况。6.7.4
对试验材料进行评价。
7原发性皮肤刺激试验
7.1方法提要
本试验是将材料或材料浸提液与动物皮肤在规定时间内接触,通过动物皮肤的局部反应情况来评价材料对皮肤的原发性刺激作用。7.2试验动物
7.2.1采用白色家兔,体重不低于2kg,堆雄均可,同-样品同一品系,每种材料至少需3只家兔,7.2.2试验前24h动物背部去毛,脊柱两侧各选两个3cm×3cm面积的去毛区,间距10cm。7.3试验样品的制备和要求
7.3.1液体材料0.5mL。
7.3.2粉末状材料或半固体材料0.5g制成一定浓度软膏或其他更接近实际使用的剂型。7.3.3薄膜材料制成2.5cm×2.5cm试片。7.3.4材料浸提液制备按第3章进行。7.3.5阴性对照:同批号浸提介质或材料赋形剂。7.4试验步骤
7.4.170%(V/V)乙醇消毒动物背部去毛区。7.4.2将适量材料置于图3所示试验部位,或用2.5cm×2.5cm滤纸块浸泡于试液中至饱和,贴敷于试验部位。
GB/T 16175--1996
“试验材料贴敷部位
阴性对照品贴敷部位
图3试验部位图示
7.4.3材料贴数于皮肤后,立即用3cm×3cm纱布块覆盖,最外层用胶布固定。7.5结果观察
7.5.1贴敷固定24h后,除去贴敷物,用温水清洁试验部位。7.5.2按表9所规定的记分标准,在除去贴敷物后1h、24h、48h,72h对试验部位的红斑和水肿反应记分。注意与由于皮肤温度的改变或皮肤的破损造成的感染所引起的红斑和水肿和材料所引起的刺激反应相区别。
表9皮反应记分标准
7.6结果评价
无红斑
极轻微的红斑(几乎着不到)
边界清蜥的红斑(淡红色)
中等到严重的红斑(鲜红色,界限分明)极严重的红斑(呈紫红色)并有轻微焦痴出现无水肿
极轻微的水肿(刚可察出)
轻度水肿(边缘明显高出周围皮面)中等水肿(水肿区高出周围皮面约1mm)严重水肿(水肿高出表皮面在1 mm以上,面积超出斑贴区)记分
7.6.7按表9记分标准,分别计算每一动物材料试验部位和对照试验部位红斑、水肿平均记分,材料部位记分减去对照部位记分为每一动物原发性刺撤记分。7.6.2每一动物原发性刺激记分相加再除以动物总数为原发性刺激指数(PII)。7.6.3除去贴敷物后24h、48h、72h观察记分用于结果计算。按表10规定划分反应等级。表10皮肤反应分级标准
反应分级
7.7试验报告
原发性刺激指数(PII)
0. 0~0. 4
0. 5~1. 9
5. 0~8. 0
7.7.1试验材料的化学名称、商品名称、产品批号和生产厂家;浸提介质和浸提条件。11
GB/T16175-1996
使用动物的品系、性别、体重和健康状况7.7.2
7.7.3描述每次观察期间试验部位和对照部位皮肤反应记分分级情况。7.7.4对试验材料进行评价。
8口腔粘膜刺激试验
8.1方法提要
本试验将材料或材料浸提液与动物口腔粘膜接触,观察局部组织反应程度,以评价材料对生物体口腔粘膜的刺激作用。
8.2试验动物
8.2.1健康成年仓鼠,雌鼠应无孕,口腔双侧颊囊应无病变,每种材料至少需3只动物。8.2.2每只动物套上3~4mm宽的项圈,使动物能维持正常进食和呼吸,但又能防止动物口腔内棉球移出。动物每天称重,连续7d,检查动物体重变化情况以调整好项圈。8.3试验样品的制备和要求
8.3.1材料浸提液制备按第3章规定进行。8.3.2液体材料,材料浸提液或材料浸提介质浸湿直径不大于5mm的灭菌脱脂棉球。8.4试验步骤
8.4.1除掉动物项圈,采用10g/L戊巴比妥钠水溶液腹腔注射麻醉动物,注射剂量3~~6mL/kg。8.4.2翻转动物颊囊用生理盐水冲洗后,检查有无异常。8.4.3将材料或材料浸提液漫湿的棉球放入动物一侧颊囊内,液体材料另一侧作为空白对照,材料浸提液另一侧放置浸提介质棉球作为试剂对照。重新给动物带上项圈。8.4.4每次接触时间根据材料预期实际使用时间而定,但不能少于5min。每次接触后取下项圈和棉球,用生理盐水冲洗颊囊。
8.4.5急性接触:重复上述步骤,每小时1次,共4次。8.4.6重复接触:根据材料预期临床使用情况决定试验用量、试验周期和间隔期。8.5结果观察
8.5.1每次接触后取出棉球肉眼观察比较动物颊囊试验侧和对照侧组织反应情况,检查有无糜烂、溃疡、充血及肿胀。
8.5.2最后一次接触后24h,肉眼观察动物颊囊后麻醉处死动物,取与棉球接触的颊部组织,10%(V/V)甲醛溶液固定后常规切片,伊红-苏木紊染色,每块组织至少做两张组织切片,显微镜下观察。8.5.3镜下观察试验侧和对照侧组织反应记分标准按表11规定。试验组或对照组平均记分为该组全部动物记分相加除以观察数;刺激指数为试验组平均记分减去对照组平均记分所得。表11口腔粘膜组织反应记分标准反应
细胞变性或变平
组织变形
局部糜烂
广泛糜烂
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。