DB 33/T 436-2003
基本信息
标准号: DB 33/T 436-2003
中文名称:蜂产品质量安全监督抽查检验细则
标准类别:地方标准(DB)
标准状态:现行
出版语种:简体中文
下载格式:.rar .pdf
下载大小:214KB

标准分类号
关联标准
出版信息
相关单位信息
标准简介
DB 33/T 436-2003 蜂产品质量安全监督抽查检验细则
DB33/T436-2003
标准下载解压密码:www.bzxz.net
标准图片预览


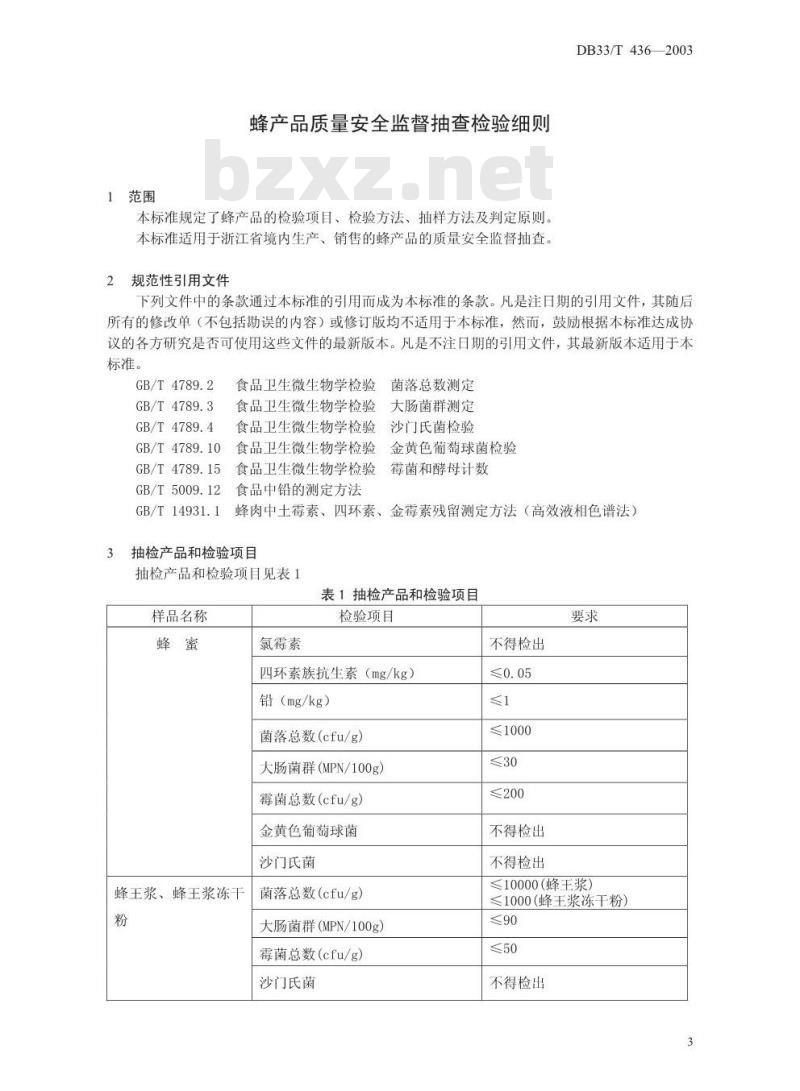


标准内容
ICS65.020.01
备案号:14147-2003
方标准
DB33/T436-2003
蜂产品质量安全监督抽查
检验细则
Test regulation on quality safety supervision of honey products2003-08-12发布
2003-08-15实施
浙江省质量技术监督局发布
DB33/T436—2003
为保障人民群众身体健康,全面推进“无公害农产品行动计划”,保证蜂产品质量安全指导有关检验机构进行蜂产品质量安全监督抽查检验工作,特制定本检验细则,作为组织监督抽查的依据。
本标准之附录A为规范性附录。
本标准所列的检验项目与法律、法规、规章有不一致时,应以法律、法规、规章的规定为准。
本标准由浙江省农产品质量安全监督检测协调会议办公室提出。本标准起草单位:浙江省畜产品质量安全检测中心。本标准主要起草人:陈慧华、屈健、施杏芬、汪刚、陈勇2
1范围
蜂产品质量安全监督抽查检验细则本标准规定了蜂产品的检验项目、检验方法、抽样方法及判定原则。本标准适用于浙江省境内生产、销售的蜂产品的质量安全监督抽查。2规范性引用文件wwW.bzxz.Net
DB33/T4362003
下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成切议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。
GB/T4789.2
GB/T4789.3
GB/T 4789.4
GB/T 4789.10
GB/T 4789.15
GB/T5009.12
GB/T14931.1
拉菌落总数测定
食品卫生微生物学检验
食品卫生微生物学检验大肠菌群测定食品卫生微生物学检验
沙门氏菌检验
食品卫生微生物学检验
食品卫生微生物学检验
食品中铅的测定方法
金黄色葡萄球菌检验
霉菌和酵母计数
蜂肉中土霉素、四环素、金霉素残留测定方法(高效液相色谱法)3抽检产品和检验项目
抽检产品和检验项目见表1
表1抽检产品和检验项目
样品名称
蜂王浆、蜂王浆冻干
氯霉素
检验项目
四环素族抗生素(mg/kg)
铅(mg/kg)
菌落总数(cfu/g)
大肠菌群(MPN/100g)
霉菌总数(cfu/g)
金黄色葡萄球菌
沙门氏菌
菌落总数(cfu/g)
大肠菌群(MPN/100g)
霉菌总数(cfu/g)
沙门氏菌
不得检出
≤1000
≤200
不得检出
不得检出
≤10000(蜂王浆)
≤1000(蜂王浆冻干粉)
不得检出
4检验方法
4.1菌落总数
金黄色葡萄球菌
铅(mg/kg)
氯霉素
按GB/T4789.2规定检验。
4.2大肠菌群
按GB4789.3规定检验。
4.3霉素总数
按GB/T4789.15规定检验。
4.4沙门氏菌
按GB4789.4规定检验。
4.5金黄色葡萄球菌
按GB/T4789.10规定检验。
4.6四环素
按GB/T14931.1规定检验。
4.7氯霉素
4.7.1按本标准附录A中方法2筛选。表1(续)
不得检出
不得检出
DB33/T4362003
4.7.1筛选结果为阳性的样品按本标准附录A中方法1的规定重新检验,结果判定以本次检验结果为准。
按GB/T5009.12规定检验。
5抽样方法
5,1组批产地检验以同一品种、同期加工、同一规格的蜂产品为一个抽样批次,市场抽检以同一产区、同一规格、同一销售单位的产品为一个抽样批次。5.2抽样
按农业部发布的《官方取样程序》执行。5.3注意事项
5.3.1抽样时抽样人员应认真填写《浙江省农产品质量监督检查抽样单》,样品一式二份,其中份用于检验,一份为备样。抽取的样品应立即用干净容器妥善保存,蜂蜜应保存于-10℃以下,蜂王浆样品于-18℃保存。
5.3.2抽样后应及时将样品送至相应的检验机构检验。5.3.3抽样单位或人员应采取必要的措施,保证送检样品满足检验需要。6判定原则
6.1氯霉素可按本标准规定用酶联免疫法筛选。筛选结果为阴性的,单项判定为合格,筛选结果为阳性的,必须按本标准规定的第二种方法重新检验,检验结果仍不合格的,单项判定为不合格:检验结果合格的,则单项判定合格。6.2按本标准检验,所有项目均符合标准要求,判定该批样品为合格;有一项或一项以上不符合4
标准要求的,判定该批样品不合格。7复检
DB33/T4362003
检验结果有异议时,可申请复检(微生物指标除外),微生物指标不予复检。复检申请向原检验机构提出。原检验机构应在三个工作日内做出受理或不受理决定。若受检方对不受理决定仍有异议的,可由受检单位向农产品质量安全监督检测协调会议办公室提出。不合格结果以检验结果通知书方式送达受检方。受检方应在收到不合格通知之日起三日内提出复检申请,逾期不予受理。
A.1使用范围
附录A
(规范性附录)
蜂蜜中氯霉素残留量检测方法
方法1HPLC-MS法
A.1.1本方法适用于检测蜂蜜中氯霉素残留量A.1.2检测限量0.3ug/kg(ppb)
A.1.3定量限量0.6ug/kg(ppb)A.1.4分析范围0.6-10ug/kg(ppb)A.2原理
A.2.1样品用水溶解后用乙酸乙酯提取震荡,离心。A.2.2蒸干乙酸乙酯,加水溶解。A.2.3提取物过C-18小柱净化。
A.2.4氯霉素和类标再用乙酸乙酯提取,并蒸干。A.2.5样品用25:75乙腈水溶解。A.2.6HPLC-MS检测。
A.3制样
称样品,充分混匀。
A.4仪器设备
A.4.1涡旋器
A.4.2试管(16mmX125mm)
A.4.3移液管(10uL-100uL:100U1-1000U1)A.4.4一次性聚脂离心管(50mL)A.4.5玻璃离心管(15mL)
A.4.6氮蒸干器,OrganomationN-Evap或等同品,A.4.7离心器,Mistral3000E或等同品。A.4.8WatersSep-PakPlusC-18
A.4.9注射性滤膜,GelmanAcrodiscPVDF0.45um滤膜(13mm)或等同品。A.4.10一次性注射器(3mL,10mL)A.4.l1SPE复合系统,SupelcoVisi-Prep或等同品。A.4.12Eberbach震荡器
A.4.13容积烧瓶,A级玻瑙(210.50.1000mL)A.4.142mL带帽小瓶
A.4.15HPLC系统
A.4.15.1带质谱选择器的HP1100HPLC系统或等同品。DB33/T436—2003
A.4.15.2柱:XterraRP18,150mmX2.1mmID(3.5um颗粒大小)(Waters)或等同品。A.4.15.3数据处理系统:化学处理站或等同品。A.5试剂
A.5.1水:所有用水均应用一类试剂级。(18M2-cm)A.5.2乙睛(D.I.G)
A.5.3冰醋酸(HPLC级)
DB33/T4362003
A.5.40.1%醋酸。在1000mL容积烧瓶中加入1.0mL的冰醋酸,然后加入MQ水至烧瓶容积。A.5.5乙酸乙酯(D.I.G)
A.5.6甲醇(HPLC级)
A.5.7淋洗液。水:乙腈(7:1)将140mL的水与20mL的乙睛混合。A.5.8洗脱液。水:乙腈(7:3)将140mL的水与60mL的乙腈混合。A.5.9溶解液。水:乙腈(75:25)将25mL的乙腈与75mL的水混合。A.5.10流动相25.0%乙,10.0%醋酸(0.1%)A.6标准品
A.6.1氯霉素(CAP)-Sigma
A..2m-氯霉素(m-CAP)-内标
A.6.3CAP储备液(1000ug/mL)。将25mg的氯霉素加入到25mL的容量瓶内,用甲醇定容。A.6.4CAP中间储备液(10ug/mL).将0.5mL的CAP中间储备液加入到50mL的容量瓶内,用甲醇定容、
A.6.5CAP工作标准液(1.Oug/mL)。将1mL的CAP中间储备液加入到10mL的容量瓶内,用甲醇定容。
A.6.6CAP工作标准液(0.1ug/mL)。将0.5ml的CAP中间储备液加入到50mL的容量瓶内,用甲醇定容。
A.6.7m-CAP储备液(100ug/mL)。称取5.Omg的m-CAP加入到50mL的容量瓶。用甲醇定容。A.6.8m-CAP标准液(2ng/uL)。用甲醇将1mL的m-CAP稀释到50mL。A.6.9矫正曲线的制备:用水稀释到最终的容积。标
CAP容积
A.7对照准备
CAP浓度
(ug/mL)
m-CAP容积
MeOH容积
终容积溶液浓度
(ng/mL)
蜂蜜中相
应浓度
(ng/g)
A.7.1加标(1/10样品)。重复样品用工作标准混合液确定。确定过程在方法中明确。回复率可从控制图中追溯到。
A.7.2平行样(1/10样品)。制平行样的过程在方法中明确。A.7.3试剂空白。空白样用于检测干扰因素。A.7.4检测限标准。在检测限的标准液用于测定灵敏度。A.8检测程序
A.8.1样品:蜂蜜
A.8.1.1未知:将准确称量的5g土0.05g的混匀蜂蜜加入到50mL的聚脂离心管内。A.8.1.2加标(每10个样品加一个):将准确称量的5g土0.05g的蜂蜜加入到50mL的聚脂离心7
管内。加标样品是加入50uL0.1ug/ml的工作标准液B(相当于样品中1ppb)DB33/T4362003
A.8.1.3平行样:将未知的混匀蜂蜜样制双份5g土0.05g,并加入到50mL的聚脂离心管内。A.8.1.4试剂空白:将4g士0.05g的蔗糖加入到50mL的聚脂离心管内。A.8.1.5检测限标准。将60uL0.1ug/mL的工作标准液,200uL的甲醇加入到2mL的容量瓶内,用水定容。相当于样品0.3ppb。A.8.2加入50uL的工作内标。
A.8.3加入5mL的水,震荡5分钟或直至蜂蜜溶解。A.8.4加入15mL乙酸乙脂,再次震荡5分钟。A.8.52500RPM离心5分钟。
A.8.6将乙酸乙脂转移至16mmX125mm的试管内。A.8.755°在N-Evap上将提取物蒸干。A.8.8将残渣在3mL的水中溶解并涡动。A.8.9用所附10mL注射器将提取物转移至预先准备好的C-18Sep-PakPlus小柱内。SPE小柱的调节:加入5mL甲醇,然后加入5mL水。(CCP1.调节后,注意在样品加入到SPE柱前不要让SPE小柱全干)。
A.8.10让提取物缓慢流过SPE柱。A.8.11用10mL水淋洗SPE小柱。
A.8.12用5mL水:乙晴7:1淋洗SPE小柱。A.8.13通过小柱吸入空气,干燥SPE小柱。A.8.14用5mL7:3水/乙睛洗脱amphenico1,并将15mL的洗脱液收集在离心管内。A.8.15用10mL乙酸乙酯提取洗脱液。A.8.16将乙酸乙酯转移至16mmX125mm的试管中。A.8.1755°在N-Evap上将提取物蒸于。A.8.18再次在试管内加入500uL75:25的水:乙睛,涡动30秒,溶解残渣。A.8.19通过0.45umPVDF滤膜,并转移至500uL的自动样品瓶。A.8.20HPLC系统条件:
流速:0.2mL/min.
时间:20分钟。
柱温:30°
注射容积:50uL
质谱仪检测参数:
电离模式:API-ESNegFragmentor:75干燥气体:10.0L/min
干燥气体温度:350°
A.9计算及结果解释
喷雾器压力:55psig
毛细管电压:4500V
A.9.1在标准分析的反应范围内:进行曲线矫正(手工或HPLC软件)。未知样品或加样的反应高度从曲线上查找。
A.9.2样品回收率计算:
回收率(%)=(S-U)*m/CstockX100S=加样样品中药品含量(ug/kg)U=空白样品中药物含量(ug/kg)m=加样样品的质量(g)
Cstock=药物储备液的近似浓度(0.1ug/mL)8
V=确定样品的药标体积
A.9.3确证:阳性样品需通过LC/MS/MS三次确证。DB33/T4362003
A.9.4控制样品及加样:如果加样或控制结果超出控制限,根据实验室规定,结果无效,需重新分析。
A.9.5线性回归系数:r≥0.995
A.10报告
A.10.1报告结果接近于0.1ug/kg(ppb)。A.10.2结果判断:如果结果低于检测限量,则视为未检出。方法2酶联免疫色谱法
A.11范围
本标准规定了用酶联免疫方法测定蜂密中氯霉素残留量的方法。本标准适用于天然或加工蜂蜜中氯霉素残留量的测定。A.12原理
测定的基础是抗原抗体反应。微孔板包被有针对免IgG9(氯霉素抗体)的羊抗体。加入氯霉素抗体,氯霉素标记物,氯霉素标准或样品溶液后,游离的氯霉素与氯霉素酶标记物竞争氯霉素抗体结合位点,同时氯霉素抗体与固定的羊抗体结合。没有结合的氯霉素标记物在洗涤步骤中被除去。将酶基质(过氧化)和发色剂(四甲基联苯胺)加到板孔中并且孵育。结合的氯霉素酶标记物将无色的发色剂转化为兰色的产物。加入反应终止液后使颜色由兰色转变为黄色。用酶标仪在450nm处测量,吸光度值与样品中的氯霉素浓度成反比。A.13试剂
A.13.1氯霉素残留测定试剂盒
A.13.2乙酸乙酯,(色谱纯)
A.13.3蒸馏水
A.14仪器
A.14.1BI0-RADMode1550微孔板酶标仪(450nm)A.14.2锣口瓶
A.14.3离心管25ml
A.14.4离心机
A.14.5单道进样器,20μ-100μ,50-200L,200-1000和八道加样器30-300μl
A.14.6加样槽
A.14.7液体混匀器
A.14.8恒温水浴槽
A.14.9氮气流
A.14.10电子天平0.001g
A.15操作步骤
A.15.1样品处理:
A.15.1.1称取2克蜂蜜样品于20m1离心管中,加入4m1水使之溶解。再加入4m1乙酸乙酯在液体混匀器上快速混匀2分钟。以4000转/分离心10分钟。9
DB33/T436—2003
A.15.1.2从离心管中,移取1m1上层的乙酸乙酯(相当于0.5克样品)于另一干净的试管中。A.15.1.3恒温水浴到60℃,用氮气流将乙酸乙酯吹干,残渣用0.5ml1缓冲液1溶解,取50uL样品测定。
A.15.2测定过程:
A.15.2.1将所有试剂及标本在开始实验前回到室温,取出实验所需数量的微孔板条(20℃-24℃,盒中试剂取出,放置盒外大约2个小时,确保回到室温)。以下操作必须在20℃-24℃下进行。
A.15.2.2制备标准应用液:50uL标准浓缩液(稀释前轻轻混勾)用450uL缓冲液稀释并混合均匀。(用玻璃瓶)氯霉素标记物,氯霉素抗体用缓冲液1:11稀释。A.15.2.3加入50uL稀释后的酶标记物,50uL标准液或样品溶液及50uL稀释后的抗体溶液到各自的微孔中,充分混合(轻轻震荡板并在桌面上做圆周运动),用薄膜覆盖在板上室温孵育2小时(注意加入抗体的过程中移液器管尖千万不要接触放进孔中的液体,避免交叉感染)。记录好标样或样品的位置,
A15.2.4倒出孔中液体,将微孔板架倒置在吸水纸上拍打(每行拍打3次)以保证完除去孔中的液体。用250uL去离子水充入孔中,再次倒掉微孔中液体,再重复操作2次。洗板后立即进行下一步操作不要让板孔干燥。A.15.2.5迅速加入50uL基质及50uL发色剂到每一个孔中(轻轻震荡板并在桌面上做圆周运动以混匀)。室温孵育30分钟,注意暗处避光放置。在孵育期间准备好反应停止液。A15.2.6每孔加入100μL反应停止正液,混匀。立即测量,如不能立即测量必须放置在暗处并于60分钟内450nm测量OD值。
A.16计算
按下面的公式计算。
标准的吸光度值(或样品)
0标准的吸光度值
%吸光度值
计算的标准值绘成为一个对应氯霉素浓度(ng/1)的半对数坐标系统曲线图,校正曲线在150ng/1-1350ng/1(ppt)范围内应当成为线性。对应样品的浓度可以从校正曲线上读出。样品中氯霉素的实际浓度=标准曲线读出的浓X稀释系数(1)注意测定的同一样品的吸光度值的差值应在0.1内。A.17特异性
试剂盒(R-Biopharm产品)的特异性:交叉反应:
氯霉素-
氯霉素碱
甲霉素
与四环素,庆大霉素,氨比西林无交叉反应。-100%
试剂盒提供的交叉反应的数据证明该试剂盒对氯霉素残留有很高的特异性。A.18检测限
该试剂盒的检出限为0.15ppb
A.19试剂空白
不称量样品,其它按6操作,测定值吸光度为零乙酸乙酯未吹干会导致本底值高。DB33/T436—2003
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
备案号:14147-2003
方标准
DB33/T436-2003
蜂产品质量安全监督抽查
检验细则
Test regulation on quality safety supervision of honey products2003-08-12发布
2003-08-15实施
浙江省质量技术监督局发布
DB33/T436—2003
为保障人民群众身体健康,全面推进“无公害农产品行动计划”,保证蜂产品质量安全指导有关检验机构进行蜂产品质量安全监督抽查检验工作,特制定本检验细则,作为组织监督抽查的依据。
本标准之附录A为规范性附录。
本标准所列的检验项目与法律、法规、规章有不一致时,应以法律、法规、规章的规定为准。
本标准由浙江省农产品质量安全监督检测协调会议办公室提出。本标准起草单位:浙江省畜产品质量安全检测中心。本标准主要起草人:陈慧华、屈健、施杏芬、汪刚、陈勇2
1范围
蜂产品质量安全监督抽查检验细则本标准规定了蜂产品的检验项目、检验方法、抽样方法及判定原则。本标准适用于浙江省境内生产、销售的蜂产品的质量安全监督抽查。2规范性引用文件wwW.bzxz.Net
DB33/T4362003
下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成切议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。
GB/T4789.2
GB/T4789.3
GB/T 4789.4
GB/T 4789.10
GB/T 4789.15
GB/T5009.12
GB/T14931.1
拉菌落总数测定
食品卫生微生物学检验
食品卫生微生物学检验大肠菌群测定食品卫生微生物学检验
沙门氏菌检验
食品卫生微生物学检验
食品卫生微生物学检验
食品中铅的测定方法
金黄色葡萄球菌检验
霉菌和酵母计数
蜂肉中土霉素、四环素、金霉素残留测定方法(高效液相色谱法)3抽检产品和检验项目
抽检产品和检验项目见表1
表1抽检产品和检验项目
样品名称
蜂王浆、蜂王浆冻干
氯霉素
检验项目
四环素族抗生素(mg/kg)
铅(mg/kg)
菌落总数(cfu/g)
大肠菌群(MPN/100g)
霉菌总数(cfu/g)
金黄色葡萄球菌
沙门氏菌
菌落总数(cfu/g)
大肠菌群(MPN/100g)
霉菌总数(cfu/g)
沙门氏菌
不得检出
≤1000
≤200
不得检出
不得检出
≤10000(蜂王浆)
≤1000(蜂王浆冻干粉)
不得检出
4检验方法
4.1菌落总数
金黄色葡萄球菌
铅(mg/kg)
氯霉素
按GB/T4789.2规定检验。
4.2大肠菌群
按GB4789.3规定检验。
4.3霉素总数
按GB/T4789.15规定检验。
4.4沙门氏菌
按GB4789.4规定检验。
4.5金黄色葡萄球菌
按GB/T4789.10规定检验。
4.6四环素
按GB/T14931.1规定检验。
4.7氯霉素
4.7.1按本标准附录A中方法2筛选。表1(续)
不得检出
不得检出
DB33/T4362003
4.7.1筛选结果为阳性的样品按本标准附录A中方法1的规定重新检验,结果判定以本次检验结果为准。
按GB/T5009.12规定检验。
5抽样方法
5,1组批产地检验以同一品种、同期加工、同一规格的蜂产品为一个抽样批次,市场抽检以同一产区、同一规格、同一销售单位的产品为一个抽样批次。5.2抽样
按农业部发布的《官方取样程序》执行。5.3注意事项
5.3.1抽样时抽样人员应认真填写《浙江省农产品质量监督检查抽样单》,样品一式二份,其中份用于检验,一份为备样。抽取的样品应立即用干净容器妥善保存,蜂蜜应保存于-10℃以下,蜂王浆样品于-18℃保存。
5.3.2抽样后应及时将样品送至相应的检验机构检验。5.3.3抽样单位或人员应采取必要的措施,保证送检样品满足检验需要。6判定原则
6.1氯霉素可按本标准规定用酶联免疫法筛选。筛选结果为阴性的,单项判定为合格,筛选结果为阳性的,必须按本标准规定的第二种方法重新检验,检验结果仍不合格的,单项判定为不合格:检验结果合格的,则单项判定合格。6.2按本标准检验,所有项目均符合标准要求,判定该批样品为合格;有一项或一项以上不符合4
标准要求的,判定该批样品不合格。7复检
DB33/T4362003
检验结果有异议时,可申请复检(微生物指标除外),微生物指标不予复检。复检申请向原检验机构提出。原检验机构应在三个工作日内做出受理或不受理决定。若受检方对不受理决定仍有异议的,可由受检单位向农产品质量安全监督检测协调会议办公室提出。不合格结果以检验结果通知书方式送达受检方。受检方应在收到不合格通知之日起三日内提出复检申请,逾期不予受理。
A.1使用范围
附录A
(规范性附录)
蜂蜜中氯霉素残留量检测方法
方法1HPLC-MS法
A.1.1本方法适用于检测蜂蜜中氯霉素残留量A.1.2检测限量0.3ug/kg(ppb)
A.1.3定量限量0.6ug/kg(ppb)A.1.4分析范围0.6-10ug/kg(ppb)A.2原理
A.2.1样品用水溶解后用乙酸乙酯提取震荡,离心。A.2.2蒸干乙酸乙酯,加水溶解。A.2.3提取物过C-18小柱净化。
A.2.4氯霉素和类标再用乙酸乙酯提取,并蒸干。A.2.5样品用25:75乙腈水溶解。A.2.6HPLC-MS检测。
A.3制样
称样品,充分混匀。
A.4仪器设备
A.4.1涡旋器
A.4.2试管(16mmX125mm)
A.4.3移液管(10uL-100uL:100U1-1000U1)A.4.4一次性聚脂离心管(50mL)A.4.5玻璃离心管(15mL)
A.4.6氮蒸干器,OrganomationN-Evap或等同品,A.4.7离心器,Mistral3000E或等同品。A.4.8WatersSep-PakPlusC-18
A.4.9注射性滤膜,GelmanAcrodiscPVDF0.45um滤膜(13mm)或等同品。A.4.10一次性注射器(3mL,10mL)A.4.l1SPE复合系统,SupelcoVisi-Prep或等同品。A.4.12Eberbach震荡器
A.4.13容积烧瓶,A级玻瑙(210.50.1000mL)A.4.142mL带帽小瓶
A.4.15HPLC系统
A.4.15.1带质谱选择器的HP1100HPLC系统或等同品。DB33/T436—2003
A.4.15.2柱:XterraRP18,150mmX2.1mmID(3.5um颗粒大小)(Waters)或等同品。A.4.15.3数据处理系统:化学处理站或等同品。A.5试剂
A.5.1水:所有用水均应用一类试剂级。(18M2-cm)A.5.2乙睛(D.I.G)
A.5.3冰醋酸(HPLC级)
DB33/T4362003
A.5.40.1%醋酸。在1000mL容积烧瓶中加入1.0mL的冰醋酸,然后加入MQ水至烧瓶容积。A.5.5乙酸乙酯(D.I.G)
A.5.6甲醇(HPLC级)
A.5.7淋洗液。水:乙腈(7:1)将140mL的水与20mL的乙睛混合。A.5.8洗脱液。水:乙腈(7:3)将140mL的水与60mL的乙腈混合。A.5.9溶解液。水:乙腈(75:25)将25mL的乙腈与75mL的水混合。A.5.10流动相25.0%乙,10.0%醋酸(0.1%)A.6标准品
A.6.1氯霉素(CAP)-Sigma
A..2m-氯霉素(m-CAP)-内标
A.6.3CAP储备液(1000ug/mL)。将25mg的氯霉素加入到25mL的容量瓶内,用甲醇定容。A.6.4CAP中间储备液(10ug/mL).将0.5mL的CAP中间储备液加入到50mL的容量瓶内,用甲醇定容、
A.6.5CAP工作标准液(1.Oug/mL)。将1mL的CAP中间储备液加入到10mL的容量瓶内,用甲醇定容。
A.6.6CAP工作标准液(0.1ug/mL)。将0.5ml的CAP中间储备液加入到50mL的容量瓶内,用甲醇定容。
A.6.7m-CAP储备液(100ug/mL)。称取5.Omg的m-CAP加入到50mL的容量瓶。用甲醇定容。A.6.8m-CAP标准液(2ng/uL)。用甲醇将1mL的m-CAP稀释到50mL。A.6.9矫正曲线的制备:用水稀释到最终的容积。标
CAP容积
A.7对照准备
CAP浓度
(ug/mL)
m-CAP容积
MeOH容积
终容积溶液浓度
(ng/mL)
蜂蜜中相
应浓度
(ng/g)
A.7.1加标(1/10样品)。重复样品用工作标准混合液确定。确定过程在方法中明确。回复率可从控制图中追溯到。
A.7.2平行样(1/10样品)。制平行样的过程在方法中明确。A.7.3试剂空白。空白样用于检测干扰因素。A.7.4检测限标准。在检测限的标准液用于测定灵敏度。A.8检测程序
A.8.1样品:蜂蜜
A.8.1.1未知:将准确称量的5g土0.05g的混匀蜂蜜加入到50mL的聚脂离心管内。A.8.1.2加标(每10个样品加一个):将准确称量的5g土0.05g的蜂蜜加入到50mL的聚脂离心7
管内。加标样品是加入50uL0.1ug/ml的工作标准液B(相当于样品中1ppb)DB33/T4362003
A.8.1.3平行样:将未知的混匀蜂蜜样制双份5g土0.05g,并加入到50mL的聚脂离心管内。A.8.1.4试剂空白:将4g士0.05g的蔗糖加入到50mL的聚脂离心管内。A.8.1.5检测限标准。将60uL0.1ug/mL的工作标准液,200uL的甲醇加入到2mL的容量瓶内,用水定容。相当于样品0.3ppb。A.8.2加入50uL的工作内标。
A.8.3加入5mL的水,震荡5分钟或直至蜂蜜溶解。A.8.4加入15mL乙酸乙脂,再次震荡5分钟。A.8.52500RPM离心5分钟。
A.8.6将乙酸乙脂转移至16mmX125mm的试管内。A.8.755°在N-Evap上将提取物蒸干。A.8.8将残渣在3mL的水中溶解并涡动。A.8.9用所附10mL注射器将提取物转移至预先准备好的C-18Sep-PakPlus小柱内。SPE小柱的调节:加入5mL甲醇,然后加入5mL水。(CCP1.调节后,注意在样品加入到SPE柱前不要让SPE小柱全干)。
A.8.10让提取物缓慢流过SPE柱。A.8.11用10mL水淋洗SPE小柱。
A.8.12用5mL水:乙晴7:1淋洗SPE小柱。A.8.13通过小柱吸入空气,干燥SPE小柱。A.8.14用5mL7:3水/乙睛洗脱amphenico1,并将15mL的洗脱液收集在离心管内。A.8.15用10mL乙酸乙酯提取洗脱液。A.8.16将乙酸乙酯转移至16mmX125mm的试管中。A.8.1755°在N-Evap上将提取物蒸于。A.8.18再次在试管内加入500uL75:25的水:乙睛,涡动30秒,溶解残渣。A.8.19通过0.45umPVDF滤膜,并转移至500uL的自动样品瓶。A.8.20HPLC系统条件:
流速:0.2mL/min.
时间:20分钟。
柱温:30°
注射容积:50uL
质谱仪检测参数:
电离模式:API-ESNegFragmentor:75干燥气体:10.0L/min
干燥气体温度:350°
A.9计算及结果解释
喷雾器压力:55psig
毛细管电压:4500V
A.9.1在标准分析的反应范围内:进行曲线矫正(手工或HPLC软件)。未知样品或加样的反应高度从曲线上查找。
A.9.2样品回收率计算:
回收率(%)=(S-U)*m/CstockX100S=加样样品中药品含量(ug/kg)U=空白样品中药物含量(ug/kg)m=加样样品的质量(g)
Cstock=药物储备液的近似浓度(0.1ug/mL)8
V=确定样品的药标体积
A.9.3确证:阳性样品需通过LC/MS/MS三次确证。DB33/T4362003
A.9.4控制样品及加样:如果加样或控制结果超出控制限,根据实验室规定,结果无效,需重新分析。
A.9.5线性回归系数:r≥0.995
A.10报告
A.10.1报告结果接近于0.1ug/kg(ppb)。A.10.2结果判断:如果结果低于检测限量,则视为未检出。方法2酶联免疫色谱法
A.11范围
本标准规定了用酶联免疫方法测定蜂密中氯霉素残留量的方法。本标准适用于天然或加工蜂蜜中氯霉素残留量的测定。A.12原理
测定的基础是抗原抗体反应。微孔板包被有针对免IgG9(氯霉素抗体)的羊抗体。加入氯霉素抗体,氯霉素标记物,氯霉素标准或样品溶液后,游离的氯霉素与氯霉素酶标记物竞争氯霉素抗体结合位点,同时氯霉素抗体与固定的羊抗体结合。没有结合的氯霉素标记物在洗涤步骤中被除去。将酶基质(过氧化)和发色剂(四甲基联苯胺)加到板孔中并且孵育。结合的氯霉素酶标记物将无色的发色剂转化为兰色的产物。加入反应终止液后使颜色由兰色转变为黄色。用酶标仪在450nm处测量,吸光度值与样品中的氯霉素浓度成反比。A.13试剂
A.13.1氯霉素残留测定试剂盒
A.13.2乙酸乙酯,(色谱纯)
A.13.3蒸馏水
A.14仪器
A.14.1BI0-RADMode1550微孔板酶标仪(450nm)A.14.2锣口瓶
A.14.3离心管25ml
A.14.4离心机
A.14.5单道进样器,20μ-100μ,50-200L,200-1000和八道加样器30-300μl
A.14.6加样槽
A.14.7液体混匀器
A.14.8恒温水浴槽
A.14.9氮气流
A.14.10电子天平0.001g
A.15操作步骤
A.15.1样品处理:
A.15.1.1称取2克蜂蜜样品于20m1离心管中,加入4m1水使之溶解。再加入4m1乙酸乙酯在液体混匀器上快速混匀2分钟。以4000转/分离心10分钟。9
DB33/T436—2003
A.15.1.2从离心管中,移取1m1上层的乙酸乙酯(相当于0.5克样品)于另一干净的试管中。A.15.1.3恒温水浴到60℃,用氮气流将乙酸乙酯吹干,残渣用0.5ml1缓冲液1溶解,取50uL样品测定。
A.15.2测定过程:
A.15.2.1将所有试剂及标本在开始实验前回到室温,取出实验所需数量的微孔板条(20℃-24℃,盒中试剂取出,放置盒外大约2个小时,确保回到室温)。以下操作必须在20℃-24℃下进行。
A.15.2.2制备标准应用液:50uL标准浓缩液(稀释前轻轻混勾)用450uL缓冲液稀释并混合均匀。(用玻璃瓶)氯霉素标记物,氯霉素抗体用缓冲液1:11稀释。A.15.2.3加入50uL稀释后的酶标记物,50uL标准液或样品溶液及50uL稀释后的抗体溶液到各自的微孔中,充分混合(轻轻震荡板并在桌面上做圆周运动),用薄膜覆盖在板上室温孵育2小时(注意加入抗体的过程中移液器管尖千万不要接触放进孔中的液体,避免交叉感染)。记录好标样或样品的位置,
A15.2.4倒出孔中液体,将微孔板架倒置在吸水纸上拍打(每行拍打3次)以保证完除去孔中的液体。用250uL去离子水充入孔中,再次倒掉微孔中液体,再重复操作2次。洗板后立即进行下一步操作不要让板孔干燥。A.15.2.5迅速加入50uL基质及50uL发色剂到每一个孔中(轻轻震荡板并在桌面上做圆周运动以混匀)。室温孵育30分钟,注意暗处避光放置。在孵育期间准备好反应停止液。A15.2.6每孔加入100μL反应停止正液,混匀。立即测量,如不能立即测量必须放置在暗处并于60分钟内450nm测量OD值。
A.16计算
按下面的公式计算。
标准的吸光度值(或样品)
0标准的吸光度值
%吸光度值
计算的标准值绘成为一个对应氯霉素浓度(ng/1)的半对数坐标系统曲线图,校正曲线在150ng/1-1350ng/1(ppt)范围内应当成为线性。对应样品的浓度可以从校正曲线上读出。样品中氯霉素的实际浓度=标准曲线读出的浓X稀释系数(1)注意测定的同一样品的吸光度值的差值应在0.1内。A.17特异性
试剂盒(R-Biopharm产品)的特异性:交叉反应:
氯霉素-
氯霉素碱
甲霉素
与四环素,庆大霉素,氨比西林无交叉反应。-100%
试剂盒提供的交叉反应的数据证明该试剂盒对氯霉素残留有很高的特异性。A.18检测限
该试剂盒的检出限为0.15ppb
A.19试剂空白
不称量样品,其它按6操作,测定值吸光度为零乙酸乙酯未吹干会导致本底值高。DB33/T436—2003
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。