WS/T 406-2012
基本信息
标准号: WS/T 406-2012
中文名称:临床血液学检验常规项目分析质量要求
标准类别:卫生行业标准(WS)
标准状态:现行
出版语种:简体中文
下载格式:.rar .pdf
下载大小:2595KB

标准分类号
关联标准
出版信息
相关单位信息
标准简介
WS/T 406-2012 临床血液学检验常规项目分析质量要求
WS/T406-2012
标准压缩包解压密码:www.bzxz.net
标准图片预览




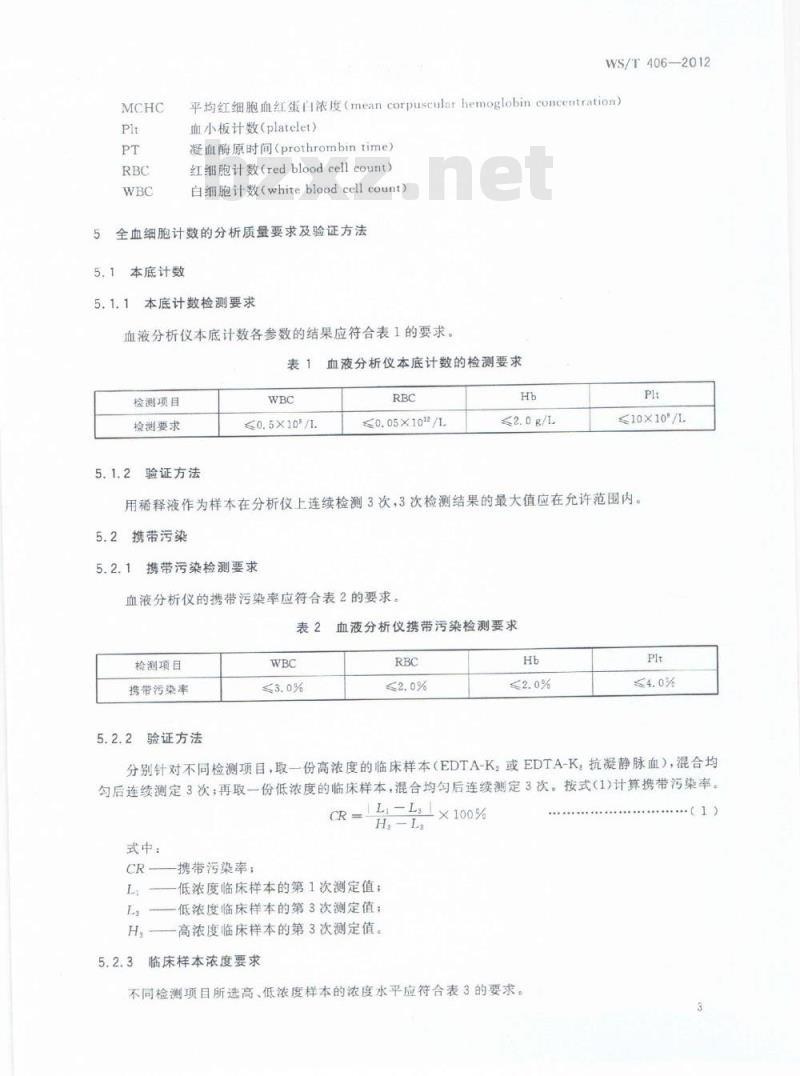
标准内容
ICS11.100
中华人民共和国卫生行业标准
WS/T406—2012
临床血液学检验常规项目分析质量要求Analytical quality specifications for routine tests in clinical hematology2012-12-25发布
中华人民共和国卫生部
2013-08-01实施
本标准按照GB/T1.1—2009给出的规则起草本标准由卫生部临床检验标准专业委员会提出。本标准起草单位:卫生部临床检验中心、四川大学华西医院、北京协和医院。本标准起草人:彭明婷、周文宾、谷小林、李臣宾、吴际、陆红、江虹、李建英。TrKAoNhrKAca
WS/T406—2012
1范围
临床血液学检验常规项目分析质量要求WS/T406-2012
本标准规定了临床血液学检验常规项目(全血细胞计数和凝血试验)的分析质量要求及验证方法。本标准适用于使用血液分析仪和血凝仪的临床实验室、室间质量评价机构或体外诊断企业的内部质量控制、外部质量评价及检测系统的性能验证。2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。WS/T407医疗机构内定量检验结果的可比性验证指南WS/T408临床化学设备线性评价指南CLSIEP9-A2用患者样本进行方法学比对及偏倚评估:批准指南一第二版(Methodcomparisonand bias estimation using patient samples:Approved guideline-Second edition)3术语和定义
下列术语和定义适用于本文件。3.1
血液分析仪hematologyanalyzer血细胞分析仪
主要用于检测血液样本,能对血液中的有形成分进行定性、定量分析,并提供相关信息的仪器。血凝仪coagulationanalyzer
血液凝固分析仪
检测凝血功能相关参数的分析仪器。3.3
验证verification
提供客观证据以认定规定要求得到满足。3.4
carryover
携带污染
由测量系统将一个检测样品反应携带到另一个检测样品反应的分析物不连续的量,由此错误地影响了另一个检测样品的表现量。3.5
precision
精密度
在规定的条件下,独立检测结果间的一致程度,精密度的度量通常以不精密度表示。不精密度imprecision
同一实验室用同种方法在多次独立检测中分析同一样品所得结果的离散程度。WS/T406—2012
批内精密度within-run precision在相同的检测条件下,对同一被测物进行连续测量所得结果间的一致程度。注:批内精密度又称为重复性,3.8
inter-dayprecision
日间精密度
在不同天内对同一被测物进行重复测量所得结果间的一致程度。3.9
linearity
检测样本时,在一定范围内可以直接按比例关系得出分析物含量的能力。3.10
正确度
trueness
系列检测结果的均值与靶值之间的一致程度,以偏倚表示。3.11
偏倚bias
同一实验室用同种方法在多次独立检测中分析同一样品所得结果的均值与靶值之间的差异。注1:靶值可以是参考方法测定值、有证标准物质定值或其他适当定值,如室间质量评价计划的统计值。注2:偏倚一般通过分析有证标准物质及其他适当参考物质、与参考方法或已知准确度的其他方法(如公认的指定比对方法)比对而获得。
注3:偏倚可用绝对值或相对值表示。注4:偏倚有方向性,即可能是正偏倚或负偏倚。3.12
准确度
accuracy
单次检测结果与参考值间的一致程度,以误差表示。3.13
totalerror
总误差
实验室用某方法在多次独立检测中分析某样品所得各个结果值与靶值之差在一定置信区间内的最大允许范围。
可比性
comparability
使用不同的检测程序测定某种分析物获得的检测结果间的一致性。结果间的差异不超过规定的可接受标准时,可认为结果具有可比性。缩略语
下列缩略语适用于本文件。
活化部分凝血活酶时间(activatedpartialthromboplastintime)美国临床和实验室标准协会(ClinicalandLaboratoryStandardsInstitute)纤维蛋白原测定(fibrinogen)血红蛋白测定(hemoglobin)
血细胞比容测定(hematocrit)平均红细胞容积(meancorpuscularvolume)平均红细胞血红蛋白含量(meancorpuscularhemoglobin)iKAoNiKAca
WS/T406-2012
平均红细胞血红蛋白浓度(meancorpuscularhemoglobinconcentration)血小板计数(platelet)
凝血酶原时间(prothrombintime)红细胞计数(redbloodcell count)白细胞计数(whitebloodcellcount)全血细胞计数的分析质量要求及验证方法5
本底计数
5.1.1本底计数检测要求
血液分析仪本底计数各参数的结果应符合表1的要求。表1血液分析仪本底计数的检测要求检测项目
检测要求
5.1.2验证方法
≤0.5×10/
≤0.05×1012/1
≤2.0g/L
≤10×10%/
用稀释液作为样本在分析仪上连续检测3次,3次检测结果的最大值应在允许范围内。5.2携带污染
携带污染检测要求
血液分析仪的携带污染率应符合表2的要求。2血液分析仪携带污染检测要求
检测项目
携带污染率
5.2.2验证方法
分别针对不同检测项目,取一份高浓度的临床样本(EDTA-K,或EDTA-K,抗凝静脉血),混合均匀后连续测定3次:再取一份低浓度的临床样本,混合均勾后连续测定3次。按式(1)计算携带污染率。CR=二×100%
式中:
携带污染率:
低浓度临床样本的第1次测定值;低浓度临床样本的第3次测定值;一高浓度临床样本的第3次测定值。临床样本浓度要求
不同检测项目所选高、低浓度样本的浓度水平应符合表3的要求。....1)
WS/T406-2012
检测项目
高浓度值
低浓度值
5.3批内精密度
表3携带污染率验证样本的浓度要求WBC
>90×10°/L
>0~<3×10/L
批内精密度检测要求
>6.20×10/l
>0~<150×10/L
>0~<50g/
>900X10\/L
>0~<30×10°/L
批内精密度以连续检测结果的变异系数为评价指标,批内精密度应达到厂家说明书的要求,检测正常浓度水平新鲜血的批内精密度至少应符合表4的要求。表4批内精密度检测要求
检测项目
2验证方法
检测范围
4.0×10/l~10.0×10*/L
3.5×1012/l.~5.5×101%/L
110g/l.~160g/L
35%~55%
100×10%/L~300×10°/L
80ff.~100fL
27pg~34pg
320g/L~360g/L.
变异系数
取一份浓度水平在上述检测范围内的临床样本,按常规方法重复检测11次,计算后10次检测结果的算术平均值和标准差,按照式(2)计算变异系数。CV=
式中:
变异系数:
标准差;
算数平均值。
日间精密度
日间精密度检测要求
=×100%
日间精密度以室内质控在控结果的变异系数为评价指标,日间精密度应符合表5的要求。4
HTKAoNrKAca-
检测项目
变异系数
验证方法
日间精密度检测要求
WS/T406-2012
至少使用两个浓度水平(包含正常和异常水平)的质控品,在检测当天至少进行一次室内质控,别除失控数据(失控结果已得到纠正)后按批号或者月份计算在控数据的变异系数。5.5线性
5.5.1线性验证检测要求
线性回归方程的斜率在1士0.05范围内,相关系数r≥0.975或r≥0.95。WBC、RBC、Hb和Plt项目满足要求的线性范围在厂家说明书规定的范围内。5.5.2
验证方法
验证方法按照WS/T408的要求进行。5.6正确度
5.6.1偏倚
正确度验证以偏倚为评价指标,偏倚应符合表6的要求。6正确度验证的允许偏倚
检测项目
验证方法
至少使用10份检测结果在参考区间内的新鲜血样本,每份样本检测两次,计算20次以上检测结果的均值,以校准实验室的定值或临床实验室内部规范操作检测系统(如使用配套试剂、用配套校准物定期进行仪器校准、仪器性能良好、规范地开展室内质量控制、参加室间质量评价成绩优良、检测程序规范、人员经过良好培训的检测系统)的测定均值为标准,计算偏倚。5.7不同吸样模式的结果可比性
适用条件
使用不同吸样模式检测样本并报告结果时。5.7.2
可比性要求
同一台血液分析仪不同吸样模式的结果可比性应符合表7的要求,WS/T406—2012
检测项目
相对差异
3验证方法
表7血液分析仪不同吸样模式的结果可比性要求RBC
每次校准后,取5份临床样本分别使用不同模式进行检测,每份样本各检测两次,分别计算两种模式下检测结果均值间的相对差异,结果应符合表7的要求。5.8实验室内的结果可比性
5.8.1偏差
实验室内的结果可比性以相对偏差为评价指标,相对偏差应符合表8的要求。5.8.2验证方法
5.8.2.1新仪器使用前,配套检测系统至少使用20份临床样本(浓度要求见表8),每份样本分别使用临床实验室内部规范操作检测系统和被比对仪器进行检测,以内部规范操作检测系统的测定结果为标准,计算相对偏差,每个检测项目的相对偏差符合表8要求的比例应≥80%。5.8.2.2新仪器使用前,非配套检测系统按CLSI颁布的EP9-A2文件与配套检测系统进行比对,至少使用40份临床样本(浓度要求见表8),计算相对偏差,每个检测项目的相对偏差符合表8要求的比例应≥80%。然后再按5.8.2.1的方法进行验证。5.8.2.3常规检测仪器使用过程中,至少使用20份临床样本(血细胞计数项目所选标本的浓度水平应符合表8的要求,其他检测项目所选标本应含正常、异常浓度水平各占50%;比对可分次进行)定期(至少半年)进行一次结果比对,每个检测项目的相对偏差符合表8要求的比例应≥80%。5.8.2.4以下情况,可按WS/T407的方法和要求进行比对:a)
室内质控结果有漂移趋势时;
室间质评结果不合格,采取纠正措施后;更换试剂批号(必要时);
更换重要部件或重大维修后;
软件程序变更后;
临床医生对结果的可比性有疑问时;患者投诉对结果可比性有疑问(需要确认时);需要提高周期性比对频率时(如每季度或每月一次)。表8可比性验证的允许偏差及比对样本的浓度要求检测项目
X10°/L
浓度范围
11.1~50.0
样本数量所占比例
相对偏差
检测项目
X10°%/L
注:“一”表示对该项目无要求。5.9准确度
总误差
浓度范围
3.00~4.00
4.01~5.00
5.01~6.00
100~120
121~160
161~180
40~125
126~300
301500
500~600
表8(续)
样本数量所古比例
WS/T406—2012
相对偏差bzxZ.net
准确度验证以总误差为评价指标,用相对偏差表示,相对偏差应符合表9的要求。表9
检测项目
相对偏差
2验证方法
准确度验证的允许偏差
至少使用5份质评物或定值临床样本分别进行单次检测,计算每份样本检测结果与靶值(公议值或参考值)的相对偏差,每个检测项目的相对偏差符合表9要求的比例应≥80%。WS/T406—2012
6凝血试验的分析质量要求及验证方法批内精密度
6.1.1批内精密度检测要求
批内精密度以连续检测结果的变异系数为评价指标,凝血试验的批内精密度应符合表10的要求。表10
检测项目
正常样本
变异系数
异常样本
凝血试验批内精密度检测要求
·异常样本的浓度水平要求大于仪器检测结果参考区间中位值的2倍。Fib异常样本的浓度要求大于6g/L或小于1.5g/L.APTT
6.1.2验证方法
取3个浓度水平(包含位于正常、中度异常和高度异常)的临床样本(枸橡酸钠抗凝血浆)或质控品各一支,每支样本按常规方法重复检测11次,计算后10次检测结果的算术平均值和标准差·按照式(2)计算变异系数。
6.2日间精密度
日间精密度检测要求
日间精密度以室内质控在控结果的变异系数为评价指标,日间精密度应符合表11的要求。表11
检测项目
正常样本
变异系数
异常样本
凝血试验的日间精密度检测要求PT
6.2.2验证方法
至少使用两个浓度水平(包含正常和异常水平)的质控品,在检测当天至少进行一次室内质控,别除失控数据后(失控结果已得到纠正)按批号或者月份计算在控数据的变异系数6.3线性
6.3.1线性验证检测要求
线性回归方程的斜率在1士0.05范围内,相关系数r≥0.975或≥0.95。Fib项目满足要求的线性范围在厂家说明书规定的范围内。6.3.2验证方法
验证方法按照WS/T408的要求进行。8
6.4正确度
6.4.1偏倚
正确度验证结果以偏倚为评价指标,Fib的偏倚应≤10%。6.4.2
验证方法
WS/T406-2012
至少使用10份检测结果在参考区间范围内的临床样本,每份样本检测两次,计算20次以上检测结果的均值,以校准实验室的定值或临床实验室内部规范操作检测系统(Clauss法)的测定均值为标准,计算偏倚。
准确度
6.5.1误差
准确度验证以总误差为评价指标,用相对偏差表示,相对偏差应符合表12的要求。表12
检测项目
相对偏差
验证方法
准确度验证的允许偏差
至少使用5份质评物或定值临床样本分别进行单次检测,计算每份样本检测结果与靶值(公议值或参考值)的相对偏差,每个检测项目的相对偏差符合表12要求的比例应≥80%。WS/T406-2012
参考文献
[1] CLSI.H26-A2 Validation,Verification,and Quality Assurance of Automated Hematology.Analyzers;Approved Standard-Second Edition.CLSI document.Wayne,Pa,Clinical and LaboratoryStandardsInstitute;2o1o.
E2JCLSI,H57-AProtocol for the Evaluation,Validation,and Implementation of Coagulometers;Approved Guideline,CLSI document.Wayne,Pa.:Clinical andLaboratory Standards Institute2oo8.[3]CLSI:EP15-A2User Verification of Performance for Precision and Trueness;ApprovedGuideline-Second Edition, CLSI document.Wayne,Pa.:Clinical and Laboratory Standards Institute;2006.
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
中华人民共和国卫生行业标准
WS/T406—2012
临床血液学检验常规项目分析质量要求Analytical quality specifications for routine tests in clinical hematology2012-12-25发布
中华人民共和国卫生部
2013-08-01实施
本标准按照GB/T1.1—2009给出的规则起草本标准由卫生部临床检验标准专业委员会提出。本标准起草单位:卫生部临床检验中心、四川大学华西医院、北京协和医院。本标准起草人:彭明婷、周文宾、谷小林、李臣宾、吴际、陆红、江虹、李建英。TrKAoNhrKAca
WS/T406—2012
1范围
临床血液学检验常规项目分析质量要求WS/T406-2012
本标准规定了临床血液学检验常规项目(全血细胞计数和凝血试验)的分析质量要求及验证方法。本标准适用于使用血液分析仪和血凝仪的临床实验室、室间质量评价机构或体外诊断企业的内部质量控制、外部质量评价及检测系统的性能验证。2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。WS/T407医疗机构内定量检验结果的可比性验证指南WS/T408临床化学设备线性评价指南CLSIEP9-A2用患者样本进行方法学比对及偏倚评估:批准指南一第二版(Methodcomparisonand bias estimation using patient samples:Approved guideline-Second edition)3术语和定义
下列术语和定义适用于本文件。3.1
血液分析仪hematologyanalyzer血细胞分析仪
主要用于检测血液样本,能对血液中的有形成分进行定性、定量分析,并提供相关信息的仪器。血凝仪coagulationanalyzer
血液凝固分析仪
检测凝血功能相关参数的分析仪器。3.3
验证verification
提供客观证据以认定规定要求得到满足。3.4
carryover
携带污染
由测量系统将一个检测样品反应携带到另一个检测样品反应的分析物不连续的量,由此错误地影响了另一个检测样品的表现量。3.5
precision
精密度
在规定的条件下,独立检测结果间的一致程度,精密度的度量通常以不精密度表示。不精密度imprecision
同一实验室用同种方法在多次独立检测中分析同一样品所得结果的离散程度。WS/T406—2012
批内精密度within-run precision在相同的检测条件下,对同一被测物进行连续测量所得结果间的一致程度。注:批内精密度又称为重复性,3.8
inter-dayprecision
日间精密度
在不同天内对同一被测物进行重复测量所得结果间的一致程度。3.9
linearity
检测样本时,在一定范围内可以直接按比例关系得出分析物含量的能力。3.10
正确度
trueness
系列检测结果的均值与靶值之间的一致程度,以偏倚表示。3.11
偏倚bias
同一实验室用同种方法在多次独立检测中分析同一样品所得结果的均值与靶值之间的差异。注1:靶值可以是参考方法测定值、有证标准物质定值或其他适当定值,如室间质量评价计划的统计值。注2:偏倚一般通过分析有证标准物质及其他适当参考物质、与参考方法或已知准确度的其他方法(如公认的指定比对方法)比对而获得。
注3:偏倚可用绝对值或相对值表示。注4:偏倚有方向性,即可能是正偏倚或负偏倚。3.12
准确度
accuracy
单次检测结果与参考值间的一致程度,以误差表示。3.13
totalerror
总误差
实验室用某方法在多次独立检测中分析某样品所得各个结果值与靶值之差在一定置信区间内的最大允许范围。
可比性
comparability
使用不同的检测程序测定某种分析物获得的检测结果间的一致性。结果间的差异不超过规定的可接受标准时,可认为结果具有可比性。缩略语
下列缩略语适用于本文件。
活化部分凝血活酶时间(activatedpartialthromboplastintime)美国临床和实验室标准协会(ClinicalandLaboratoryStandardsInstitute)纤维蛋白原测定(fibrinogen)血红蛋白测定(hemoglobin)
血细胞比容测定(hematocrit)平均红细胞容积(meancorpuscularvolume)平均红细胞血红蛋白含量(meancorpuscularhemoglobin)iKAoNiKAca
WS/T406-2012
平均红细胞血红蛋白浓度(meancorpuscularhemoglobinconcentration)血小板计数(platelet)
凝血酶原时间(prothrombintime)红细胞计数(redbloodcell count)白细胞计数(whitebloodcellcount)全血细胞计数的分析质量要求及验证方法5
本底计数
5.1.1本底计数检测要求
血液分析仪本底计数各参数的结果应符合表1的要求。表1血液分析仪本底计数的检测要求检测项目
检测要求
5.1.2验证方法
≤0.5×10/
≤0.05×1012/1
≤2.0g/L
≤10×10%/
用稀释液作为样本在分析仪上连续检测3次,3次检测结果的最大值应在允许范围内。5.2携带污染
携带污染检测要求
血液分析仪的携带污染率应符合表2的要求。2血液分析仪携带污染检测要求
检测项目
携带污染率
5.2.2验证方法
分别针对不同检测项目,取一份高浓度的临床样本(EDTA-K,或EDTA-K,抗凝静脉血),混合均匀后连续测定3次:再取一份低浓度的临床样本,混合均勾后连续测定3次。按式(1)计算携带污染率。CR=二×100%
式中:
携带污染率:
低浓度临床样本的第1次测定值;低浓度临床样本的第3次测定值;一高浓度临床样本的第3次测定值。临床样本浓度要求
不同检测项目所选高、低浓度样本的浓度水平应符合表3的要求。....1)
WS/T406-2012
检测项目
高浓度值
低浓度值
5.3批内精密度
表3携带污染率验证样本的浓度要求WBC
>90×10°/L
>0~<3×10/L
批内精密度检测要求
>6.20×10/l
>0~<150×10/L
>0~<50g/
>900X10\/L
>0~<30×10°/L
批内精密度以连续检测结果的变异系数为评价指标,批内精密度应达到厂家说明书的要求,检测正常浓度水平新鲜血的批内精密度至少应符合表4的要求。表4批内精密度检测要求
检测项目
2验证方法
检测范围
4.0×10/l~10.0×10*/L
3.5×1012/l.~5.5×101%/L
110g/l.~160g/L
35%~55%
100×10%/L~300×10°/L
80ff.~100fL
27pg~34pg
320g/L~360g/L.
变异系数
取一份浓度水平在上述检测范围内的临床样本,按常规方法重复检测11次,计算后10次检测结果的算术平均值和标准差,按照式(2)计算变异系数。CV=
式中:
变异系数:
标准差;
算数平均值。
日间精密度
日间精密度检测要求
=×100%
日间精密度以室内质控在控结果的变异系数为评价指标,日间精密度应符合表5的要求。4
HTKAoNrKAca-
检测项目
变异系数
验证方法
日间精密度检测要求
WS/T406-2012
至少使用两个浓度水平(包含正常和异常水平)的质控品,在检测当天至少进行一次室内质控,别除失控数据(失控结果已得到纠正)后按批号或者月份计算在控数据的变异系数。5.5线性
5.5.1线性验证检测要求
线性回归方程的斜率在1士0.05范围内,相关系数r≥0.975或r≥0.95。WBC、RBC、Hb和Plt项目满足要求的线性范围在厂家说明书规定的范围内。5.5.2
验证方法
验证方法按照WS/T408的要求进行。5.6正确度
5.6.1偏倚
正确度验证以偏倚为评价指标,偏倚应符合表6的要求。6正确度验证的允许偏倚
检测项目
验证方法
至少使用10份检测结果在参考区间内的新鲜血样本,每份样本检测两次,计算20次以上检测结果的均值,以校准实验室的定值或临床实验室内部规范操作检测系统(如使用配套试剂、用配套校准物定期进行仪器校准、仪器性能良好、规范地开展室内质量控制、参加室间质量评价成绩优良、检测程序规范、人员经过良好培训的检测系统)的测定均值为标准,计算偏倚。5.7不同吸样模式的结果可比性
适用条件
使用不同吸样模式检测样本并报告结果时。5.7.2
可比性要求
同一台血液分析仪不同吸样模式的结果可比性应符合表7的要求,WS/T406—2012
检测项目
相对差异
3验证方法
表7血液分析仪不同吸样模式的结果可比性要求RBC
每次校准后,取5份临床样本分别使用不同模式进行检测,每份样本各检测两次,分别计算两种模式下检测结果均值间的相对差异,结果应符合表7的要求。5.8实验室内的结果可比性
5.8.1偏差
实验室内的结果可比性以相对偏差为评价指标,相对偏差应符合表8的要求。5.8.2验证方法
5.8.2.1新仪器使用前,配套检测系统至少使用20份临床样本(浓度要求见表8),每份样本分别使用临床实验室内部规范操作检测系统和被比对仪器进行检测,以内部规范操作检测系统的测定结果为标准,计算相对偏差,每个检测项目的相对偏差符合表8要求的比例应≥80%。5.8.2.2新仪器使用前,非配套检测系统按CLSI颁布的EP9-A2文件与配套检测系统进行比对,至少使用40份临床样本(浓度要求见表8),计算相对偏差,每个检测项目的相对偏差符合表8要求的比例应≥80%。然后再按5.8.2.1的方法进行验证。5.8.2.3常规检测仪器使用过程中,至少使用20份临床样本(血细胞计数项目所选标本的浓度水平应符合表8的要求,其他检测项目所选标本应含正常、异常浓度水平各占50%;比对可分次进行)定期(至少半年)进行一次结果比对,每个检测项目的相对偏差符合表8要求的比例应≥80%。5.8.2.4以下情况,可按WS/T407的方法和要求进行比对:a)
室内质控结果有漂移趋势时;
室间质评结果不合格,采取纠正措施后;更换试剂批号(必要时);
更换重要部件或重大维修后;
软件程序变更后;
临床医生对结果的可比性有疑问时;患者投诉对结果可比性有疑问(需要确认时);需要提高周期性比对频率时(如每季度或每月一次)。表8可比性验证的允许偏差及比对样本的浓度要求检测项目
X10°/L
浓度范围
11.1~50.0
样本数量所占比例
相对偏差
检测项目
X10°%/L
注:“一”表示对该项目无要求。5.9准确度
总误差
浓度范围
3.00~4.00
4.01~5.00
5.01~6.00
100~120
121~160
161~180
40~125
126~300
301500
500~600
表8(续)
样本数量所古比例
WS/T406—2012
相对偏差bzxZ.net
准确度验证以总误差为评价指标,用相对偏差表示,相对偏差应符合表9的要求。表9
检测项目
相对偏差
2验证方法
准确度验证的允许偏差
至少使用5份质评物或定值临床样本分别进行单次检测,计算每份样本检测结果与靶值(公议值或参考值)的相对偏差,每个检测项目的相对偏差符合表9要求的比例应≥80%。WS/T406—2012
6凝血试验的分析质量要求及验证方法批内精密度
6.1.1批内精密度检测要求
批内精密度以连续检测结果的变异系数为评价指标,凝血试验的批内精密度应符合表10的要求。表10
检测项目
正常样本
变异系数
异常样本
凝血试验批内精密度检测要求
·异常样本的浓度水平要求大于仪器检测结果参考区间中位值的2倍。Fib异常样本的浓度要求大于6g/L或小于1.5g/L.APTT
6.1.2验证方法
取3个浓度水平(包含位于正常、中度异常和高度异常)的临床样本(枸橡酸钠抗凝血浆)或质控品各一支,每支样本按常规方法重复检测11次,计算后10次检测结果的算术平均值和标准差·按照式(2)计算变异系数。
6.2日间精密度
日间精密度检测要求
日间精密度以室内质控在控结果的变异系数为评价指标,日间精密度应符合表11的要求。表11
检测项目
正常样本
变异系数
异常样本
凝血试验的日间精密度检测要求PT
6.2.2验证方法
至少使用两个浓度水平(包含正常和异常水平)的质控品,在检测当天至少进行一次室内质控,别除失控数据后(失控结果已得到纠正)按批号或者月份计算在控数据的变异系数6.3线性
6.3.1线性验证检测要求
线性回归方程的斜率在1士0.05范围内,相关系数r≥0.975或≥0.95。Fib项目满足要求的线性范围在厂家说明书规定的范围内。6.3.2验证方法
验证方法按照WS/T408的要求进行。8
6.4正确度
6.4.1偏倚
正确度验证结果以偏倚为评价指标,Fib的偏倚应≤10%。6.4.2
验证方法
WS/T406-2012
至少使用10份检测结果在参考区间范围内的临床样本,每份样本检测两次,计算20次以上检测结果的均值,以校准实验室的定值或临床实验室内部规范操作检测系统(Clauss法)的测定均值为标准,计算偏倚。
准确度
6.5.1误差
准确度验证以总误差为评价指标,用相对偏差表示,相对偏差应符合表12的要求。表12
检测项目
相对偏差
验证方法
准确度验证的允许偏差
至少使用5份质评物或定值临床样本分别进行单次检测,计算每份样本检测结果与靶值(公议值或参考值)的相对偏差,每个检测项目的相对偏差符合表12要求的比例应≥80%。WS/T406-2012
参考文献
[1] CLSI.H26-A2 Validation,Verification,and Quality Assurance of Automated Hematology.Analyzers;Approved Standard-Second Edition.CLSI document.Wayne,Pa,Clinical and LaboratoryStandardsInstitute;2o1o.
E2JCLSI,H57-AProtocol for the Evaluation,Validation,and Implementation of Coagulometers;Approved Guideline,CLSI document.Wayne,Pa.:Clinical andLaboratory Standards Institute2oo8.[3]CLSI:EP15-A2User Verification of Performance for Precision and Trueness;ApprovedGuideline-Second Edition, CLSI document.Wayne,Pa.:Clinical and Laboratory Standards Institute;2006.
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。