DBS22 027-2014
基本信息
标准号: DBS22 027-2014
中文名称:食品安全地方标准 食品中肠球菌的定性定量检验
标准类别:地方标准(DB)
标准状态:现行
出版语种:简体中文
下载格式:.rar .pdf
下载大小:407KB

标准分类号
关联标准
出版信息
相关单位信息
标准简介
DBS22 027-2014 食品安全地方标准 食品中肠球菌的定性定量检验
DBS22027-2014
标准压缩包解压密码:www.bzxz.net
标准图片预览




标准内容
吉林省地
DBS22/027—2014
食品安全地方标准
食品中肠球菌的定性定量检验
2014-07-30发布
吉林省卫生和计划生育委员会
2014-08-30实施
1范围
吉林省食品安全地方标准
食品中肠球菌的定性定量检验
本标准规定了食品中肠球菌(Enterococcus)的检验方法。本标准适用于食品中肠球菌的定性定量检验2术语和定义
肠球菌(Enterococcus)
DBS22/027—2014
类革兰氏阳性球菌,兼性厌氧,无芽胞和荚膜,可分解胆汁七叶苷。是评估食品、水、食品加工设备、食品生产环境等卫生状况的指标菌之一。3设备与材料
除微生物实验室常规灭菌与培养设备外,其他设备与材料如下:3.1冰箱:0℃~4℃。
3.2恒温培养箱:36℃±2℃、45℃±2℃。3.3显微镜:10×~100×。
3.4全自动细菌生化鉴定系统。
3.5均质器。
3.6过滤装置:抽滤瓶、真空泵和耐高温处理的过滤器。3.7天平:感量0.1g。
3.8酒精灯和接种环。
3.9无菌剪刀、勺子、镊子。
3.10无菌均质袋、均质杯或灭菌乳钵。滤膜:直径47mm,微孔径0.45mm土0.02mm。3.11
无菌试管:18mm×180mm、15mm×100mm及相应的试管架,3.12
无菌吸管:1mL(具0.01mL刻度)、10mL具0.1mL刻度)。3.13
无菌锥形瓶:容量500mL。
无菌培养皿:直径90mm。
4培养基和试剂免费标准下载网bzxz
4.1叠氮化钠葡萄糖肉汤:按附录中A.1。4.2肠球菌肉汤:按附录中A.2。4.3KF链球菌琼脂:按附录中A.3。4.4肠球菌琼脂(胆汁七叶苷叠氮钠琼脂):按附录中A.4。胆汁七叶苷琼脂(BEA琼脂):按附录中A.5。4.5
6脑心浸液肉汤(BHIB):按附录中A.6。4.6
DBS22/027-2014
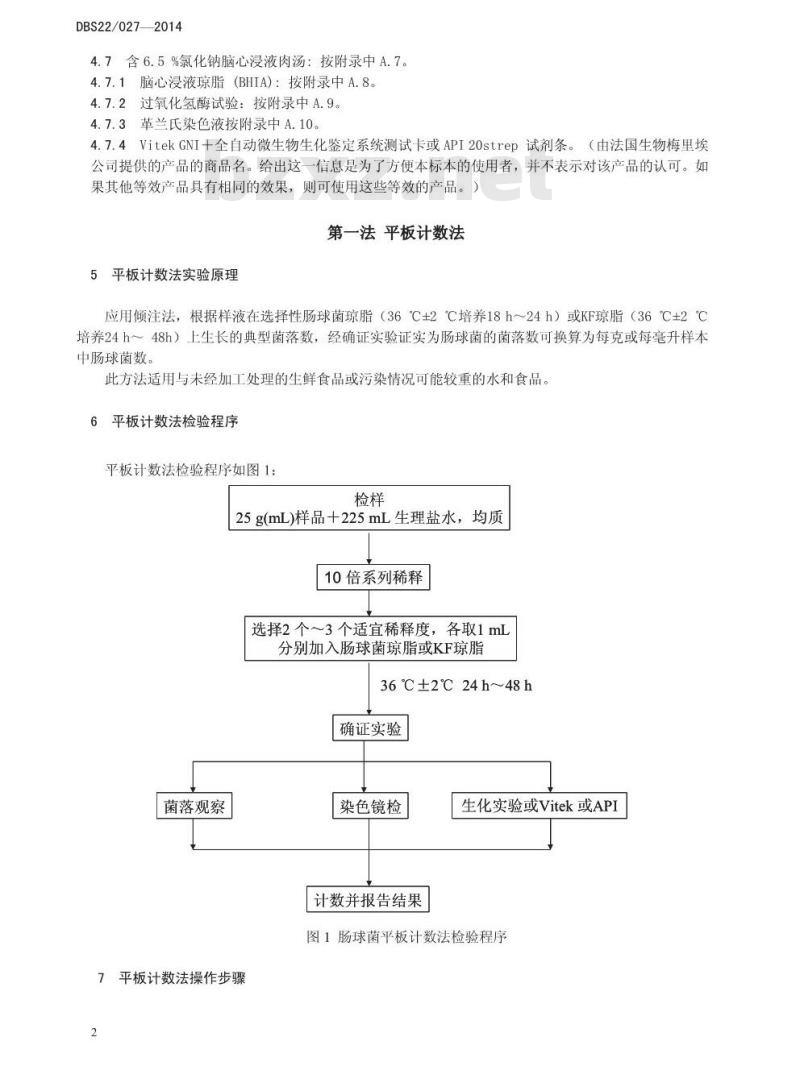
4.7含6.5%氯化钠脑心浸液肉汤:按附录中A.7。4.7.1脑心浸液琼脂(BHIA):按附录中A.8。4.7.2过氧化氢酶试验:按附录中A.9。4.7.3革兰氏染色液按附录中A.10。4.7.4VitekGNI十全自动微生物生化鉴定系统测试卡或API20strep试剂条。(由法国生物梅里埃公司提供的产品的商品名。给出这一信息是为了方便本标本的使用者,并不表示对该产品的认可。如果其他等效产品具有相同的效果,则可使用这些等效的产品。)第一法平板计数法
5平板计数法实验原理
应用倾注法,根据样液在选择性肠球菌琼脂(36℃±2℃培养18h~24h)或KF琼脂(36℃±2℃培养24h~48h)上生长的典型菌落数,经确证实验证实为肠球菌的菌落数可换算为每克或每毫升样本中肠球菌数。
此方法适用与未经加工处理的生鲜食品或污染情况可能较重的水和食品。6平板计数法检验程序
平板计数法检验程序如图1:
25g(mL)样品十225mL生理盐水,均质10倍系列稀释
选择2个~3个适宜稀释度,各取1mL分别加入肠球菌琼脂或KF琼脂
36℃±2℃24h~48h
确证实验
菌落观察
平板计数法操作步骤
染色镜检
计数并报告结果
生化实验或Vitek或API
图1肠球菌平板计数法检验程序
7.1样品保存
DBS22/027—2014
采样后应尽快进行检验,若不能及时检验,应放于18℃左右保存;非冷冻而易腐的样品应尽可能及时检验。若不能及时检验,应冷藏保存的待检样品在运送实验室后应1℃~4℃冰箱保存。样品采集后8h内要完成检验。
7.2样品处理
7.2.1固态样品:以无菌操作称取25g检样,放入含有225mL灭菌生理盐水的无菌均质杯或均质袋或灭菌乳钵中,使用旋转刀片式均质器均质(8001000r/min)2min或拍击式均质器均质2min或充分研磨做成1:10稀释液。
7.2.2液态样品:以无菌操作量取25mL检样,放入含有225mL灭菌生理盐水的无菌均质杯或均质袋中,振荡混匀。
7.2.3样品稀释:取1:10稀释液1mL加到含有9mL无菌生理盐水的稀释瓶中,充分混匀制成1:100的稀释液。根据对样品的污染状况的估计,依次制成十倍递增稀释样品匀液。每递增稀释1次,换用1支1mL无菌吸管或吸头。
7.3定量检测
7.3.1接种和培养
根据样品的污染程度估计,选择2个~3个连续的适宜稀释度的稀释液各1mL加入无菌培养皿内,每个稀释度做2个平皿。把融化45℃±1℃的肠球菌琼脂或KF琼脂12mL~15mL倾入培养血内,转动平板充分混合,水平放置,使琼脂凝固。可在凝固后的琼脂表面覆盖一薄层肠球菌琼脂或KF琼脂(约4mL),凝固后翻转平板。肠球菌琼脂置于36℃±2C培养18h~24h:KF平板置于36C±2C培养24h~48h。同时分别取1mL空白稀释液加入两个无菌平血内作空白对照。7.3.2典型菌落观察
在肠球菌琼脂平板上形成带棕色环的棕黑色菌落;在KF平板上形成暗红色至粉红色菌落,边缘整齐,用无菌接种针从每个肠球菌琼脂平板或KF平板挑取5个典型菌落,进一步做确证实验7.3.3革兰氏染色镜检
在肠球菌琼脂平板或KF平板上挑取典型菌落作革兰民染色镜检,鉴定为革兰氏阳性球菌。7.3.4确证实验
7.3.4.1纯培养
将肠球菌琼脂平板或KF平板上的革兰氏阳性球菌的典型菌落分别接种到脑心浸液肉汤(BHIB)和葡萄糖琼脂斜面或脑心浸液琼脂(BHIA)斜面。BHIB肉汤置于36℃±2℃培养24h,葡萄糖琼脂斜面和BHIA斜面置于36℃±2℃培养24h48h。7.3.4.2生化实验
将培养后的BHIB肉汤或斜面分别接种到胆汁七叶苷琼脂(BEA)平板和含6.5%氯化钠的BHIB肉汤,置于36℃±2℃培养24h~48h,观察细菌生长情况。如果BEA平板上生长并水解七叶苷(形成黑色或棕色沉淀),6.5%氯化钠的BHIB肉汤中36℃±2℃培养24h~48h生长良好,则可确证为肠球菌。也可以采用API试剂条或Vitek鉴定试卡进行生化鉴定8平板计数法结果计算
DBS22/027-2014
选择有典型肠球菌菌落的平板,且同一稀释度2个平板所有菌落数合计在20CFU~200CFU之间,计数典型菌落数。如果:
a)只有一个稀释度的平板菌落数在20CFU~200CFU之间且有典型菌落,计数该稀释度平板上的典型菌落;
所有稀释度的平板菌落数均小于20CFU且有典型菌落,应计数最低稀释度平板上的典型菌落:某一稀释度的平板菌落数大于200CFU且有典型菌落,但下一稀释度平板上没有典型菌落,应c)
计数该稀释度平板上的典型菌落;d)
若所有稀释度的平板菌落数大于200CFU目有典型菌落,应计数最高稀释度平板上的典型菌落:
若所有稀释度的平板菌落数均不在20CFU~200CFU之间且有典型菌落,其中一部分小于20e
CFU或大于200CFU时,应计数最接近20CFU或200CFU的稀释度平板上的典型菌落。以上情况按公式(1)计算。
公式(1):T=-
式中:
一样品中肠球菌菌落数:
-某一稀释度肠球菌典型菌落的总数:B
-鉴定结果为肠球菌的菌落数:
-用于肠球菌鉴定的菌落数;
稀释因子。
f)若2个连续稀释度的平板菌落数均在20CFU~200CFU之间,按公式(2)计算公式(2):
式中:
样品中肠球菌的菌落数;
第一稀释度(低稀释倍数)肠球菌典型菌落的总数第二稀释度(高稀释倍数)肠球菌典型菌落的总数:第一稀释度(低稀释倍数)鉴定结果为肠球菌的菌落数:第二稀释度(高稀释倍数)鉴定结果为肠球菌的菌落数:第一稀释度(低稀释倍数)用于肠球菌鉴定的菌落数:第二稀释度(高稀释倍数)用于肠球菌鉴定的菌落数;-计算系数(如果第二稀释度肠球菌鉴定结果为0,计算系数采用1):1.1
稀释因子(第一稀释度)。
9平板计数法结果报告
根据样品的取样量和稀释度,按7中公式计算,报告样品中肠球菌的菌落数,以CFU/g(mL)表示:如T值为0,则以小于1乘以最低稀释倍数报告。第二法肠球菌的MPN计数法
10MPN计数法实验原理
DBS22/027—2014
应用MPN9管法,选择三个适宜的连续稀释度的样液接种于叠氮化钠葡萄糖肉汤和肠球菌肉汤,进行选择性增菌,经确证实验证明含有肠球菌的对应管计为阳性管,查MPN表,计数并报告每克或每毫升样品中肠球菌的MPN值。
此方法适用于污染程度较低的样品。11MPN计数法的检验程序
MPN计数法的检验程序见图2
25g(mL)样品+225mL生理盐水,均质10倍系列稀释
选择3个连续的适宜稀释度,每个稀释度各取1mL分别接种于3管叠氮化钠葡萄糖肉汤或肠球菌肉汤,共9管36℃±2℃或45℃±2℃
24h~48h
变黑或混浊
确证实验
菌落观察
12MPN计数法操作步骤
12.1样品保存与处理
同6.1和6.2。
12.2样品接种与培养
染色镜检
查MPN表
报告结果
不变黑或无混浊
肠球菌阴性
生化实验或Vitek或API
图2肠球菌MPN计数法的检验程序根据样品污染情况的估计,选择适宜的3个连续稀释度,每一稀释度分别接种3管叠氮化钠葡萄糖肉汤或肠球菌肉汤,每管接种1ml样液(如接种样液量超过1ml.则应接种于双料叠氮化钠葡萄糖肉汤活或双料SF肉汤管中),混匀,共9管。叠氮化钠葡萄糖肉汤置于36℃±1℃培养18h~24h,检查各试管混5
DBS22/027—2014
浊情况;肠球菌肉汤置于36℃±1℃培养24h~48h;肉眼观察颜色变为黑色或混浊的试管,表明有肠球菌生长。
12.3接种选择性平板
对所有呈现混浊的叠氮化钠葡萄糖肉汤或颜色变为黑色的肠球菌肉汤进行确证试验。用接种环将各管的培养物划线接种于肠球菌琼脂平板或KF琼脂平板。肠球菌琼脂平板置于36℃±1℃培养18h~24h;KF琼脂平板置于36℃±1℃培养24h~48h。12.4典型菌落观察与确证实验
肠球菌在肠球菌琼脂平板上形成带棕色环的棕黑色菌落;在KF平板上形成暗红色至粉红色菌落,边缘整齐。用无菌接种针从每个肠球菌琼脂平板或KF平板至少挑取5个典型菌落。按6.3.3和6.3.4所述做进一步的确证实验。可以采用API试剂条或Vitek试卡进行生化鉴定。3MPN计数法结果计算
如一管培养物中所挑取的典型菌落中,有一个确认为肠球菌,则该管应视为阳性。根据样品接种量、稀释倍数以及确证阳性的反应管数,查MPN值表(参见附录B),得出样品中肠球菌最近似值。14MPN计数法结果报告
报告样品中肠球菌的MPN值,以MPN/g(mL)表示。第三法肠球菌的滤膜检测法
15滤膜检测法实验原理
将滤膜置于选择性培养基上增养时,肠球菌菌落呈现特异的颜色。经过肠球菌确证实验之后,计数并计算滤膜上确证肠球菌菌落的数量,即可计算出样品中肠球菌的数量。本方法适用于水和液体样品中肠球菌的检验。滤膜检测法操作程序
滤膜检测法的操作程序见图3
25mL样品+十225mL生理盐水
10倍系列稀释
选择2个~3个适宜稀释度,取适量样液用灭菌滤膜过滤紧贴在肠球菌琼脂或KF琼脂表面36℃±2℃48h
确证实验
菌落观察
17滤膜检测法操作步骤
17.1样品保存
同6.1。
17.2样品处理
染色镜检
计数并报告结果
DBS22/027—2014
生化实验或Vitek或API
图3肠球菌的滤膜检测法操作程序17.2.1污染程度低的水或其他液体样品可直接进行检验。17.2.2污染程度较高的水或其他液体样品可吸取25mL放入含有225mL灭菌生理盐水中,制成1:10稀释液。取1:10稀释液25mL加到含有225mL无菌生理盐水的稀释瓶中,充分混匀制成1:100的稀释液。根据对样品的污染状况的估计,依次制成十倍递增稀释样品匀液。根据样品的污染程度,取不同稀释度的样液的量为100mL。
17.3样液过滤、接种与培养
每个样品至少选择三个连续的适宜稀释度的样液进行过滤(接种样液量应在这交代吧?)。将灭菌后的过滤器与抽滤瓶进行连接,用无菌镊子夹取无菌滤膜,将滤膜放在滤器底部。无菌吸取待过滤样液加入过滤器,打开真空泵进行抽滤。当全部样液通过滤膜后,用20mL灭菌生理盐水轻洗过滤器边缘至少两次。关闭真空泵,打开滤器,用无菌镊子移取滤膜,将滤膜紧贴在肠球菌琼脂或KF琼脂培养基表面上,避免出现气泡。倒置平板置于36℃±2℃培养24h~48h。17.4典型菌落观察和确证实验
DBS22/027—2014
肠球菌在肠球菌琼脂平板滤膜上形成带棕色环的棕黑色菌落;在KF平板滤膜上形成暗红色至粉红色菌落。用无菌接种针从滤膜上至少挑取10个典型菌落进行确证实验。按6.3.3和6.3.4所述进行进一步的确证实验。
滤膜检测法结果计算
对确证生长肠球菌菌落的滤膜进行菌落计数,选择生长有20个~100个肠球菌的滤膜,计数滤膜上的菌落数。具体公式如下:以上按公式(1)计算。T
公式(1):2
式中:
.....++..
T样品中肠球菌菌落数:
A某一稀释度的滤膜上生长的肠球菌典型菌落的总数;B鉴定结果为肠球菌的菌落数;
C用于肠球菌鉴定的菌落数;
d稀释因子。
滤膜检测法结果报告
根据样品稀释情况,计算出样品中的肠球菌菌数,以CFU/100mL表示叠氮化钠葡萄糖肉汤培养基
A.1.1成分
牛肉浸膏
胰蛋白陈
葡萄糖
叠氮化钠
蒸馏水
1000mL
附录A
(资料性附录)
培养基配制与生化试验
DBS22/027—2014
将上述各成分混匀,不断搅拌加热溶解。每管分装10mL,121℃高压灭菌15min调整pH7.2±0.2。若制备双料浓度的叠氮化钠葡萄糖肉汤,可将上述配方蒸馏水改为500mL。A.2
肠球菌肉汤培养基
A.2.1成分
胰蛋白陈
牛肉浸膏
酵母浸膏
牛胆粉
氯化钠
柠檬酸钠
七叶苷
柠檬酸铁铵
叠氮化钠
蒸馏水
2制法
1000mL
将上述各成分加热煮沸溶解冷却后,调节pH7.2±0.2,分装,121℃高压灭菌15min,备用。A.3
KF链球菌琼脂培养基
A.3.1成分
蛋白陈
叠氮钠
酵母浸膏
溴甲酚紫(也可不加)
DBS22/027-2014
氯化钠
甘油磷酸钠
蒸馏水
麦芽糖
1000mL
1%2,3,5一氯化三苯基四氮唑(TTC)水溶液10.0mL乳糖
A.3.2制法
将上述各成分(TTC水溶液除外)加热溶解于蒸馏水中,煮沸5min,121℃高压灭菌15min;1)
冷却至50℃~60℃时,加入已灭菌的1%TTC水溶液,每100ml加1ml,混匀,调整pH7.2±0.2(3)倾注无菌平血中、冷却待用。A.4肠球菌琼脂(胆汁七叶苷叠氮钠琼脂)培养基A.4.1成分
胰蛋白陈
牛肉浸膏
酵母浸膏
牛胆粉
氯化钠
柠檬酸钠
七叶苷
柠檬酸铁铵
叠氮化钠
蒸馏水
A.4.2制法
1000mL
将上述各成分加热煮沸溶解冷却后,121℃高压灭菌15min,调节pH7.2±0.2,分装,于45℃~50℃倾注平板备用。
胆汁七叶苷琼脂培养基
A.5.1成分
蛋白陈
柠檬酸铁
蒸馏水
A.5.2制法
1000mL
将上述各成分加入蒸馏水中,缓慢加热使溶解,分装试管,每管5mI,高压灭菌121℃15min,做成斜面.在冰箱中(4℃~8℃)保存。10
6脑心浸液肉汤(BHIB)培养基
A.6.1成分
牛脑浸出粉
牛心浸出粉
胰蛋白陈
葡萄糖
氯化钠
磷酸氢二钠
蒸馏水
1000mL
DBS22/027—2014
将各成分加入蒸馏水中,加热溶解,调整pH7.2±0.2,分装,高压灭菌121℃15min。、含6.5%氯化钠脑心肉汤培养基A
A.7.1成分
牛脑浸出粉
牛心浸出粉
胰蛋白陈
葡萄糖
氯化钠
磷酸氢二钠
氯化钠
蒸馏水
2制法
1000mL
将各成分加入蒸馏水中,加热溶解,调整pH7.2±0.2,分装,高压灭菌121℃15min。A.8
(BHIA)培养基
脑心浸液琼脂
A.8.1成分
牛脑浸出粉
牛心浸出粉
胰蛋白陈
葡萄糖
氯化钠
磷酸氢二钠
蒸馏水
2制法
1000mL
将各成分加入蒸馏水中,加热溶解,调整pH7.2±0.2,高压灭菌121℃15min。11
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
DBS22/027—2014
食品安全地方标准
食品中肠球菌的定性定量检验
2014-07-30发布
吉林省卫生和计划生育委员会
2014-08-30实施
1范围
吉林省食品安全地方标准
食品中肠球菌的定性定量检验
本标准规定了食品中肠球菌(Enterococcus)的检验方法。本标准适用于食品中肠球菌的定性定量检验2术语和定义
肠球菌(Enterococcus)
DBS22/027—2014
类革兰氏阳性球菌,兼性厌氧,无芽胞和荚膜,可分解胆汁七叶苷。是评估食品、水、食品加工设备、食品生产环境等卫生状况的指标菌之一。3设备与材料
除微生物实验室常规灭菌与培养设备外,其他设备与材料如下:3.1冰箱:0℃~4℃。
3.2恒温培养箱:36℃±2℃、45℃±2℃。3.3显微镜:10×~100×。
3.4全自动细菌生化鉴定系统。
3.5均质器。
3.6过滤装置:抽滤瓶、真空泵和耐高温处理的过滤器。3.7天平:感量0.1g。
3.8酒精灯和接种环。
3.9无菌剪刀、勺子、镊子。
3.10无菌均质袋、均质杯或灭菌乳钵。滤膜:直径47mm,微孔径0.45mm土0.02mm。3.11
无菌试管:18mm×180mm、15mm×100mm及相应的试管架,3.12
无菌吸管:1mL(具0.01mL刻度)、10mL具0.1mL刻度)。3.13
无菌锥形瓶:容量500mL。
无菌培养皿:直径90mm。
4培养基和试剂免费标准下载网bzxz
4.1叠氮化钠葡萄糖肉汤:按附录中A.1。4.2肠球菌肉汤:按附录中A.2。4.3KF链球菌琼脂:按附录中A.3。4.4肠球菌琼脂(胆汁七叶苷叠氮钠琼脂):按附录中A.4。胆汁七叶苷琼脂(BEA琼脂):按附录中A.5。4.5
6脑心浸液肉汤(BHIB):按附录中A.6。4.6
DBS22/027-2014
4.7含6.5%氯化钠脑心浸液肉汤:按附录中A.7。4.7.1脑心浸液琼脂(BHIA):按附录中A.8。4.7.2过氧化氢酶试验:按附录中A.9。4.7.3革兰氏染色液按附录中A.10。4.7.4VitekGNI十全自动微生物生化鉴定系统测试卡或API20strep试剂条。(由法国生物梅里埃公司提供的产品的商品名。给出这一信息是为了方便本标本的使用者,并不表示对该产品的认可。如果其他等效产品具有相同的效果,则可使用这些等效的产品。)第一法平板计数法
5平板计数法实验原理
应用倾注法,根据样液在选择性肠球菌琼脂(36℃±2℃培养18h~24h)或KF琼脂(36℃±2℃培养24h~48h)上生长的典型菌落数,经确证实验证实为肠球菌的菌落数可换算为每克或每毫升样本中肠球菌数。
此方法适用与未经加工处理的生鲜食品或污染情况可能较重的水和食品。6平板计数法检验程序
平板计数法检验程序如图1:
25g(mL)样品十225mL生理盐水,均质10倍系列稀释
选择2个~3个适宜稀释度,各取1mL分别加入肠球菌琼脂或KF琼脂
36℃±2℃24h~48h
确证实验
菌落观察
平板计数法操作步骤
染色镜检
计数并报告结果
生化实验或Vitek或API
图1肠球菌平板计数法检验程序
7.1样品保存
DBS22/027—2014
采样后应尽快进行检验,若不能及时检验,应放于18℃左右保存;非冷冻而易腐的样品应尽可能及时检验。若不能及时检验,应冷藏保存的待检样品在运送实验室后应1℃~4℃冰箱保存。样品采集后8h内要完成检验。
7.2样品处理
7.2.1固态样品:以无菌操作称取25g检样,放入含有225mL灭菌生理盐水的无菌均质杯或均质袋或灭菌乳钵中,使用旋转刀片式均质器均质(8001000r/min)2min或拍击式均质器均质2min或充分研磨做成1:10稀释液。
7.2.2液态样品:以无菌操作量取25mL检样,放入含有225mL灭菌生理盐水的无菌均质杯或均质袋中,振荡混匀。
7.2.3样品稀释:取1:10稀释液1mL加到含有9mL无菌生理盐水的稀释瓶中,充分混匀制成1:100的稀释液。根据对样品的污染状况的估计,依次制成十倍递增稀释样品匀液。每递增稀释1次,换用1支1mL无菌吸管或吸头。
7.3定量检测
7.3.1接种和培养
根据样品的污染程度估计,选择2个~3个连续的适宜稀释度的稀释液各1mL加入无菌培养皿内,每个稀释度做2个平皿。把融化45℃±1℃的肠球菌琼脂或KF琼脂12mL~15mL倾入培养血内,转动平板充分混合,水平放置,使琼脂凝固。可在凝固后的琼脂表面覆盖一薄层肠球菌琼脂或KF琼脂(约4mL),凝固后翻转平板。肠球菌琼脂置于36℃±2C培养18h~24h:KF平板置于36C±2C培养24h~48h。同时分别取1mL空白稀释液加入两个无菌平血内作空白对照。7.3.2典型菌落观察
在肠球菌琼脂平板上形成带棕色环的棕黑色菌落;在KF平板上形成暗红色至粉红色菌落,边缘整齐,用无菌接种针从每个肠球菌琼脂平板或KF平板挑取5个典型菌落,进一步做确证实验7.3.3革兰氏染色镜检
在肠球菌琼脂平板或KF平板上挑取典型菌落作革兰民染色镜检,鉴定为革兰氏阳性球菌。7.3.4确证实验
7.3.4.1纯培养
将肠球菌琼脂平板或KF平板上的革兰氏阳性球菌的典型菌落分别接种到脑心浸液肉汤(BHIB)和葡萄糖琼脂斜面或脑心浸液琼脂(BHIA)斜面。BHIB肉汤置于36℃±2℃培养24h,葡萄糖琼脂斜面和BHIA斜面置于36℃±2℃培养24h48h。7.3.4.2生化实验
将培养后的BHIB肉汤或斜面分别接种到胆汁七叶苷琼脂(BEA)平板和含6.5%氯化钠的BHIB肉汤,置于36℃±2℃培养24h~48h,观察细菌生长情况。如果BEA平板上生长并水解七叶苷(形成黑色或棕色沉淀),6.5%氯化钠的BHIB肉汤中36℃±2℃培养24h~48h生长良好,则可确证为肠球菌。也可以采用API试剂条或Vitek鉴定试卡进行生化鉴定8平板计数法结果计算
DBS22/027-2014
选择有典型肠球菌菌落的平板,且同一稀释度2个平板所有菌落数合计在20CFU~200CFU之间,计数典型菌落数。如果:
a)只有一个稀释度的平板菌落数在20CFU~200CFU之间且有典型菌落,计数该稀释度平板上的典型菌落;
所有稀释度的平板菌落数均小于20CFU且有典型菌落,应计数最低稀释度平板上的典型菌落:某一稀释度的平板菌落数大于200CFU且有典型菌落,但下一稀释度平板上没有典型菌落,应c)
计数该稀释度平板上的典型菌落;d)
若所有稀释度的平板菌落数大于200CFU目有典型菌落,应计数最高稀释度平板上的典型菌落:
若所有稀释度的平板菌落数均不在20CFU~200CFU之间且有典型菌落,其中一部分小于20e
CFU或大于200CFU时,应计数最接近20CFU或200CFU的稀释度平板上的典型菌落。以上情况按公式(1)计算。
公式(1):T=-
式中:
一样品中肠球菌菌落数:
-某一稀释度肠球菌典型菌落的总数:B
-鉴定结果为肠球菌的菌落数:
-用于肠球菌鉴定的菌落数;
稀释因子。
f)若2个连续稀释度的平板菌落数均在20CFU~200CFU之间,按公式(2)计算公式(2):
式中:
样品中肠球菌的菌落数;
第一稀释度(低稀释倍数)肠球菌典型菌落的总数第二稀释度(高稀释倍数)肠球菌典型菌落的总数:第一稀释度(低稀释倍数)鉴定结果为肠球菌的菌落数:第二稀释度(高稀释倍数)鉴定结果为肠球菌的菌落数:第一稀释度(低稀释倍数)用于肠球菌鉴定的菌落数:第二稀释度(高稀释倍数)用于肠球菌鉴定的菌落数;-计算系数(如果第二稀释度肠球菌鉴定结果为0,计算系数采用1):1.1
稀释因子(第一稀释度)。
9平板计数法结果报告
根据样品的取样量和稀释度,按7中公式计算,报告样品中肠球菌的菌落数,以CFU/g(mL)表示:如T值为0,则以小于1乘以最低稀释倍数报告。第二法肠球菌的MPN计数法
10MPN计数法实验原理
DBS22/027—2014
应用MPN9管法,选择三个适宜的连续稀释度的样液接种于叠氮化钠葡萄糖肉汤和肠球菌肉汤,进行选择性增菌,经确证实验证明含有肠球菌的对应管计为阳性管,查MPN表,计数并报告每克或每毫升样品中肠球菌的MPN值。
此方法适用于污染程度较低的样品。11MPN计数法的检验程序
MPN计数法的检验程序见图2
25g(mL)样品+225mL生理盐水,均质10倍系列稀释
选择3个连续的适宜稀释度,每个稀释度各取1mL分别接种于3管叠氮化钠葡萄糖肉汤或肠球菌肉汤,共9管36℃±2℃或45℃±2℃
24h~48h
变黑或混浊
确证实验
菌落观察
12MPN计数法操作步骤
12.1样品保存与处理
同6.1和6.2。
12.2样品接种与培养
染色镜检
查MPN表
报告结果
不变黑或无混浊
肠球菌阴性
生化实验或Vitek或API
图2肠球菌MPN计数法的检验程序根据样品污染情况的估计,选择适宜的3个连续稀释度,每一稀释度分别接种3管叠氮化钠葡萄糖肉汤或肠球菌肉汤,每管接种1ml样液(如接种样液量超过1ml.则应接种于双料叠氮化钠葡萄糖肉汤活或双料SF肉汤管中),混匀,共9管。叠氮化钠葡萄糖肉汤置于36℃±1℃培养18h~24h,检查各试管混5
DBS22/027—2014
浊情况;肠球菌肉汤置于36℃±1℃培养24h~48h;肉眼观察颜色变为黑色或混浊的试管,表明有肠球菌生长。
12.3接种选择性平板
对所有呈现混浊的叠氮化钠葡萄糖肉汤或颜色变为黑色的肠球菌肉汤进行确证试验。用接种环将各管的培养物划线接种于肠球菌琼脂平板或KF琼脂平板。肠球菌琼脂平板置于36℃±1℃培养18h~24h;KF琼脂平板置于36℃±1℃培养24h~48h。12.4典型菌落观察与确证实验
肠球菌在肠球菌琼脂平板上形成带棕色环的棕黑色菌落;在KF平板上形成暗红色至粉红色菌落,边缘整齐。用无菌接种针从每个肠球菌琼脂平板或KF平板至少挑取5个典型菌落。按6.3.3和6.3.4所述做进一步的确证实验。可以采用API试剂条或Vitek试卡进行生化鉴定。3MPN计数法结果计算
如一管培养物中所挑取的典型菌落中,有一个确认为肠球菌,则该管应视为阳性。根据样品接种量、稀释倍数以及确证阳性的反应管数,查MPN值表(参见附录B),得出样品中肠球菌最近似值。14MPN计数法结果报告
报告样品中肠球菌的MPN值,以MPN/g(mL)表示。第三法肠球菌的滤膜检测法
15滤膜检测法实验原理
将滤膜置于选择性培养基上增养时,肠球菌菌落呈现特异的颜色。经过肠球菌确证实验之后,计数并计算滤膜上确证肠球菌菌落的数量,即可计算出样品中肠球菌的数量。本方法适用于水和液体样品中肠球菌的检验。滤膜检测法操作程序
滤膜检测法的操作程序见图3
25mL样品+十225mL生理盐水
10倍系列稀释
选择2个~3个适宜稀释度,取适量样液用灭菌滤膜过滤紧贴在肠球菌琼脂或KF琼脂表面36℃±2℃48h
确证实验
菌落观察
17滤膜检测法操作步骤
17.1样品保存
同6.1。
17.2样品处理
染色镜检
计数并报告结果
DBS22/027—2014
生化实验或Vitek或API
图3肠球菌的滤膜检测法操作程序17.2.1污染程度低的水或其他液体样品可直接进行检验。17.2.2污染程度较高的水或其他液体样品可吸取25mL放入含有225mL灭菌生理盐水中,制成1:10稀释液。取1:10稀释液25mL加到含有225mL无菌生理盐水的稀释瓶中,充分混匀制成1:100的稀释液。根据对样品的污染状况的估计,依次制成十倍递增稀释样品匀液。根据样品的污染程度,取不同稀释度的样液的量为100mL。
17.3样液过滤、接种与培养
每个样品至少选择三个连续的适宜稀释度的样液进行过滤(接种样液量应在这交代吧?)。将灭菌后的过滤器与抽滤瓶进行连接,用无菌镊子夹取无菌滤膜,将滤膜放在滤器底部。无菌吸取待过滤样液加入过滤器,打开真空泵进行抽滤。当全部样液通过滤膜后,用20mL灭菌生理盐水轻洗过滤器边缘至少两次。关闭真空泵,打开滤器,用无菌镊子移取滤膜,将滤膜紧贴在肠球菌琼脂或KF琼脂培养基表面上,避免出现气泡。倒置平板置于36℃±2℃培养24h~48h。17.4典型菌落观察和确证实验
DBS22/027—2014
肠球菌在肠球菌琼脂平板滤膜上形成带棕色环的棕黑色菌落;在KF平板滤膜上形成暗红色至粉红色菌落。用无菌接种针从滤膜上至少挑取10个典型菌落进行确证实验。按6.3.3和6.3.4所述进行进一步的确证实验。
滤膜检测法结果计算
对确证生长肠球菌菌落的滤膜进行菌落计数,选择生长有20个~100个肠球菌的滤膜,计数滤膜上的菌落数。具体公式如下:以上按公式(1)计算。T
公式(1):2
式中:
.....++..
T样品中肠球菌菌落数:
A某一稀释度的滤膜上生长的肠球菌典型菌落的总数;B鉴定结果为肠球菌的菌落数;
C用于肠球菌鉴定的菌落数;
d稀释因子。
滤膜检测法结果报告
根据样品稀释情况,计算出样品中的肠球菌菌数,以CFU/100mL表示叠氮化钠葡萄糖肉汤培养基
A.1.1成分
牛肉浸膏
胰蛋白陈
葡萄糖
叠氮化钠
蒸馏水
1000mL
附录A
(资料性附录)
培养基配制与生化试验
DBS22/027—2014
将上述各成分混匀,不断搅拌加热溶解。每管分装10mL,121℃高压灭菌15min调整pH7.2±0.2。若制备双料浓度的叠氮化钠葡萄糖肉汤,可将上述配方蒸馏水改为500mL。A.2
肠球菌肉汤培养基
A.2.1成分
胰蛋白陈
牛肉浸膏
酵母浸膏
牛胆粉
氯化钠
柠檬酸钠
七叶苷
柠檬酸铁铵
叠氮化钠
蒸馏水
2制法
1000mL
将上述各成分加热煮沸溶解冷却后,调节pH7.2±0.2,分装,121℃高压灭菌15min,备用。A.3
KF链球菌琼脂培养基
A.3.1成分
蛋白陈
叠氮钠
酵母浸膏
溴甲酚紫(也可不加)
DBS22/027-2014
氯化钠
甘油磷酸钠
蒸馏水
麦芽糖
1000mL
1%2,3,5一氯化三苯基四氮唑(TTC)水溶液10.0mL乳糖
A.3.2制法
将上述各成分(TTC水溶液除外)加热溶解于蒸馏水中,煮沸5min,121℃高压灭菌15min;1)
冷却至50℃~60℃时,加入已灭菌的1%TTC水溶液,每100ml加1ml,混匀,调整pH7.2±0.2(3)倾注无菌平血中、冷却待用。A.4肠球菌琼脂(胆汁七叶苷叠氮钠琼脂)培养基A.4.1成分
胰蛋白陈
牛肉浸膏
酵母浸膏
牛胆粉
氯化钠
柠檬酸钠
七叶苷
柠檬酸铁铵
叠氮化钠
蒸馏水
A.4.2制法
1000mL
将上述各成分加热煮沸溶解冷却后,121℃高压灭菌15min,调节pH7.2±0.2,分装,于45℃~50℃倾注平板备用。
胆汁七叶苷琼脂培养基
A.5.1成分
蛋白陈
柠檬酸铁
蒸馏水
A.5.2制法
1000mL
将上述各成分加入蒸馏水中,缓慢加热使溶解,分装试管,每管5mI,高压灭菌121℃15min,做成斜面.在冰箱中(4℃~8℃)保存。10
6脑心浸液肉汤(BHIB)培养基
A.6.1成分
牛脑浸出粉
牛心浸出粉
胰蛋白陈
葡萄糖
氯化钠
磷酸氢二钠
蒸馏水
1000mL
DBS22/027—2014
将各成分加入蒸馏水中,加热溶解,调整pH7.2±0.2,分装,高压灭菌121℃15min。、含6.5%氯化钠脑心肉汤培养基A
A.7.1成分
牛脑浸出粉
牛心浸出粉
胰蛋白陈
葡萄糖
氯化钠
磷酸氢二钠
氯化钠
蒸馏水
2制法
1000mL
将各成分加入蒸馏水中,加热溶解,调整pH7.2±0.2,分装,高压灭菌121℃15min。A.8
(BHIA)培养基
脑心浸液琼脂
A.8.1成分
牛脑浸出粉
牛心浸出粉
胰蛋白陈
葡萄糖
氯化钠
磷酸氢二钠
蒸馏水
2制法
1000mL
将各成分加入蒸馏水中,加热溶解,调整pH7.2±0.2,高压灭菌121℃15min。11
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。