DBS13 001-2015
基本信息
标准号: DBS13 001-2015
中文名称:食品安全地方标准 食品中诺如病毒检测
标准类别:地方标准(DB)
标准状态:现行
出版语种:简体中文
下载格式:.rar .pdf
下载大小:309KB

标准分类号
关联标准
出版信息
相关单位信息
标准简介
DBS13 001-2015 食品安全地方标准 食品中诺如病毒检测
DBS13001-2015
标准压缩包解压密码:www.bzxz.net
标准图片预览




标准内容
方标准
河北省地
DBS13/001—2015
食品安全地方标准
食品中诺如病毒检测
2015-04-23发布
2015-05-01实施
河北省卫生和计划生育委员会发布前
本标准按GB/T1.1-2009规定的格式编写。本标准的附录A为规范性附录。
本标准由河北省卫生和计划生育委员会归口。本标准于2015年4月23日首次发布。言
DBS13/001—2015
1范围
食品安全地方标准
食品中诺如病毒检测
DBS13/001—2015
本标准规定了贝类、生食叶类蔬菜和包装饮用水等食品中诺如病毒普通RT-PCR和实时荧光RT-PCR检测方法
本标准适用于贝类、生食叶类蔬菜和包装饮用水等食品中GI型和GIⅡ型诺如病毒的检测。2
术语和定义
下列术语和定义适用于本标准。诺如病毒
norovirus
诺如病毒属于人类杯状病毒科,诺如病毒属,是一组形态相似、抗原性略有不同的病毒颗粒。诺如病毒直径约为26nm~35nm,无包膜,表面粗糙,球形,呈二十面体对称。诺如病毒基因组是单股正链RNA,组成长约7kb~7.5kb,电镜下缺乏显著的形态学特征,负染色电镜照片显示,诺如病毒是具有典型的羽状边缘、表面有凹痕的小圆状结构病毒。诺如病毒共可分为GI~GV5个基因型,其中感染人的主要是GI型和GI型。
设备和材料
电子天平:感量0.1g
组织匀浆器或其他可以破碎样品的工具。普通冰箱:2℃~8℃。
超低温冰箱:-80℃土5℃。
高速冷冻离心机:最大离心力大于15000g。恒温水浴箱或金属浴:37℃~65℃。PCR扩增仪。
实时荧光PCR扩增仪
电泳仪。
凝胶成像系统。
震荡混匀器。
电热干燥箱。
3.13pH计。
3.14水过滤系统。
3.15微量可调移液器:1L~10L、10μL~100μL、100~1000μ3.16洗耳球或电动移液器。
DBS13/001—2015
3.17无RNA酶的玻璃容器、微量加样器吸头、无菌50mL离心管、无菌1.5mL离心管和PCR管。3.18:无RNA酶的一次性移液管:10mL、25mL。3.19
混合硝酸纤维素膜:孔径0.22μm。4试剂
除有特殊说明外,所有实验用试剂均为分析纯。4.1
无RNA酶的超纯水:见附录A.1。甘氨酸缓冲液:见附录A.2。
5XPEG8000溶液:见附录A.3。
2.5mol/L氯化镁(MgCl)溶液:见附录A.4。牛肉膏-甘氨酸洗脱液:见附录A.5。氯仿。
1mol/L盐酸溶液。
1mol/L氢氧化钠溶液。
病毒RNA提取试剂盒。
TaqDNA聚合酶:-20℃保存,避免反复冻融。逆转录酶:-20℃保存,避免反复冻融4.12
RNA酶抑制剂:-20℃保存,避免反复冻融。4.13
dNTPs:含dCTP、dGTP、dATP、dTTP各10mmol/L。引物和探针:使用浓度为25umol/L,-20℃保存,引物和探针序列见表1和表2。4.14
表1普通RT-PCR检测引物
检测的病毒类群
GI和GII
引物序列
正向引物F:5”-ATACCACTATGATGCAGATTA-3”反向引物R:5”-TCATCATCACCATAGAAAGAG-3”片段大小/bp
检测的病毒类群
1XTAE:
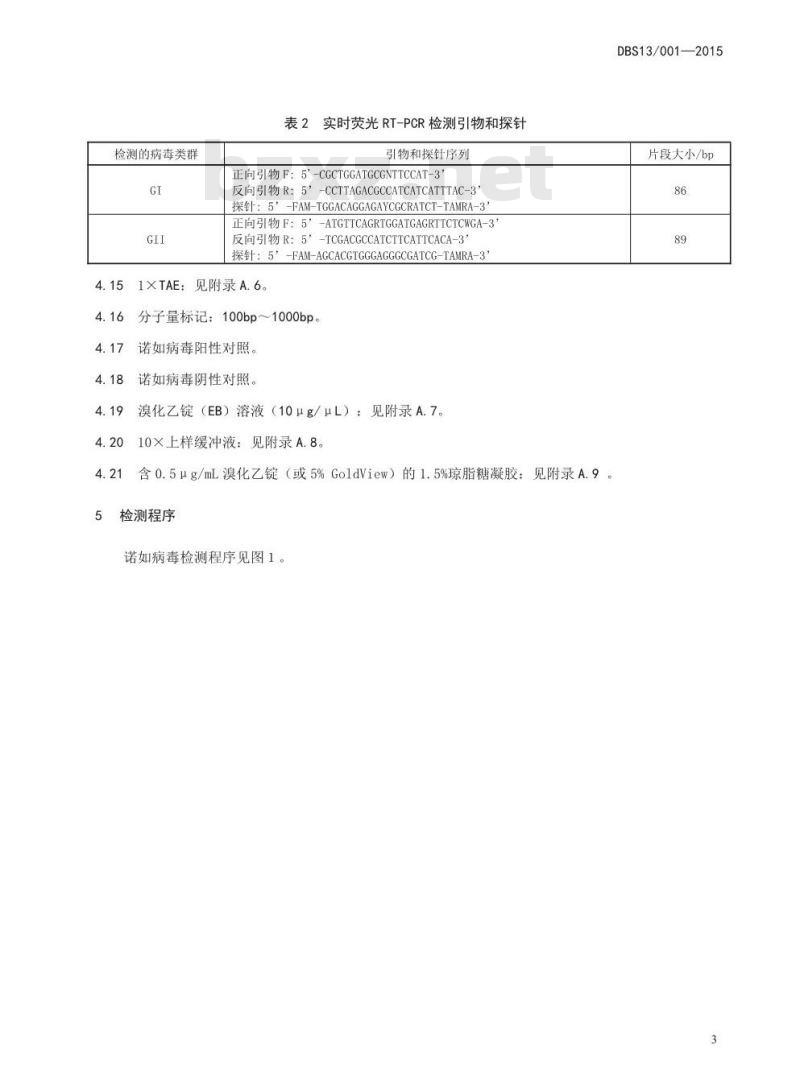
实时荧光RT-PCR检测引物和探针引物和探针序列
正向引物F:5'-CGCTGGATGCGNTTCCAT-3”反向引物R:5”-CCTTAGACGCCATCATCATTTAC-3”探针:5”-FAM-TGGACAGGAGAYCGCRATCT-TAMRA-3”正向引物F:5-ATGTTCAGRTGGATGAGRTTCTCWGA-3反向引物R:5-TCGACGCCATCTTCATTCACA-3探针:5'-FAM-AGCACGTGGGAGGGCGATCG-TAMRA-3见附录A.6。
分子量标记:100bp~1000bp。
诺如病毒阳性对照。
诺如病毒阴性对照。
溴化乙锭(EB)溶液(10μg/μL):见附录A.7。10X上样缓冲液:见附录A.8。
含0.5μg/mL溴化乙锭(或5%GoldView)的1.5%琼脂糖凝胶:见附录A.9检测程序
诺如病毒检测程序见图1。
DBS13/001—2015
片段大小/bp
贝实消化滕5
35LH震酸缓冲液
切碎,卵育或需荡,
4c高心33uir.
三食[+类蔬25s|
4L nL=氨酸缓冲液
切碎,呼育或震荡,
4℃两心30m^
上清!nL氯仿
这段,
离30nn
上清IFEG3020
上4C过
夜,离心suir.
检测步骤
样品的运输与保存
上清1PEG300
冰上1h或4C过
夜,离心min
汽淀1200μL元F酶超纯水
包装饮用水.530mL
调pI[至3. , 过滤
滤膜11rimL牛肉膏 甘氨酸
洗脱20-33mr
云除滤膜
上清1338CC0
夜,离心
6c溶群=mr,
离心职上清
病毒粗提产场
提职RNA
总RNA
芒译R--PCR法或实时
荧光R- PCR检测
结果报
诺如病毒检测程序
DBS13/0012015
运输过程中保持样品温度在0℃~5℃。实验室接到样品后应尽快进行检测。如果暂时不能检测应将样品保存于-80℃冰箱中,避免样品反复冻融。6.2样品处理和病毒富集
6.2.1贝类
6.2.1.1取样:首先用灭菌蒸馏水将贝壳表面的污泥清洗于净,打开贝壳后,倒掉腔内的液体,使用无菌的剪刀和镊子取贝类消化腺组织。6.2.1.2按无菌操作取5g消化腺组织,在组织匀浆器中高速匀浆3min或切碎成2mm以下的小块,放入50mL离心管中,加入35mL甘氨酸缓冲液(样品重量与缓冲液体积之比为1:7),37℃孵育30min4
或室温下剧振荡10min。4℃,10000g离心30min。DBS13/001—2015
6.2.1.3转移上清液至另一个50mL离心管中,加入10mL或更多氯仿,充分振荡,放置10min,4℃10000g离心30min。如上清较浑浊,可重复用氯仿再抽提一次。6.2.1.4转移上清至另一个50mL离心管中,用1mo1/L盐酸调节pH至7.0士0.5,加入0.25倍体积的PEG8000溶液(PEG终浓度为8%),上下颠倒离心管以充分混匀。6.2.1.5冰上放置至少1h或4℃放置过夜。4℃,10000g离心5min。弃去上清,保留沉淀。6.2.1.6加入200μL无RNA酶的超纯水,60℃加热5min充分溶解沉淀。4℃,10000g离心3min,取上清,得到病毒粗提产物。
6.2.2生食叶类蔬菜
6.2.2.1使用无菌的剪刀和镊子将25g生食叶类蔬菜剪成约2.5cm×2.5cm×2.5cm的小块,装入50ml离心管中,加入40mL甘氨酸缓冲液,37℃孵育30min或室温下剧烈震荡10min,4℃,10000g离心30min。6.2.2.2转移上清至另一个50mL离心管中,用1mo1/L盐酸溶液调节pH至7.0±0.5,加入0.25倍体积的PEG8000溶液,上下颠倒离心管以充分混匀6.2.2.3冰上放置至少1h或4℃放置过夜。4℃,10000g离心5min。弃去上清,保留沉淀6.2.2.4加入200μL无RNA酶的超纯水,60℃加热5min充分溶解沉淀。4℃,10000g离心3min,取上清,得到病毒粗提产物,
6.2.3包装饮用水
6.2.3.1500mL水样中加入10mL的2.5mo1/L氯化镁溶液,使其终浓度达到0.05mo1/L;用1mo1/L盐酸调节水样pH至3.0±0.5。
6.2.3.2采用真空抽滤使之通过孔径为0.22μm的混合硝酸纤维素膜(混浊度较大的污水,需预先澄清),然后用10mL牛肉膏-甘氨酸洗脱液(pH9.5)震荡洗脱滤膜20~30min6.2.3.3去除滤膜,用1mo1/L盐酸溶液调节洗脱液pH至7.0土0.5,向洗脱液中加入0.25倍体积的PEG8000溶液,上下颠倒离心管以充分混匀。6.2.3.4将离心管及样液一起放在冰上放置至少1h或4℃放置过夜。4℃,10000g离心5min。弃去上清,保留沉淀。
6.2.3.5加入200uL无RNA酶的超纯水,60℃加热5min充分溶解沉淀。4℃,10000g离心3min,取上清,得到病毒粗提产物。
6.3病毒RNA的提取和纯化
使用病毒RNA提取试剂盒进行RNA的提取和纯化,采用如下方法,或根据仪器和试剂盒要求调整操作步骤。
6.3.1在核酸提取板每孔中加入20μL磁珠混合物,加入200uL病毒粗提产物,加入500μL含有CarrierRNA的裂解/结合混合液,混匀后震荡5min使裂解完全。6.3.2提取板放置磁性抽提架上至少3min以捕获磁珠(捕获的时间取决于磁架的类别和型号)。当捕获完全,磁珠会在磁架上形成颗粒。5
DBS13/001—2015
弃去上清,加入300μL漂洗液1,震荡1min,在磁架上放置1min,弃去上清。6.3.3
重复上一步骤一次。
6.3.5加入450uL漂洗液2,震荡1min,在磁架上放置1min,弃去上清。5重复上一步骤一次。
6.3.7离心2min,去除漂洗液和酒精。6.3.8加入60μL室温或预热至60℃~65℃的洗脱液,震荡3min,放置磁架上1min,转移上清至另一个1.5mL离心管中,-20℃保存纯化的RNA。注意事项:为防止RNA降解,所用实验用具及溶液应无RNA酶,操作过程中应自始至终佩戴一次性橡胶或乳胶手套,并经常更换。提取后的RNA应迅速冷藏或冷冻保存,4℃保存不超过8h,-20℃保存不超过6个月,如需长期保存,应放在-80℃±5℃。
6.4病毒核酸检测
两种方法可任选一种。
6.4.1普通RT-PCR法
6.4.1.1普通RT-PCR反应体系
步法普通RT-PCR反应体系见表3。每个反应体系设置两个平行反应。反应体系中各试剂的量可根据具体情况或不同的反应总体积进行适当调整。以诺如病毒RNA为阳性对照,以不含有诺如病毒RNA作为阴性对照,以水代替模板作为空白对照,表3普通RT-PCR反应体系
RT-PCR缓冲液
正向引物
反向引物
逆转录酶
DNA聚合酶
水(无RNA酶)
储液浓度
10mmol/L
25μmol/L
25μmol/L
普通RT-PCR反应条件
反应条件为:
反转录42℃,60min;
热失活94℃,10min;
94℃,1min
37℃,90s
72℃,1min
74℃,7min。
40个循环
终浓度
0.2mmol/L
1umol/L
1μmol/L
加样量/μL(25uL体系)
或根据试剂要求调整反应条件。6.4.1.3PCR扩增产物的电泳检测DBS13/001—2015
用电泳缓冲液(1XTAE)、0.5μg/mL溴化乙锭(或GoldView等核酸染料)配制1.5%的琼脂糖凝胶(见附录A.9)。在电泳槽中加入电泳缓冲液,使液面刚刚没过凝胶。将9μLPCR扩增产物,加1μL10×上样缓冲液,点样,电泳。电压根据电泳槽长度来确定,一般控制在3V/cm~5V/cm,当溴酚蓝移动到凝胶边缘时关闭电源。凝胶成像系统观察电泳结果,获取并保存图像6.4.2实时荧光RT-PCR法
6.4.2.1实时荧光RT-PCR反应体系一步法RT-PCR反应体系见表4。反应体系中各试剂的量可根据具体情况或不同的反应总体积进行适当调整。
以诺如病毒RNA为阳性对照,以不含有诺如病毒RNA作为阴性对照,以水代替模板作为空白对照。表4实时荧光RT-PCR反应体系
RT-PCR缓冲液
正向引物
反向引物
RNA 酶抑制剂此内容来自标准下载网
水(无RNA酶)
储液浓度
25μmol/L
25μmol/L
25μmol/L
20U/μL
6.4.2.2实时荧光RT-PCR反应条件反应条件为:
反转录55℃,60min;
热失活95℃,5min:
95℃,15s
60℃,1min
65℃,1min(检测荧光)
或根据试剂要求调整反应条件。7
结果判定标准
7.1普通RT-PCR法
终浓度
0.25μmol/L
0.5μmo1/l
1μmol/L
45个循环
加样量/(50体系)
如果阴性对照和空白对照均未出现条带,阳性对照出现一条326bp大小的条带,而样品未出现预期大小的条带,则可判定样品为诺如病毒阴性。如果阴性对照和空白对照均未出现条带,阳性对照出现一条326bp大小的条带,样品也出现预期大小条带,则可判定样品为诺如病毒阳性。7.2实时荧光RT-PCR法
待测样品的Ct值大于或等于45时,则判定诺如病毒阴性。待测样品的Ct值小于或等于30时,则判定诺如病毒阳性。DBS13/001—2015
待测样品的Ct值小于45而大于30时,应重新进行测试,如果重测样品的Ct值大于或等于45时,则判定诺如病毒阴性;如果重测样品的Ct值小于45时,则判定诺如病毒阳性8
结果报告
8.1阴性结果报告方式
若贝类检测结果为阴性,则结果报告为5g贝类消化腺未检出诺如病毒。若生食叶类蔬菜检测结果为阴性,则结果报告为25g生食叶类蔬菜未检出诺如病毒。若包装饮用水检测结果为阴性,则结果报告为500mL包装饮用水未检出诺如病毒。8.2阳性结果报告方式
若贝类检测结果为阳性,则结果报告为5g贝类消化腺检出诺如病毒。若生食叶类蔬菜检测结果为阳性,则结果报告为25g生食叶类蔬菜检出诺如病毒。若包装饮用水检测结果为阳性,则结果报告为500mL包装饮用水检出诺如病毒。8
附录A
(规范性附录)
试剂的配制
除有特殊说明外,所有实验用试剂均为分析纯。DBS13/001—2015
RNA酶的去除和无RNA酶溶液的配制:配制溶液用的液体和固体应采用未开封的新品。配制溶液所用的超纯水、玻璃容器、移液器吸头、药匙等用具应无RNA酶。操作过程中应始终佩戴乳胶手套,并经常更换,以避免皮肤上的细菌和真菌及人体自身分泌的RNA酶污染用具或带入溶液。玻璃容器应在240℃烘烤4h以去除RNA酶。离心管、移液器吸头、药匙等用具可购买无RNA酶级别的,或用0.1%的焦炭酸二乙酯(DEPC)水溶液室温浸泡过夜,然后高压灭菌并烘干。A.1无RNA酶的超纯水
A.1.1成分
超纯水
焦炭酸二乙酯(DEPC)
A.1.2制法
避光,室温搅拌过夜,121℃高压灭菌15min,备用。1000.0mL
2甘氨酸缓冲液(含0.1mol/L甘氨酸,0.3mol/L氯化钠,pH9.5)A.2
A.2.1成分
甘氨酸
氯化钠
A.2.2制法
将上述各成分搅拌溶解于超纯水中,调节pH至9.5,用超纯水定容至1000mL,分装,121℃高压灭菌15min,备用。
5XPEG8000溶液[含40%(w/v)PEG8000,1.5moI/L氯化钠A.3
A.3.1成分
PEG8000
氯化钠
A.3.2制法
将上述各成分搅拌溶解于超纯水中,用超纯水定容至1000mL,分装,121℃高压灭菌15min,备用。
A.42.5mol/L氯化镁(MgCl,)溶液9
A.4.1成分
氯化镁(MgC1,)
A.4.2制法
DBS13/001—2015
将上述各成分搅拌溶解于超纯水中,用超纯水定容至1000mL,分装,121℃高压灭菌15min,备用。A.5牛肉膏-甘氨酸洗脱液(含3%牛肉膏,0.05mol/L甘氨酸,pH9.5)A.5.1成分
牛肉膏
甘氨酸
A.5.2制法
将上述各成分搅拌溶解于超纯水中,调节pH至9.5,用超纯水定容至1000mL,分装,121℃高压灭菌15min,备用。
1XTAE电泳缓冲液
A.6.10.5mo1/L乙二铵四乙酸二钠(EDTA-Naz)溶液,pH8.0A.6.1.1成分
乙二铵四乙酸二钠(EDTA-Naz·2H,O)A.6.1.2制法
将上述各成分搅拌溶解于超纯水中,调节pH至8.0,用超纯水定容至1000mL,分装,121℃高压灭菌15min,备用。
50×TAE电泳缓冲液
A.6.2.1成分
羟基甲基氨基甲烷(Tris)
冰乙酸
0.5mo1/LEDTA溶液(pH8.0)
A.6.2.2制法
将上述各成分搅拌溶解于超纯水中,定容至1000mL,分装,121℃高压灭菌15min,备用。A.6.3
1X×TAE电泳缓冲液
A.6.3.1制法
使用时,将50XTAE电泳缓冲液用灭菌超纯水稀释至1XTAE电泳缓冲液。A.7
(EB)溶液(10μg/μL)
漠化乙锭
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
河北省地
DBS13/001—2015
食品安全地方标准
食品中诺如病毒检测
2015-04-23发布
2015-05-01实施
河北省卫生和计划生育委员会发布前
本标准按GB/T1.1-2009规定的格式编写。本标准的附录A为规范性附录。
本标准由河北省卫生和计划生育委员会归口。本标准于2015年4月23日首次发布。言
DBS13/001—2015
1范围
食品安全地方标准
食品中诺如病毒检测
DBS13/001—2015
本标准规定了贝类、生食叶类蔬菜和包装饮用水等食品中诺如病毒普通RT-PCR和实时荧光RT-PCR检测方法
本标准适用于贝类、生食叶类蔬菜和包装饮用水等食品中GI型和GIⅡ型诺如病毒的检测。2
术语和定义
下列术语和定义适用于本标准。诺如病毒
norovirus
诺如病毒属于人类杯状病毒科,诺如病毒属,是一组形态相似、抗原性略有不同的病毒颗粒。诺如病毒直径约为26nm~35nm,无包膜,表面粗糙,球形,呈二十面体对称。诺如病毒基因组是单股正链RNA,组成长约7kb~7.5kb,电镜下缺乏显著的形态学特征,负染色电镜照片显示,诺如病毒是具有典型的羽状边缘、表面有凹痕的小圆状结构病毒。诺如病毒共可分为GI~GV5个基因型,其中感染人的主要是GI型和GI型。
设备和材料
电子天平:感量0.1g
组织匀浆器或其他可以破碎样品的工具。普通冰箱:2℃~8℃。
超低温冰箱:-80℃土5℃。
高速冷冻离心机:最大离心力大于15000g。恒温水浴箱或金属浴:37℃~65℃。PCR扩增仪。
实时荧光PCR扩增仪
电泳仪。
凝胶成像系统。
震荡混匀器。
电热干燥箱。
3.13pH计。
3.14水过滤系统。
3.15微量可调移液器:1L~10L、10μL~100μL、100~1000μ3.16洗耳球或电动移液器。
DBS13/001—2015
3.17无RNA酶的玻璃容器、微量加样器吸头、无菌50mL离心管、无菌1.5mL离心管和PCR管。3.18:无RNA酶的一次性移液管:10mL、25mL。3.19
混合硝酸纤维素膜:孔径0.22μm。4试剂
除有特殊说明外,所有实验用试剂均为分析纯。4.1
无RNA酶的超纯水:见附录A.1。甘氨酸缓冲液:见附录A.2。
5XPEG8000溶液:见附录A.3。
2.5mol/L氯化镁(MgCl)溶液:见附录A.4。牛肉膏-甘氨酸洗脱液:见附录A.5。氯仿。
1mol/L盐酸溶液。
1mol/L氢氧化钠溶液。
病毒RNA提取试剂盒。
TaqDNA聚合酶:-20℃保存,避免反复冻融。逆转录酶:-20℃保存,避免反复冻融4.12
RNA酶抑制剂:-20℃保存,避免反复冻融。4.13
dNTPs:含dCTP、dGTP、dATP、dTTP各10mmol/L。引物和探针:使用浓度为25umol/L,-20℃保存,引物和探针序列见表1和表2。4.14
表1普通RT-PCR检测引物
检测的病毒类群
GI和GII
引物序列
正向引物F:5”-ATACCACTATGATGCAGATTA-3”反向引物R:5”-TCATCATCACCATAGAAAGAG-3”片段大小/bp
检测的病毒类群
1XTAE:
实时荧光RT-PCR检测引物和探针引物和探针序列
正向引物F:5'-CGCTGGATGCGNTTCCAT-3”反向引物R:5”-CCTTAGACGCCATCATCATTTAC-3”探针:5”-FAM-TGGACAGGAGAYCGCRATCT-TAMRA-3”正向引物F:5-ATGTTCAGRTGGATGAGRTTCTCWGA-3反向引物R:5-TCGACGCCATCTTCATTCACA-3探针:5'-FAM-AGCACGTGGGAGGGCGATCG-TAMRA-3见附录A.6。
分子量标记:100bp~1000bp。
诺如病毒阳性对照。
诺如病毒阴性对照。
溴化乙锭(EB)溶液(10μg/μL):见附录A.7。10X上样缓冲液:见附录A.8。
含0.5μg/mL溴化乙锭(或5%GoldView)的1.5%琼脂糖凝胶:见附录A.9检测程序
诺如病毒检测程序见图1。
DBS13/001—2015
片段大小/bp
贝实消化滕5
35LH震酸缓冲液
切碎,卵育或需荡,
4c高心33uir.
三食[+类蔬25s|
4L nL=氨酸缓冲液
切碎,呼育或震荡,
4℃两心30m^
上清!nL氯仿
这段,
离30nn
上清IFEG3020
上4C过
夜,离心suir.
检测步骤
样品的运输与保存
上清1PEG300
冰上1h或4C过
夜,离心min
汽淀1200μL元F酶超纯水
包装饮用水.530mL
调pI[至3. , 过滤
滤膜11rimL牛肉膏 甘氨酸
洗脱20-33mr
云除滤膜
上清1338CC0
夜,离心
6c溶群=mr,
离心职上清
病毒粗提产场
提职RNA
总RNA
芒译R--PCR法或实时
荧光R- PCR检测
结果报
诺如病毒检测程序
DBS13/0012015
运输过程中保持样品温度在0℃~5℃。实验室接到样品后应尽快进行检测。如果暂时不能检测应将样品保存于-80℃冰箱中,避免样品反复冻融。6.2样品处理和病毒富集
6.2.1贝类
6.2.1.1取样:首先用灭菌蒸馏水将贝壳表面的污泥清洗于净,打开贝壳后,倒掉腔内的液体,使用无菌的剪刀和镊子取贝类消化腺组织。6.2.1.2按无菌操作取5g消化腺组织,在组织匀浆器中高速匀浆3min或切碎成2mm以下的小块,放入50mL离心管中,加入35mL甘氨酸缓冲液(样品重量与缓冲液体积之比为1:7),37℃孵育30min4
或室温下剧振荡10min。4℃,10000g离心30min。DBS13/001—2015
6.2.1.3转移上清液至另一个50mL离心管中,加入10mL或更多氯仿,充分振荡,放置10min,4℃10000g离心30min。如上清较浑浊,可重复用氯仿再抽提一次。6.2.1.4转移上清至另一个50mL离心管中,用1mo1/L盐酸调节pH至7.0士0.5,加入0.25倍体积的PEG8000溶液(PEG终浓度为8%),上下颠倒离心管以充分混匀。6.2.1.5冰上放置至少1h或4℃放置过夜。4℃,10000g离心5min。弃去上清,保留沉淀。6.2.1.6加入200μL无RNA酶的超纯水,60℃加热5min充分溶解沉淀。4℃,10000g离心3min,取上清,得到病毒粗提产物。
6.2.2生食叶类蔬菜
6.2.2.1使用无菌的剪刀和镊子将25g生食叶类蔬菜剪成约2.5cm×2.5cm×2.5cm的小块,装入50ml离心管中,加入40mL甘氨酸缓冲液,37℃孵育30min或室温下剧烈震荡10min,4℃,10000g离心30min。6.2.2.2转移上清至另一个50mL离心管中,用1mo1/L盐酸溶液调节pH至7.0±0.5,加入0.25倍体积的PEG8000溶液,上下颠倒离心管以充分混匀6.2.2.3冰上放置至少1h或4℃放置过夜。4℃,10000g离心5min。弃去上清,保留沉淀6.2.2.4加入200μL无RNA酶的超纯水,60℃加热5min充分溶解沉淀。4℃,10000g离心3min,取上清,得到病毒粗提产物,
6.2.3包装饮用水
6.2.3.1500mL水样中加入10mL的2.5mo1/L氯化镁溶液,使其终浓度达到0.05mo1/L;用1mo1/L盐酸调节水样pH至3.0±0.5。
6.2.3.2采用真空抽滤使之通过孔径为0.22μm的混合硝酸纤维素膜(混浊度较大的污水,需预先澄清),然后用10mL牛肉膏-甘氨酸洗脱液(pH9.5)震荡洗脱滤膜20~30min6.2.3.3去除滤膜,用1mo1/L盐酸溶液调节洗脱液pH至7.0土0.5,向洗脱液中加入0.25倍体积的PEG8000溶液,上下颠倒离心管以充分混匀。6.2.3.4将离心管及样液一起放在冰上放置至少1h或4℃放置过夜。4℃,10000g离心5min。弃去上清,保留沉淀。
6.2.3.5加入200uL无RNA酶的超纯水,60℃加热5min充分溶解沉淀。4℃,10000g离心3min,取上清,得到病毒粗提产物。
6.3病毒RNA的提取和纯化
使用病毒RNA提取试剂盒进行RNA的提取和纯化,采用如下方法,或根据仪器和试剂盒要求调整操作步骤。
6.3.1在核酸提取板每孔中加入20μL磁珠混合物,加入200uL病毒粗提产物,加入500μL含有CarrierRNA的裂解/结合混合液,混匀后震荡5min使裂解完全。6.3.2提取板放置磁性抽提架上至少3min以捕获磁珠(捕获的时间取决于磁架的类别和型号)。当捕获完全,磁珠会在磁架上形成颗粒。5
DBS13/001—2015
弃去上清,加入300μL漂洗液1,震荡1min,在磁架上放置1min,弃去上清。6.3.3
重复上一步骤一次。
6.3.5加入450uL漂洗液2,震荡1min,在磁架上放置1min,弃去上清。5重复上一步骤一次。
6.3.7离心2min,去除漂洗液和酒精。6.3.8加入60μL室温或预热至60℃~65℃的洗脱液,震荡3min,放置磁架上1min,转移上清至另一个1.5mL离心管中,-20℃保存纯化的RNA。注意事项:为防止RNA降解,所用实验用具及溶液应无RNA酶,操作过程中应自始至终佩戴一次性橡胶或乳胶手套,并经常更换。提取后的RNA应迅速冷藏或冷冻保存,4℃保存不超过8h,-20℃保存不超过6个月,如需长期保存,应放在-80℃±5℃。
6.4病毒核酸检测
两种方法可任选一种。
6.4.1普通RT-PCR法
6.4.1.1普通RT-PCR反应体系
步法普通RT-PCR反应体系见表3。每个反应体系设置两个平行反应。反应体系中各试剂的量可根据具体情况或不同的反应总体积进行适当调整。以诺如病毒RNA为阳性对照,以不含有诺如病毒RNA作为阴性对照,以水代替模板作为空白对照,表3普通RT-PCR反应体系
RT-PCR缓冲液
正向引物
反向引物
逆转录酶
DNA聚合酶
水(无RNA酶)
储液浓度
10mmol/L
25μmol/L
25μmol/L
普通RT-PCR反应条件
反应条件为:
反转录42℃,60min;
热失活94℃,10min;
94℃,1min
37℃,90s
72℃,1min
74℃,7min。
40个循环
终浓度
0.2mmol/L
1umol/L
1μmol/L
加样量/μL(25uL体系)
或根据试剂要求调整反应条件。6.4.1.3PCR扩增产物的电泳检测DBS13/001—2015
用电泳缓冲液(1XTAE)、0.5μg/mL溴化乙锭(或GoldView等核酸染料)配制1.5%的琼脂糖凝胶(见附录A.9)。在电泳槽中加入电泳缓冲液,使液面刚刚没过凝胶。将9μLPCR扩增产物,加1μL10×上样缓冲液,点样,电泳。电压根据电泳槽长度来确定,一般控制在3V/cm~5V/cm,当溴酚蓝移动到凝胶边缘时关闭电源。凝胶成像系统观察电泳结果,获取并保存图像6.4.2实时荧光RT-PCR法
6.4.2.1实时荧光RT-PCR反应体系一步法RT-PCR反应体系见表4。反应体系中各试剂的量可根据具体情况或不同的反应总体积进行适当调整。
以诺如病毒RNA为阳性对照,以不含有诺如病毒RNA作为阴性对照,以水代替模板作为空白对照。表4实时荧光RT-PCR反应体系
RT-PCR缓冲液
正向引物
反向引物
RNA 酶抑制剂此内容来自标准下载网
水(无RNA酶)
储液浓度
25μmol/L
25μmol/L
25μmol/L
20U/μL
6.4.2.2实时荧光RT-PCR反应条件反应条件为:
反转录55℃,60min;
热失活95℃,5min:
95℃,15s
60℃,1min
65℃,1min(检测荧光)
或根据试剂要求调整反应条件。7
结果判定标准
7.1普通RT-PCR法
终浓度
0.25μmol/L
0.5μmo1/l
1μmol/L
45个循环
加样量/(50体系)
如果阴性对照和空白对照均未出现条带,阳性对照出现一条326bp大小的条带,而样品未出现预期大小的条带,则可判定样品为诺如病毒阴性。如果阴性对照和空白对照均未出现条带,阳性对照出现一条326bp大小的条带,样品也出现预期大小条带,则可判定样品为诺如病毒阳性。7.2实时荧光RT-PCR法
待测样品的Ct值大于或等于45时,则判定诺如病毒阴性。待测样品的Ct值小于或等于30时,则判定诺如病毒阳性。DBS13/001—2015
待测样品的Ct值小于45而大于30时,应重新进行测试,如果重测样品的Ct值大于或等于45时,则判定诺如病毒阴性;如果重测样品的Ct值小于45时,则判定诺如病毒阳性8
结果报告
8.1阴性结果报告方式
若贝类检测结果为阴性,则结果报告为5g贝类消化腺未检出诺如病毒。若生食叶类蔬菜检测结果为阴性,则结果报告为25g生食叶类蔬菜未检出诺如病毒。若包装饮用水检测结果为阴性,则结果报告为500mL包装饮用水未检出诺如病毒。8.2阳性结果报告方式
若贝类检测结果为阳性,则结果报告为5g贝类消化腺检出诺如病毒。若生食叶类蔬菜检测结果为阳性,则结果报告为25g生食叶类蔬菜检出诺如病毒。若包装饮用水检测结果为阳性,则结果报告为500mL包装饮用水检出诺如病毒。8
附录A
(规范性附录)
试剂的配制
除有特殊说明外,所有实验用试剂均为分析纯。DBS13/001—2015
RNA酶的去除和无RNA酶溶液的配制:配制溶液用的液体和固体应采用未开封的新品。配制溶液所用的超纯水、玻璃容器、移液器吸头、药匙等用具应无RNA酶。操作过程中应始终佩戴乳胶手套,并经常更换,以避免皮肤上的细菌和真菌及人体自身分泌的RNA酶污染用具或带入溶液。玻璃容器应在240℃烘烤4h以去除RNA酶。离心管、移液器吸头、药匙等用具可购买无RNA酶级别的,或用0.1%的焦炭酸二乙酯(DEPC)水溶液室温浸泡过夜,然后高压灭菌并烘干。A.1无RNA酶的超纯水
A.1.1成分
超纯水
焦炭酸二乙酯(DEPC)
A.1.2制法
避光,室温搅拌过夜,121℃高压灭菌15min,备用。1000.0mL
2甘氨酸缓冲液(含0.1mol/L甘氨酸,0.3mol/L氯化钠,pH9.5)A.2
A.2.1成分
甘氨酸
氯化钠
A.2.2制法
将上述各成分搅拌溶解于超纯水中,调节pH至9.5,用超纯水定容至1000mL,分装,121℃高压灭菌15min,备用。
5XPEG8000溶液[含40%(w/v)PEG8000,1.5moI/L氯化钠A.3
A.3.1成分
PEG8000
氯化钠
A.3.2制法
将上述各成分搅拌溶解于超纯水中,用超纯水定容至1000mL,分装,121℃高压灭菌15min,备用。
A.42.5mol/L氯化镁(MgCl,)溶液9
A.4.1成分
氯化镁(MgC1,)
A.4.2制法
DBS13/001—2015
将上述各成分搅拌溶解于超纯水中,用超纯水定容至1000mL,分装,121℃高压灭菌15min,备用。A.5牛肉膏-甘氨酸洗脱液(含3%牛肉膏,0.05mol/L甘氨酸,pH9.5)A.5.1成分
牛肉膏
甘氨酸
A.5.2制法
将上述各成分搅拌溶解于超纯水中,调节pH至9.5,用超纯水定容至1000mL,分装,121℃高压灭菌15min,备用。
1XTAE电泳缓冲液
A.6.10.5mo1/L乙二铵四乙酸二钠(EDTA-Naz)溶液,pH8.0A.6.1.1成分
乙二铵四乙酸二钠(EDTA-Naz·2H,O)A.6.1.2制法
将上述各成分搅拌溶解于超纯水中,调节pH至8.0,用超纯水定容至1000mL,分装,121℃高压灭菌15min,备用。
50×TAE电泳缓冲液
A.6.2.1成分
羟基甲基氨基甲烷(Tris)
冰乙酸
0.5mo1/LEDTA溶液(pH8.0)
A.6.2.2制法
将上述各成分搅拌溶解于超纯水中,定容至1000mL,分装,121℃高压灭菌15min,备用。A.6.3
1X×TAE电泳缓冲液
A.6.3.1制法
使用时,将50XTAE电泳缓冲液用灭菌超纯水稀释至1XTAE电泳缓冲液。A.7
(EB)溶液(10μg/μL)
漠化乙锭
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。