DBS13 003-2015
基本信息
标准号: DBS13 003-2015
中文名称:食品安全地方标准 阪崎肠杆菌和沙门氏菌检测
标准类别:地方标准(DB)
标准状态:现行
出版语种:简体中文
下载格式:.rar .pdf
下载大小:165KB

标准分类号
关联标准
出版信息
相关单位信息
标准简介
DBS13 003-2015 食品安全地方标准 阪崎肠杆菌和沙门氏菌检测
DBS13003-2015
标准压缩包解压密码:www.bzxz.net
标准图片预览




标准内容
方标准
河北省地
DBS13/003—2015
食品安全地方标准
阪崎肠杆菌和沙门氏菌检测
2015-04-23发布
2015-05-01实施
河北省卫生和计划生育委员会发布前
本标准按GB/T1.1-2009规定的格式编写本标准由河北省卫生和计划生育委员会归口。本标准于2015年4月23日首次发布。言
DBS13/003—2015
1范围
食品安全地方标准
阪崎肠杆菌和沙门氏菌检测
本标准适用于应用实时荧光定量PCR法定性检测阪崎肠杆菌和沙门氏菌。2
规范性引用文件
DBS13/003—2015
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅所注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。GB4789.4食品安全国家标准食品微生物学检验沙门氏菌检验。GB4789.40食品安全国家标准食品微生物学检验阪崎肠杆菌检验。方法提要
阪崎肠杆菌和沙门氏菌均属于肠杆菌科,本检测方法首先对肠杆菌科和阪崎肠杆菌进行同步检测当肠杆菌科为阴性时可直接报告沙门氏菌阴性:当肠杆菌科为阳性时再进行沙门氏菌的检测:当阪崎肠杆菌为阳性时需按照GB4789.40进行确证;当沙门氏菌为阳性时需按照GB4789.4进行确证。设备和材料
除微生物实验室常规灭菌及培养设备外,其他设备和材料如下:4.1二级生物安全柜
4.2磁力搅拌器:0-2400r/min。4.3
3卤素灯:500W。
低温离心管架:1.5mL,0℃。
水浴锅或金属恒温加热器:5℃-100℃。4.6漩涡振荡器。
离心机:12000r/min。
移液器及对应吸头:10μL、100μ200μ、1000μL。超净工作台。
实时荧光定量PCR仪(含有FAM-,HEX-和ROX-检测通道)。冰箱:2℃一8℃和-20℃两种。
2天平:感量0.1g。
4.130.2mL8联排管以及8联排帽(与PCR仪配套使用)4.141.5mL无菌透明离心管。
恒温培养箱:25℃±1℃,36℃±1℃,44℃±0.5℃。无菌锥形瓶:容量100mL、200mL、2000mL。培养基和试剂
除有特殊说明外,所有实验用试剂均为分析纯。5.1缓冲蛋白陈水(BPW):见附录A.1。5.2营养肉汤培养基(NB):见附录A.2。5.3
125Hg/mL溴化乙锭单叠氮溴溶液(EMA):见附录A.3。5.4DNA提取缓冲液:0.1%Chelex100(螯合树脂)水溶液。5.5
吐温80。
按照表1和表4的序列合成的引物和标记的探针。TaqDNA聚合酶:5U/μL
TagPCR缓冲液。
50mmol/LMgC1溶液:见附录A.4。5.10
dNTPs(dATP,dUTP,dCTP,dGTP),浓度均为10mmol/L。尿嘧啶-N-糖基化酶:1U/L。
pUC19质粒DNA,200拷贝/μL。
阪崎肠杆菌质控菌株:ATCC29544,或等效菌株。5.14
沙门氏菌质控菌株:ATCC13311,或等效菌株。5.15大肠杆菌质控菌株:ATCC10536,或等效菌株。金黄色葡萄球菌:CICC10301,或其它非肠杆菌科的阴性质控等效菌株。5.16
检验程序
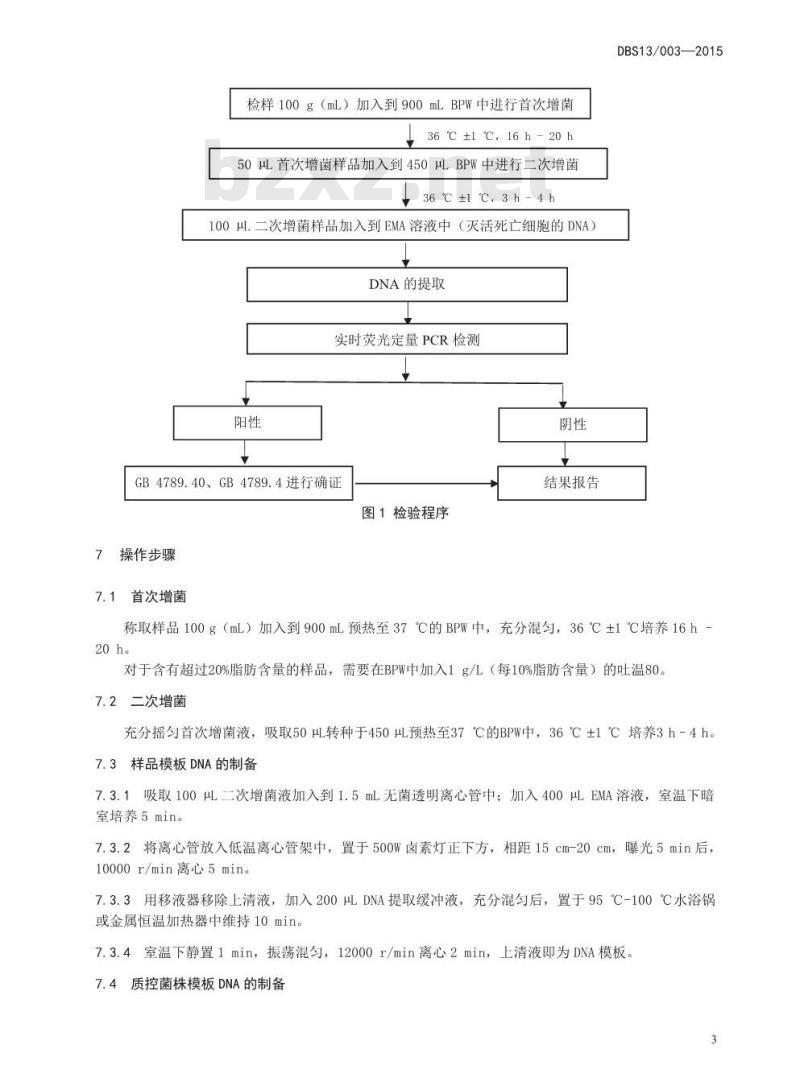
检验程序见图1。
DBS13/003—2015
检样100g(mL)加入到900mLBPW中进行首次增菌36℃±1℃,16h-20h
50L首次增菌样品加入到450BPW中进行二次增菌36℃±1℃3h-4h
100μ二次增菌样品加入到EMA溶液中(灭活死亡细胞的DNA)DNA 的提取
实时荧光定量PCR检测
GB4789.40、GB4789.4进行确证
操作步骤
7.1首次增菌
图1检验程序
结果报告
DBS13/003—2015
称取样品100g(mL)加入到900mL.预热至37℃C的BPW中,充分混匀,36C+1℃培养16h20 h。
对于含有超过20%脂肪含量的样品,需要在BPW中加入1g/L(每10%脂肪含量)的吐温80。7.2二次增菌
充分摇匀首次增菌液,吸取50μ转种于450预热至37℃的BPW中,36℃±1℃培养3h-4h。7.3样品模板DNA的制备
7.3.1吸取100μ二次增菌液加入到1.5mL无菌透明离心管中;加入400μEMA溶液,室温下暗室培养5min。
7.3.2将离心管放入低温离心管架中,置于500W卤素灯正下方,相距15cm-20cm,曝光5min后,10000r/min离心5min。
7.3.3用移液器移除上清液,加入200DNA提取缓冲液,充分混匀后,置于95℃-100℃水浴锅或金属恒温加热器中维持10min。7.3.4室温下静置1min,振荡混匀,12000r/min离心2min,上清液即为DNA模板7.4质控菌株模板DNA的制备
DBS13/003—2015
分别接种供试的阳性对照菌株(大肠杆菌、阪崎肠杆菌、沙门氏菌)和阴性对照菌株(金黄色葡萄球菌)到10mLNB培养液中,36℃±1℃培养过夜,各取1.5mL增菌液,同上离心、提取DNA模板,5PCR反应所用引物和探针工作液的配制7.5
根据表1反应体系中每种引物和探针的终浓度,使用灭菌去离子水配制含有6种目标基因引物的工作液(浓度分别为10Hmo1/L)和含有3种探针的工作液(浓度分别为10Hmo1/L)。目标基因引物和探针序列及每个反应体系内的终浓度表1
引物和探针名称
肠杆菌科-F
肠杆菌科-R
阪崎肠杆菌-F
阪崎肠杆菌-R
内部扩增对照(IAC)-F
内部扩增对照(IAC)-R
肠杆菌科探针
阪崎肠杆菌探针
IAC探针
5'-CTG AAA GCA TCT AAG CAC GAA ACT TG-35'-GTCGTCTTCAACGTTCCTTCAGG-35-AGGGGATATTGTCCCCTGAAACAG-35'-AAA CGA GAA TAA GCC GCG CAT T-35-TGT GAA ATA CCG CAC AGA TG-35'-AGCTGG CGTAAT AGC GAA G-3\5′-FAM-CCCGAGATGAGTTCTCCCTGASMCTTTAAGT-BHQ-13\5'-HEX-AGAGTAGTAGTTGTAGAGGCCGTGCTTCCGAAAG-BHQ-1-3'5'-ROX-TAAGGAGAAAATACCGCATCAGGCGCC-BHQ-2-3模板DNA荧光PCR反应体系的配制7.6
每个样品按照表2的加液量配制25μL反应体系。表2
目标基因扩增体系配制表
试剂名称
灭菌去离子水
10×TagPCR反应缓冲液
50mmo1/LMgC12
10mmol/LdNTPs
引物工作液
探针工作液
5U/uLTaqDNA聚合酶
1U/uL尿啶-N-糖基化酶
200拷贝/LpUC19质粒DNA
DNA模板
总体积
加样体积(L)
终浓度(Hmol/L)
每次进行PCR反应均需使用pUC19质粒DNA作为内部扩增对照,并设置阳性、阴性和空白对照(灭菌去离子水)。
肠杆菌科和阪崎肠杆菌实时荧光定量PCR检测将配制完成的反应管放入实时荧光定量PCR仪中,按照如下步骤设置反应条件:反应步骤一:预变性,37℃4min,95℃5min,1个循环:4
DBS13/003—2015
反应步骤二:扩增和信号收集,95℃变性10s,65℃退火和延伸(每个循环降低0.1℃)70s,40个循环,同时收集FAM,HEX和ROX的荧光信号。核查反应条件正确后,启动反应程序。7.8结果判读
当检测样本Ct值小于或等于35时,报告为阳性:Ct值大于35且小于40时,需要重复一次,如果Ct值仍小于40,且曲线有明显的对数增长期,报告为阳性,否则为阴性;样本没有Ct值时,报告为阴性。
具体结果判定参照表3。
表3肠杆菌科和阪崎肠杆菌结果判读表肠杆菌科
阪崎肠杆菌
内部扩增对照(IAC)
阳性或阴性
阳性或阴性
结果判读
肠杆菌科及阪崎肠杆菌阳性,可能含有沙门氏菌肠杆菌科阳性,阪崎肠杆菌阴性,可能含有沙门氏菌肠杆菌科、阪崎肠杆菌及沙门氏菌阴性无效的结果
当FAM通道为阳性,HEX通道为阳性时,可报告肠杆菌科和阪崎肠杆菌阳性:当FAM通道为阳性,HEX通道为阴性时,可报告肠杆菌科阳性但阪崎肠杆菌阴性;当FAM通道为阴性,HEX通道为阴性,ROX通道为阳性时,可报告肠杆菌科和阪崎肠杆菌阴性;当FAM通道,HEX通道和ROX通道均为阴性时,为无效的结果应重做实验。
当肠杆菌科和阪崎肠杆菌均为阴性时,可报告沙门氏菌阴性:当肠杆菌科为阳性时,需要按下一步骤进一步单独确证样本中是否含有沙门氏菌。7.9沙门氏菌的确证实验
DNA模板可直接采用7.3已制备的样品DNA模板7.9.1PCR反应所用引物和探针工作液的配制根据表4反应体系中每种引物和探针的终浓度,使用灭菌去离子水配制含有4种目标基因引物的工作液(浓度分别为10Hmol/L)和含有2种探针的工作液(浓度分别为10Hmo1/L)。表4目标基因引物和探针序列及每个反应体系内的终浓度引物和探针名称
沙门氏菌-F
沙门氏菌-R
内部扩增对照(IAC)-F
内部扩增对照(IAC)-R
沙门氏菌探针
IAC探针
5'-AGC CAA CCA TTG CTA AAT TGG CGC A-35'-GGT AGA AAT TCC CAG CGG GTA CTG-3\5'-TGTGAAATACCG CACAGATG-3
5'-AGC TGGCGTAATAGC GAAG-3
5'-FAM-TTTTTCCTCGCTGGCTACCGCTTCA-BHQ-1-35-ROX-TAAGGAGAAAATACCGCATCAGGCGCC-BHQ-2-37.9.2PCR检测体系的配制
每个样品按照表5的加液量配制25反应体系。终浓度(μmol/L)
灭菌去离子水
试剂名称
10×TaqPCR反应缓冲液wwW.bzxz.Net
50mmo1/LMgClz
10 mmo1/L dNTPs
引物工作液
探针工作液
5U/μLTagDNA聚合酶
1 U/μ尿嘧啶-N-糖基化酶
200拷贝/μLpUC19质粒DNA
DNA模板
总体积
PCR检测
目标基因扩增体系配制表
加样体积(L)
将配制完成的反应管放入实时荧光定量PCR仪中,按照如下步骤设置反应条件:反应步骤一:预变性,37℃4min,95℃5min,1个循环;DBS13/003—2015
反应步骤二:扩增和信号收集,95℃变性5s,60℃退火和延伸60S,50个循环,同时收集FAM和ROX的荧光信号。核查反应条件正确后,启动反应程序。7.9.4结果判读
检测样本Ct值小于或等于40时,报告为阳性;Ct值大于40且小于50时,需要重复一次,如果Ct值仍小于50,且曲线有明显的对数增长期,报告为阳性,否则为阴性;样本没有Ct值时,报告为阴性。
具体结果判定参照表6。
沙门氏菌结果判读表
沙门氏菌
内部扩增对照(IAC)
结果判读
沙门氏菌阳性
沙门氏菌阳性
沙门氏菌阴性
无效的结果
当FAM通道为阳性时,可报告沙门氏菌阳性;当FAM通道为阴性,ROX通道为阳性时,可报告沙门氏菌阴性;当FAM通道和ROX通道均为阴性时,为无效的结果应重做实验。8
筛选阪崎肠杆菌和沙门氏菌阳性的样品,需分别按GB4789.40、GB4789.4进行确证。报告每100g(mL)样本中检出或者未检出阪崎肠杆菌和沙门氏菌。6
附录A
(规范性附录)
培养基和试剂的配制
除有特殊说明外,所有实验用试剂均为分析纯。缓冲蛋白陈水(BPW)
蛋白陈
氯化钠
磷酸氢二钠(Na,HPO·12H,O)
磷酸二氢钾
蒸馏水
A.1.2制法
加热搅拌至溶解,调节pH,121℃高压灭菌15min。A.2
营养肉汤培养基(NB)
蛋白陈
牛肉粉
氯化钠
蒸馏水
加热搅拌至溶解,调节pH,121℃高压灭菌15min。A.3
125μg/mL溴化乙锭单叠氮溴溶液(EMA)A.3.1成分
溴化乙锭单叠氮溴
灭菌超纯水
A.3.2制法
将125mg溴化乙锭单叠氮溴加至1000mL灭菌超纯水中,混匀。A.4
50mmol/L的MgClz溶液
1000mL
1000mL
1000mL
DBS13/003—2015
A.4.1成分
超纯水
A.4.2制法
将上述各成分搅拌溶解,定容至1L,分装,121℃高压灭菌15min,备用。DBS13/003—2015
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
河北省地
DBS13/003—2015
食品安全地方标准
阪崎肠杆菌和沙门氏菌检测
2015-04-23发布
2015-05-01实施
河北省卫生和计划生育委员会发布前
本标准按GB/T1.1-2009规定的格式编写本标准由河北省卫生和计划生育委员会归口。本标准于2015年4月23日首次发布。言
DBS13/003—2015
1范围
食品安全地方标准
阪崎肠杆菌和沙门氏菌检测
本标准适用于应用实时荧光定量PCR法定性检测阪崎肠杆菌和沙门氏菌。2
规范性引用文件
DBS13/003—2015
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅所注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。GB4789.4食品安全国家标准食品微生物学检验沙门氏菌检验。GB4789.40食品安全国家标准食品微生物学检验阪崎肠杆菌检验。方法提要
阪崎肠杆菌和沙门氏菌均属于肠杆菌科,本检测方法首先对肠杆菌科和阪崎肠杆菌进行同步检测当肠杆菌科为阴性时可直接报告沙门氏菌阴性:当肠杆菌科为阳性时再进行沙门氏菌的检测:当阪崎肠杆菌为阳性时需按照GB4789.40进行确证;当沙门氏菌为阳性时需按照GB4789.4进行确证。设备和材料
除微生物实验室常规灭菌及培养设备外,其他设备和材料如下:4.1二级生物安全柜
4.2磁力搅拌器:0-2400r/min。4.3
3卤素灯:500W。
低温离心管架:1.5mL,0℃。
水浴锅或金属恒温加热器:5℃-100℃。4.6漩涡振荡器。
离心机:12000r/min。
移液器及对应吸头:10μL、100μ200μ、1000μL。超净工作台。
实时荧光定量PCR仪(含有FAM-,HEX-和ROX-检测通道)。冰箱:2℃一8℃和-20℃两种。
2天平:感量0.1g。
4.130.2mL8联排管以及8联排帽(与PCR仪配套使用)4.141.5mL无菌透明离心管。
恒温培养箱:25℃±1℃,36℃±1℃,44℃±0.5℃。无菌锥形瓶:容量100mL、200mL、2000mL。培养基和试剂
除有特殊说明外,所有实验用试剂均为分析纯。5.1缓冲蛋白陈水(BPW):见附录A.1。5.2营养肉汤培养基(NB):见附录A.2。5.3
125Hg/mL溴化乙锭单叠氮溴溶液(EMA):见附录A.3。5.4DNA提取缓冲液:0.1%Chelex100(螯合树脂)水溶液。5.5
吐温80。
按照表1和表4的序列合成的引物和标记的探针。TaqDNA聚合酶:5U/μL
TagPCR缓冲液。
50mmol/LMgC1溶液:见附录A.4。5.10
dNTPs(dATP,dUTP,dCTP,dGTP),浓度均为10mmol/L。尿嘧啶-N-糖基化酶:1U/L。
pUC19质粒DNA,200拷贝/μL。
阪崎肠杆菌质控菌株:ATCC29544,或等效菌株。5.14
沙门氏菌质控菌株:ATCC13311,或等效菌株。5.15大肠杆菌质控菌株:ATCC10536,或等效菌株。金黄色葡萄球菌:CICC10301,或其它非肠杆菌科的阴性质控等效菌株。5.16
检验程序
检验程序见图1。
DBS13/003—2015
检样100g(mL)加入到900mLBPW中进行首次增菌36℃±1℃,16h-20h
50L首次增菌样品加入到450BPW中进行二次增菌36℃±1℃3h-4h
100μ二次增菌样品加入到EMA溶液中(灭活死亡细胞的DNA)DNA 的提取
实时荧光定量PCR检测
GB4789.40、GB4789.4进行确证
操作步骤
7.1首次增菌
图1检验程序
结果报告
DBS13/003—2015
称取样品100g(mL)加入到900mL.预热至37℃C的BPW中,充分混匀,36C+1℃培养16h20 h。
对于含有超过20%脂肪含量的样品,需要在BPW中加入1g/L(每10%脂肪含量)的吐温80。7.2二次增菌
充分摇匀首次增菌液,吸取50μ转种于450预热至37℃的BPW中,36℃±1℃培养3h-4h。7.3样品模板DNA的制备
7.3.1吸取100μ二次增菌液加入到1.5mL无菌透明离心管中;加入400μEMA溶液,室温下暗室培养5min。
7.3.2将离心管放入低温离心管架中,置于500W卤素灯正下方,相距15cm-20cm,曝光5min后,10000r/min离心5min。
7.3.3用移液器移除上清液,加入200DNA提取缓冲液,充分混匀后,置于95℃-100℃水浴锅或金属恒温加热器中维持10min。7.3.4室温下静置1min,振荡混匀,12000r/min离心2min,上清液即为DNA模板7.4质控菌株模板DNA的制备
DBS13/003—2015
分别接种供试的阳性对照菌株(大肠杆菌、阪崎肠杆菌、沙门氏菌)和阴性对照菌株(金黄色葡萄球菌)到10mLNB培养液中,36℃±1℃培养过夜,各取1.5mL增菌液,同上离心、提取DNA模板,5PCR反应所用引物和探针工作液的配制7.5
根据表1反应体系中每种引物和探针的终浓度,使用灭菌去离子水配制含有6种目标基因引物的工作液(浓度分别为10Hmo1/L)和含有3种探针的工作液(浓度分别为10Hmo1/L)。目标基因引物和探针序列及每个反应体系内的终浓度表1
引物和探针名称
肠杆菌科-F
肠杆菌科-R
阪崎肠杆菌-F
阪崎肠杆菌-R
内部扩增对照(IAC)-F
内部扩增对照(IAC)-R
肠杆菌科探针
阪崎肠杆菌探针
IAC探针
5'-CTG AAA GCA TCT AAG CAC GAA ACT TG-35'-GTCGTCTTCAACGTTCCTTCAGG-35-AGGGGATATTGTCCCCTGAAACAG-35'-AAA CGA GAA TAA GCC GCG CAT T-35-TGT GAA ATA CCG CAC AGA TG-35'-AGCTGG CGTAAT AGC GAA G-3\5′-FAM-CCCGAGATGAGTTCTCCCTGASMCTTTAAGT-BHQ-13\5'-HEX-AGAGTAGTAGTTGTAGAGGCCGTGCTTCCGAAAG-BHQ-1-3'5'-ROX-TAAGGAGAAAATACCGCATCAGGCGCC-BHQ-2-3模板DNA荧光PCR反应体系的配制7.6
每个样品按照表2的加液量配制25μL反应体系。表2
目标基因扩增体系配制表
试剂名称
灭菌去离子水
10×TagPCR反应缓冲液
50mmo1/LMgC12
10mmol/LdNTPs
引物工作液
探针工作液
5U/uLTaqDNA聚合酶
1U/uL尿啶-N-糖基化酶
200拷贝/LpUC19质粒DNA
DNA模板
总体积
加样体积(L)
终浓度(Hmol/L)
每次进行PCR反应均需使用pUC19质粒DNA作为内部扩增对照,并设置阳性、阴性和空白对照(灭菌去离子水)。
肠杆菌科和阪崎肠杆菌实时荧光定量PCR检测将配制完成的反应管放入实时荧光定量PCR仪中,按照如下步骤设置反应条件:反应步骤一:预变性,37℃4min,95℃5min,1个循环:4
DBS13/003—2015
反应步骤二:扩增和信号收集,95℃变性10s,65℃退火和延伸(每个循环降低0.1℃)70s,40个循环,同时收集FAM,HEX和ROX的荧光信号。核查反应条件正确后,启动反应程序。7.8结果判读
当检测样本Ct值小于或等于35时,报告为阳性:Ct值大于35且小于40时,需要重复一次,如果Ct值仍小于40,且曲线有明显的对数增长期,报告为阳性,否则为阴性;样本没有Ct值时,报告为阴性。
具体结果判定参照表3。
表3肠杆菌科和阪崎肠杆菌结果判读表肠杆菌科
阪崎肠杆菌
内部扩增对照(IAC)
阳性或阴性
阳性或阴性
结果判读
肠杆菌科及阪崎肠杆菌阳性,可能含有沙门氏菌肠杆菌科阳性,阪崎肠杆菌阴性,可能含有沙门氏菌肠杆菌科、阪崎肠杆菌及沙门氏菌阴性无效的结果
当FAM通道为阳性,HEX通道为阳性时,可报告肠杆菌科和阪崎肠杆菌阳性:当FAM通道为阳性,HEX通道为阴性时,可报告肠杆菌科阳性但阪崎肠杆菌阴性;当FAM通道为阴性,HEX通道为阴性,ROX通道为阳性时,可报告肠杆菌科和阪崎肠杆菌阴性;当FAM通道,HEX通道和ROX通道均为阴性时,为无效的结果应重做实验。
当肠杆菌科和阪崎肠杆菌均为阴性时,可报告沙门氏菌阴性:当肠杆菌科为阳性时,需要按下一步骤进一步单独确证样本中是否含有沙门氏菌。7.9沙门氏菌的确证实验
DNA模板可直接采用7.3已制备的样品DNA模板7.9.1PCR反应所用引物和探针工作液的配制根据表4反应体系中每种引物和探针的终浓度,使用灭菌去离子水配制含有4种目标基因引物的工作液(浓度分别为10Hmol/L)和含有2种探针的工作液(浓度分别为10Hmo1/L)。表4目标基因引物和探针序列及每个反应体系内的终浓度引物和探针名称
沙门氏菌-F
沙门氏菌-R
内部扩增对照(IAC)-F
内部扩增对照(IAC)-R
沙门氏菌探针
IAC探针
5'-AGC CAA CCA TTG CTA AAT TGG CGC A-35'-GGT AGA AAT TCC CAG CGG GTA CTG-3\5'-TGTGAAATACCG CACAGATG-3
5'-AGC TGGCGTAATAGC GAAG-3
5'-FAM-TTTTTCCTCGCTGGCTACCGCTTCA-BHQ-1-35-ROX-TAAGGAGAAAATACCGCATCAGGCGCC-BHQ-2-37.9.2PCR检测体系的配制
每个样品按照表5的加液量配制25反应体系。终浓度(μmol/L)
灭菌去离子水
试剂名称
10×TaqPCR反应缓冲液wwW.bzxz.Net
50mmo1/LMgClz
10 mmo1/L dNTPs
引物工作液
探针工作液
5U/μLTagDNA聚合酶
1 U/μ尿嘧啶-N-糖基化酶
200拷贝/μLpUC19质粒DNA
DNA模板
总体积
PCR检测
目标基因扩增体系配制表
加样体积(L)
将配制完成的反应管放入实时荧光定量PCR仪中,按照如下步骤设置反应条件:反应步骤一:预变性,37℃4min,95℃5min,1个循环;DBS13/003—2015
反应步骤二:扩增和信号收集,95℃变性5s,60℃退火和延伸60S,50个循环,同时收集FAM和ROX的荧光信号。核查反应条件正确后,启动反应程序。7.9.4结果判读
检测样本Ct值小于或等于40时,报告为阳性;Ct值大于40且小于50时,需要重复一次,如果Ct值仍小于50,且曲线有明显的对数增长期,报告为阳性,否则为阴性;样本没有Ct值时,报告为阴性。
具体结果判定参照表6。
沙门氏菌结果判读表
沙门氏菌
内部扩增对照(IAC)
结果判读
沙门氏菌阳性
沙门氏菌阳性
沙门氏菌阴性
无效的结果
当FAM通道为阳性时,可报告沙门氏菌阳性;当FAM通道为阴性,ROX通道为阳性时,可报告沙门氏菌阴性;当FAM通道和ROX通道均为阴性时,为无效的结果应重做实验。8
筛选阪崎肠杆菌和沙门氏菌阳性的样品,需分别按GB4789.40、GB4789.4进行确证。报告每100g(mL)样本中检出或者未检出阪崎肠杆菌和沙门氏菌。6
附录A
(规范性附录)
培养基和试剂的配制
除有特殊说明外,所有实验用试剂均为分析纯。缓冲蛋白陈水(BPW)
蛋白陈
氯化钠
磷酸氢二钠(Na,HPO·12H,O)
磷酸二氢钾
蒸馏水
A.1.2制法
加热搅拌至溶解,调节pH,121℃高压灭菌15min。A.2
营养肉汤培养基(NB)
蛋白陈
牛肉粉
氯化钠
蒸馏水
加热搅拌至溶解,调节pH,121℃高压灭菌15min。A.3
125μg/mL溴化乙锭单叠氮溴溶液(EMA)A.3.1成分
溴化乙锭单叠氮溴
灭菌超纯水
A.3.2制法
将125mg溴化乙锭单叠氮溴加至1000mL灭菌超纯水中,混匀。A.4
50mmol/L的MgClz溶液
1000mL
1000mL
1000mL
DBS13/003—2015
A.4.1成分
超纯水
A.4.2制法
将上述各成分搅拌溶解,定容至1L,分装,121℃高压灭菌15min,备用。DBS13/003—2015
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。