GB/T 34224-2017
基本信息
标准号: GB/T 34224-2017
中文名称:生物产品中功能性微生物检测
标准类别:国家标准(GB)
英文名称:Method for determination of functional microorganism in biologic products
标准状态:现行
发布日期:2017-09-07
实施日期:2018-04-01
出版语种:简体中文
下载格式:.rar .pdf
下载大小:2332KB

标准分类号
标准ICS号: 数学、自然科学>>07.080生物学、植物学、动物学
中标分类号:综合>>基础标准>>A21环境条件与通用试验方法
关联标准
出版信息
出版社:中国标准出版社
页数:44页
标准价格:70.0
出版日期:2017-09-01
相关单位信息
起草人:张岩、王彦波、傅玲琳、赵峰、马爱进、王丽霞、王顺余、吕品、周巍、孙勇、郑磊、康文艺、周鹏、刘道亮、柴艳兵、张耀广、郜晓峰、刘忠甫、李永波
起草单位:河北省食品检验研究院、浙江工商大学、中国水产科学研究院黄海水产研究所、中国标准化研究院、浙江李子园食品股份有限公司、河北医科大学、北京食品科学研究院、合肥工业大学、河南大学、江南大学、河北省出入境检验检疫局、石家庄君乐宝乳业有限公司 等
提出单位:中国标准化研究院
发布部门:中华人民共和国国家质量监督检验检疫总局 中国国家标准化管理委员会
标准简介
GB/T 34224-2017 生物产品中功能性微生物检测
GB/T34224-2017
标准压缩包解压密码:www.bzxz.net
本标准规定了生物产品中功能性微生物检验的基本原则、一般要求和检验方法。本标准适用于生物产品中植物乳杆菌(Lactobacillus plantarum)、嗜酸乳杆菌(Lactobacillus acidophilus)、 枯草芽孢杆菌(Bacillus subtilis)、地衣芽孢杆菌检测(Bacillus licheniformis)、粪肠球菌(Enterococcus faecalis)、屎肠球菌(Enterococcus faecium)、产朊假丝酵母(Candida utilis)和酿酒酵母(Saccharomyces cerevisiae)的检验.
本标准规定了生物产品中功能性微生物检验的基本原则、一般要求和检验方法。本标准适用于生物产品中植物乳杆菌(Lactobacillus plantarum)、嗜酸乳杆菌(Lactobacillus acidophilus)、 枯草芽孢杆菌(Bacillus subtilis)、地衣芽孢杆菌检测(Bacillus licheniformis)、粪肠球菌(Enterococcus faecalis)、屎肠球菌(Enterococcus faecium)、产朊假丝酵母(Candida utilis)和酿酒酵母(Saccharomyces cerevisiae)的检验.
标准图片预览




标准内容
ICS07.080
中华人民共和国国家标准
GB/T34224—2017
生物产品中功能性微生物检测
Method for determination of functional microorganism in biologic products2017-09-07发布
中华人民共和国国家质量监督检验检疫总局中国国家标准化管理委员会
2018-04-01实施
本标准按照GB/T1.1—2009给出的规则起草。本标准由中国标准化研究院提出并归口。GB/T34224—2017
本标准起草单位:河北省食品检验研究院、浙江工商大学、中国水产科学研究院黄海水产研究所、中国标准化研究院、浙江李子园食品股份有限公司、河北医科大学、北京食品科学研究院、合肥工业大学,河南大学、江南大学、河北省出入境检验检疫局、石家庄君乐宝乳业有限公司、荣成市华通海洋生物科技有限公司。
本标准主要起草人:张岩、王彦波、傅玲琳、赵峰、马爱进、王丽霞、王顺余、吕品、周巍、孙勇、郑磊、康文艺、周鹏、刘道亮、柴艳兵、张耀广、部晓峰、刘忠甫、李永波。1范围
生物产品中功能性微生物检测
GB/T34224—2017
本标准规定了生物产品中功能性微生物检验的基本原则、一般要求和检验方法。本标准适用于生物产品中植物乳杆菌(Lactobacillusplantarum)、嗜酸乳杆菌(Lactobacillusacidophilus)、枯草芽孢杆菌(Bacillussubtilis)、地衣芽孢杆菌检测(Bacilluslicheniformis)、粪肠球菌(Enterococcusfaecalis)、屎肠球菌(Enterococcusfaecium)、产假丝酵母(Candidautilis)和酿酒醇母(Saccharomycescerevisiae)的检验。规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件GB4789.1食品安全国家标准食品微生物学检验总则GB4789.28食品安全国家标准食品微生物学检验培养基和试剂的质量要求GB19489实验室生物安全通用要求GB/T27405实验室质量控制规范食品微生物检测RB/T151
食品微生物定量检测的测量不确定度评估指南SN/T0330
SN/T2632
SN/T2660
3术语和定义
出口食品微生物学检验通则
微生物菌种常规保藏技术规程
食品微生物实验室菌种保藏方法下列术语和定义适用于本文件,3.1
biologic products
生物产品
与生物有关的工业产品。
注:本标准中的生物产品特指功能性微生物经过工业化生产扩繁后加工制成的活菌制剂及添加了该类制剂的产品。
functional microorganism
功能性微生物
一定条件下,具有确切调节改良功能的活的微生物菌株。3.3
菌落形成单位
colony-formingunits;CFU
在活菌培养计数时,由单个菌体或聚集成团的多个菌体在固体培养基上生长繁殖所形成的集落。1
GB/T34224—2017
4总则
按照本标准执行的功能性微生物检验应符合SN/T0330的规定。4.1
实验室生物安全要求应符合GB19489的规定。实验室人员应满足GB4789.1的规定。4.4
菌株保存应符合SN/T2632和SN/T2660的规定培养基和试剂的质量要求应符合GB4789.28的规定。实验室质量控制应符合GB/T27405的规定。定量检测数值修约按“四舍五人\原则进行,报告单位为CFU/g/(CFU/mL)。定量检测的测量不4.7
确定度评估按照RB/T151的要求执行4.8
检验结果报告后,被检样品方能处理。样品要经过无害化处理。植物乳杆菌
设备和材料
除微生物实验室常规灭菌及培养设备外,其他设备和材料如下。5.1.1恒温厌氧培养箱:37℃土1℃。5.1.2冰箱:2℃~5℃。
5.1.3天平:感量为0.1g。
5.1.4均质器及无菌均质袋、均质杯。5.1.5振荡器
5.1.6无菌吸管:1mL(具0.01mL刻度)、10mL(具0.1mL刻度)或微量移液器及吸头。5.1.7无菌锥形瓶:容量250mL、500mL。5.1.8无菌培养皿:直径90mm。
5.1.9显微镜:10倍~100倍。
pH计或pH比色管或精密pH试纸。5.1.10
培养基和试剂
MRS(ManRogosaSharpe)琼脂培养基:见附录A中A.1。MRS肉汤培养基:见A.2。
无菌生理盐水:见A.10。
5.2.4革兰氏染色液:见A.11。
5.2.5细菌生化鉴定试剂盒。
检验程序
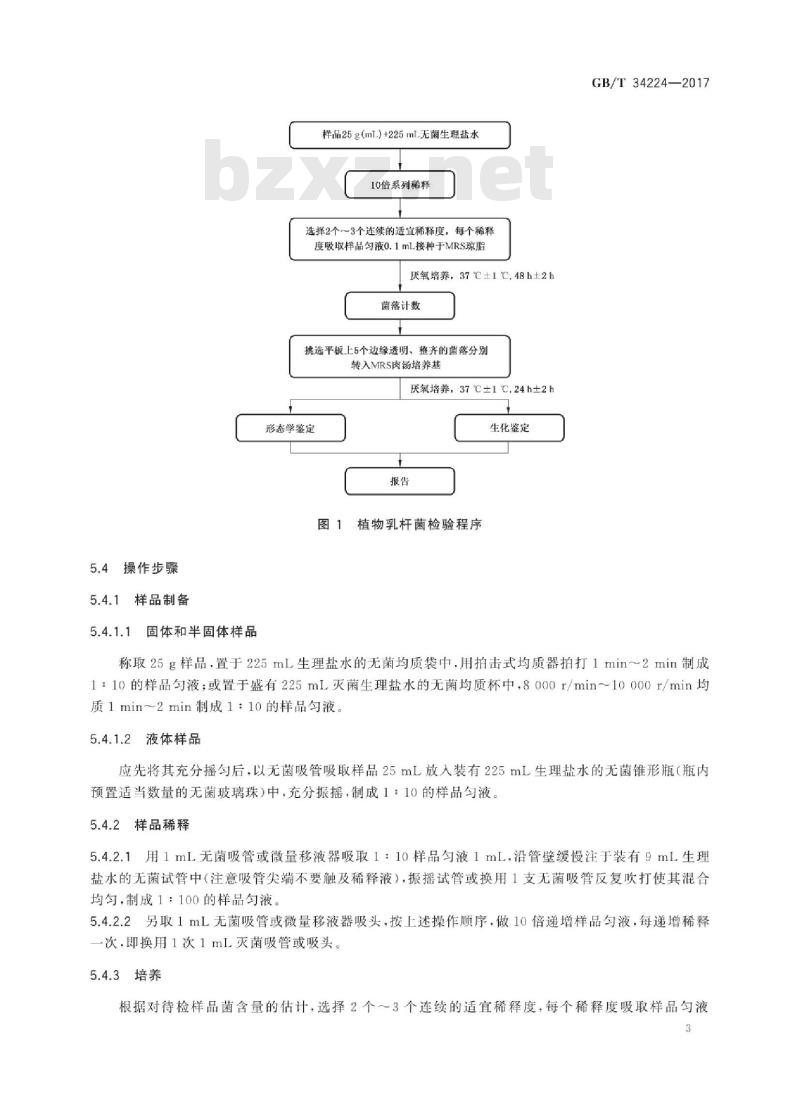
植物乳杆菌检验程序见图1。
5.4操作步骤
5.4.1样品制备
1固体和半固体样品免费标准bzxz.net
样品25g(mL)+225mL无菌生理盐水10倍系列稀释
选择2个~3个连续的适宜稀释度,每个稀释度吸取样品匀液0.1mL接种于MRS琼脂厌氧培养,37℃±1℃,48h2h
菌落计数
挑选平板上5个边缘透明、整齐的菌落分别转入MRS肉荡培养基
厌氧培养,37℃±1℃,24h士2h形态学鉴定
图1植物乳杆菌检验程序
生化鉴定
GB/T34224—2017
称取25g样品,置于225mL生理盐水的无菌均质袋中,用拍击式均质器拍打1min~2min制成1:10的样品匀液;或置于盛有225mL灭菌生理盐水的无菌均质杯中,8000r/min~10000r/min均质1min~2min制成1:10的样品勾液。5.4.1.2液体样品
应先将其充分摇勾后,以无菌吸管吸取样品25mL放入装有225mL生理盐水的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中,充分振摇,制成1:10的样品匀液。5.4.2样品稀释
5.4.2.1用1mL无菌吸管或微量移液器吸取1:10样品勾液1mL.沿管壁缓慢注于装有9mL生理盐水的无菌试管中(注意吸管尖端不要触及稀释液),振摇试管或换用1支无菌吸管反复吹打使其混合均匀,制成1:100的样品匀液。5.4.2.2另取1mL无菌吸管或微量移液器吸头,按上述操作顺序,做10倍递增样品勾液,每递增稀释一次,即换用1次1mL灭菌吸管或吸头。5.4.3培养
根据对待检样品菌含量的估计,选择2个~3个连续的适宜稀释度,每个稀释度吸取样品勾液3
GB/T34224—2017
0.1mL接种于MRS琼脂平板内,使用涂布棒尽可能小心快速地涂布接种液于琼脂表面,涂布棒不得接触平皿边缘。每个稀释度接种2个平板。涂布后,将平板静置10min使接种物完全被培养基吸收。翻转平血置于37℃土1℃厌氧培养箱中培养48h土2h。5.4.4菌落计数
5.4.4.1选取特征菌落数在30CFU~300CFU之间、无蔓延菌落生长的平板计数菌落总数。低于30CFU的平板记录具体菌落数,大于300CFU的可记录为多不可计。每个稀释度的菌落数应采用两个平板的平均数。
5.4.4.2其中一个平板有较大片状菌落生长时,则不宜采用,而应以无片状菌落生长的平板作为该稀释度的菌落数;若片状菌落不到平板的一半,而其余一半中菌落分布又很均勾,即可计算半个平板后乘以2,代表一个平板菌落数。
5.4.4.3当平板上出现菌落间无明显界线的链状生长时,则将每条单链作为一个菌落计数。5.4.5鉴定
5.4.5.1菌落挑选和纯培养
挑选平板上5个边缘透明、整齐的菌落分别转人MRS肉汤培养基37℃土1℃厌氧培养箱中培养24h士2h后进行形态学、生化鉴定。5.4.5.2形态学鉴定
革兰氏染色,镜检。植物乳杆菌为革兰氏阳性杆菌,呈直杆状,长度3.0μm~8.0um,单个、成对或成链状,通常缺少鞭毛,无芽孢。5.4.5.3生化鉴定
使用细菌生化鉴定试剂盒进行生化鉴定。鉴定特征见附录B中表B.1。乳杆菌属常见菌种主要鉴别特征参见附录C中表C.1。
5.5结果计算
5.5.1每个平板中植物乳杆菌的数量每个平板中植物乳杆菌菌落数的计算见式(1):bxc
式中:
每块平板上的植物乳杆菌菌落数;b
挑取后经证实为植物乳杆菌的菌落数;A
挑取平板上用于验证的菌落数:C
平板上的所有特征菌落数。
5.5.2菌落总数的计算方法
..(1)
5.5.2.1若只有一个稀释度平板上的菌落数在适宜计数范围内,计算两个平板中植物乳杆菌菌落数的平均值,再将平均值乘以相应稀释倍数,作为每克(毫升)中菌落总数结果。5.5.2.2若有两个连续稀释度的平板菌落数在适宜计数范围内时,按式(2)计算:N
(n+0.1nz)d
(2)
式中:
5.6报告
样品中菌落数;
平板(含适宜范围菌落数的平板)菌落数之和:第一稀释度(低稀释倍数)平板个数;第二稀释度(高稀释倍数)平板个数:稀释因子(第一稀释度)。
结果判定
若样品菌落符合植物乳杆菌形态学及生化鉴定的特征,可判定为植物乳杆菌5.6.2结果报告
定性报告
在25g(mL)样品中检出或未检出植物乳杆菌。5.6.2.2
定量报告
GB/T34224—2017
菌落数小于100CFU时,以整数报告。菌落数大于或等于100CFU时,对第3位数字进行修约后,取前2位数字,后面用0代替位数:也可用10的指数形式来表示,采用两位有效数字。嗜酸乳杆菌
设备和材料
除微生物实验室常规灭菌及培养设备外,其他设备和材料如下。6.1.1恒温厌氧培养箱:37℃土1℃。6.1.2冰箱:2℃~5℃。
6.1.3天平:感量为0.1g。
6.1.4均质器及无菌均质袋、均质杯。6.1.5振荡器。
无菌吸管:1mL(具0.01mL刻度),10mL(具0.1mL刻度)或微量移液器及吸头。6.1.7
无菌锥形瓶:容量250mL、500mL。无菌培养皿:直径90mm。
显微镜:10倍~100倍。
pH计或pH比色管或精密pH试纸。6.1.10
培养基和试剂
MRS琼脂培养基:见A.1。
MRS肉汤培养基:见A.2。
6.2.3无菌生理盐水:见A.10。
6.2.4革兰氏染色液:见A.11。
6.2.5细菌生化鉴定试剂盒。
GB/T34224—2017
6.3检验程序
嗜酸乳杆菌的检验程序见图2。
样品25g(mL)+225mL无菌生理盐水10倍系列稀释
选择2个~3个连续的适宜稀释度,每个稀释度吸取样品勾液0.1mL接种于MRS琼脂厌氧培养,37℃±1℃,48h2h
菌落计数
挑选平板上5个凸起、表面粗糙、边缘卷曲的菌落分别转入MRS肉汤培养基
厌氧培养,37℃±1℃.24h土2h
形态学鉴定
6.4操作步骤
6.4.1样品制备
固体和半固体样品
图2嗜酸乳杆菌检验程序
生化鉴定
称取25g样品,置于225mL生理盐水的无菌均质袋中,用拍击式均质器拍打1min~2min制成1:10的样品勾液;或置于盛有225mL灭菌生理盐水的无菌均质杯中,8000r/min~10000r/min均质1min~2min制成1:10的样品勾液。6.4.1.2液体样品
应先将其充分摇勾后,以无菌吸管吸取样品25mL放入装有225mL生理盐水的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中,充分振摇,制成1:10的样品勾液。6.4.2样品稀释
6.4.2.1用1mL无菌吸管或微量移液器吸取1:10样品勾液1mL,沿管壁缓慢注于装有9mL生理盐水的无菌试管中(注意吸管尖端不要触及稀释液),振摇试管或换用1支无菌吸管反复吹打使其混合均匀,制成1:100的样品勾液。6.4.2.2另取1mL无菌吸管或微量移液器吸头,按上述操作顺序,做10倍递增样品勾液,每递增稀释一次,即换用1次1mL灭菌吸管或吸头。6
6.4.3培养
GB/T34224—2017
根据对待检样品菌含量的估计,选择2个~3个连续的适宜稀释度,每个稀释度吸取样品匀液0.1mL接种于MRS琼脂平板内,使用涂布棒尽可能小心快速地涂布接种液于琼脂表面,涂布棒不得接触平皿边缘。每个稀释度接种2个平板。涂布后,将平板静置10min使接种物完全被培养基吸收。翻转平皿置于37℃士1℃厌氧培养箱中培养48h士2h6.4.4菌落计数
6.4.4.1选取特征菌落数在30CFU~300CFU之间、无蔓延菌落生长的平板计数菌落总数。低于30CFU的平板记录具体菌落数,大于300CFU的可记录为多不可计。每个稀释度的菌落数应采用两个平板的平均数。
6.4.4.2其中一个平板有较大片状菌落生长时,则不宜采用,而应以无片状菌落生长的平板作为该稀释度的菌落数;若片状菌落不到平板的一半,而其余一半中菌落分布又很均勾,即可计算半个平板后乘以2,代表一个平板菌落数
6.4.4.3当平板上出现菌落间无明显界线的链状生长时,则将每条单链作为一个菌落计数、6.4.5鉴定
菌落挑选和纯培养
挑选平板上5个凸起、表面粗糙、边缘卷曲的菌落分别转入MRS肉汤培养基37℃土1℃厌氧培养箱中培养24h土2h后进行形态学、生化鉴定。6.4.5.2形态学鉴定
革兰氏染色,镜检。嗜酸乳杆菌为革兰氏阳性杆菌,呈杆状,两端圆,长度0.9μm~6.0um,单个、成对或成链状,无鞭毛,无芽孢。6.4.5.3生化鉴定
使用细菌生化鉴定试剂盒进行生化鉴定。鉴定特征见附录B中表B.2。乳杆菌属常见菌种主要鉴别特征参见附录C中表C.1。
6.5结果计算
6.5.1每个平板中嗜酸乳杆菌的数量每个平板中嗜酸乳杆菌菌落数的计算见式(3):b
式中:
每块平板上的嗜酸乳杆菌菌落数;a
b挑取后经证实为嗜酸乳杆菌的菌落数;A——挑取平板上用于验证的菌落数;平板上的所有特征菌落数、
6.5.2菌落总数的计算方法
(3)
6.5.2.1若只有一个稀释度平板上的菌落数在适宜计数范围内,计算两个平板中嗜酸乳杆菌菌落数的7
GB/T34224—2017
平均值,再将平均值乘以相应稀释倍数,作为每克(毫升)中菌落总数结果2若有两个连续稀释度的平板菌落数在适宜计数范围内时,按式(4)计算:6.5.2.2
式中:
6.6报告
样品中菌落数;
(n+0.1nz)d
平板(含适宜范围菌落数的平板)菌落数之和;第一稀释度(低稀释倍数)平板个数;第二稀释度(高稀释倍数)平板个数;稀释因子(第一稀释度)。
结果判定
若样品菌落符合嗜酸乳杆菌形态学及生化鉴定的特征,可判定为嗜酸乳杆菌。6.6.2
结果报告
6.6.2.1定性报告
在25g(mL)样品中检出或未检出嗜酸乳杆菌。6.6.2.2
定量报告
.(4)
菌落数小于100CFU时,以整数报告。菌落数大于或等于100CFU时,对第3位数字进行修约后,取前2位数字,后面用0代替位数;也可用10的指数形式来表示,采用两位有效数字。7枯草芽孢杆菌
设备和材料
除微生物实验室常规灭菌及培养设备外,其他设备和材料如下。7.1.1恒温培养箱:37℃土1℃。7.1.2冰箱:2℃~5℃。
7.1.3恒温水浴箱:80℃士1℃。7.1.4天平:感量为0.1g。
7.1.5均质器及无菌均质袋、均质杯。7.1.6振荡器。
无菌吸管:1mL(具0.01mL刻度)、10mL(具0.1mL刻度)或微量移液器及吸头。7.1.7
7.1.8无菌锥形瓶:容量250mL、500mL。7.1.9无菌培养皿:直径90mm。
显微镜:10倍~100倍。
pH计或pH比色管或精密pH试纸。7.2培养基和试剂
营养琼脂培养基:见A.3。
营养肉汤培养基:见A.4。
7.2.3无菌生理盐水:见A.10。
7.2.4革兰氏染色液:见A.11。
7.2.5细菌生化鉴定试剂盒。
检验程序
枯草芽孢杆菌的检验程序见图3。样品25g(mL)+225mL无菌生理盐水10倍系列稀释
选择2个~3个连续的适宜稀释度,每个稀释度水浴80℃±1℃维持10min,吸取菌液0.2mL接种于营养琼脂平板内
37 C±1 C, 48 h±2 h
菌落计数
挑选平板上5个表面粗糙、不透明,灰色或微黄色的菌落分别转入营养肉汤培养基37℃±1℃.24h±2h
形态学鉴定
生化鉴定
图3枯草芽孢杆菌检验程序
7.4操作步骤
7.4.1样品制备
固体和半固体样品
GB/T34224—2017
称取25g样品,置于225mL生理盐水的无菌均质袋中,用拍击式均质器拍打1min2min制成1:10的样品勾液:或置于盛有225mL灭菌生理盐水的无菌均质杯中,8000r/min~10000/min均质1min~2min制成1:10的样品勾液。7.4.1.2液体样品
应先将其充分摇勾后.以无菌吸管吸取样品25mL放入装有225mL生理盐水的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中,充分振摇,制成1:10的样品匀液。7.4.2样品稀释
7.4.2.1用1mL无菌吸管或微量移液器吸取1:10样品勾液1mL沿管壁缓慢注于装有9mL生理盐水的无菌试管中(注意吸管尖端不要触及稀释液),振摇试管或换用1支无菌吸管反复吹打使其混合9
GB/T34224—2017
均匀,制成1:100的样品勾液。7.4.2.2另取1mL无菌吸管或微量移液器吸头,按上述操作顺序,做10倍递增样品勾液,每递增稀释一次,即换用1次1mL灭菌吸管或吸头。7.4.3培养
根据对待检样品菌含量的估计,选择2个~3个连续的适宜稀释度,每个稀释度水浴80℃土1℃维持10min,吸取菌液0.2mL接种于营养琼脂平板内,使用涂布棒尽可能小心快速地涂布接种液于琼脂表面,涂布棒不得接触平皿边缘。每个稀释度接种2个平板。涂布后,将平板静置10min使接种物完全被培养基吸收。翻转平皿置于37℃士1℃培养箱中培养48h士2h。7.4.4菌落计数
7.4.4.1选取特征菌落数在20CFU~200CFU之间、无蔓延菌落生长的平板计数菌落总数。低于20CFU的平板记录具体菌落数,大于200CFU的可记录为多不可计。每个稀释度的菌落数应采用两个平板的平均数。
7.4.4.2其中一个平板有较大片状菌落生长时,则不宜采用,而应以无片状菌落生长的平板作为该稀释度的菌落数;若片状菌落不到平板的一半,而其余一半中菌落分布又很均勾,即可计算半个平板后乘以2,代表一个平板菌落数。
7.4.4.3当平板上出现菌落间无明显界线的链状生长时,则将每条单链作为一个菌落计数,7.4.5鉴定
7.4.5.1菌落挑选和纯培养
挑选平板上5个表面粗糙、不透明,灰色或微黄色的菌落分别转人营养肉汤培养基37℃土1℃培养箱中培养24h士2h后进行形态学、生化鉴定,7.4.5.2形态学鉴定
革兰氏染色,镜检。枯草芽孢杆菌为革兰氏阳性杆菌,呈杆状,长度1.5um~3.0μm,无荚膜,周生鞭毛,有芽抱,芽抱椭圆形,中生或近中生,芽抱囊不明显膨大。7.4.5.3生化鉴定
使用细菌生化鉴定试剂盒进行生化鉴定。鉴定特征见附录B中表B.3。7.5结果计算
7.5.1每个平板中枯草芽孢杆菌的数量每个平板中枯草芽孢杆菌菌落数的计算见式(5):b
式中:
每块平板上的枯草芽孢杆菌菌落数;a
挑取后经证实为枯草芽孢杆菌的菌落数;挑取平板上用于验证的菌落数;C——平板上的所有特征菌落数。10
·(5)
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
中华人民共和国国家标准
GB/T34224—2017
生物产品中功能性微生物检测
Method for determination of functional microorganism in biologic products2017-09-07发布
中华人民共和国国家质量监督检验检疫总局中国国家标准化管理委员会
2018-04-01实施
本标准按照GB/T1.1—2009给出的规则起草。本标准由中国标准化研究院提出并归口。GB/T34224—2017
本标准起草单位:河北省食品检验研究院、浙江工商大学、中国水产科学研究院黄海水产研究所、中国标准化研究院、浙江李子园食品股份有限公司、河北医科大学、北京食品科学研究院、合肥工业大学,河南大学、江南大学、河北省出入境检验检疫局、石家庄君乐宝乳业有限公司、荣成市华通海洋生物科技有限公司。
本标准主要起草人:张岩、王彦波、傅玲琳、赵峰、马爱进、王丽霞、王顺余、吕品、周巍、孙勇、郑磊、康文艺、周鹏、刘道亮、柴艳兵、张耀广、部晓峰、刘忠甫、李永波。1范围
生物产品中功能性微生物检测
GB/T34224—2017
本标准规定了生物产品中功能性微生物检验的基本原则、一般要求和检验方法。本标准适用于生物产品中植物乳杆菌(Lactobacillusplantarum)、嗜酸乳杆菌(Lactobacillusacidophilus)、枯草芽孢杆菌(Bacillussubtilis)、地衣芽孢杆菌检测(Bacilluslicheniformis)、粪肠球菌(Enterococcusfaecalis)、屎肠球菌(Enterococcusfaecium)、产假丝酵母(Candidautilis)和酿酒醇母(Saccharomycescerevisiae)的检验。规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件GB4789.1食品安全国家标准食品微生物学检验总则GB4789.28食品安全国家标准食品微生物学检验培养基和试剂的质量要求GB19489实验室生物安全通用要求GB/T27405实验室质量控制规范食品微生物检测RB/T151
食品微生物定量检测的测量不确定度评估指南SN/T0330
SN/T2632
SN/T2660
3术语和定义
出口食品微生物学检验通则
微生物菌种常规保藏技术规程
食品微生物实验室菌种保藏方法下列术语和定义适用于本文件,3.1
biologic products
生物产品
与生物有关的工业产品。
注:本标准中的生物产品特指功能性微生物经过工业化生产扩繁后加工制成的活菌制剂及添加了该类制剂的产品。
functional microorganism
功能性微生物
一定条件下,具有确切调节改良功能的活的微生物菌株。3.3
菌落形成单位
colony-formingunits;CFU
在活菌培养计数时,由单个菌体或聚集成团的多个菌体在固体培养基上生长繁殖所形成的集落。1
GB/T34224—2017
4总则
按照本标准执行的功能性微生物检验应符合SN/T0330的规定。4.1
实验室生物安全要求应符合GB19489的规定。实验室人员应满足GB4789.1的规定。4.4
菌株保存应符合SN/T2632和SN/T2660的规定培养基和试剂的质量要求应符合GB4789.28的规定。实验室质量控制应符合GB/T27405的规定。定量检测数值修约按“四舍五人\原则进行,报告单位为CFU/g/(CFU/mL)。定量检测的测量不4.7
确定度评估按照RB/T151的要求执行4.8
检验结果报告后,被检样品方能处理。样品要经过无害化处理。植物乳杆菌
设备和材料
除微生物实验室常规灭菌及培养设备外,其他设备和材料如下。5.1.1恒温厌氧培养箱:37℃土1℃。5.1.2冰箱:2℃~5℃。
5.1.3天平:感量为0.1g。
5.1.4均质器及无菌均质袋、均质杯。5.1.5振荡器
5.1.6无菌吸管:1mL(具0.01mL刻度)、10mL(具0.1mL刻度)或微量移液器及吸头。5.1.7无菌锥形瓶:容量250mL、500mL。5.1.8无菌培养皿:直径90mm。
5.1.9显微镜:10倍~100倍。
pH计或pH比色管或精密pH试纸。5.1.10
培养基和试剂
MRS(ManRogosaSharpe)琼脂培养基:见附录A中A.1。MRS肉汤培养基:见A.2。
无菌生理盐水:见A.10。
5.2.4革兰氏染色液:见A.11。
5.2.5细菌生化鉴定试剂盒。
检验程序
植物乳杆菌检验程序见图1。
5.4操作步骤
5.4.1样品制备
1固体和半固体样品免费标准bzxz.net
样品25g(mL)+225mL无菌生理盐水10倍系列稀释
选择2个~3个连续的适宜稀释度,每个稀释度吸取样品匀液0.1mL接种于MRS琼脂厌氧培养,37℃±1℃,48h2h
菌落计数
挑选平板上5个边缘透明、整齐的菌落分别转入MRS肉荡培养基
厌氧培养,37℃±1℃,24h士2h形态学鉴定
图1植物乳杆菌检验程序
生化鉴定
GB/T34224—2017
称取25g样品,置于225mL生理盐水的无菌均质袋中,用拍击式均质器拍打1min~2min制成1:10的样品匀液;或置于盛有225mL灭菌生理盐水的无菌均质杯中,8000r/min~10000r/min均质1min~2min制成1:10的样品勾液。5.4.1.2液体样品
应先将其充分摇勾后,以无菌吸管吸取样品25mL放入装有225mL生理盐水的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中,充分振摇,制成1:10的样品匀液。5.4.2样品稀释
5.4.2.1用1mL无菌吸管或微量移液器吸取1:10样品勾液1mL.沿管壁缓慢注于装有9mL生理盐水的无菌试管中(注意吸管尖端不要触及稀释液),振摇试管或换用1支无菌吸管反复吹打使其混合均匀,制成1:100的样品匀液。5.4.2.2另取1mL无菌吸管或微量移液器吸头,按上述操作顺序,做10倍递增样品勾液,每递增稀释一次,即换用1次1mL灭菌吸管或吸头。5.4.3培养
根据对待检样品菌含量的估计,选择2个~3个连续的适宜稀释度,每个稀释度吸取样品勾液3
GB/T34224—2017
0.1mL接种于MRS琼脂平板内,使用涂布棒尽可能小心快速地涂布接种液于琼脂表面,涂布棒不得接触平皿边缘。每个稀释度接种2个平板。涂布后,将平板静置10min使接种物完全被培养基吸收。翻转平血置于37℃土1℃厌氧培养箱中培养48h土2h。5.4.4菌落计数
5.4.4.1选取特征菌落数在30CFU~300CFU之间、无蔓延菌落生长的平板计数菌落总数。低于30CFU的平板记录具体菌落数,大于300CFU的可记录为多不可计。每个稀释度的菌落数应采用两个平板的平均数。
5.4.4.2其中一个平板有较大片状菌落生长时,则不宜采用,而应以无片状菌落生长的平板作为该稀释度的菌落数;若片状菌落不到平板的一半,而其余一半中菌落分布又很均勾,即可计算半个平板后乘以2,代表一个平板菌落数。
5.4.4.3当平板上出现菌落间无明显界线的链状生长时,则将每条单链作为一个菌落计数。5.4.5鉴定
5.4.5.1菌落挑选和纯培养
挑选平板上5个边缘透明、整齐的菌落分别转人MRS肉汤培养基37℃土1℃厌氧培养箱中培养24h士2h后进行形态学、生化鉴定。5.4.5.2形态学鉴定
革兰氏染色,镜检。植物乳杆菌为革兰氏阳性杆菌,呈直杆状,长度3.0μm~8.0um,单个、成对或成链状,通常缺少鞭毛,无芽孢。5.4.5.3生化鉴定
使用细菌生化鉴定试剂盒进行生化鉴定。鉴定特征见附录B中表B.1。乳杆菌属常见菌种主要鉴别特征参见附录C中表C.1。
5.5结果计算
5.5.1每个平板中植物乳杆菌的数量每个平板中植物乳杆菌菌落数的计算见式(1):bxc
式中:
每块平板上的植物乳杆菌菌落数;b
挑取后经证实为植物乳杆菌的菌落数;A
挑取平板上用于验证的菌落数:C
平板上的所有特征菌落数。
5.5.2菌落总数的计算方法
..(1)
5.5.2.1若只有一个稀释度平板上的菌落数在适宜计数范围内,计算两个平板中植物乳杆菌菌落数的平均值,再将平均值乘以相应稀释倍数,作为每克(毫升)中菌落总数结果。5.5.2.2若有两个连续稀释度的平板菌落数在适宜计数范围内时,按式(2)计算:N
(n+0.1nz)d
(2)
式中:
5.6报告
样品中菌落数;
平板(含适宜范围菌落数的平板)菌落数之和:第一稀释度(低稀释倍数)平板个数;第二稀释度(高稀释倍数)平板个数:稀释因子(第一稀释度)。
结果判定
若样品菌落符合植物乳杆菌形态学及生化鉴定的特征,可判定为植物乳杆菌5.6.2结果报告
定性报告
在25g(mL)样品中检出或未检出植物乳杆菌。5.6.2.2
定量报告
GB/T34224—2017
菌落数小于100CFU时,以整数报告。菌落数大于或等于100CFU时,对第3位数字进行修约后,取前2位数字,后面用0代替位数:也可用10的指数形式来表示,采用两位有效数字。嗜酸乳杆菌
设备和材料
除微生物实验室常规灭菌及培养设备外,其他设备和材料如下。6.1.1恒温厌氧培养箱:37℃土1℃。6.1.2冰箱:2℃~5℃。
6.1.3天平:感量为0.1g。
6.1.4均质器及无菌均质袋、均质杯。6.1.5振荡器。
无菌吸管:1mL(具0.01mL刻度),10mL(具0.1mL刻度)或微量移液器及吸头。6.1.7
无菌锥形瓶:容量250mL、500mL。无菌培养皿:直径90mm。
显微镜:10倍~100倍。
pH计或pH比色管或精密pH试纸。6.1.10
培养基和试剂
MRS琼脂培养基:见A.1。
MRS肉汤培养基:见A.2。
6.2.3无菌生理盐水:见A.10。
6.2.4革兰氏染色液:见A.11。
6.2.5细菌生化鉴定试剂盒。
GB/T34224—2017
6.3检验程序
嗜酸乳杆菌的检验程序见图2。
样品25g(mL)+225mL无菌生理盐水10倍系列稀释
选择2个~3个连续的适宜稀释度,每个稀释度吸取样品勾液0.1mL接种于MRS琼脂厌氧培养,37℃±1℃,48h2h
菌落计数
挑选平板上5个凸起、表面粗糙、边缘卷曲的菌落分别转入MRS肉汤培养基
厌氧培养,37℃±1℃.24h土2h
形态学鉴定
6.4操作步骤
6.4.1样品制备
固体和半固体样品
图2嗜酸乳杆菌检验程序
生化鉴定
称取25g样品,置于225mL生理盐水的无菌均质袋中,用拍击式均质器拍打1min~2min制成1:10的样品勾液;或置于盛有225mL灭菌生理盐水的无菌均质杯中,8000r/min~10000r/min均质1min~2min制成1:10的样品勾液。6.4.1.2液体样品
应先将其充分摇勾后,以无菌吸管吸取样品25mL放入装有225mL生理盐水的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中,充分振摇,制成1:10的样品勾液。6.4.2样品稀释
6.4.2.1用1mL无菌吸管或微量移液器吸取1:10样品勾液1mL,沿管壁缓慢注于装有9mL生理盐水的无菌试管中(注意吸管尖端不要触及稀释液),振摇试管或换用1支无菌吸管反复吹打使其混合均匀,制成1:100的样品勾液。6.4.2.2另取1mL无菌吸管或微量移液器吸头,按上述操作顺序,做10倍递增样品勾液,每递增稀释一次,即换用1次1mL灭菌吸管或吸头。6
6.4.3培养
GB/T34224—2017
根据对待检样品菌含量的估计,选择2个~3个连续的适宜稀释度,每个稀释度吸取样品匀液0.1mL接种于MRS琼脂平板内,使用涂布棒尽可能小心快速地涂布接种液于琼脂表面,涂布棒不得接触平皿边缘。每个稀释度接种2个平板。涂布后,将平板静置10min使接种物完全被培养基吸收。翻转平皿置于37℃士1℃厌氧培养箱中培养48h士2h6.4.4菌落计数
6.4.4.1选取特征菌落数在30CFU~300CFU之间、无蔓延菌落生长的平板计数菌落总数。低于30CFU的平板记录具体菌落数,大于300CFU的可记录为多不可计。每个稀释度的菌落数应采用两个平板的平均数。
6.4.4.2其中一个平板有较大片状菌落生长时,则不宜采用,而应以无片状菌落生长的平板作为该稀释度的菌落数;若片状菌落不到平板的一半,而其余一半中菌落分布又很均勾,即可计算半个平板后乘以2,代表一个平板菌落数
6.4.4.3当平板上出现菌落间无明显界线的链状生长时,则将每条单链作为一个菌落计数、6.4.5鉴定
菌落挑选和纯培养
挑选平板上5个凸起、表面粗糙、边缘卷曲的菌落分别转入MRS肉汤培养基37℃土1℃厌氧培养箱中培养24h土2h后进行形态学、生化鉴定。6.4.5.2形态学鉴定
革兰氏染色,镜检。嗜酸乳杆菌为革兰氏阳性杆菌,呈杆状,两端圆,长度0.9μm~6.0um,单个、成对或成链状,无鞭毛,无芽孢。6.4.5.3生化鉴定
使用细菌生化鉴定试剂盒进行生化鉴定。鉴定特征见附录B中表B.2。乳杆菌属常见菌种主要鉴别特征参见附录C中表C.1。
6.5结果计算
6.5.1每个平板中嗜酸乳杆菌的数量每个平板中嗜酸乳杆菌菌落数的计算见式(3):b
式中:
每块平板上的嗜酸乳杆菌菌落数;a
b挑取后经证实为嗜酸乳杆菌的菌落数;A——挑取平板上用于验证的菌落数;平板上的所有特征菌落数、
6.5.2菌落总数的计算方法
(3)
6.5.2.1若只有一个稀释度平板上的菌落数在适宜计数范围内,计算两个平板中嗜酸乳杆菌菌落数的7
GB/T34224—2017
平均值,再将平均值乘以相应稀释倍数,作为每克(毫升)中菌落总数结果2若有两个连续稀释度的平板菌落数在适宜计数范围内时,按式(4)计算:6.5.2.2
式中:
6.6报告
样品中菌落数;
(n+0.1nz)d
平板(含适宜范围菌落数的平板)菌落数之和;第一稀释度(低稀释倍数)平板个数;第二稀释度(高稀释倍数)平板个数;稀释因子(第一稀释度)。
结果判定
若样品菌落符合嗜酸乳杆菌形态学及生化鉴定的特征,可判定为嗜酸乳杆菌。6.6.2
结果报告
6.6.2.1定性报告
在25g(mL)样品中检出或未检出嗜酸乳杆菌。6.6.2.2
定量报告
.(4)
菌落数小于100CFU时,以整数报告。菌落数大于或等于100CFU时,对第3位数字进行修约后,取前2位数字,后面用0代替位数;也可用10的指数形式来表示,采用两位有效数字。7枯草芽孢杆菌
设备和材料
除微生物实验室常规灭菌及培养设备外,其他设备和材料如下。7.1.1恒温培养箱:37℃土1℃。7.1.2冰箱:2℃~5℃。
7.1.3恒温水浴箱:80℃士1℃。7.1.4天平:感量为0.1g。
7.1.5均质器及无菌均质袋、均质杯。7.1.6振荡器。
无菌吸管:1mL(具0.01mL刻度)、10mL(具0.1mL刻度)或微量移液器及吸头。7.1.7
7.1.8无菌锥形瓶:容量250mL、500mL。7.1.9无菌培养皿:直径90mm。
显微镜:10倍~100倍。
pH计或pH比色管或精密pH试纸。7.2培养基和试剂
营养琼脂培养基:见A.3。
营养肉汤培养基:见A.4。
7.2.3无菌生理盐水:见A.10。
7.2.4革兰氏染色液:见A.11。
7.2.5细菌生化鉴定试剂盒。
检验程序
枯草芽孢杆菌的检验程序见图3。样品25g(mL)+225mL无菌生理盐水10倍系列稀释
选择2个~3个连续的适宜稀释度,每个稀释度水浴80℃±1℃维持10min,吸取菌液0.2mL接种于营养琼脂平板内
37 C±1 C, 48 h±2 h
菌落计数
挑选平板上5个表面粗糙、不透明,灰色或微黄色的菌落分别转入营养肉汤培养基37℃±1℃.24h±2h
形态学鉴定
生化鉴定
图3枯草芽孢杆菌检验程序
7.4操作步骤
7.4.1样品制备
固体和半固体样品
GB/T34224—2017
称取25g样品,置于225mL生理盐水的无菌均质袋中,用拍击式均质器拍打1min2min制成1:10的样品勾液:或置于盛有225mL灭菌生理盐水的无菌均质杯中,8000r/min~10000/min均质1min~2min制成1:10的样品勾液。7.4.1.2液体样品
应先将其充分摇勾后.以无菌吸管吸取样品25mL放入装有225mL生理盐水的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中,充分振摇,制成1:10的样品匀液。7.4.2样品稀释
7.4.2.1用1mL无菌吸管或微量移液器吸取1:10样品勾液1mL沿管壁缓慢注于装有9mL生理盐水的无菌试管中(注意吸管尖端不要触及稀释液),振摇试管或换用1支无菌吸管反复吹打使其混合9
GB/T34224—2017
均匀,制成1:100的样品勾液。7.4.2.2另取1mL无菌吸管或微量移液器吸头,按上述操作顺序,做10倍递增样品勾液,每递增稀释一次,即换用1次1mL灭菌吸管或吸头。7.4.3培养
根据对待检样品菌含量的估计,选择2个~3个连续的适宜稀释度,每个稀释度水浴80℃土1℃维持10min,吸取菌液0.2mL接种于营养琼脂平板内,使用涂布棒尽可能小心快速地涂布接种液于琼脂表面,涂布棒不得接触平皿边缘。每个稀释度接种2个平板。涂布后,将平板静置10min使接种物完全被培养基吸收。翻转平皿置于37℃士1℃培养箱中培养48h士2h。7.4.4菌落计数
7.4.4.1选取特征菌落数在20CFU~200CFU之间、无蔓延菌落生长的平板计数菌落总数。低于20CFU的平板记录具体菌落数,大于200CFU的可记录为多不可计。每个稀释度的菌落数应采用两个平板的平均数。
7.4.4.2其中一个平板有较大片状菌落生长时,则不宜采用,而应以无片状菌落生长的平板作为该稀释度的菌落数;若片状菌落不到平板的一半,而其余一半中菌落分布又很均勾,即可计算半个平板后乘以2,代表一个平板菌落数。
7.4.4.3当平板上出现菌落间无明显界线的链状生长时,则将每条单链作为一个菌落计数,7.4.5鉴定
7.4.5.1菌落挑选和纯培养
挑选平板上5个表面粗糙、不透明,灰色或微黄色的菌落分别转人营养肉汤培养基37℃土1℃培养箱中培养24h士2h后进行形态学、生化鉴定,7.4.5.2形态学鉴定
革兰氏染色,镜检。枯草芽孢杆菌为革兰氏阳性杆菌,呈杆状,长度1.5um~3.0μm,无荚膜,周生鞭毛,有芽抱,芽抱椭圆形,中生或近中生,芽抱囊不明显膨大。7.4.5.3生化鉴定
使用细菌生化鉴定试剂盒进行生化鉴定。鉴定特征见附录B中表B.3。7.5结果计算
7.5.1每个平板中枯草芽孢杆菌的数量每个平板中枯草芽孢杆菌菌落数的计算见式(5):b
式中:
每块平板上的枯草芽孢杆菌菌落数;a
挑取后经证实为枯草芽孢杆菌的菌落数;挑取平板上用于验证的菌落数;C——平板上的所有特征菌落数。10
·(5)
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。