GB/T 22952-2008
基本信息
标准号: GB/T 22952-2008
中文名称:河豚鱼和鳗鱼中阿莫西林、氨苄西林、哌拉西林、青霉素 G、青霉素 V、苯唑西林、氯唑西林、萘夫西林、双氯西林残留量的测定 液相色谱-串联质谱法
标准类别:国家标准(GB)
标准状态:现行
发布日期:2008-12-31
实施日期:2009-05-01
出版语种:简体中文
下载格式:.rar.pdf
下载大小:469739
相关标签: 河豚鱼 鳗鱼 青霉素 残留量 测定 色谱 串联 质谱法

标准分类号
标准ICS号:食品技术>>67.050食品试验和分析的一般方法
中标分类号:食品>>食品综合>>X04基础标准与通用方法
关联标准
出版信息
出版社:中国标准出版社
页数:12页
标准价格:14.0 元
计划单号:20079492-T-469
出版日期:2009-05-01
相关单位信息
首发日期:2008-12-31
起草人:李学民、母健、刘晓茂、曹彦忠、刘亚新、庞国芳
起草单位:中华人民共和国秦皇岛出入境检验检疫局
归口单位:国家质量监督检验检疫总局
提出单位:国家质量监督检验检疫总局
发布部门:中华人民共和国国家质量监督检验检疫总局 中国国家标准化管理委员会
主管部门:国家标准化管理委员会
标准简介
本标准规定了河豚鱼和鳗鱼中阿莫西林、氨苄西林、哌拉西林、青霉素G、青霉素V、苯唑西林、氯唑西林、萘夫西林、双氯西林九种青霉素类药物残留量的液相色谱?串联质谱测定方法。本标准适用于河豚鱼和鳗鱼中阿莫西林、氨苄西林、哌拉西林、青霉素G、青霉素V、苯唑西林、氯唑西林、萘夫西林、双氯西林九种青霉素类药物残留量的测定。 GB/T 22952-2008 河豚鱼和鳗鱼中阿莫西林、氨苄西林、哌拉西林、青霉素 G、青霉素 V、苯唑西林、氯唑西林、萘夫西林、双氯西林残留量的测定 液相色谱-串联质谱法 GB/T22952-2008 标准下载解压密码:www.bzxz.net
标准图片预览




标准内容
ICS67.050
中华人民共和国国家标准
GB/T22952--2008
河豚鱼和鳗鱼中阿莫西林、氨西林、哌拉西林、青霉素G、青霉素V、苯唑西林、氯唑西林、蔡夫西林、双氯西林残留量的测定液相色谱-串联质谱法
Determination of amoxicillin, ampicillin, piperacillin, penicillin G,penicillin V, oxacillin, cloxacillin, nafcillin, dicloxacillin residues infuguandeel-LC-MS-MSmethod
2008-12-31发布
中华人民共和国国家质量监督检验检疫总局中国国家标准化管理委员会
2009-05-01实施
本标准的附录A、附录B为资料性附录。本标准由国家质量监督检验检疫总局提出并归口。本标准起草单位:中华人民共和国秦皇岛出入境检验检疫局。本标准主要起草人:李学民、母健、刘晓茂、曹彦忠、刘亚新、庞国芳GB/T22952--2008
1范围
河豚鱼和鳗鱼中阿莫西林、氨芒西林哌拉西林、青霉素G、青霉素V、苯唑西林氯唑西林、蔡夫西林、双氯西林残留量的测定液相色谱-串联质谱法
GB/T22952—2008
本标准规定了河豚鱼和鳗鱼中阿莫西林、氨苄西林、哌拉西林、青霉素G、青霉素V、苯唑西林、氯唑西林、萘夫西林、双氯西林九种青霉素类药物残留量的液相色谱-串联质谱测定方法。本标准适用于河豚鱼和鳗鱼中阿莫西林、氨苄西林、哌拉西林、青霉素G、青霉素V、苯唑西林、氯唑西林、萘夫西林、双氯西林九种青霉素类药物残留量的测定本标准方法的检出限:萘夫西林、青霉素G、哌拉西林、青霉素V、苯唑西林为1.0μg/kg;阿莫西林、氨芋西林、氯唑西林、双氯西林为2.0ug/kg。2规范性引用文件
下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。GB/T6379.1测量方法与结果的准确度(正确度与精密度)第1部分:总则与定义(GB/T6379.1—2004,ISO5725-1:1994,IDT)GB/T6379.2测量方法与结果的准确度(正确度与精密度)第2部分:确定标准测量方法重复性与再现性的基本方法(GB/T6379.2—2004,ISO5725-2:1994,IDT)GB/T6682分析实验室用水规格和试验方法(GB/T6682—2008,ISO3696:1987,MOD)3原理
试样中青霉素类药物残留用乙睛提取,旋转蒸发除去乙睛,用水定容,液相色谱-串联质谱仪测定外标法定量。
4试剂和材料
除另有说明外,所用试剂均为分析纯。4.1水:GB/T6682,—级水。
4.2甲醇:色谱纯。
4.3乙腈:色谱纯。
4.4正已烷。
4.5乙腈饱和的正已烷:取100mL正已烷(4.4)和50mL乙腈(4.3)于250mL分液漏斗中,振摇1min,静置分层后,弃掉乙睛。4.6氨水。
4.7乙腈提取液:将100mL乙睛与0.6mL氨水(4.6),充分混合。4.8标准物质:阿莫西林(CAS:26787-78-0)、氨苄西林(CAS:69-53-4)、哌拉西林(CAS:59703-84-3)、1
GB/T22952—2008
青霉素G(CAS:69-57-8)、青霉素V(CAS:132-98-9)、苯唑西林(CAS:7240-38-2)、氯唑西林(CAS:642-78-4)、萘夫西林(CAS:7177-50-6)、双氯西林(CAS:13412-64-1),纯度≥99%。4.91.0mg/mL九种青霉素类药物标准储备溶液:准确称取适量的每种标准物质(4.8),分别用水配制成浓度为1.0mg/mL的标准储备溶液。储备液贮存在一18℃冰柜中。4.10九种青素类药物标准工作溶液:根据需要吸取适量的每种青霉素类药物标准储备溶液(4.9),用水稀释成适当浓度的混合标工作溶液。4.11滤膜:0.2um。
5仪器
5.1液相色谱-串联四极杆质谱仪:配有电喷雾离子源。5.2分析天平:感量0.1mg,0.01g。5.3微量注射器:25μ,100μ
5.4刻度样品管:5mL,精度为0.1mL。5.5均质器。
5.6高速冷冻离心机:带有50mL具塞离心管,转速达到10000r/min以上。6试样制备与保存
6.1试样的制备
从全部样品中取出有代表性样品约1kg,充分搅碎,混匀,均分成两份,分别装人洁净容器内。密封后作为试样,标明标记。在抽样和制样的操作过程中,应防止样品受到污染或发生残留物含量的变化。
6.2试样的保存
将试样于-18℃保存。
7测定步骤
7.1试样溶液的制备
称取5g试样(精确到0.01g)置于50mL离心管中,加入20mL乙睛提取液(4.7),使用均质器(5.5)均质1min,提取液使用高速冷冻离心机(5.6)在10℃,10000r/min离心10min,把上层提取液移至另一离心管中。用15mL乙腈提取液重复提取一次,合并两次的提取液,并加入10mL乙睛饱和的正已烷(4.5),振荡1min,弃掉正已烷。把提取液移至100mL鸡心瓶中,在40℃旋转蒸发除去乙睛。加人2mL水溶解残渣,混匀,样液过0.2um滤膜(4.11),供液相色谱-串联质谱仪测定。7.2空白样品添加标准混合工作溶液的制备分别准确移取适量九种青霉素类药物标准混合工作溶液(4.10),添加到5.0g样品中,按照7.1步骤操作,配制萘夫西林、青霉素G、哌拉西林、青霉素V、苯唑西林浓度为1. 0μg/kg、2.0μg/kg、4.0μg/kg、10μg/kg;阿莫西林、氨苄西林、氯唑西林、双氯西林浓度为2.0μg/kg、4.0μg/kg、8.0μg/kg、20μg/kg四个样品添加标准混合工作溶液,供液相色谱-串联质谱仪测定。7.3测定条件
7.3.1液相色谱参考条件
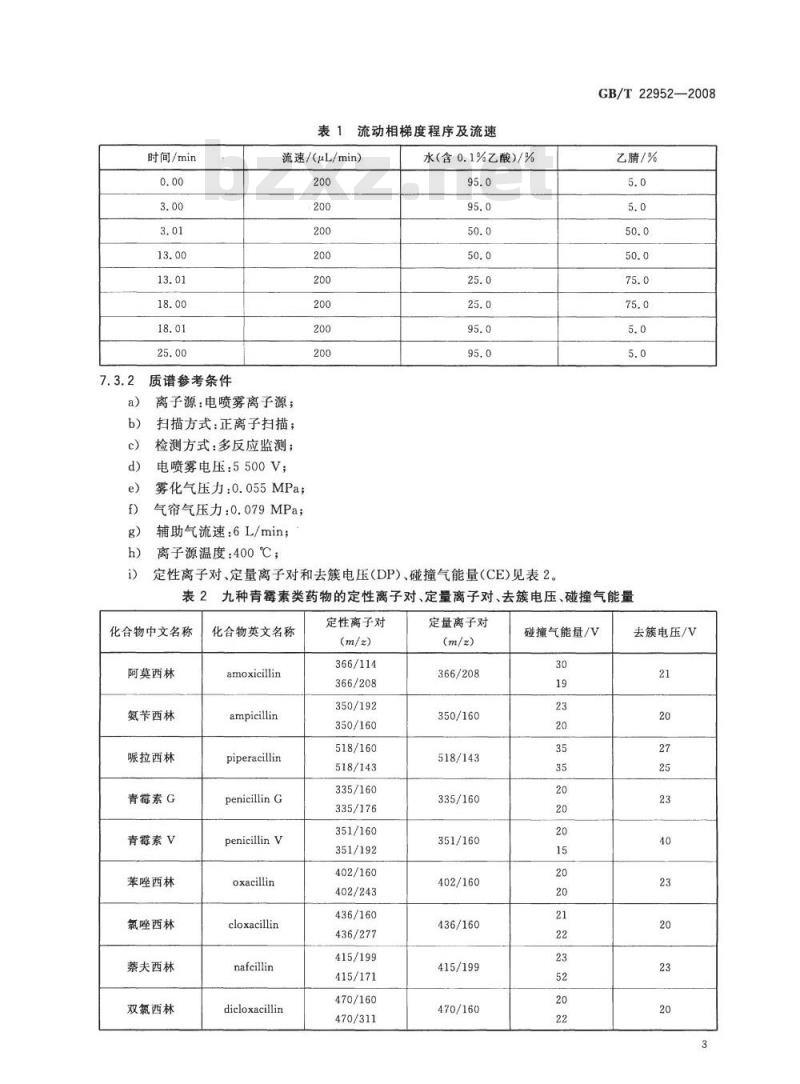
a)色谱柱:ZORBAXSB-C,3.5μm,150mmX2.1mm(内径)或相当者;b)流动相组成、流速及梯度程序见表1;c)柱温:30℃;
d)进样量:20μL。
时间/min
质谱参考条件
流动相梯度程序及流速
流速/(μL/min)
离子源:电喷雾离子源;
扫描方式:正离子扫描;
检测方式:多反应监测;
电喷雾电压:5500V;
雾化气压力:0.055MPa;
气帘气压力:0.079MPa;
辅助气流速:6L/min;
离子源温度:400℃;
水(含0.1%乙酸)/%
定性离子对、定量离子对和去簇电压(DP)、碰撞气能量(CE)见表2。GB/T22952—2008
2九种青霉素类药物的定性离子对、定量离子对、去簇电压、碰撞气能量化合物中文名称
阿莫西林
氨芋西林
赈拉西林
青霉素G
青霉素V
苯唑西林
氯唑西林
蔡夫西林
双氯西林
化合物英文名称
amoxiillin
ampicillin
piperacillin
penicillinG
penicillinV
oxacillin
cloxacillin
nafcillin
dicloxaillin
定性离子对
366/114
366/208
350/192
350/160
518/160
518/143
335/160
335/176
351/160
351/192
402/160
402/243
436/160
436/277
415/199
415/171
470/160
470/311
定量离子对
366/208
350/160
518/143
335/160
351/160
402/160
436/160
415/199
470/160
碰撞气能量/V
去簇电压/V
GB/T22952—2008
7.4液相色谱-串联质谱测定
7.4.1定性测定
选择每种待测物质的1个母离子,2个以上子离子,在相同试验条件下,样品中待测物质的保留时间,与基质标准溶液中对应物质的保留时间偏差在土2.5%之内;样品谱图中各定性离子相对丰度与浓度接近的基质标准溶液的谱图中离子相对丰度相比,偏差不超过表3规定的范围,则可判定为样品中存在对应的待测物。
表3定性确证时相对离子丰度的最大允许偏差相对离子丰度K
允许的最大偏差
7.4.2定量测定
2010以%表示
K≤10
用7.2制备的空白样品添加标准混合工作溶液分别进样,以标准工作溶液浓度为横坐标,以峰面积为纵坐标,绘制标准工作曲线。用标准工作曲线对样品进行定量,样品溶液中九种青霉素类药物的响应值均应在仪器测定的线性范围内。在上述色谱条件下,九种青霉素类药物标准物质的多反应监测(MRM)色谱图参见附录A中的图A.1。本方法的添加回收率数据参见附录B中的表B1:7.5平行试验
按上述步骤,对同一试样进行平行试验测定。7.6空白试验
除不称取试样外,均按上述分析步骤进行。8结果计算
试样中青霉素类药物残留量利用数据处理系统计算或按式(1)计算。Vy1000下载标准就来标准下载网
式中:
X一-试样中被测组分残留量,单位为微克每千克(ug/kg);c—从标准工作曲线得到的试样溶液中被测组分的浓度,单位为纳克每毫升(ng/mL);V-试样溶液定容体积,单位为毫升(mL);m—最终试样溶液所代表的试样质量,单位为克(g)。计算结果应扣除空白值。
9精密度
9.1一般规定
·(1)
本标准的精密度数据是按照GB/T6379.1和GB/T6379.2规定确定的,其重复性和再现性的值是以95%的可信度来计算。
9.2重复性
在重复性试验条件下,获得的两次独立测试结果的绝对差值不超过重复性限r,试样中九种青霉素类药物添加浓度范围及重复性方程见表4。4
化合物名称
蔡夫西林
青霉素G
眼拉西林
苯唑西林
青番素V
阿莫西林
氨苄西林
氯唑西林
双氯西林
GB/T22952—2008
表4九种青霉素类药物添加浓度范围及重复性和再现性方程单位为微克每干克
添加浓度范围
注:m为两次测定结果的算术平均值。重复性限
lgr=0.8315lgm-1.0541
lgr=0.8373lgm-1.0657
lgr=0.8282lgm-1.0580
Igr=0.8202lgm-1.0640
lgr=0.8481lgm-1.0388
lgr=0.8303Igm-1. 007 2
lgr=0.8305lgm-1.0055
lgr=0.8194lgm-1.001 7
lgr=0.8384lgm-1.0151
再现性限R
lgR=0.9712lgm-0.6843
lgR=0.9763lgm-0.690.7
lgR=0.9738lgm-0.6887
lgR=0.9772lgm-0.6915
IgR=0.9697lgm-0.6697
Ig R=0.9778 lgm-0.684 6
IgR=0.9322lgm-0.6577
lgR=0.9743lgm-0.6800
lgR=0.9731lgm-0.6789
如果两次测定值的差值超过重复性限r,应舍弃试验结果并重新完成两次单个试验的测定。9.3
再现性
在再现性试验条件下,获得的两次独立测试结果的绝对差值不超过再现性限R,试样中九种青霉素类药物添加浓度范围及再现性方程见表4。5
GB/T22952—2008
附录A
(资料性附录)
标准物质的多反应监测(MRM)色谱图九种青霉素类药物标准物质的多反应监测(MRM)色谱图见图A.1。sda/
sda/功到
阿莫西林
氨西林
眼拉西林
青莓素G
青霉素V
苯唑西林
氯唑西林
蔡夫西林
双氯西林
图A.1九种青霉素类药物标准物质的多反应监测(MRM)色谱图t/min
附录B
(资料性附录)
回收率
九种青霉素类药物添加浓度及其平均回收率的试验数据见表B.1。GB/T22952—2008
表B.1九种青霉素类药物添加浓度及其平均回收率的试验数据化合物名称
蔡夫西林
青素G
哌拉西林
苯唑西林
青霉素V
阿莫西林
氨荠西林
唑西林
双氯西林
添加浓度/(μg/kg)
平均回收率/%
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
中华人民共和国国家标准
GB/T22952--2008
河豚鱼和鳗鱼中阿莫西林、氨西林、哌拉西林、青霉素G、青霉素V、苯唑西林、氯唑西林、蔡夫西林、双氯西林残留量的测定液相色谱-串联质谱法
Determination of amoxicillin, ampicillin, piperacillin, penicillin G,penicillin V, oxacillin, cloxacillin, nafcillin, dicloxacillin residues infuguandeel-LC-MS-MSmethod
2008-12-31发布
中华人民共和国国家质量监督检验检疫总局中国国家标准化管理委员会
2009-05-01实施
本标准的附录A、附录B为资料性附录。本标准由国家质量监督检验检疫总局提出并归口。本标准起草单位:中华人民共和国秦皇岛出入境检验检疫局。本标准主要起草人:李学民、母健、刘晓茂、曹彦忠、刘亚新、庞国芳GB/T22952--2008
1范围
河豚鱼和鳗鱼中阿莫西林、氨芒西林哌拉西林、青霉素G、青霉素V、苯唑西林氯唑西林、蔡夫西林、双氯西林残留量的测定液相色谱-串联质谱法
GB/T22952—2008
本标准规定了河豚鱼和鳗鱼中阿莫西林、氨苄西林、哌拉西林、青霉素G、青霉素V、苯唑西林、氯唑西林、萘夫西林、双氯西林九种青霉素类药物残留量的液相色谱-串联质谱测定方法。本标准适用于河豚鱼和鳗鱼中阿莫西林、氨苄西林、哌拉西林、青霉素G、青霉素V、苯唑西林、氯唑西林、萘夫西林、双氯西林九种青霉素类药物残留量的测定本标准方法的检出限:萘夫西林、青霉素G、哌拉西林、青霉素V、苯唑西林为1.0μg/kg;阿莫西林、氨芋西林、氯唑西林、双氯西林为2.0ug/kg。2规范性引用文件
下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。GB/T6379.1测量方法与结果的准确度(正确度与精密度)第1部分:总则与定义(GB/T6379.1—2004,ISO5725-1:1994,IDT)GB/T6379.2测量方法与结果的准确度(正确度与精密度)第2部分:确定标准测量方法重复性与再现性的基本方法(GB/T6379.2—2004,ISO5725-2:1994,IDT)GB/T6682分析实验室用水规格和试验方法(GB/T6682—2008,ISO3696:1987,MOD)3原理
试样中青霉素类药物残留用乙睛提取,旋转蒸发除去乙睛,用水定容,液相色谱-串联质谱仪测定外标法定量。
4试剂和材料
除另有说明外,所用试剂均为分析纯。4.1水:GB/T6682,—级水。
4.2甲醇:色谱纯。
4.3乙腈:色谱纯。
4.4正已烷。
4.5乙腈饱和的正已烷:取100mL正已烷(4.4)和50mL乙腈(4.3)于250mL分液漏斗中,振摇1min,静置分层后,弃掉乙睛。4.6氨水。
4.7乙腈提取液:将100mL乙睛与0.6mL氨水(4.6),充分混合。4.8标准物质:阿莫西林(CAS:26787-78-0)、氨苄西林(CAS:69-53-4)、哌拉西林(CAS:59703-84-3)、1
GB/T22952—2008
青霉素G(CAS:69-57-8)、青霉素V(CAS:132-98-9)、苯唑西林(CAS:7240-38-2)、氯唑西林(CAS:642-78-4)、萘夫西林(CAS:7177-50-6)、双氯西林(CAS:13412-64-1),纯度≥99%。4.91.0mg/mL九种青霉素类药物标准储备溶液:准确称取适量的每种标准物质(4.8),分别用水配制成浓度为1.0mg/mL的标准储备溶液。储备液贮存在一18℃冰柜中。4.10九种青素类药物标准工作溶液:根据需要吸取适量的每种青霉素类药物标准储备溶液(4.9),用水稀释成适当浓度的混合标工作溶液。4.11滤膜:0.2um。
5仪器
5.1液相色谱-串联四极杆质谱仪:配有电喷雾离子源。5.2分析天平:感量0.1mg,0.01g。5.3微量注射器:25μ,100μ
5.4刻度样品管:5mL,精度为0.1mL。5.5均质器。
5.6高速冷冻离心机:带有50mL具塞离心管,转速达到10000r/min以上。6试样制备与保存
6.1试样的制备
从全部样品中取出有代表性样品约1kg,充分搅碎,混匀,均分成两份,分别装人洁净容器内。密封后作为试样,标明标记。在抽样和制样的操作过程中,应防止样品受到污染或发生残留物含量的变化。
6.2试样的保存
将试样于-18℃保存。
7测定步骤
7.1试样溶液的制备
称取5g试样(精确到0.01g)置于50mL离心管中,加入20mL乙睛提取液(4.7),使用均质器(5.5)均质1min,提取液使用高速冷冻离心机(5.6)在10℃,10000r/min离心10min,把上层提取液移至另一离心管中。用15mL乙腈提取液重复提取一次,合并两次的提取液,并加入10mL乙睛饱和的正已烷(4.5),振荡1min,弃掉正已烷。把提取液移至100mL鸡心瓶中,在40℃旋转蒸发除去乙睛。加人2mL水溶解残渣,混匀,样液过0.2um滤膜(4.11),供液相色谱-串联质谱仪测定。7.2空白样品添加标准混合工作溶液的制备分别准确移取适量九种青霉素类药物标准混合工作溶液(4.10),添加到5.0g样品中,按照7.1步骤操作,配制萘夫西林、青霉素G、哌拉西林、青霉素V、苯唑西林浓度为1. 0μg/kg、2.0μg/kg、4.0μg/kg、10μg/kg;阿莫西林、氨苄西林、氯唑西林、双氯西林浓度为2.0μg/kg、4.0μg/kg、8.0μg/kg、20μg/kg四个样品添加标准混合工作溶液,供液相色谱-串联质谱仪测定。7.3测定条件
7.3.1液相色谱参考条件
a)色谱柱:ZORBAXSB-C,3.5μm,150mmX2.1mm(内径)或相当者;b)流动相组成、流速及梯度程序见表1;c)柱温:30℃;
d)进样量:20μL。
时间/min
质谱参考条件
流动相梯度程序及流速
流速/(μL/min)
离子源:电喷雾离子源;
扫描方式:正离子扫描;
检测方式:多反应监测;
电喷雾电压:5500V;
雾化气压力:0.055MPa;
气帘气压力:0.079MPa;
辅助气流速:6L/min;
离子源温度:400℃;
水(含0.1%乙酸)/%
定性离子对、定量离子对和去簇电压(DP)、碰撞气能量(CE)见表2。GB/T22952—2008
2九种青霉素类药物的定性离子对、定量离子对、去簇电压、碰撞气能量化合物中文名称
阿莫西林
氨芋西林
赈拉西林
青霉素G
青霉素V
苯唑西林
氯唑西林
蔡夫西林
双氯西林
化合物英文名称
amoxiillin
ampicillin
piperacillin
penicillinG
penicillinV
oxacillin
cloxacillin
nafcillin
dicloxaillin
定性离子对
366/114
366/208
350/192
350/160
518/160
518/143
335/160
335/176
351/160
351/192
402/160
402/243
436/160
436/277
415/199
415/171
470/160
470/311
定量离子对
366/208
350/160
518/143
335/160
351/160
402/160
436/160
415/199
470/160
碰撞气能量/V
去簇电压/V
GB/T22952—2008
7.4液相色谱-串联质谱测定
7.4.1定性测定
选择每种待测物质的1个母离子,2个以上子离子,在相同试验条件下,样品中待测物质的保留时间,与基质标准溶液中对应物质的保留时间偏差在土2.5%之内;样品谱图中各定性离子相对丰度与浓度接近的基质标准溶液的谱图中离子相对丰度相比,偏差不超过表3规定的范围,则可判定为样品中存在对应的待测物。
表3定性确证时相对离子丰度的最大允许偏差相对离子丰度K
允许的最大偏差
7.4.2定量测定
20
K≤10
用7.2制备的空白样品添加标准混合工作溶液分别进样,以标准工作溶液浓度为横坐标,以峰面积为纵坐标,绘制标准工作曲线。用标准工作曲线对样品进行定量,样品溶液中九种青霉素类药物的响应值均应在仪器测定的线性范围内。在上述色谱条件下,九种青霉素类药物标准物质的多反应监测(MRM)色谱图参见附录A中的图A.1。本方法的添加回收率数据参见附录B中的表B1:7.5平行试验
按上述步骤,对同一试样进行平行试验测定。7.6空白试验
除不称取试样外,均按上述分析步骤进行。8结果计算
试样中青霉素类药物残留量利用数据处理系统计算或按式(1)计算。Vy1000下载标准就来标准下载网
式中:
X一-试样中被测组分残留量,单位为微克每千克(ug/kg);c—从标准工作曲线得到的试样溶液中被测组分的浓度,单位为纳克每毫升(ng/mL);V-试样溶液定容体积,单位为毫升(mL);m—最终试样溶液所代表的试样质量,单位为克(g)。计算结果应扣除空白值。
9精密度
9.1一般规定
·(1)
本标准的精密度数据是按照GB/T6379.1和GB/T6379.2规定确定的,其重复性和再现性的值是以95%的可信度来计算。
9.2重复性
在重复性试验条件下,获得的两次独立测试结果的绝对差值不超过重复性限r,试样中九种青霉素类药物添加浓度范围及重复性方程见表4。4
化合物名称
蔡夫西林
青霉素G
眼拉西林
苯唑西林
青番素V
阿莫西林
氨苄西林
氯唑西林
双氯西林
GB/T22952—2008
表4九种青霉素类药物添加浓度范围及重复性和再现性方程单位为微克每干克
添加浓度范围
注:m为两次测定结果的算术平均值。重复性限
lgr=0.8315lgm-1.0541
lgr=0.8373lgm-1.0657
lgr=0.8282lgm-1.0580
Igr=0.8202lgm-1.0640
lgr=0.8481lgm-1.0388
lgr=0.8303Igm-1. 007 2
lgr=0.8305lgm-1.0055
lgr=0.8194lgm-1.001 7
lgr=0.8384lgm-1.0151
再现性限R
lgR=0.9712lgm-0.6843
lgR=0.9763lgm-0.690.7
lgR=0.9738lgm-0.6887
lgR=0.9772lgm-0.6915
IgR=0.9697lgm-0.6697
Ig R=0.9778 lgm-0.684 6
IgR=0.9322lgm-0.6577
lgR=0.9743lgm-0.6800
lgR=0.9731lgm-0.6789
如果两次测定值的差值超过重复性限r,应舍弃试验结果并重新完成两次单个试验的测定。9.3
再现性
在再现性试验条件下,获得的两次独立测试结果的绝对差值不超过再现性限R,试样中九种青霉素类药物添加浓度范围及再现性方程见表4。5
GB/T22952—2008
附录A
(资料性附录)
标准物质的多反应监测(MRM)色谱图九种青霉素类药物标准物质的多反应监测(MRM)色谱图见图A.1。sda/
sda/功到
阿莫西林
氨西林
眼拉西林
青莓素G
青霉素V
苯唑西林
氯唑西林
蔡夫西林
双氯西林
图A.1九种青霉素类药物标准物质的多反应监测(MRM)色谱图t/min
附录B
(资料性附录)
回收率
九种青霉素类药物添加浓度及其平均回收率的试验数据见表B.1。GB/T22952—2008
表B.1九种青霉素类药物添加浓度及其平均回收率的试验数据化合物名称
蔡夫西林
青素G
哌拉西林
苯唑西林
青霉素V
阿莫西林
氨荠西林
唑西林
双氯西林
添加浓度/(μg/kg)
平均回收率/%
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。