GB 5413.19-2010
基本信息
标准号: GB 5413.19-2010
中文名称:食品安全国家标准婴幼儿食品和乳品中游离生物素的测定
标准类别:国家标准(GB)
标准状态:现行
出版语种:简体中文
下载格式:.rar .pdf
下载大小:213255
相关标签: 食品安全 国家标准 婴幼儿 食品 乳品 游离 生物素 测定

标准分类号
关联标准
出版信息
相关单位信息
标准简介
GB 5413.19-2010 食品安全国家标准婴幼儿食品和乳品中游离生物素的测定
GB5413.19-2010
标准下载解压密码:www.bzxz.net
标准图片预览




标准内容
中华人民共和国国家标准
GB5413.192010
食品安全国家标准
婴幼儿食品和乳品中游离生物素的测定Nationalfoodsafetystandard
Determination of free biotin in foods for infants and young childrenmilkandmilkproducts
2010-03-26发布
中华人民共和国卫生部
2010-06-01实施
GB5413.192010
本标准代替GB/T5413.19-1997《婴幼儿配方食品和乳粉游离生物素的测定》本标准附录A为规范性附录。
本标准所代替标准的历次版本发布情况为:GB5413-1985、GB/T5413.19-1997。I
1范围
食品安全国家标准
GB5413.192010
婴幼儿食品和乳品中游离生物素的测定本标准规定了婴幼儿食品和乳品中游离生物素的测定方法。本标准适用于婴幼儿食品和乳品中游离生物素的测定。2规范性引用文件
本标准中引用的文件对于本标准的应用是必不可少的。凡是注日期的引用文件,仅所注日期的版本适用于本标准。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本标准。3原理
利用植物乳杆菌(Lactobacillusplantarum)对游离生物素的特异性和灵敏性,定量测定出试样中得测物质的含量。在含有除待测物质以外所有营养成分的培养基中,微生物的生长与待测物质含量呈线性关系,根据透光率与标准工作曲线进行比较,即可计算出试样中待测物质的含量。4试剂和材料
除非另有规定,本方法所用试剂均为分析纯,水为GB/T6682规定的二级水。4.1菌株:植物乳杆菌(Lactobacillusplantarum),ATCC8014。4.2生物素(d-Biotin或VitaminH)标准品(CioHi6N2O,S):纯度≥99%。4.3培养基
4.3.1乳酸杆菌琼脂培养基:见附录A。4.3.2乳酸杆菌肉汤培养基:见附录A。4.3.3生物素测定用培养基:见附录A。注:一些商品化合成培养基效果良好,商品化合成培养基按标签说明进行配制。4.4乙醇溶液(50%)。
4.5硫酸溶液(3%):量取3mL硫酸加入到水中,定容至100mL。4.6氢氧化钠溶液(0.5mol/L):称取20g氢氧化钠溶于1000mL水中。4.7氯化钠溶液(9g/L):称取9.0g氯化钠溶解于1000mL水中,分装试管,每管10mL。121℃灭菌15min。
4.8标准溶液的制备
4.8.1生物素标准贮备液(100μg/mL):称取生物素标准品(4.2)用乙醇溶液(4.4)定容至生物素浓度为100μg/mL,贮于冰箱中。4.8.2生物素标准中间液(1μg/mL):吸取1mL生物素标准贮备液(4.8.1),用乙醇溶液(4.4)定容至100mL。
4.8.3生物素标准工作液(10ng/mL):吸取1mL生物素标准中间液(4.8.2),用乙醇溶液(4.4)定容至100mL。
4.8.4标准曲线工作液
GB5413.192010
分两个浓度,高浓度溶液的浓度为0.2ng/mL:低浓度溶液的浓度为0.1ng/mL。从工作液中(4.8.3)吸取两次各5mL,用水分别定容到250mL和500mL。注:所有标准溶液要储存于冰箱内。4.8.1、4.8.2、和4.8.3保存期三个月,4.8.4临用前配制。5仪器和设备
除微生物实验室常规灭菌及培养设备外,其他设备和材料如下:5.1天平:感量为0.1mg。
5.2pH计:精度≤0.02
5.3分光光度计。
5.4涡旋混合器。
5.5离心机:转速≥2000转/分钟。5.6恒温培养箱:36℃±1℃。
5.7冰箱:2℃~5℃。
5.8无菌吸管:10mL(具0.1mL刻度)或微量移液器或吸头。5.9瓶口分液器:0mL~10mL。
5.10锥形瓶:200mL。
容量瓶(A类):100mL,250mL,500mL。5.12单刻度移液管(A类):容量5mL。漏斗:直径90mm。
5.14定量滤纸:直径90mm。
5.15试管:18mm×180mm。
注:玻璃仪器使用前,用活性剂(月桂磺酸钠或家用洗涤剂加入到洗涤用水中即可)对硬玻璃测定管及其他必要的玻璃器皿进行清洗,清洗之后在200℃干热2h。6分析步骤
6.1接种菌悬液的制备
6.1.1将冻干菌株(4.1)活化后,转接到乳酸杆菌琼脂培养基(4.3.1)中,36℃±1℃培养过夜。再转接2~3代来增强活力。然后再将其从固体培养上转接到乳酸杆菌肉汤培养基(4.3.2)中培养。6.1.2将乳酸杆菌肉汤中的培养液以2000转/分钟离心2min~3min,倾出上清液,加入10mL氯化钠溶液(4.7),混匀,再离心2min~3min,如此清洗3次~4次,吸适量该菌悬液于10mL盐水(4.7中,待测。
6.1.3用分光光度计以氯化钠溶液(4.7)做空白,于550nm波长下测菌悬液(6.1.2)的透光率,使其透光率在60%~80%之间。
6.2样品的处理
6.2.1干粉样品
称取一定量样品(精确至0.0001g)于250mL三角瓶中,该样品应含0.2μg~0.5μg生物素。继续6.2.3步骤。
6.2.2液体样品
吸一定量的液体样品于250mL三角瓶中,该样品应含0.2μg~0.5μg生物素。继续6.2.3步骤。6.2.3样品的提取
GB5413.192010
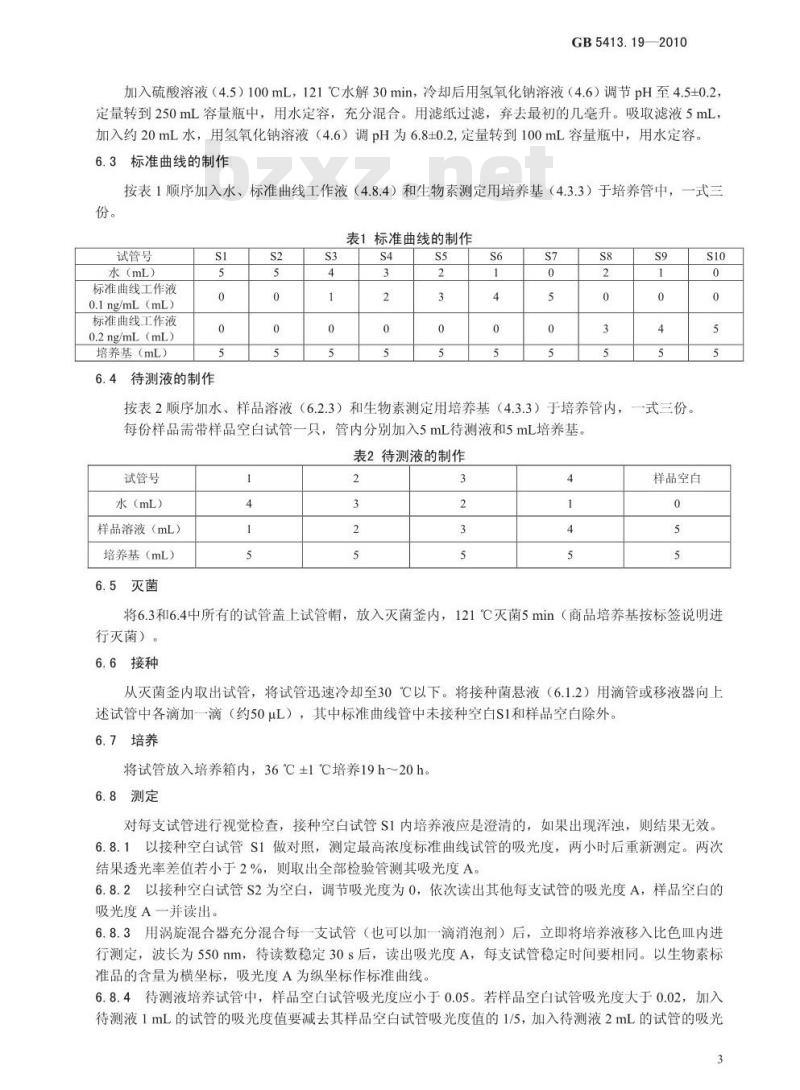
加入硫酸溶液(4.5)100mL,121℃水解30min,冷却后用氢氧化钠溶液(4.6)调节pH至4.5±0.2,定量转到250mL容量瓶中,用水定容,充分混合。用滤纸过滤,弃去最初的几毫升。吸取滤液5mL,加入约20mL水,用氢氧化钠溶液(4.6)调pH为6.8±0.2,定量转到100mL容量瓶中,用水定容。6.3标准曲线的制作
按表1顺序加入水、标准曲线工作液(4.8.4)和生物素测定用培养基(4.3.3)于培养管中,一式三份。
表1标准曲线的制作
试管号
水(mL)
标准曲线工作液
0.1ng/mL(mL)
标准曲线工作液
0.2ng/mL (mL)
培养基(mL)
6.4待测液的制作
按表2顺序加水、样品溶液(6.2.3)和生物素测定用培养基(4.3.3)于培养管内,每份样品需带样品空白试管一只,管内分别加入5mL待测液和5mL培养基。表2待测液的制作
试管号
水(mL)
样品溶液(mL)
培养基(mL)
6.5灭菌
一式三份。
样品空白
将6.3和6.4中所有的试管盖上试管帽,放入灭菌釜内,121℃灭菌5min(商品培养基按标签说明进行灭菌)。
6.6接种
从灭菌釜内取出试管,将试管迅速冷却至30℃以下。将接种菌悬液(6.1.2)用滴管或移液器向上述试管中各滴加一滴(约50uμL),其中标准曲线管中未接种空白S1和样品空白除外。6.7培养
将试管放入培养箱内,36℃±1℃培养19h~20h。6.8测定
对每支试管进行视觉检查,接种空白试管S1内培养液应是澄清的,如果出现浑浊,则结果无效。6.8.1以接种空白试管S1做对照,测定最高浓度标准曲线试管的吸光度,两小时后重新测定。两次结果透光率差值若小于2%,则取出全部检验管测其吸光度A。6.8.2以接种空白试管S2为空白,调节吸光度为0,依次读出其他每支试管的吸光度A,样品空白的吸光度A一并读出。
6.8.3用涡旋混合器充分混合每一支试管(也可以加一滴消泡剂)后,立即将培养液移入比色血内进行测定,波长为550nm,待读数稳定30s后,读出吸光度A,每支试管稳定时间要相同。以生物素标准品的含量为横坐标,吸光度A为纵坐标作标准曲线。6.8.4待测液培养试管中,样品空白试管吸光度应小于0.05。若样品空白试管吸光度大于0.02,加入待测液1mL的试管的吸光度值要减去其样品空白试管吸光度值的1/5,加入待测液2mL的试管的吸光3
GB5413.192010bzxZ.net
度值要减去其样品空白试管吸光度值的2/5,以此类推,作为计算结果的依据。根据待测液的吸光度A,从标准曲线中查得该待测液中生物素的浓度,再根据稀释因子和称样量计算出试样中生物素的含量。吸光度值超出标准曲线管S3~S10范围的试样管要舍去。6.8.5对每个编号的待测液试管,用每支试管的吸光度值计算每毫升该编号待测液生物素的含量,并计算该编号待测液的生物素含量平均值,每支试管测得的该浓度不得超过该平均值的土15%,超过者要舍去。如果符合该要求的管数少于所有四个编号待测液总管数的2/3,需要重新检验。如果符合该要求的管数大于等于原来管数的2/3,重新计算每一编号的有效试样管中每毫升测定液生物素含量的平均值,以此平均值计算全部编号试样管的总平均值C,用于计算试样中的生物素含量。7分析结果的表述
试样中生物素的含量按公式(1)计算:C
式中:
X—试样中生物素的含量,单位为微克每百克(μg/100g);Cx6.8.5中计算所得的总平均值,单位为纳克(ng);m试样的质量,单位为克(g);
f稀释倍数。
以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留两位有效数字。8精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。9其他
本标准检出限为20.0μg/kg。
A.1乳酸杆菌琼脂培养基
A.1.1成分
附录A
(规范性附录)
培养基和试剂
GB5413.192010
陈化乳15.0g,酵母浸膏5.0g,葡萄糖10.0g,番茄汁100mL,磷酸二氢钾2.0g,聚山梨糖单油酸酯1.0g,加水至1000mL,调节pH至6.8±0.2(25℃±5℃)。A.1.2制法
在A.1.1中加入10.0g琼脂,加热煮沸,使琼脂溶化。混合均匀后分装试管,每管10mL。121℃高压灭菌15min,备用。
A.2乳酸杆菌肉汤培养基
A.2.1成分
陈化乳15.0g,酵母浸膏5.0g,葡萄糖10.0g,番茄汁100mL,磷酸二氢钾2.0g,聚山梨糖单油酸酯1.0g,加水至1000mL,调节pH至6.8±0.2(25℃±5℃)。A.2.2制法
将A.2.1成分加热煮沸,混合均匀后分装试管,每管10mL。121℃高压灭菌15min。A.3生物素测定用培养基
A.3.1成分
维生素测定用酪蛋白氨基酸12.0g,葡萄糖40.0g,乙酸钠20.0g,L-胱氨酸0.2g,DL-色氨酸0.2g,硫酸腺嘌呤20.0mg,盐酸鸟嘌呤20.0mg,尿嘧啶20.0mg,盐酸硫胺素2.0mg,核黄素2.0mg,烟酸2.0mg,泛酸钙2.0mg,盐酸吡哆醇4.0mg,p-氨基苯甲酸200.0μg,磷酸氢二钾1.0g,磷酸二氢钾1.0g,硫酸镁0.4g,氯化钠20.0mg,硫酸亚铁20.0mg,硫酸锰20.0mg,加水至1000mL,pH6.8±0.2(25℃±5℃)。
A.3.2制法
将上述成分溶解于水中,调节pH,备用。
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
GB5413.192010
食品安全国家标准
婴幼儿食品和乳品中游离生物素的测定Nationalfoodsafetystandard
Determination of free biotin in foods for infants and young childrenmilkandmilkproducts
2010-03-26发布
中华人民共和国卫生部
2010-06-01实施
GB5413.192010
本标准代替GB/T5413.19-1997《婴幼儿配方食品和乳粉游离生物素的测定》本标准附录A为规范性附录。
本标准所代替标准的历次版本发布情况为:GB5413-1985、GB/T5413.19-1997。I
1范围
食品安全国家标准
GB5413.192010
婴幼儿食品和乳品中游离生物素的测定本标准规定了婴幼儿食品和乳品中游离生物素的测定方法。本标准适用于婴幼儿食品和乳品中游离生物素的测定。2规范性引用文件
本标准中引用的文件对于本标准的应用是必不可少的。凡是注日期的引用文件,仅所注日期的版本适用于本标准。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本标准。3原理
利用植物乳杆菌(Lactobacillusplantarum)对游离生物素的特异性和灵敏性,定量测定出试样中得测物质的含量。在含有除待测物质以外所有营养成分的培养基中,微生物的生长与待测物质含量呈线性关系,根据透光率与标准工作曲线进行比较,即可计算出试样中待测物质的含量。4试剂和材料
除非另有规定,本方法所用试剂均为分析纯,水为GB/T6682规定的二级水。4.1菌株:植物乳杆菌(Lactobacillusplantarum),ATCC8014。4.2生物素(d-Biotin或VitaminH)标准品(CioHi6N2O,S):纯度≥99%。4.3培养基
4.3.1乳酸杆菌琼脂培养基:见附录A。4.3.2乳酸杆菌肉汤培养基:见附录A。4.3.3生物素测定用培养基:见附录A。注:一些商品化合成培养基效果良好,商品化合成培养基按标签说明进行配制。4.4乙醇溶液(50%)。
4.5硫酸溶液(3%):量取3mL硫酸加入到水中,定容至100mL。4.6氢氧化钠溶液(0.5mol/L):称取20g氢氧化钠溶于1000mL水中。4.7氯化钠溶液(9g/L):称取9.0g氯化钠溶解于1000mL水中,分装试管,每管10mL。121℃灭菌15min。
4.8标准溶液的制备
4.8.1生物素标准贮备液(100μg/mL):称取生物素标准品(4.2)用乙醇溶液(4.4)定容至生物素浓度为100μg/mL,贮于冰箱中。4.8.2生物素标准中间液(1μg/mL):吸取1mL生物素标准贮备液(4.8.1),用乙醇溶液(4.4)定容至100mL。
4.8.3生物素标准工作液(10ng/mL):吸取1mL生物素标准中间液(4.8.2),用乙醇溶液(4.4)定容至100mL。
4.8.4标准曲线工作液
GB5413.192010
分两个浓度,高浓度溶液的浓度为0.2ng/mL:低浓度溶液的浓度为0.1ng/mL。从工作液中(4.8.3)吸取两次各5mL,用水分别定容到250mL和500mL。注:所有标准溶液要储存于冰箱内。4.8.1、4.8.2、和4.8.3保存期三个月,4.8.4临用前配制。5仪器和设备
除微生物实验室常规灭菌及培养设备外,其他设备和材料如下:5.1天平:感量为0.1mg。
5.2pH计:精度≤0.02
5.3分光光度计。
5.4涡旋混合器。
5.5离心机:转速≥2000转/分钟。5.6恒温培养箱:36℃±1℃。
5.7冰箱:2℃~5℃。
5.8无菌吸管:10mL(具0.1mL刻度)或微量移液器或吸头。5.9瓶口分液器:0mL~10mL。
5.10锥形瓶:200mL。
容量瓶(A类):100mL,250mL,500mL。5.12单刻度移液管(A类):容量5mL。漏斗:直径90mm。
5.14定量滤纸:直径90mm。
5.15试管:18mm×180mm。
注:玻璃仪器使用前,用活性剂(月桂磺酸钠或家用洗涤剂加入到洗涤用水中即可)对硬玻璃测定管及其他必要的玻璃器皿进行清洗,清洗之后在200℃干热2h。6分析步骤
6.1接种菌悬液的制备
6.1.1将冻干菌株(4.1)活化后,转接到乳酸杆菌琼脂培养基(4.3.1)中,36℃±1℃培养过夜。再转接2~3代来增强活力。然后再将其从固体培养上转接到乳酸杆菌肉汤培养基(4.3.2)中培养。6.1.2将乳酸杆菌肉汤中的培养液以2000转/分钟离心2min~3min,倾出上清液,加入10mL氯化钠溶液(4.7),混匀,再离心2min~3min,如此清洗3次~4次,吸适量该菌悬液于10mL盐水(4.7中,待测。
6.1.3用分光光度计以氯化钠溶液(4.7)做空白,于550nm波长下测菌悬液(6.1.2)的透光率,使其透光率在60%~80%之间。
6.2样品的处理
6.2.1干粉样品
称取一定量样品(精确至0.0001g)于250mL三角瓶中,该样品应含0.2μg~0.5μg生物素。继续6.2.3步骤。
6.2.2液体样品
吸一定量的液体样品于250mL三角瓶中,该样品应含0.2μg~0.5μg生物素。继续6.2.3步骤。6.2.3样品的提取
GB5413.192010
加入硫酸溶液(4.5)100mL,121℃水解30min,冷却后用氢氧化钠溶液(4.6)调节pH至4.5±0.2,定量转到250mL容量瓶中,用水定容,充分混合。用滤纸过滤,弃去最初的几毫升。吸取滤液5mL,加入约20mL水,用氢氧化钠溶液(4.6)调pH为6.8±0.2,定量转到100mL容量瓶中,用水定容。6.3标准曲线的制作
按表1顺序加入水、标准曲线工作液(4.8.4)和生物素测定用培养基(4.3.3)于培养管中,一式三份。
表1标准曲线的制作
试管号
水(mL)
标准曲线工作液
0.1ng/mL(mL)
标准曲线工作液
0.2ng/mL (mL)
培养基(mL)
6.4待测液的制作
按表2顺序加水、样品溶液(6.2.3)和生物素测定用培养基(4.3.3)于培养管内,每份样品需带样品空白试管一只,管内分别加入5mL待测液和5mL培养基。表2待测液的制作
试管号
水(mL)
样品溶液(mL)
培养基(mL)
6.5灭菌
一式三份。
样品空白
将6.3和6.4中所有的试管盖上试管帽,放入灭菌釜内,121℃灭菌5min(商品培养基按标签说明进行灭菌)。
6.6接种
从灭菌釜内取出试管,将试管迅速冷却至30℃以下。将接种菌悬液(6.1.2)用滴管或移液器向上述试管中各滴加一滴(约50uμL),其中标准曲线管中未接种空白S1和样品空白除外。6.7培养
将试管放入培养箱内,36℃±1℃培养19h~20h。6.8测定
对每支试管进行视觉检查,接种空白试管S1内培养液应是澄清的,如果出现浑浊,则结果无效。6.8.1以接种空白试管S1做对照,测定最高浓度标准曲线试管的吸光度,两小时后重新测定。两次结果透光率差值若小于2%,则取出全部检验管测其吸光度A。6.8.2以接种空白试管S2为空白,调节吸光度为0,依次读出其他每支试管的吸光度A,样品空白的吸光度A一并读出。
6.8.3用涡旋混合器充分混合每一支试管(也可以加一滴消泡剂)后,立即将培养液移入比色血内进行测定,波长为550nm,待读数稳定30s后,读出吸光度A,每支试管稳定时间要相同。以生物素标准品的含量为横坐标,吸光度A为纵坐标作标准曲线。6.8.4待测液培养试管中,样品空白试管吸光度应小于0.05。若样品空白试管吸光度大于0.02,加入待测液1mL的试管的吸光度值要减去其样品空白试管吸光度值的1/5,加入待测液2mL的试管的吸光3
GB5413.192010bzxZ.net
度值要减去其样品空白试管吸光度值的2/5,以此类推,作为计算结果的依据。根据待测液的吸光度A,从标准曲线中查得该待测液中生物素的浓度,再根据稀释因子和称样量计算出试样中生物素的含量。吸光度值超出标准曲线管S3~S10范围的试样管要舍去。6.8.5对每个编号的待测液试管,用每支试管的吸光度值计算每毫升该编号待测液生物素的含量,并计算该编号待测液的生物素含量平均值,每支试管测得的该浓度不得超过该平均值的土15%,超过者要舍去。如果符合该要求的管数少于所有四个编号待测液总管数的2/3,需要重新检验。如果符合该要求的管数大于等于原来管数的2/3,重新计算每一编号的有效试样管中每毫升测定液生物素含量的平均值,以此平均值计算全部编号试样管的总平均值C,用于计算试样中的生物素含量。7分析结果的表述
试样中生物素的含量按公式(1)计算:C
式中:
X—试样中生物素的含量,单位为微克每百克(μg/100g);Cx6.8.5中计算所得的总平均值,单位为纳克(ng);m试样的质量,单位为克(g);
f稀释倍数。
以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留两位有效数字。8精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。9其他
本标准检出限为20.0μg/kg。
A.1乳酸杆菌琼脂培养基
A.1.1成分
附录A
(规范性附录)
培养基和试剂
GB5413.192010
陈化乳15.0g,酵母浸膏5.0g,葡萄糖10.0g,番茄汁100mL,磷酸二氢钾2.0g,聚山梨糖单油酸酯1.0g,加水至1000mL,调节pH至6.8±0.2(25℃±5℃)。A.1.2制法
在A.1.1中加入10.0g琼脂,加热煮沸,使琼脂溶化。混合均匀后分装试管,每管10mL。121℃高压灭菌15min,备用。
A.2乳酸杆菌肉汤培养基
A.2.1成分
陈化乳15.0g,酵母浸膏5.0g,葡萄糖10.0g,番茄汁100mL,磷酸二氢钾2.0g,聚山梨糖单油酸酯1.0g,加水至1000mL,调节pH至6.8±0.2(25℃±5℃)。A.2.2制法
将A.2.1成分加热煮沸,混合均匀后分装试管,每管10mL。121℃高压灭菌15min。A.3生物素测定用培养基
A.3.1成分
维生素测定用酪蛋白氨基酸12.0g,葡萄糖40.0g,乙酸钠20.0g,L-胱氨酸0.2g,DL-色氨酸0.2g,硫酸腺嘌呤20.0mg,盐酸鸟嘌呤20.0mg,尿嘧啶20.0mg,盐酸硫胺素2.0mg,核黄素2.0mg,烟酸2.0mg,泛酸钙2.0mg,盐酸吡哆醇4.0mg,p-氨基苯甲酸200.0μg,磷酸氢二钾1.0g,磷酸二氢钾1.0g,硫酸镁0.4g,氯化钠20.0mg,硫酸亚铁20.0mg,硫酸锰20.0mg,加水至1000mL,pH6.8±0.2(25℃±5℃)。
A.3.2制法
将上述成分溶解于水中,调节pH,备用。
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。