GB/T 25878-2010
基本信息
标准号: GB/T 25878-2010
中文名称:对虾传染性皮下及造血组织坏死病毒(IHHNV)检测 PCR法
标准类别:国家标准(GB)
标准状态:现行
出版语种:简体中文
下载格式:.rar .pdf
下载大小:207KB
相关标签: 对虾 传染性 皮下 造血 组织 坏死病毒 检测 PCR

标准分类号
关联标准
出版信息
相关单位信息
标准简介
GB/T 25878-2010 对虾传染性皮下及造血组织坏死病毒(IHHNV)检测 PCR法
GB/T25878-2010
标准压缩包解压密码:www.bzxz.net
标准图片预览




标准内容
ICS 65. 020. 30
中华人民共和国国家标准
GB/T25878-—2010
对虾传染性皮下及造血组织坏死病毒PCR法
IHHNV)检测
Polymerase chain reaction (PCR) method for infectious hypodermal andhaernatopoietic necrosis virus (IHHNV)2011-01-10 发布
中华人民共和国国家质量监督检验检疫总局中国国家标准化管理委员会
2011-06-01实施
本标准的附录 A 和附录 B 为资料性附录。本标准由中华人民共和国农业部提出。本标准由全国水产标准化技术委员会归口。GB/T25878—2010
本标准起草单位:中国水产科学研究院黄海水产研究所、农业部全国水产技术推广总站。本标准主要起草人,黄健、杨冰、朱泽闻、朱晓玲、孙喜模、赵红萍、刘莉。H
TYKAoNYKAa
对虾传染性皮下及造血组织坏死病霉(IHHN)检测PCR法
GB/T 258782010
警告:使用本标准的人员应有正规实验室工作的实殿经验,本标准并未指出所有可能的安全问题。使用者有责任采取适当的安全和随廉施,并保证符合国家有关法规规定的条件。1范圈
本标准规定了对虾传染性皮下及造血组织坏死病毒(IHHNV)骤合酶链式反应(PCR)检测方法的原理、所需试剂和材料、仪器和设备、操作步乐和结果判定。本标准适用于对虾,环境生物、饵料生物和其他各种非生物样品中传染性皮下及造血组织坏死病毒(IHHNV)的定性检测。不适于对病毒或感染活性的估测以及宿主感染程度的评估。2规范性引用文件
下列文件中的条款通过本标准的引用而成为本标推的条款。凡是注期的引用文件,其随后所有的修改单(不包括谢误的内容)或像订版均不适用手本标准,就而,敏根据本标推送成协设的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。SC/T7202.1---2007斑节对虾杆状病毒诊断规程第1部分:压片显微镜检查法SC/T7202.2—2007斑节对虾杆状病表诊断规程第2部分:PCR检测法3原理
3.1对虾传染性皮下及造血组织坏死病毒及其流行特征传染性皮下及造血组织坏死病毒(infectioushypodermaland haetnatopoieticnecrogisvirusIHHNV)粒子大小为 20 nm~~22 ntm,是无塞膜二十面体,在氛化艳中的浮力密度为 1. 40 g/mL.合含线状单链 DNA,长度为 4. 1 kb,衣壳由 4个分子质量分别为 74 kD,47 kD,39 kD,37.5 kD的多肽组成。IHHNV可感染世界各地的养殖对虾,其感染细角滨对虾(Litopenaeusstytirostris)会引起篇性传染病和商死亡率(9o%),稚虾受到的危害最严重。IHHNV感染纳滨对虾(Litopenaexs vannamei)会引起慢性\矮小残缺综合症\(RDS),主要影响是患病对虾生长缓慢,瞄形,受感染存活对虾终生带毒,通过垂直和水平传播。
3.2技术原理
IHHNV 的聚合酶链式反应(polymerase chain reartion,PCR)是以 IHHNV 的一段 389 个碱基(b)长度的特异性DNA序列作为模板,以与模板两端序列互补的一对特异性寻核替酸序刻作为引物,在四种脱氧核糖孩者三碟酸存在下,利用依糖NA的A案合醇的合成作用,经过数十款变性,退火和延伸的反应循环,使模板上介于两个引物之间的DNA片段得到特异性地缎数扩增:再通过电泳等手段检测到被特异性扩增的片段,从而揭示微盘 IHHNV DNA的存在。4试剂和材料
4.1所需试剂除引物,阳性对照和阴性对照以外,按照 SC/T 7202,2一2007中第 5 章的规定。4.2100ng/uL号[物F:5'-CGG-AAC-ACA-ACC-CGA-CTT-TA-3',—20C保存。4.3100 g/μL引物 R:5'-GGC-CAA-GAC-CAA-AAT-ACG-AA-3,-20保存4. 4阳性对照为已知 IHHVV 阳性的组织样品的 DNA 模板,-20 C保存。1
GB/T 25876—2010
4.5阴性对照为已知IHHNV阴性的组织样品的DVA模板,一20保存。4.6空白对照以无菌双蒸水为模板。5仪馨和设备
所带仪器设备按照SC/T7202.2—2007中第6章的规定。6 操作步骤
6.1反应体系的准备
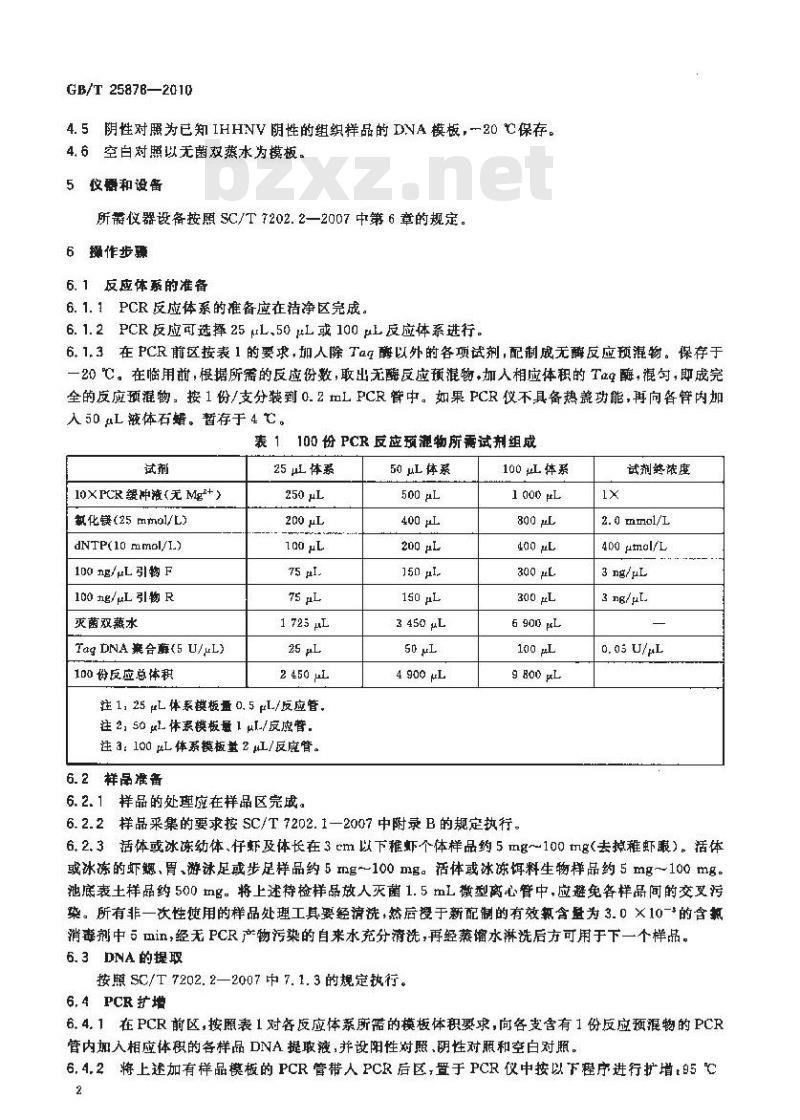
6.1.1PCR反应体系的准备应在洁净区完成。6.1.2PCR反应可选择25μL、50μL或100μL反应体系进行。6. 1,3 在 PCR 前区按表 1 的要求,加人除 Ta4 酶以外的各项试剂,配制成无酶反应预混物。 保存于一20℃。在临用前,根据所需的反应份数取出无酶反应预混物,加人相应体积的T酶,混,即成完全的反应预涯物,按1份/支分装到0.2mLPCR管中。如果PCR仪不具备热盖功能,再向各内加入 50 L 被体石蜡。暂存于 4 亡,表 1 100 份 PCR 反应项灌物所需试剂组成试剂
10×PCR缓冲液(无Mg+)
氯化镁(25mml/L)
dNTP(10 mmol/L.)
100 ng/μL引物 F
100 ng/μL 引物 R
灭菌双蒸水
Tag DNA 案合酶(5 U/μL)
100份反应总体积
25 uL 体系
250μL
200 μL
75 μL
1725μ
25 μL
2 450 μL
注 1, 25 μL 体系模板量 0. 5 eL /反应管,注2,50 μL-体系模板量 1 μl-/反应管.注3:100μ体系模板量2/反应管。6. 2 样品准备
6.2.1样品的处理应在样品区完成。50 μL 体系
500 μL
200 μL
150 μL
3 450μL
50 μL
4.900 μL
100 μu体系
1000μL
4ao μL
300 μL
300 μL
6.900 μL
100 μL
g800 pL
6.2.2样品采集的要求按SC/T7202.12007中附录B的规定执行。1x
试剂终浓度免费标准下载网bzxz
2. mmol/L
400 μmol/L
3 ng/μL
3 ng/μL.
0. 0s U/μL
6.2.3活体或冰冻体,仔虾及体长在 3 m 以下推虾个体样品约 5 mg~100 tg(去掉稚虾眼)。活体或冰冻的虾竭,胃、游泳足或步足样品约5mg~100mg。活体或冰冻饵料生物样品约5mg~100mg。池底表土样品约500mg。将上述待检样品放人灭菌1.5mL微型离心管中,应避免各样品间的交支污染。所有非一次性使用的样品处理工其要经清洗,然后没于新配制的有效氧含量为3.0×10-的含氯消毒剂中5min,经无PCR产物污染的自来水充分清洗,再经蒸馏水淋洗后方可用于下一个样品。6.3DNA的提取
按照SC/T7202.2—2007中7.1.3的规定执行。6.4PCR扩增
6.4. 1在PCR前区,按照表1对各反应体系所需的模板体积要求,向各支含有 1份反应预混物的PCR管内加入相应体积的各样品DNA提取液,并设阳性对照、阴性对照和空白对照。6.4.2将上述加有样品模板的PCR管带人PCR后区,置于PCR仅中按以下程序进行扩增:95C2
TYKAONYKACA
GB/T25878—2010
5min;95℃30s、55℃30s、721min.35个循环;72℃廷伸7min,最后4℃保。准备进行产物的电泳。
6.5PCR产物电逐
按照SC/T7202.22007中7.1.5--7.1.8的规定执行。7结果判定
7.1阳性对照和阳性样品在389 bp处应有一条特定条带出现阴性对照和阴性样品在389 bp处应无条带出现,空自对照不出现任何蔡带,阳性对在389b处无特定系带出现或阴性对照在39的处有条带出现都表期PCR失败,应在排除故障和清除污染后,重新取样检测。对虾传染性皮下及造血组织坏死病毒(IHHNV)PCR检测产物序列参见附录A。7.2条带的亮暗表示扩增产物浓度的多少,但并不对应于模板的盘的多少。7.3阳性结果表明被检样品中存在IHHNV DNA。对活虾和敏感宿主而言,提示已受 IHHNV 康染对冰鲜或冰冻对虾而言,挺示曾受到IHHNV感染。.4电球猫巢的分析和向题排除方法参见附录B。GB/T 25878-2010
附录 A
(资料性附录)
对虾传染性皮下及造血组织环死病毒(IHHNV)骤合酶链式反应(PCR)检测产物序列1
GAGGACAGAG
CGGACGAAAT
CAACATGGTA
CGCCRAACTT
CAACCAATAA
CCAGAGCCGA
ATCTTATCAG
CTGTAGTAGC
GGACGGAAGG
CACCTTCGEC
CACCATTACA
GACCAGACAT
AGCTGAAGCG
ATACGGTATT
GGAACACAAC
CGACTGGAAG
ATCAGAGAAA
GATCATGGTG
AGAGCTACAA
ACTACGGTAC
GAACGGCTTT
CCGACTTTAT
AGAGTGAGAT
TGAAGGGACT
TGATAAACAA
AAGAAGACTC
AACCACAACC
ACCACTGGCA
TCCTCGCCTA
TTGTTAGAAA
CGTATTETGG
CATCACATAC
TTTGGGAGTT
TATCAAGAGA
TCTTGGCCAC
对虾LHHNVV PCR检测产物序列
TYKAONYKACA
CCCAACGGAC
GTGGAAAGTA
TCCGGACGAA
TCCGGACACC
ACCTTTGCTG
TGGATACTCT
GCCATTTTTA
试验结果
对虾样品
附录B
(资料性附录)
对虾传染性皮下及造血组织坏死病毒(IHIHNV)聚合酶链式反应(FCR)检测电泳结果分析和问题排除方法囊B.1对虾 IHHNVPCR检测电泳结果分析和间硒排除方法结果判读及原因分析
阳性对照和阳性样品
在389bp处有条带阴性对
照和空白对照无 389 bp
阳性对照有条带,但分
子质量标准设有影像
分子质量标准有影像,
但阳性对照无条带
阴性对照或空白对照
在 389 bp 处有案带出现
阳性对关和阴性对照
组正常,但已知带牵样品无
分子质基标准正常,但
阳性对照,阴性对照和样品
出现较多杂带或明显的殊
凝胶上无任何影像,包
括 DNA 分子质量标准
1.PCR反应正常.结果有效
1,分子质量标准失效或加样域
1.PCR反应失败
2. 阳性对照失效
1. 散盐秘液器污染
名。试剂污染
3,环境污染
4.操作污染
1.DNA提取失败或降解
2. DNA 浓度过高
3. PCR 抑制物介入
1. 未往意热启动操作,使 PCR
出现非特异性扩增
2. 酶活性、dNTP 浓度或 Mg*+
浓度差异
3. 温度控制异常
1.紫外规察仪故障
2、背景发红太充
GB/T 2587B-2010
问题排除
更换分子质虽标准或增加其加样盘检查并更换 PCR反应所用试剂及 FCR 程序是否正确
更换阳性对照,直新实验
清洗微孟液器,只能用PCR后区的誉量移液器取反应产物
更换试剂
清洁实验室及所用仪器设备,SC/T7202,2一2007中的附录B
禁止从 PCR 后区到 PCR前区的交疏,如强择作隔离
控查提取 DNA所用试剂情况,重新试验,确认样品新鲜槿度
将样品稀释 10 倍以上
希释样品10循以上变重新提取DNA做好热启动操作。样品先要加到 PCR管蓝上,反应预准物预热后,短督离心(1~2s)以据人样品,迅速散回预热PCR仪中
确认须混物制备的准确性、试剂质量,对不间批衣的醇重新测定量佳 Mg+高子浓度检查 PCR 仪是否复性温度过低
检查累外观案仪
减少湾化乙雄(EB)~用量,将琼脂糖凝胶量于湾水中 30 min后再观塞辑巢
GB/T25878—2010
试验结果
凝胶上无任何影像,包
括DNA分子质盘标准
表 B. 1 (续)
结果判读及原因分析
凝胶太厚
电极频倒或电泳时间过长
5.浪化乙锭(EB)分解失效
问痴排除
重新制作琼脂糖護胶片
改正电极方向,新加样电泳
重新配制溴化乙途(EB)
激化乙(EB)有毒,试剂的操作和废奔物的处理按SC/T7202.2—2007中附录B的规定执行6
YKAONYKA
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
中华人民共和国国家标准
GB/T25878-—2010
对虾传染性皮下及造血组织坏死病毒PCR法
IHHNV)检测
Polymerase chain reaction (PCR) method for infectious hypodermal andhaernatopoietic necrosis virus (IHHNV)2011-01-10 发布
中华人民共和国国家质量监督检验检疫总局中国国家标准化管理委员会
2011-06-01实施
本标准的附录 A 和附录 B 为资料性附录。本标准由中华人民共和国农业部提出。本标准由全国水产标准化技术委员会归口。GB/T25878—2010
本标准起草单位:中国水产科学研究院黄海水产研究所、农业部全国水产技术推广总站。本标准主要起草人,黄健、杨冰、朱泽闻、朱晓玲、孙喜模、赵红萍、刘莉。H
TYKAoNYKAa
对虾传染性皮下及造血组织坏死病霉(IHHN)检测PCR法
GB/T 258782010
警告:使用本标准的人员应有正规实验室工作的实殿经验,本标准并未指出所有可能的安全问题。使用者有责任采取适当的安全和随廉施,并保证符合国家有关法规规定的条件。1范圈
本标准规定了对虾传染性皮下及造血组织坏死病毒(IHHNV)骤合酶链式反应(PCR)检测方法的原理、所需试剂和材料、仪器和设备、操作步乐和结果判定。本标准适用于对虾,环境生物、饵料生物和其他各种非生物样品中传染性皮下及造血组织坏死病毒(IHHNV)的定性检测。不适于对病毒或感染活性的估测以及宿主感染程度的评估。2规范性引用文件
下列文件中的条款通过本标准的引用而成为本标推的条款。凡是注期的引用文件,其随后所有的修改单(不包括谢误的内容)或像订版均不适用手本标准,就而,敏根据本标推送成协设的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。SC/T7202.1---2007斑节对虾杆状病毒诊断规程第1部分:压片显微镜检查法SC/T7202.2—2007斑节对虾杆状病表诊断规程第2部分:PCR检测法3原理
3.1对虾传染性皮下及造血组织坏死病毒及其流行特征传染性皮下及造血组织坏死病毒(infectioushypodermaland haetnatopoieticnecrogisvirusIHHNV)粒子大小为 20 nm~~22 ntm,是无塞膜二十面体,在氛化艳中的浮力密度为 1. 40 g/mL.合含线状单链 DNA,长度为 4. 1 kb,衣壳由 4个分子质量分别为 74 kD,47 kD,39 kD,37.5 kD的多肽组成。IHHNV可感染世界各地的养殖对虾,其感染细角滨对虾(Litopenaeusstytirostris)会引起篇性传染病和商死亡率(9o%),稚虾受到的危害最严重。IHHNV感染纳滨对虾(Litopenaexs vannamei)会引起慢性\矮小残缺综合症\(RDS),主要影响是患病对虾生长缓慢,瞄形,受感染存活对虾终生带毒,通过垂直和水平传播。
3.2技术原理
IHHNV 的聚合酶链式反应(polymerase chain reartion,PCR)是以 IHHNV 的一段 389 个碱基(b)长度的特异性DNA序列作为模板,以与模板两端序列互补的一对特异性寻核替酸序刻作为引物,在四种脱氧核糖孩者三碟酸存在下,利用依糖NA的A案合醇的合成作用,经过数十款变性,退火和延伸的反应循环,使模板上介于两个引物之间的DNA片段得到特异性地缎数扩增:再通过电泳等手段检测到被特异性扩增的片段,从而揭示微盘 IHHNV DNA的存在。4试剂和材料
4.1所需试剂除引物,阳性对照和阴性对照以外,按照 SC/T 7202,2一2007中第 5 章的规定。4.2100ng/uL号[物F:5'-CGG-AAC-ACA-ACC-CGA-CTT-TA-3',—20C保存。4.3100 g/μL引物 R:5'-GGC-CAA-GAC-CAA-AAT-ACG-AA-3,-20保存4. 4阳性对照为已知 IHHVV 阳性的组织样品的 DNA 模板,-20 C保存。1
GB/T 25876—2010
4.5阴性对照为已知IHHNV阴性的组织样品的DVA模板,一20保存。4.6空白对照以无菌双蒸水为模板。5仪馨和设备
所带仪器设备按照SC/T7202.2—2007中第6章的规定。6 操作步骤
6.1反应体系的准备
6.1.1PCR反应体系的准备应在洁净区完成。6.1.2PCR反应可选择25μL、50μL或100μL反应体系进行。6. 1,3 在 PCR 前区按表 1 的要求,加人除 Ta4 酶以外的各项试剂,配制成无酶反应预混物。 保存于一20℃。在临用前,根据所需的反应份数取出无酶反应预混物,加人相应体积的T酶,混,即成完全的反应预涯物,按1份/支分装到0.2mLPCR管中。如果PCR仪不具备热盖功能,再向各内加入 50 L 被体石蜡。暂存于 4 亡,表 1 100 份 PCR 反应项灌物所需试剂组成试剂
10×PCR缓冲液(无Mg+)
氯化镁(25mml/L)
dNTP(10 mmol/L.)
100 ng/μL引物 F
100 ng/μL 引物 R
灭菌双蒸水
Tag DNA 案合酶(5 U/μL)
100份反应总体积
25 uL 体系
250μL
200 μL
75 μL
1725μ
25 μL
2 450 μL
注 1, 25 μL 体系模板量 0. 5 eL /反应管,注2,50 μL-体系模板量 1 μl-/反应管.注3:100μ体系模板量2/反应管。6. 2 样品准备
6.2.1样品的处理应在样品区完成。50 μL 体系
500 μL
200 μL
150 μL
3 450μL
50 μL
4.900 μL
100 μu体系
1000μL
4ao μL
300 μL
300 μL
6.900 μL
100 μL
g800 pL
6.2.2样品采集的要求按SC/T7202.12007中附录B的规定执行。1x
试剂终浓度免费标准下载网bzxz
2. mmol/L
400 μmol/L
3 ng/μL
3 ng/μL.
0. 0s U/μL
6.2.3活体或冰冻体,仔虾及体长在 3 m 以下推虾个体样品约 5 mg~100 tg(去掉稚虾眼)。活体或冰冻的虾竭,胃、游泳足或步足样品约5mg~100mg。活体或冰冻饵料生物样品约5mg~100mg。池底表土样品约500mg。将上述待检样品放人灭菌1.5mL微型离心管中,应避免各样品间的交支污染。所有非一次性使用的样品处理工其要经清洗,然后没于新配制的有效氧含量为3.0×10-的含氯消毒剂中5min,经无PCR产物污染的自来水充分清洗,再经蒸馏水淋洗后方可用于下一个样品。6.3DNA的提取
按照SC/T7202.2—2007中7.1.3的规定执行。6.4PCR扩增
6.4. 1在PCR前区,按照表1对各反应体系所需的模板体积要求,向各支含有 1份反应预混物的PCR管内加入相应体积的各样品DNA提取液,并设阳性对照、阴性对照和空白对照。6.4.2将上述加有样品模板的PCR管带人PCR后区,置于PCR仅中按以下程序进行扩增:95C2
TYKAONYKACA
GB/T25878—2010
5min;95℃30s、55℃30s、721min.35个循环;72℃廷伸7min,最后4℃保。准备进行产物的电泳。
6.5PCR产物电逐
按照SC/T7202.22007中7.1.5--7.1.8的规定执行。7结果判定
7.1阳性对照和阳性样品在389 bp处应有一条特定条带出现阴性对照和阴性样品在389 bp处应无条带出现,空自对照不出现任何蔡带,阳性对在389b处无特定系带出现或阴性对照在39的处有条带出现都表期PCR失败,应在排除故障和清除污染后,重新取样检测。对虾传染性皮下及造血组织坏死病毒(IHHNV)PCR检测产物序列参见附录A。7.2条带的亮暗表示扩增产物浓度的多少,但并不对应于模板的盘的多少。7.3阳性结果表明被检样品中存在IHHNV DNA。对活虾和敏感宿主而言,提示已受 IHHNV 康染对冰鲜或冰冻对虾而言,挺示曾受到IHHNV感染。.4电球猫巢的分析和向题排除方法参见附录B。GB/T 25878-2010
附录 A
(资料性附录)
对虾传染性皮下及造血组织环死病毒(IHHNV)骤合酶链式反应(PCR)检测产物序列1
GAGGACAGAG
CGGACGAAAT
CAACATGGTA
CGCCRAACTT
CAACCAATAA
CCAGAGCCGA
ATCTTATCAG
CTGTAGTAGC
GGACGGAAGG
CACCTTCGEC
CACCATTACA
GACCAGACAT
AGCTGAAGCG
ATACGGTATT
GGAACACAAC
CGACTGGAAG
ATCAGAGAAA
GATCATGGTG
AGAGCTACAA
ACTACGGTAC
GAACGGCTTT
CCGACTTTAT
AGAGTGAGAT
TGAAGGGACT
TGATAAACAA
AAGAAGACTC
AACCACAACC
ACCACTGGCA
TCCTCGCCTA
TTGTTAGAAA
CGTATTETGG
CATCACATAC
TTTGGGAGTT
TATCAAGAGA
TCTTGGCCAC
对虾LHHNVV PCR检测产物序列
TYKAONYKACA
CCCAACGGAC
GTGGAAAGTA
TCCGGACGAA
TCCGGACACC
ACCTTTGCTG
TGGATACTCT
GCCATTTTTA
试验结果
对虾样品
附录B
(资料性附录)
对虾传染性皮下及造血组织坏死病毒(IHIHNV)聚合酶链式反应(FCR)检测电泳结果分析和问题排除方法囊B.1对虾 IHHNVPCR检测电泳结果分析和间硒排除方法结果判读及原因分析
阳性对照和阳性样品
在389bp处有条带阴性对
照和空白对照无 389 bp
阳性对照有条带,但分
子质量标准设有影像
分子质量标准有影像,
但阳性对照无条带
阴性对照或空白对照
在 389 bp 处有案带出现
阳性对关和阴性对照
组正常,但已知带牵样品无
分子质基标准正常,但
阳性对照,阴性对照和样品
出现较多杂带或明显的殊
凝胶上无任何影像,包
括 DNA 分子质量标准
1.PCR反应正常.结果有效
1,分子质量标准失效或加样域
1.PCR反应失败
2. 阳性对照失效
1. 散盐秘液器污染
名。试剂污染
3,环境污染
4.操作污染
1.DNA提取失败或降解
2. DNA 浓度过高
3. PCR 抑制物介入
1. 未往意热启动操作,使 PCR
出现非特异性扩增
2. 酶活性、dNTP 浓度或 Mg*+
浓度差异
3. 温度控制异常
1.紫外规察仪故障
2、背景发红太充
GB/T 2587B-2010
问题排除
更换分子质虽标准或增加其加样盘检查并更换 PCR反应所用试剂及 FCR 程序是否正确
更换阳性对照,直新实验
清洗微孟液器,只能用PCR后区的誉量移液器取反应产物
更换试剂
清洁实验室及所用仪器设备,SC/T7202,2一2007中的附录B
禁止从 PCR 后区到 PCR前区的交疏,如强择作隔离
控查提取 DNA所用试剂情况,重新试验,确认样品新鲜槿度
将样品稀释 10 倍以上
希释样品10循以上变重新提取DNA做好热启动操作。样品先要加到 PCR管蓝上,反应预准物预热后,短督离心(1~2s)以据人样品,迅速散回预热PCR仪中
确认须混物制备的准确性、试剂质量,对不间批衣的醇重新测定量佳 Mg+高子浓度检查 PCR 仪是否复性温度过低
检查累外观案仪
减少湾化乙雄(EB)~用量,将琼脂糖凝胶量于湾水中 30 min后再观塞辑巢
GB/T25878—2010
试验结果
凝胶上无任何影像,包
括DNA分子质盘标准
表 B. 1 (续)
结果判读及原因分析
凝胶太厚
电极频倒或电泳时间过长
5.浪化乙锭(EB)分解失效
问痴排除
重新制作琼脂糖護胶片
改正电极方向,新加样电泳
重新配制溴化乙途(EB)
激化乙(EB)有毒,试剂的操作和废奔物的处理按SC/T7202.2—2007中附录B的规定执行6
YKAONYKA
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。