GB 4789.31-2013
基本信息
标准号: GB 4789.31-2013
中文名称:食品微生物学检验 沙门氏菌、志贺氏菌和致泻大肠埃希氏菌的肠杆菌科噬菌体诊断检验
标准类别:国家标准(GB)
标准状态:现行
出版语种:简体中文
下载格式:.rar .pdf
下载大小:417KB
相关标签: 食品 微生物学 检验 沙门氏菌 氏菌 致泻 大肠 埃希氏 杆菌 噬菌体 诊断

标准分类号
关联标准
出版信息
相关单位信息
标准简介
GB 4789.31-2013 食品微生物学检验 沙门氏菌、志贺氏菌和致泻大肠埃希氏菌的肠杆菌科噬菌体诊断检验
GB4789.31-2013
标准压缩包解压密码:www.bzxz.net
标准图片预览




标准内容
中华人民共和国国家标准
GB4789.31—2013
食品安全国家标准
食品微生物学检验
沙门氏菌、志贺氏菌和致泻大肠埃希氏菌的肠杆菌科噬菌体诊断检验
2013-11-29发布
中华人民共和国
国家卫生和计划生育委员会
2014-06-01实施
GB4789.31—2013
本标准代替GB/T4789.31-2003《食品卫生微生物学检验沙门氏菌、志贺氏菌和致泻大肠埃希氏菌的肠杆菌科噬菌体检验方法》。本标准与GB/T4789.31-2003相比,主要变化如下:修改了操作步骤;
—增加了附录B。
1范围
食品安全国家标准
食品微生物学检验
沙门氏菌、志贺氏菌和致泻大肠埃希氏菌的肠杆菌科噬菌体诊断检验
GB4789.312013
本标准规定了应用肠杆菌科噬菌体诊断方法检验食品中沙门氏菌、志贺氏菌和致泻大肠埃希氏菌。本标准适用于各类食品和食源性疾病事件样品中沙门氏菌、志贺氏菌和致泻大肠埃希氏菌的检验。本标准适用于食品行业从业人员肠道沙门氏菌和志贺氏菌带菌检验设备和材料
除微生物实验室常规灭菌、培养的设备外,其他设备和材料如下:恒温培养箱:36℃±1℃,42℃±1℃,50℃±1℃;a)
厌氧培养装置:41.5℃±0.5℃;显微镜:10倍~100倍;
水平仪:噬菌体试验的工作台面应调整至水平位置;已灭菌1mL一次性注射器(应为塑料材质),针头无编号,使用前测定每滴5μL~10μL(每mL有100~200滴)可用;此内容来自标准下载网
微量移液器及吸头(10μL和5μL);定量移液器及吸头(100μL和50μL);无菌吸管:10mL、5mL、1mL;
无菌毛细管:
无菌培养皿:90mm;
无菌棉签;
带盖的灭菌小试管:8mm×50mm;m)载物玻片。
培养基和试剂
亚硒酸盐胱氨酸(SC)增菌液:见附录A中的A.1。四硫磺酸钠煌绿(TTB)增菌液:见附录A中的A.2。3.3志贺氏菌(BCT)增菌液:见附录A中的A.3。3.4营养肉汤(NB):见附录A中的A.4。3.5营养琼脂(NA):见附录A中的A.5。3.6营养半固体琼脂(NSA):见附录A中的A.6。1
3.7三糖铁琼脂(TSI):见附录A中的A.7。3.8葡萄糖铵琼脂:见附录A中的A.8。GB4789.31—2013
3.9肠杆菌科诊断用噬菌体,7种和3种。必要时可再购置大肠埃希氏菌分型噬菌体(6种)一套。安部开启后用无菌毛细管吸出移入灭菌小试管内,如果每次使用量很少,可分装于2~3支试管内,保存于5℃冰箱备用。
3.10沙门氏菌因子血清,志贺氏菌分型因子血清,致泻大肠埃希氏菌分型因子血清。因子血清的种类视需要而定。
检验程序
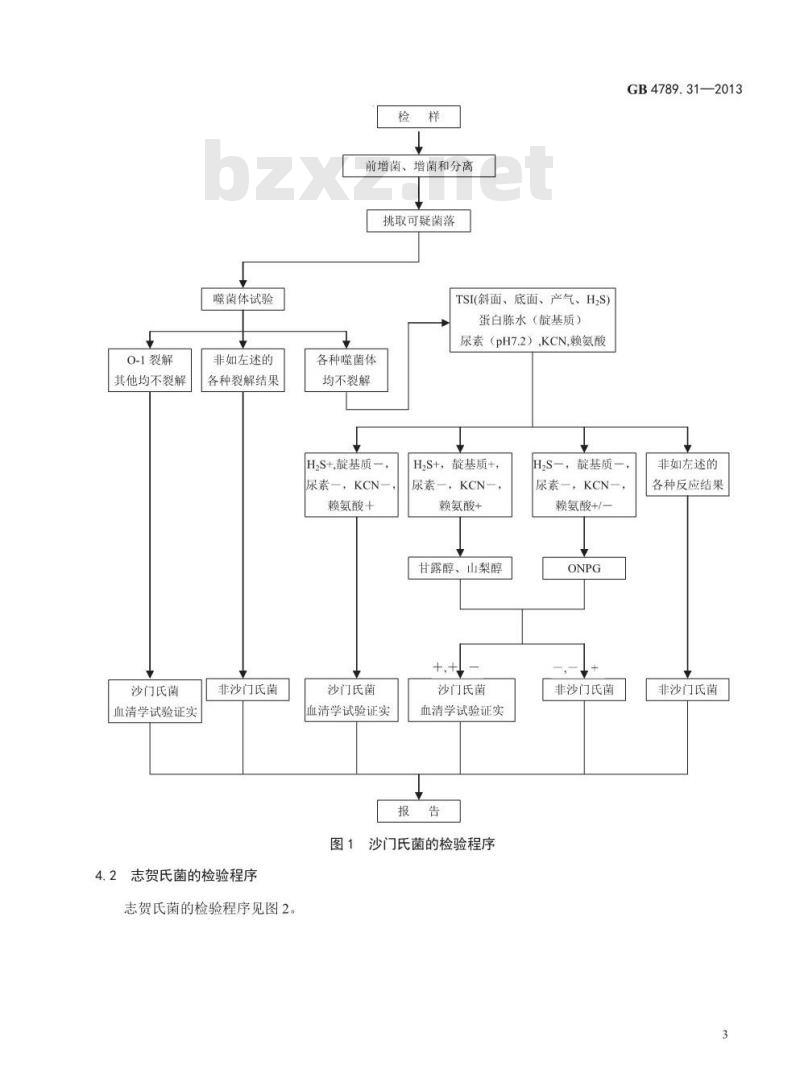
4.1沙门氏菌的检验程序
沙门氏菌的检验程序见图1。
0-1裂解
其他均不裂解
沙门氏菌
血清学试验证实
噬菌体试验
非如左述的
各种裂解结果
非沙门氏菌
4.2志贺氏菌的检验程序
志贺氏菌的检验程序见图2。
前增菌、增菌和分离
挑取可疑菌落
TSI(斜面、底面、产气、H,S)
蛋白陈水(靛基质)
尿素(pH7.2),KCN,赖氨酸
各种噬菌体
均不裂解
H,S+靛基质一,
尿素一,KCN-
赖氨酸+
沙门氏菌
血清学试验证实
H,S+,靛基质+,
尿素一,KCN-
赖氨酸+
甘露醇、山梨醇
沙门氏菌
血清学试验证实
图1沙门氏菌的检验程序
GB4789.31—2013
H,S一,靛基质一,
尿素一,KCN-,
赖氨酸+/-
非沙门氏菌
非如左述的
各种反应结果
非沙门氏菌
Sh裂解,并呈现
各种裂解模式
血清学试验与裂解模式相符
且被1RTD Sh裂解
生化分群试验
志贺氏菌属
分群及分型结果
TSI底层产酸,斜面产碱,H,S
不产气,无动力
噬菌体试验
血清学试验与裂模式不相符
或不被1RTDSh裂解
葡萄糖铵试验
必要时加做乙酸钠、克氏柠檬酸盐、黏液酸、七叶苷、水杨苷试验
葡萄糖铵+
或任何其他阳性结果
非志贺氏菌
图2志贺氏菌的检验程序
增菌和分离
挑取可疑菌落
TSI,葡萄糖半固体
Sh不裂解
非志贺氏菌
GB4789.31—2013
非如左述的各
种反应结果
非志贺氏菌
4.3致泻大肠埃希氏菌的检验程序致泻大肠埃希氏菌的检验程序见图3检样
增菌和分离
乳糖发酵或不发酵
的菌落3~5个
噬菌体试验
E和或Sh、E-4
噬菌体不裂解
其他噬菌体裂解
肠毒素+
非大肠
埃希氏菌
产肠毒素
大肠埃希氏菌
E和或Sh、E-4
噬菌体裂解
不同来源分离的菌株
其裂解模式具有同一性
GB4789.31—2013
各种噬菌体均不裂解
氧化酶一,G一杆菌
TSI,靛基质,
pH7.2尿素,KCN,
赖氨酸,动力
TSI底层+,H,S—
KCN—,尿素
血清学试验
STEC(O157)
stxl,stx2,hy+
产志贺毒素
大肠埃希氏菌
肠道致病性
大肠埃希氏菌
赖氨酸一,靛基质+,
动力—(O124动力+/—)
肠道侵袭性
大肠埃希氏菌
图3致泻大肠埃希氏菌的检验程序非如左述
非如左述
各种反应结果
各种反应结果
非致泻大
肠埃希氏菌
非大肠
埃希氏菌
5操作步骤
5.1前增菌、增菌和分离
GB4789.31—2013
5.1.1沙门氏菌的前增菌、增菌和分离按GB4789.4进行。沙门氏菌增菌液灵敏度的测定见附录B。在食品行业从业人员的肠道沙门氏菌带菌检验时,采集的标本应增菌,不应前增菌。食物中毒标本不应前增菌,所采集的标本同时做增菌和不增菌步骤,5.1.2志贺氏菌的增菌和分离按GB4789.5进行。没有厌氧培养条件的实验室可以采用附录A中的BCT增菌液。食物中毒患者的粪便标本同时做增菌和不增菌步骤。5.1.3致泻大肠埃希氏菌的增菌和分离按GB4789.6和GB4789.36进行。食物中毒标本同时做增菌和不增菌步骤。
5.2噬菌体试验
5.2.1培养基的准备
营养琼脂平板(含琼脂1%~1.5%,为防止变形杆菌的蔓延生长,可按0.02%量加入十二烷基硫酸钠)营养琼脂加热溶化后,加入每个9cm平血中约20mL~25mL,放在水平台面上待其凝固。翻转平板,在36℃±1℃培养箱内半开皿倒置约1h,或50℃±1℃培养箱内半开皿倒置约30min,以烘干培养基表面水分。
5.2.2试验菌液的准备
5.2.2.1自选择性琼脂平板上分别挑取2个以上典型或可疑菌落,检验沙门氏菌时,挑取乳糖阴性产H2S或不产H2S的菌落,和乳糖阳性产H2S的菌落。检验大肠埃希氏菌时挑取乳糖阳性或乳糖阴性的菌落。检验志贺氏菌时挑取典型或可疑菌落分别接种TSI、半固体和营养琼脂斜面各一管,置36℃±1℃培养20h~24h后选取三糖铁底层产酸、斜面产碱,不产H2S,不产气无动力的菌落。下述两种方法可供制备试验菌液时选用。
5.2.2.2方法一:将待检菌落接种于营养肉汤管内,于36℃1℃培养14h~24h。挑取此肉汤培养物1满环(约5μL),稀释于盛有1mL~2mL的营养肉汤管内,使成为1:200~1:400稀释菌液,含菌量约为1×10°CFU/mL。
5.2.2.3方法二:用接种针在鉴别平板上挑取可疑菌落,稀释于盛有1mL~2mL营养肉汤管内,含菌量约为1×10°CFU/mL。
5.2.3涂抹试验菌液
5.2.3.1斑点涂抹法:将营养琼脂表面自圆心起分为三等分或二等分,每等分可供涂抹1株细菌培养物。每挑取试验菌液1满环,涂抹直径约1cm的菌斑一个。每株培养物涂抹菌斑7个,外圈5个,内圈2个。
5.2.3.2棉签涂抹法:用无菌棉签蘸取试验菌液并略挤去过多液体,在如上琼脂平板表面三分之一的区域内涂抹。三个涂抹区之间保持适当距离,待菌液干燥。5.2.4滴加噬菌体
用定量为1mL的一次性注射器(针头无编号,1mL约有100~200滴,每滴相当于5μL~10μL),在每一个菌斑上滴加噬菌体。或用定量为10μL或5μL的微量移液器在每一个菌斑上滴加噬菌体一滴每滴加一种噬菌体应更换一副注射器或一个吸头,但是每副注射器或每一个吸头可以滴完各株细菌的同一种噬菌体。滴加的噬菌体依次为O-I、C、Sh、E、CE、E-4和Ent。滴加噬菌体时应将琼脂平板放在水平台面上,液滴应悬空滴下,不要污染针头或滴头。待7种噬菌体均滴加完毕后,略等数分钟待噬菌体液干燥。翻转平板,放在36℃培养5h~6h,和14h~24h各观察一次结果。GB4789.31—2013
如果仅有少数几株细菌作噬菌体试验,可用直径为3mm的接种环挑取噬菌体,每一满环相当于5μL,依次加在菌斑上,尽量减少在室温放置的时间。5.2.5
试验结果的判定
必要时(例如不能测定到完整的血清型),可吸取少许剩余的蛋白陈水培养物作靛基质试验,大肠埃希氏菌一般为靛基质阳性,沙门氏菌为靛基质阴性。噬菌体试验的结果见表1。表1
噬菌体试验结果
噬菌体裂解模式
判定结果
沙门氏菌属
沙门氏菌属(靛基质-),大肠埃希氏菌(靛基质+)弗劳地氏柠檬酸杆菌群“
志贺氏菌属大肠埃希氏菌
大肠埃希氏菌
大肠埃希氏菌
弗劳地氏柠檬酸杆菌群大肠埃希氏菌大肠埃希氏菌
阴沟肠杆菌
噬菌体不裂解培养物,用生化试验鉴定:(-)表示少量菌株裂解:√表示裂解或不裂解。注:CL表示融合性裂解;
一表示不裂解;
“含弗劳地氏柠檬酸杆菌、杨氏柠檬酸杆菌、布雷克氏柠檬酸杆菌、沃克曼氏柠檬酸杆菌和吉伦氏柠檬酸杆菌。b按表3检索并做血清学分型试验。5.2.6
供快速检验沙门氏菌的噬菌体简化诊断法采用如下3种噬菌体:沙门氏菌O-I噬菌体;E多价噬菌体,内含E和Sh:C多价噬菌体,内含C、CE和Ent。培养基和试验菌液的准备均同前法。涂抹试验菌液:斑点涂抹法将琼脂平板表面分为4等分或6等分,每等分可供涂抹一株细菌培养物每株培养物涂抹3个菌斑,外圈2个,内圈1个。棉签涂抹法可将试验菌液在琼脂平板上涂抹成带状,每个平板约可涂抹5条菌带,置数分钟,待菌斑于燥依次滴加上述3种噬菌体。斑点涂抹法,一般股可把O-1I噬菌体滴加在内圈的菌斑上。带状涂抹法可将0-I噬菌体滴加在菌带的左边。待噬菌体液滴于燥后,翻转平板,在36℃培养5h6h,和14h~24h各观察一次结果。按表2判定结果。噬菌体试验简化诊断法
E多价
注:CL表示融合性裂解:-表示不裂解;V表示裂解或不裂解。\除表1的注中所述外,并含阴沟肠杆菌和少数大肠埃希氏菌。c多价
判定结果
沙门氏菌属
大肠埃希氏菌
弗劳地氏柠檬酸杆菌群
噬菌体不裂解培养物
5.3噬菌体不裂解培养物的补充生化试验GB4789.31—2013
少数沙门氏菌培养物不被O-I噬菌体裂解,少数大肠埃希氏菌培养物不被相应噬菌体裂解,不被各种噬菌体裂解的培养物接种三糖铁琼脂,按GB4789.4做5项生化试验,血清学分型鉴定后判定结果5.4,血清学分型鉴定及其他补充试验5.4.1沙门氏菌分型鉴定
按GB4789.4进行。如果判定为沙门氏菌时,应得出完整的血清学分型鉴定的结果。5.4.2致泻大肠埃希氏菌鉴定
5.4.2.1按GB4789.6和GB4789.36进行。分离的菌株应该同时被同样的几个噬菌体裂解后,用大肠埃希氏菌分型噬菌体试验,这些菌株应该具有相同的裂解模式,同时测定1RTD噬菌体的裂解情况5.4.2.2产肠毒素大肠埃希氏菌,应有肠毒素试验的证实。5.4.2.3侵袭性大肠埃希氏菌,典型的生化特性为:赖氨酸脱羧酶试验阴性、无动力、产气或不产气(O124血清型亦可以为有动力、不产气),靛基质试验阳性。可进一步做豚鼠角膜试验,结果应该为阳性,质粒电泳应证明具有120~140Mdal大质粒,PCR试验证明具有ipaC或ipaH基因。5.4.2.4产志贺毒素大肠埃希氏菌O157:H7,典型的生化特性为:乳糖、蔗糖产酸,葡萄糖产酸并多数产气,硫化氢阴性,靛基质阳性,山梨醇缓发酵。PCR试验证明具有产志贺毒素基因stxl,stx2和溶血毒素基因hly。1RTD的E-2噬菌体裂解试验,能被1RTD的E-2噬菌体裂解(裂解程度包括从CL到少数几个噬斑)。对于产志贺毒素和溶血毒素其他血清型的大肠埃希氏菌,按照5.4.2.3的程序进行鉴定。
5.4.2.5肠道致病性大肠埃希氏菌具有大肠埃希氏菌的典型生化特性,eae基因(黏附屏蔽基因)的PCR试验为阳性。产志贺毒素大肠埃希氏菌eae试验也可为阳性。EAF(黏附因子质粒基因)或bfp(菌毛捆绑形成基因)的PCR试验可进一步证实。5.4.3志贺氏菌分型鉴定
5.4.3.1挑取三糖铁琼脂上的培养物,按噬菌体裂解模式,选用相应的志贺氏菌分型因子血清,做玻片凝集试验。血清学分型鉴定结果见表3。表3噬菌体试验的结果和志贺氏菌血清学分型鉴定的结果序
噬菌体裂解模式
注:CL表示融合性裂解;-表示不裂解“鲍民13型DNA同源性测定不符合志贺氏菌Ent
志贺氏菌血清学分型鉴定的结果福氏1-5(鲍氏11)
福氏1,4,痢疾2,鲍氏5,7,11,16,17(宋内氏宋内氏1,痢疾2,福氏4,鲍氏5.16宋内氏II.福氏3
福氏6,鲍氏1~4,偶数型6~18(除16外),痢疾3~12鲍氏9,15
痫疾 1,(宋内氏ⅡI)
鲍氏133
5.4.3.2如按噬菌体裂解模式结果为福氏志贺氏菌1~5型,先用福氏多价血清做凝集试验。如呈现凝集,再分别用各型和群因子血清检查,以确定所属血清型和亚型(见GB4789.5)5.4.3.3如按噬菌体裂解模式结果为福氏6型,鲍氏各型或痢疾3~12型,先用福氏6型血清做凝集试8
GB4789.31—2013
验。福氏6型血清不凝集者,用鲍氏多价血清或痢疾3~12型多价血清做凝集试验,如果呈现凝集,再分别用各型因子血清检查。
5.4.3.4如按噬菌体裂解模式结果为宋内氏II相菌而不被宋内氏血清凝集时,可直接按噬菌体裂解模式和粗糙型菌落特征判定之。
5.4.3.5按噬菌体裂解模式结果做血清学试验不凝集者,或虽发现其被某一个分型因子血清凝集而与噬菌体裂解模式不相符者,或虽与噬菌体裂解模式相符但不被1RTD的Sh噬菌体裂解者,均应做葡萄糖铵试验以与大肠埃希氏菌相鉴别。葡萄糖铵试验阳性者为大肠埃希氏菌。必要时可做如下生化试验:醋酸盐、克氏柠檬酸盐和粘液酸的利用试验,赖氨酸和鸟氨酸脱羧酶试验,七叶苷分解试验。除宋内氏菌鲍氏13型为鸟氨酸脱羧酶阳性,并有少数宋内氏菌菌株可利用黏液酸外,志贺氏菌属的培养物均为阴性结果。上述试验任何阳性结果均提示为大肠埃希氏菌(按GB4789.5)。5.4.3.6检出的志贺氏菌培养物应符合该群的生化特性。福氏志贺氏菌6型符合鲍氏志贺氏菌的特性。靛基质阳性的志贺氏菌血清型有痢疾2型、7型和8型,鲍氏5、7、9、11、13、15、16和17型。福氏志贺氏菌1~5型的靛基质反应较弱。靛基质阴性的志贺氏菌血清型为痢疾1型、3~6型、9~12型、福氏6型、鲍氏1~4、6、8、10、12、14和18型、宋内氏菌5.4.3.7鲍氏志贺氏菌13型是唯一可被沙门氏菌O-I裂解的菌株,该菌株只被高效价的Sh噬菌体裂解。5.5结果报告
5.5.1沙门氏菌检验的结果报告
5.5.1.1O-I噬菌体裂解,其他噬菌体均不裂解者,经沙门氏菌血清分型后报告。5.5.1.2各种噬菌体不裂解,生化试验结果为沙门氏菌,经沙门氏菌血清分型后报告,不可报告为未定型。
5.5.2志贺氏菌检验的结果报告
5.5.2.1Sh噬菌体裂解,呈现各种裂解模式,血清学试验与裂解模式相符者,可报告志贺氏菌血清型。罕见血清型要求被1RTDSh噬菌体裂解,并符合志贺氏菌生化分群结果。5.5.2.2非如5.5.2.1的试验结果均报告非志贺氏菌。5.5.3致泻大肠埃希氏菌检验的结果报告5.5.3.1E和或Sh、E-4噬菌体裂解,不同来源菌株的裂解模式具有同一性,或各种噬菌体均不裂解,经血清学分型确定者可分别报告为产肠毒素大肠埃希氏菌(肠毒素试验结果阳性),侵袭性大肠埃希氏菌(赖氨酸阴性、动力阴性,O124可为动力阳性),产志贺毒素大肠埃希氏菌(O157:H7和O157:NM,stxl,stx2,hly试验阳性)或肠道致病性大肠埃希氏菌(eae试验阳性)。5.5.3.2非如5.5.3.1的结果均报告为非大肠埃希氏菌或非致泻大肠埃希氏菌。9
亚硒酸盐胱氨酸(SC)增菌液
A.1.1成分
蛋白陈
亚硒酸氢钠
1%L-胱氨酸溶液
磷酸氢二钠(无水)
磷酸二氢钠(无水)
蒸馏水
A.1.2制法
附录A
培养基及试剂
加至1000.0mL
GB4789.31—2013
称取L-胱氨酸0.1g(或DL-胱氨酸0.2g),加入1mol/L氢氧化钠溶液1.5mL,使胱氨酸溶解,再
加入蒸馏水8.5mL,即为1%L-胱氨酸溶液将蛋白陈、乳糖、胱氨酸加入于蒸馏水800mL中,为基础液。将亚硒酸氢钠加入于100mL蒸馏水中,为A液。将磷酸氢二钠和磷酸二氢钠加入于100mL蒸馏水中,为B液。取基础液4.0mL,A液0.5mL,B液0.5mL混合,测定pH。校正pH至7.0~7.1,将此3份溶液分别包装,在121℃高压灭菌15min(从高压灭菌器开始加热到取出不超过1h),待其冷却至常温后放入5℃冰箱内保存。临用前将3份溶液按比例混合,分装试管。3份溶液混合后,其pH值小于7.0,则应调整磷酸氢二钠、磷酸二氢钠的用量和亚硒酸氢钠的用量。使用前应测定其增菌灵敏度,方法见附录B不同亚硒酸盐和磷酸盐的用量见表A.1。表A.1不同亚硒酸盐和磷酸盐的用量亚硒酸盐的种类和用量
主要种类
亚硒酸钠·H,O(100%)
亚硒酸钠·H,O(75%)
亚硒酸钠·H,0(50%)
亚硒酸氢钠(75%)
亚硒酸氢钠(100%)
亚硒酸氢钠(75%)
亚硒酸氢钠(50%)
亚硒酸(75%)
亚硒酸(100%)
注:表中所列均为在1000mL增菌液中的用量。磷酸盐的种类和用量
NaH,PO4(无水)
NazHPO(无水)
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
GB4789.31—2013
食品安全国家标准
食品微生物学检验
沙门氏菌、志贺氏菌和致泻大肠埃希氏菌的肠杆菌科噬菌体诊断检验
2013-11-29发布
中华人民共和国
国家卫生和计划生育委员会
2014-06-01实施
GB4789.31—2013
本标准代替GB/T4789.31-2003《食品卫生微生物学检验沙门氏菌、志贺氏菌和致泻大肠埃希氏菌的肠杆菌科噬菌体检验方法》。本标准与GB/T4789.31-2003相比,主要变化如下:修改了操作步骤;
—增加了附录B。
1范围
食品安全国家标准
食品微生物学检验
沙门氏菌、志贺氏菌和致泻大肠埃希氏菌的肠杆菌科噬菌体诊断检验
GB4789.312013
本标准规定了应用肠杆菌科噬菌体诊断方法检验食品中沙门氏菌、志贺氏菌和致泻大肠埃希氏菌。本标准适用于各类食品和食源性疾病事件样品中沙门氏菌、志贺氏菌和致泻大肠埃希氏菌的检验。本标准适用于食品行业从业人员肠道沙门氏菌和志贺氏菌带菌检验设备和材料
除微生物实验室常规灭菌、培养的设备外,其他设备和材料如下:恒温培养箱:36℃±1℃,42℃±1℃,50℃±1℃;a)
厌氧培养装置:41.5℃±0.5℃;显微镜:10倍~100倍;
水平仪:噬菌体试验的工作台面应调整至水平位置;已灭菌1mL一次性注射器(应为塑料材质),针头无编号,使用前测定每滴5μL~10μL(每mL有100~200滴)可用;此内容来自标准下载网
微量移液器及吸头(10μL和5μL);定量移液器及吸头(100μL和50μL);无菌吸管:10mL、5mL、1mL;
无菌毛细管:
无菌培养皿:90mm;
无菌棉签;
带盖的灭菌小试管:8mm×50mm;m)载物玻片。
培养基和试剂
亚硒酸盐胱氨酸(SC)增菌液:见附录A中的A.1。四硫磺酸钠煌绿(TTB)增菌液:见附录A中的A.2。3.3志贺氏菌(BCT)增菌液:见附录A中的A.3。3.4营养肉汤(NB):见附录A中的A.4。3.5营养琼脂(NA):见附录A中的A.5。3.6营养半固体琼脂(NSA):见附录A中的A.6。1
3.7三糖铁琼脂(TSI):见附录A中的A.7。3.8葡萄糖铵琼脂:见附录A中的A.8。GB4789.31—2013
3.9肠杆菌科诊断用噬菌体,7种和3种。必要时可再购置大肠埃希氏菌分型噬菌体(6种)一套。安部开启后用无菌毛细管吸出移入灭菌小试管内,如果每次使用量很少,可分装于2~3支试管内,保存于5℃冰箱备用。
3.10沙门氏菌因子血清,志贺氏菌分型因子血清,致泻大肠埃希氏菌分型因子血清。因子血清的种类视需要而定。
检验程序
4.1沙门氏菌的检验程序
沙门氏菌的检验程序见图1。
0-1裂解
其他均不裂解
沙门氏菌
血清学试验证实
噬菌体试验
非如左述的
各种裂解结果
非沙门氏菌
4.2志贺氏菌的检验程序
志贺氏菌的检验程序见图2。
前增菌、增菌和分离
挑取可疑菌落
TSI(斜面、底面、产气、H,S)
蛋白陈水(靛基质)
尿素(pH7.2),KCN,赖氨酸
各种噬菌体
均不裂解
H,S+靛基质一,
尿素一,KCN-
赖氨酸+
沙门氏菌
血清学试验证实
H,S+,靛基质+,
尿素一,KCN-
赖氨酸+
甘露醇、山梨醇
沙门氏菌
血清学试验证实
图1沙门氏菌的检验程序
GB4789.31—2013
H,S一,靛基质一,
尿素一,KCN-,
赖氨酸+/-
非沙门氏菌
非如左述的
各种反应结果
非沙门氏菌
Sh裂解,并呈现
各种裂解模式
血清学试验与裂解模式相符
且被1RTD Sh裂解
生化分群试验
志贺氏菌属
分群及分型结果
TSI底层产酸,斜面产碱,H,S
不产气,无动力
噬菌体试验
血清学试验与裂模式不相符
或不被1RTDSh裂解
葡萄糖铵试验
必要时加做乙酸钠、克氏柠檬酸盐、黏液酸、七叶苷、水杨苷试验
葡萄糖铵+
或任何其他阳性结果
非志贺氏菌
图2志贺氏菌的检验程序
增菌和分离
挑取可疑菌落
TSI,葡萄糖半固体
Sh不裂解
非志贺氏菌
GB4789.31—2013
非如左述的各
种反应结果
非志贺氏菌
4.3致泻大肠埃希氏菌的检验程序致泻大肠埃希氏菌的检验程序见图3检样
增菌和分离
乳糖发酵或不发酵
的菌落3~5个
噬菌体试验
E和或Sh、E-4
噬菌体不裂解
其他噬菌体裂解
肠毒素+
非大肠
埃希氏菌
产肠毒素
大肠埃希氏菌
E和或Sh、E-4
噬菌体裂解
不同来源分离的菌株
其裂解模式具有同一性
GB4789.31—2013
各种噬菌体均不裂解
氧化酶一,G一杆菌
TSI,靛基质,
pH7.2尿素,KCN,
赖氨酸,动力
TSI底层+,H,S—
KCN—,尿素
血清学试验
STEC(O157)
stxl,stx2,hy+
产志贺毒素
大肠埃希氏菌
肠道致病性
大肠埃希氏菌
赖氨酸一,靛基质+,
动力—(O124动力+/—)
肠道侵袭性
大肠埃希氏菌
图3致泻大肠埃希氏菌的检验程序非如左述
非如左述
各种反应结果
各种反应结果
非致泻大
肠埃希氏菌
非大肠
埃希氏菌
5操作步骤
5.1前增菌、增菌和分离
GB4789.31—2013
5.1.1沙门氏菌的前增菌、增菌和分离按GB4789.4进行。沙门氏菌增菌液灵敏度的测定见附录B。在食品行业从业人员的肠道沙门氏菌带菌检验时,采集的标本应增菌,不应前增菌。食物中毒标本不应前增菌,所采集的标本同时做增菌和不增菌步骤,5.1.2志贺氏菌的增菌和分离按GB4789.5进行。没有厌氧培养条件的实验室可以采用附录A中的BCT增菌液。食物中毒患者的粪便标本同时做增菌和不增菌步骤。5.1.3致泻大肠埃希氏菌的增菌和分离按GB4789.6和GB4789.36进行。食物中毒标本同时做增菌和不增菌步骤。
5.2噬菌体试验
5.2.1培养基的准备
营养琼脂平板(含琼脂1%~1.5%,为防止变形杆菌的蔓延生长,可按0.02%量加入十二烷基硫酸钠)营养琼脂加热溶化后,加入每个9cm平血中约20mL~25mL,放在水平台面上待其凝固。翻转平板,在36℃±1℃培养箱内半开皿倒置约1h,或50℃±1℃培养箱内半开皿倒置约30min,以烘干培养基表面水分。
5.2.2试验菌液的准备
5.2.2.1自选择性琼脂平板上分别挑取2个以上典型或可疑菌落,检验沙门氏菌时,挑取乳糖阴性产H2S或不产H2S的菌落,和乳糖阳性产H2S的菌落。检验大肠埃希氏菌时挑取乳糖阳性或乳糖阴性的菌落。检验志贺氏菌时挑取典型或可疑菌落分别接种TSI、半固体和营养琼脂斜面各一管,置36℃±1℃培养20h~24h后选取三糖铁底层产酸、斜面产碱,不产H2S,不产气无动力的菌落。下述两种方法可供制备试验菌液时选用。
5.2.2.2方法一:将待检菌落接种于营养肉汤管内,于36℃1℃培养14h~24h。挑取此肉汤培养物1满环(约5μL),稀释于盛有1mL~2mL的营养肉汤管内,使成为1:200~1:400稀释菌液,含菌量约为1×10°CFU/mL。
5.2.2.3方法二:用接种针在鉴别平板上挑取可疑菌落,稀释于盛有1mL~2mL营养肉汤管内,含菌量约为1×10°CFU/mL。
5.2.3涂抹试验菌液
5.2.3.1斑点涂抹法:将营养琼脂表面自圆心起分为三等分或二等分,每等分可供涂抹1株细菌培养物。每挑取试验菌液1满环,涂抹直径约1cm的菌斑一个。每株培养物涂抹菌斑7个,外圈5个,内圈2个。
5.2.3.2棉签涂抹法:用无菌棉签蘸取试验菌液并略挤去过多液体,在如上琼脂平板表面三分之一的区域内涂抹。三个涂抹区之间保持适当距离,待菌液干燥。5.2.4滴加噬菌体
用定量为1mL的一次性注射器(针头无编号,1mL约有100~200滴,每滴相当于5μL~10μL),在每一个菌斑上滴加噬菌体。或用定量为10μL或5μL的微量移液器在每一个菌斑上滴加噬菌体一滴每滴加一种噬菌体应更换一副注射器或一个吸头,但是每副注射器或每一个吸头可以滴完各株细菌的同一种噬菌体。滴加的噬菌体依次为O-I、C、Sh、E、CE、E-4和Ent。滴加噬菌体时应将琼脂平板放在水平台面上,液滴应悬空滴下,不要污染针头或滴头。待7种噬菌体均滴加完毕后,略等数分钟待噬菌体液干燥。翻转平板,放在36℃培养5h~6h,和14h~24h各观察一次结果。GB4789.31—2013
如果仅有少数几株细菌作噬菌体试验,可用直径为3mm的接种环挑取噬菌体,每一满环相当于5μL,依次加在菌斑上,尽量减少在室温放置的时间。5.2.5
试验结果的判定
必要时(例如不能测定到完整的血清型),可吸取少许剩余的蛋白陈水培养物作靛基质试验,大肠埃希氏菌一般为靛基质阳性,沙门氏菌为靛基质阴性。噬菌体试验的结果见表1。表1
噬菌体试验结果
噬菌体裂解模式
判定结果
沙门氏菌属
沙门氏菌属(靛基质-),大肠埃希氏菌(靛基质+)弗劳地氏柠檬酸杆菌群“
志贺氏菌属大肠埃希氏菌
大肠埃希氏菌
大肠埃希氏菌
弗劳地氏柠檬酸杆菌群大肠埃希氏菌大肠埃希氏菌
阴沟肠杆菌
噬菌体不裂解培养物,用生化试验鉴定:(-)表示少量菌株裂解:√表示裂解或不裂解。注:CL表示融合性裂解;
一表示不裂解;
“含弗劳地氏柠檬酸杆菌、杨氏柠檬酸杆菌、布雷克氏柠檬酸杆菌、沃克曼氏柠檬酸杆菌和吉伦氏柠檬酸杆菌。b按表3检索并做血清学分型试验。5.2.6
供快速检验沙门氏菌的噬菌体简化诊断法采用如下3种噬菌体:沙门氏菌O-I噬菌体;E多价噬菌体,内含E和Sh:C多价噬菌体,内含C、CE和Ent。培养基和试验菌液的准备均同前法。涂抹试验菌液:斑点涂抹法将琼脂平板表面分为4等分或6等分,每等分可供涂抹一株细菌培养物每株培养物涂抹3个菌斑,外圈2个,内圈1个。棉签涂抹法可将试验菌液在琼脂平板上涂抹成带状,每个平板约可涂抹5条菌带,置数分钟,待菌斑于燥依次滴加上述3种噬菌体。斑点涂抹法,一般股可把O-1I噬菌体滴加在内圈的菌斑上。带状涂抹法可将0-I噬菌体滴加在菌带的左边。待噬菌体液滴于燥后,翻转平板,在36℃培养5h6h,和14h~24h各观察一次结果。按表2判定结果。噬菌体试验简化诊断法
E多价
注:CL表示融合性裂解:-表示不裂解;V表示裂解或不裂解。\除表1的注中所述外,并含阴沟肠杆菌和少数大肠埃希氏菌。c多价
判定结果
沙门氏菌属
大肠埃希氏菌
弗劳地氏柠檬酸杆菌群
噬菌体不裂解培养物
5.3噬菌体不裂解培养物的补充生化试验GB4789.31—2013
少数沙门氏菌培养物不被O-I噬菌体裂解,少数大肠埃希氏菌培养物不被相应噬菌体裂解,不被各种噬菌体裂解的培养物接种三糖铁琼脂,按GB4789.4做5项生化试验,血清学分型鉴定后判定结果5.4,血清学分型鉴定及其他补充试验5.4.1沙门氏菌分型鉴定
按GB4789.4进行。如果判定为沙门氏菌时,应得出完整的血清学分型鉴定的结果。5.4.2致泻大肠埃希氏菌鉴定
5.4.2.1按GB4789.6和GB4789.36进行。分离的菌株应该同时被同样的几个噬菌体裂解后,用大肠埃希氏菌分型噬菌体试验,这些菌株应该具有相同的裂解模式,同时测定1RTD噬菌体的裂解情况5.4.2.2产肠毒素大肠埃希氏菌,应有肠毒素试验的证实。5.4.2.3侵袭性大肠埃希氏菌,典型的生化特性为:赖氨酸脱羧酶试验阴性、无动力、产气或不产气(O124血清型亦可以为有动力、不产气),靛基质试验阳性。可进一步做豚鼠角膜试验,结果应该为阳性,质粒电泳应证明具有120~140Mdal大质粒,PCR试验证明具有ipaC或ipaH基因。5.4.2.4产志贺毒素大肠埃希氏菌O157:H7,典型的生化特性为:乳糖、蔗糖产酸,葡萄糖产酸并多数产气,硫化氢阴性,靛基质阳性,山梨醇缓发酵。PCR试验证明具有产志贺毒素基因stxl,stx2和溶血毒素基因hly。1RTD的E-2噬菌体裂解试验,能被1RTD的E-2噬菌体裂解(裂解程度包括从CL到少数几个噬斑)。对于产志贺毒素和溶血毒素其他血清型的大肠埃希氏菌,按照5.4.2.3的程序进行鉴定。
5.4.2.5肠道致病性大肠埃希氏菌具有大肠埃希氏菌的典型生化特性,eae基因(黏附屏蔽基因)的PCR试验为阳性。产志贺毒素大肠埃希氏菌eae试验也可为阳性。EAF(黏附因子质粒基因)或bfp(菌毛捆绑形成基因)的PCR试验可进一步证实。5.4.3志贺氏菌分型鉴定
5.4.3.1挑取三糖铁琼脂上的培养物,按噬菌体裂解模式,选用相应的志贺氏菌分型因子血清,做玻片凝集试验。血清学分型鉴定结果见表3。表3噬菌体试验的结果和志贺氏菌血清学分型鉴定的结果序
噬菌体裂解模式
注:CL表示融合性裂解;-表示不裂解“鲍民13型DNA同源性测定不符合志贺氏菌Ent
志贺氏菌血清学分型鉴定的结果福氏1-5(鲍氏11)
福氏1,4,痢疾2,鲍氏5,7,11,16,17(宋内氏宋内氏1,痢疾2,福氏4,鲍氏5.16宋内氏II.福氏3
福氏6,鲍氏1~4,偶数型6~18(除16外),痢疾3~12鲍氏9,15
痫疾 1,(宋内氏ⅡI)
鲍氏133
5.4.3.2如按噬菌体裂解模式结果为福氏志贺氏菌1~5型,先用福氏多价血清做凝集试验。如呈现凝集,再分别用各型和群因子血清检查,以确定所属血清型和亚型(见GB4789.5)5.4.3.3如按噬菌体裂解模式结果为福氏6型,鲍氏各型或痢疾3~12型,先用福氏6型血清做凝集试8
GB4789.31—2013
验。福氏6型血清不凝集者,用鲍氏多价血清或痢疾3~12型多价血清做凝集试验,如果呈现凝集,再分别用各型因子血清检查。
5.4.3.4如按噬菌体裂解模式结果为宋内氏II相菌而不被宋内氏血清凝集时,可直接按噬菌体裂解模式和粗糙型菌落特征判定之。
5.4.3.5按噬菌体裂解模式结果做血清学试验不凝集者,或虽发现其被某一个分型因子血清凝集而与噬菌体裂解模式不相符者,或虽与噬菌体裂解模式相符但不被1RTD的Sh噬菌体裂解者,均应做葡萄糖铵试验以与大肠埃希氏菌相鉴别。葡萄糖铵试验阳性者为大肠埃希氏菌。必要时可做如下生化试验:醋酸盐、克氏柠檬酸盐和粘液酸的利用试验,赖氨酸和鸟氨酸脱羧酶试验,七叶苷分解试验。除宋内氏菌鲍氏13型为鸟氨酸脱羧酶阳性,并有少数宋内氏菌菌株可利用黏液酸外,志贺氏菌属的培养物均为阴性结果。上述试验任何阳性结果均提示为大肠埃希氏菌(按GB4789.5)。5.4.3.6检出的志贺氏菌培养物应符合该群的生化特性。福氏志贺氏菌6型符合鲍氏志贺氏菌的特性。靛基质阳性的志贺氏菌血清型有痢疾2型、7型和8型,鲍氏5、7、9、11、13、15、16和17型。福氏志贺氏菌1~5型的靛基质反应较弱。靛基质阴性的志贺氏菌血清型为痢疾1型、3~6型、9~12型、福氏6型、鲍氏1~4、6、8、10、12、14和18型、宋内氏菌5.4.3.7鲍氏志贺氏菌13型是唯一可被沙门氏菌O-I裂解的菌株,该菌株只被高效价的Sh噬菌体裂解。5.5结果报告
5.5.1沙门氏菌检验的结果报告
5.5.1.1O-I噬菌体裂解,其他噬菌体均不裂解者,经沙门氏菌血清分型后报告。5.5.1.2各种噬菌体不裂解,生化试验结果为沙门氏菌,经沙门氏菌血清分型后报告,不可报告为未定型。
5.5.2志贺氏菌检验的结果报告
5.5.2.1Sh噬菌体裂解,呈现各种裂解模式,血清学试验与裂解模式相符者,可报告志贺氏菌血清型。罕见血清型要求被1RTDSh噬菌体裂解,并符合志贺氏菌生化分群结果。5.5.2.2非如5.5.2.1的试验结果均报告非志贺氏菌。5.5.3致泻大肠埃希氏菌检验的结果报告5.5.3.1E和或Sh、E-4噬菌体裂解,不同来源菌株的裂解模式具有同一性,或各种噬菌体均不裂解,经血清学分型确定者可分别报告为产肠毒素大肠埃希氏菌(肠毒素试验结果阳性),侵袭性大肠埃希氏菌(赖氨酸阴性、动力阴性,O124可为动力阳性),产志贺毒素大肠埃希氏菌(O157:H7和O157:NM,stxl,stx2,hly试验阳性)或肠道致病性大肠埃希氏菌(eae试验阳性)。5.5.3.2非如5.5.3.1的结果均报告为非大肠埃希氏菌或非致泻大肠埃希氏菌。9
亚硒酸盐胱氨酸(SC)增菌液
A.1.1成分
蛋白陈
亚硒酸氢钠
1%L-胱氨酸溶液
磷酸氢二钠(无水)
磷酸二氢钠(无水)
蒸馏水
A.1.2制法
附录A
培养基及试剂
加至1000.0mL
GB4789.31—2013
称取L-胱氨酸0.1g(或DL-胱氨酸0.2g),加入1mol/L氢氧化钠溶液1.5mL,使胱氨酸溶解,再
加入蒸馏水8.5mL,即为1%L-胱氨酸溶液将蛋白陈、乳糖、胱氨酸加入于蒸馏水800mL中,为基础液。将亚硒酸氢钠加入于100mL蒸馏水中,为A液。将磷酸氢二钠和磷酸二氢钠加入于100mL蒸馏水中,为B液。取基础液4.0mL,A液0.5mL,B液0.5mL混合,测定pH。校正pH至7.0~7.1,将此3份溶液分别包装,在121℃高压灭菌15min(从高压灭菌器开始加热到取出不超过1h),待其冷却至常温后放入5℃冰箱内保存。临用前将3份溶液按比例混合,分装试管。3份溶液混合后,其pH值小于7.0,则应调整磷酸氢二钠、磷酸二氢钠的用量和亚硒酸氢钠的用量。使用前应测定其增菌灵敏度,方法见附录B不同亚硒酸盐和磷酸盐的用量见表A.1。表A.1不同亚硒酸盐和磷酸盐的用量亚硒酸盐的种类和用量
主要种类
亚硒酸钠·H,O(100%)
亚硒酸钠·H,O(75%)
亚硒酸钠·H,0(50%)
亚硒酸氢钠(75%)
亚硒酸氢钠(100%)
亚硒酸氢钠(75%)
亚硒酸氢钠(50%)
亚硒酸(75%)
亚硒酸(100%)
注:表中所列均为在1000mL增菌液中的用量。磷酸盐的种类和用量
NaH,PO4(无水)
NazHPO(无水)
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。