WS/T 404.7-2015
基本信息
标准号: WS/T 404.7-2015
中文名称:临床常用生化检验项目参考区间第7部分 血清乳酸脱氢酶、肌酸激酶
标准类别:卫生行业标准(WS)
标准状态:现行
出版语种:简体中文
下载格式:.rar .pdf
下载大小:335KB
相关标签: 临床 常用 生化 检验 项目 参考 区间 血清 乳酸 脱氢酶 肌酸激酶

标准分类号
关联标准
出版信息
相关单位信息
标准简介
WS/T 404.7-2015 临床常用生化检验项目参考区间第7部分 血清乳酸脱氢酶、肌酸激酶
WS/T404.7-2015
标准压缩包解压密码:www.bzxz.net
标准图片预览




标准内容
ICS11.100
中华人民共和国卫生行业标准
WS/T404.72015
临床常用生化检验项目参考区间第7部分:血清乳酸脱氢酶、肌酸激酶Reference intervals for common clinical biochemistry tests-Part 7.Serum lactate dehvdrogenase,creatine kinase2015-04-21发布
中华人民共和国
国家卫生和计划生育委员会
2015-10-01实施
WS/T404《临床常用生化检验项目参考区间》分为8个部分:WS/T404.7—2015
第1部分:血清丙氨酸氨基转移酶、天门冬氨酸氨基转移酶、碱性磷酸酶和-谷氨酰基转移酶;
第2部分:血清总蛋白、白蛋白;一第3部分:血清钾、钠、氯;
第4部分:血清总胆红素、直接胆红素;一第5部分:血清尿素、肌酐;
一第6部分:血清总钙、无机磷、镁、铁;一第7部分:血清乳酸脱氢酶、肌酸激酶;第8部分:血清淀粉酶。
本部分为WS/T404的第7部分。
本部分按照GB/T1.1一2009给出的规则起草。本部分主要起草单位:中国医科大学附属第一医院、广东省中医院、复旦大学附属中山医院、北京大学第三医院、四川大学华西医院、中国人民解放军第四军医大学附属第一医院、北京医院本部分起草人:尚红、黄宪章、潘柏申、张捷、王兰兰、郝晓柯、陈文祥、张传宝、申子瑜、穆润清、赵敏1范围
临床常用生化检验项目参考区间第7部分:血清乳酸脱氢酶、肌酸激酶WS/T404.7—2015
WS/T404的本部分规定了中国成年人群血清乳酸脱氢酶、肌酸激酶的参考区间及其应用、本部分适用于医疗卫生机构实验室血清乳酸脱氢酶、肌酸激酶检验结果的报告和解释,相关体外诊断产品生产厂商也可参照使用。规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。WS/T402临床实验室检验项目参考区间的制定3术语和定义
WS/T402界定的术语和定义适用于本文件。4参考区间建立
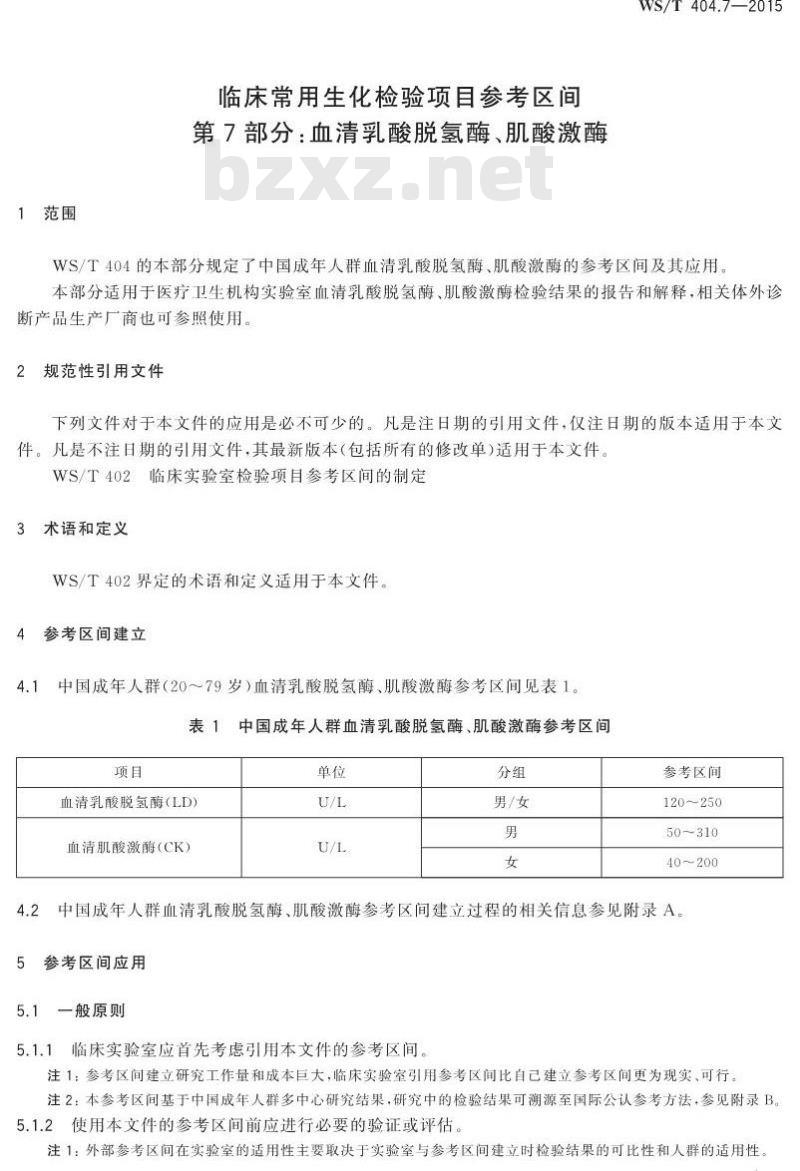
4.1中国成年人群(20~79岁)血清乳酸脱氢酶、肌酸激酶参考区间见表1。表1中国成年人群血清乳酸脱氢酶、肌酸激酶参考区间项目
血清乳酸脱氢酶(LD)
血清肌酸激酶(CK)
男/女
参考区间
120~250
50~310
40~200
4.2中国成年人群血清乳酸脱氢酶、肌酸激酶参考区间建立过程的相关信息参见附录A。参考区间应用
5.1一般原则
5.1.1临床实验室应首先考虑引用本文件的参考区间。注1:参考区间建立研究工作量和成本巨大,临床实验室引用参考区间比自已建立参考区间更为现实、可行注2:本参考区间基于中国成年人群多中心研究结果,研究中的检验结果可溯源至国际公认参考方法,参见附录B。5.1.2使用本文件的参考区间前应进行必要的验证或评估。注1:外部参考区间在实验室的适用性主要取决于实验室与参考区间建立时检验结果的可比性和人群的适用性。WS/T404.7—2015
注2:检验结果只有存在恒定的系统偏倚(检验结果正确度)才影响参考区间的适用性,过大的实验室内变异是实验室分析质量问题,不是参考区间适用性问题。注3:本文件的参考区间基于血清的检测结果建立,若临床实验室使用的标本类型为血浆,应进行适当的评估以决定是否采用本参考区间。
5.2参考区间评估、验证和使用
5.2.1按WS/T402的有关规定进行参考区间评估和验证。5.2.2如实验室确认与参考区间建立时的检验结果可比且人群适用,则可直接引用本文件的参考区间,若不确定或基于实验室管理体系的要求需对引用的参考区间进行验证,可按下列步骤进行:a)筛选合格参考个体不少于20名,筛选标准参见A.2.2;b)按本实验室操作程序采集、处理、分析样品;c)按适当方法检查并剔除离群值(若有,则另选参考个体补足);注:离群值检验采用Dixon方法:首先将检测结果按照大小排序并计算极差R,然后分别计算最大和最小值与其相邻数值之差D:若D/R≥1/3,则将最大值或最小值视为离群值予以剔除:将余下数据重复前述步骤进行离群值检验,直至剔除所有离群值。d)如选择20个合格的参考个体,将20个检验结果与参考区间比较,若超出参考区间的数据不超过2个,则通过验证;若超过2个,则另选20名合格参考个体重新按照上述判断标准进行验证。如参考个体多于20个,超出参考区间的数据不超过10%则通过验证;若超过10%的数据超出参考区间,则另选至少20名合格参考个体,重新按照上述判断标准进行验证。验证结果若符合要求,可直接使用参考区间,否则应查找原因。5.3参考区间未通过验证时的处理程序5.3.1对未通过验证的情况,应首先评价分析质量尤其是正确度,若证实是检测系统导致的分析质量问题,应改进或更换分析系统。分析质量评价可采用(但不限于)下列方式:a):分析可互通有证标准物质或其他适宜参考物质;b)参加适宜正确度验证计划或标准化计划;c)与性能可靠的其他系统或方法进行比较。5.3.2若证明是人群原因(如民族、高海拔地区、特殊生活习惯等因素)未通过验证,则应按WS/T402的要求建立或引用适宜参考区间。2
A1参考区间建立的步骤
附录A
(资料性附录)bzxZ.net
参考区间建立过程的相关信息
WS/T404.7—2015
本文件参考区间按WS/T402的要求采用多中心的研究方式建立,主要包括以下步骤:a)选择参考个体,组成参考样本组;b)采集处理血液样品,获得血清样品;c)检测血清样品,获得参考值;d)统计处理参考值,建立参考区间。A.2参考个体选择
A.2.1参考样本组的选择
设计总体参考人群为我国成年健康人群,参考样本组选自东北、华北、西北、华东、华南和西南6地区城乡居民,年龄范围为20~79岁,六地区最终人选的参考个体共计4397人,其中男性为1878人,女性为2519人。
A.2.2参考个体的选择
各中心分别在所在地区募集足够的可能参考个体,征得知情同意,进行参考个体的筛选,组成参考样本组。
通过问卷调查、体格检查、实验室检查筛选参考个体,满足以下要求:a)问卷调查、体格检查:
1)自觉健康;
2)无下列疾病:急慢性感染(急性上呼吸道感染、肺炎、肺结核等)、消化系统疾病(肝硬化、肝炎、脂肪性肝病、胆石病、胆囊炎、慢性腹泻、炎症性肠病等)、肾脏疾病(慢性肾脏病、急性肾损伤等)、代谢和营养疾病(糖尿病、代谢综合征、血脂异常和脂蛋白异常血症、高尿酸血症与痛风等)、风湿性疾病(类风湿性关节炎、系统性红斑狼疮等)、甲状腺疾病(甲状腺功能亢进症、甲状腺功能减退症等)、血液系统疾病(贫血、白血病等)、动脉粥样硬化和血管疾病、心脏病、肌病、恶性肿瘤、烧伤和肌肉损伤、肥胖或消瘦[BMI(体重指数)≥28kg/m或<18.5kg/m2]、高血压收缩压≥140mmHg和(或)舒张压≥90mmHg」:6个月内未进行手术,4个月内未献血、输血或大量失血,2周内未服用药物;3)
4)无营养不良、素食、酗酒(长期饮酒或2周内大量饮酒)、嗜烟(吸烟量>20支/d);5)
近期无剧烈运动或重体力劳动;6)女性未处于妊娠或哺乳期。
b)通过实验室检查排除:
丙氨酸氨基转移酶>80U/L;
甘油三酯≥2.26mmol/L;
总胆固醇≥6.22mmol/L;
WS/T404.7—2015
空腹血糖≥7.0mmol/L
5)血红蛋白:男性<120g/L;女性<110g/L;6)
HBsAg阳性、抗-HCV阳性、抗-HIV阳性。A.3血液样品采集与处理
血液样品采集与处理原则按WS/T225一2002有关要求进行,具体要求如下:a)参考个体准备:采血前3d保持正常生活习惯,不做剧烈运动和重体力劳动。采血前1d晚餐后至第二天上午采血前禁食,禁食时间8h~14h;b)采血:受检者取坐位,使用血清分离胶管,采用真空采血方式,自肘前静脉采血;c)血液样品处理:样品在采集后2h内及时分离血清,检查并剔除溶血、黄疽或乳廉样品,血清分离后2h内进行分析。
A.4血清样品分析
A.4.1分析系统:使用目前我国临床实验室常用的多种分析系统。注:本参考区间建立所使用的分析系统及其检测结果的计量学溯源参见附录B。各分析系统检测结果的正确度验证见A.4.2
A.4.2分析系统性能评估:分析系统应于参考个体血清样品分析前进行分析性能评估。按仪器和试剂说明书规定的操作程序运行分析系统。精密度评估:分析两个水平质控物,每日测定1批,重复测定4次,测定5d;正确度验证:分析中国国家标准物质GBW09177进行正确度验证。精密度和正确度满足WS/T403的有关要求
A.4.3血清样品分析及其质量控制:分析性能符合要求后进行血清样品分析,每份血清样品分析一次精密度控制采用两个水平质控物质,每独立分析批前后进行质控物质分析;每月分析中国国家标准物质GBW09177进行正确度控制。
A.5参考值处理与参考区间建立
A.5.1离群值检查:按照Stromme等的方法检查并剔除各组离群值。A.5.2分组判断:按照nestedANOVA方法对性别、年龄、地区各组参考值进行组-组检验,判断需否分组,将不需分组的参考值合并,确定实际参考样本组。A.5.3参考限和参考区间建立:采用中间95%区间做参考区间。用非参数方法分别计算各实际参考样本组参考值的2.5百分位数和97.5百分位数作为参考下限和参考上限。根据临床意见对参考限进行适当取整形成参考区间。
附录B
(资料性附录)
血清乳酸脱氢酶、肌酸激酶检测方法和检测结果的计量学溯源血清乳酸脱氢酶、肌酸激酶检测方法和检测结果的计量学溯源见表B.1。表B.1
WS/T404.7—2015
血清乳酸脱氢酶、肌酸激酶检测方法和检测结果的计量学溯源测定方法
血清乳酸脱氢酶(LD)
血清肌酸激酶(CK)
速率法(L→P法)
速率法
计量学潮源
IFCC参考测量程序(2002)
IFCC参考测量程序(2002)
WS/T404.7—2015
参考文献
WS/T225一2002临床化学检验血液标本的收集与处理WS/T403一2012临床生物化学检验常规项目分析质量指标[3]
王吉耀.内科学.2版.北京:人民卫生出版社,2010[4]
Donald S.Young.分析前因素对临床检验结果影响.3版.李艳,等,译.北京:人民军医出版社,2009
[5] Clinical and Laboratory Standards Institute (CLSI).Defining,establishing,and verifying ref-erence intervals in the clinical laboratory:Approved Guideline-Third Edition.CLSI document C28-A3c.CLSI.Wayne.PA.USA,2010
[6]Stromme JH,Rustad P,Steensland H.et al.Reference intervals for eight enzymes in bloodof adult females and males measured in accordance with the International Federation of Clinical Chemistry reference system at 37 degrees C:part of the Nordic Reference Interval Project.Scand J Clin LabInvest.2004.64(4):371-384
[7]Ichihara.An appraisal of statistical procedures used in derivation of reference intervals.ClinChemLabMed,2010.48:1537-1551[8]Schumann G,Bonora R, Ceriotti F,Clerc-Renaud P,Ferrero CA,et al. IFCC primaryreference procedures for the measurement of catalytic activity concentrations of enzymes at 37 degreesC.Part 2.Reference procedure for the measurement of catalytic concentration of creatine kinase.ClinChemLabMed.2002,40:635-642
gSchumann GBonora R,CeriottiF,Clerc-RenaudP,FerreroCA,et al.IFCCprimaryreference procedures for the measurement of catalytic activity concentrations of enzymes at 37 degreesC.Part 3.Referenceprocedurefor themeasurement of catalytic concentration of lactatedehydrogenase.ClinChemLabMed.2002.40:643-6486
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
中华人民共和国卫生行业标准
WS/T404.72015
临床常用生化检验项目参考区间第7部分:血清乳酸脱氢酶、肌酸激酶Reference intervals for common clinical biochemistry tests-Part 7.Serum lactate dehvdrogenase,creatine kinase2015-04-21发布
中华人民共和国
国家卫生和计划生育委员会
2015-10-01实施
WS/T404《临床常用生化检验项目参考区间》分为8个部分:WS/T404.7—2015
第1部分:血清丙氨酸氨基转移酶、天门冬氨酸氨基转移酶、碱性磷酸酶和-谷氨酰基转移酶;
第2部分:血清总蛋白、白蛋白;一第3部分:血清钾、钠、氯;
第4部分:血清总胆红素、直接胆红素;一第5部分:血清尿素、肌酐;
一第6部分:血清总钙、无机磷、镁、铁;一第7部分:血清乳酸脱氢酶、肌酸激酶;第8部分:血清淀粉酶。
本部分为WS/T404的第7部分。
本部分按照GB/T1.1一2009给出的规则起草。本部分主要起草单位:中国医科大学附属第一医院、广东省中医院、复旦大学附属中山医院、北京大学第三医院、四川大学华西医院、中国人民解放军第四军医大学附属第一医院、北京医院本部分起草人:尚红、黄宪章、潘柏申、张捷、王兰兰、郝晓柯、陈文祥、张传宝、申子瑜、穆润清、赵敏1范围
临床常用生化检验项目参考区间第7部分:血清乳酸脱氢酶、肌酸激酶WS/T404.7—2015
WS/T404的本部分规定了中国成年人群血清乳酸脱氢酶、肌酸激酶的参考区间及其应用、本部分适用于医疗卫生机构实验室血清乳酸脱氢酶、肌酸激酶检验结果的报告和解释,相关体外诊断产品生产厂商也可参照使用。规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。WS/T402临床实验室检验项目参考区间的制定3术语和定义
WS/T402界定的术语和定义适用于本文件。4参考区间建立
4.1中国成年人群(20~79岁)血清乳酸脱氢酶、肌酸激酶参考区间见表1。表1中国成年人群血清乳酸脱氢酶、肌酸激酶参考区间项目
血清乳酸脱氢酶(LD)
血清肌酸激酶(CK)
男/女
参考区间
120~250
50~310
40~200
4.2中国成年人群血清乳酸脱氢酶、肌酸激酶参考区间建立过程的相关信息参见附录A。参考区间应用
5.1一般原则
5.1.1临床实验室应首先考虑引用本文件的参考区间。注1:参考区间建立研究工作量和成本巨大,临床实验室引用参考区间比自已建立参考区间更为现实、可行注2:本参考区间基于中国成年人群多中心研究结果,研究中的检验结果可溯源至国际公认参考方法,参见附录B。5.1.2使用本文件的参考区间前应进行必要的验证或评估。注1:外部参考区间在实验室的适用性主要取决于实验室与参考区间建立时检验结果的可比性和人群的适用性。WS/T404.7—2015
注2:检验结果只有存在恒定的系统偏倚(检验结果正确度)才影响参考区间的适用性,过大的实验室内变异是实验室分析质量问题,不是参考区间适用性问题。注3:本文件的参考区间基于血清的检测结果建立,若临床实验室使用的标本类型为血浆,应进行适当的评估以决定是否采用本参考区间。
5.2参考区间评估、验证和使用
5.2.1按WS/T402的有关规定进行参考区间评估和验证。5.2.2如实验室确认与参考区间建立时的检验结果可比且人群适用,则可直接引用本文件的参考区间,若不确定或基于实验室管理体系的要求需对引用的参考区间进行验证,可按下列步骤进行:a)筛选合格参考个体不少于20名,筛选标准参见A.2.2;b)按本实验室操作程序采集、处理、分析样品;c)按适当方法检查并剔除离群值(若有,则另选参考个体补足);注:离群值检验采用Dixon方法:首先将检测结果按照大小排序并计算极差R,然后分别计算最大和最小值与其相邻数值之差D:若D/R≥1/3,则将最大值或最小值视为离群值予以剔除:将余下数据重复前述步骤进行离群值检验,直至剔除所有离群值。d)如选择20个合格的参考个体,将20个检验结果与参考区间比较,若超出参考区间的数据不超过2个,则通过验证;若超过2个,则另选20名合格参考个体重新按照上述判断标准进行验证。如参考个体多于20个,超出参考区间的数据不超过10%则通过验证;若超过10%的数据超出参考区间,则另选至少20名合格参考个体,重新按照上述判断标准进行验证。验证结果若符合要求,可直接使用参考区间,否则应查找原因。5.3参考区间未通过验证时的处理程序5.3.1对未通过验证的情况,应首先评价分析质量尤其是正确度,若证实是检测系统导致的分析质量问题,应改进或更换分析系统。分析质量评价可采用(但不限于)下列方式:a):分析可互通有证标准物质或其他适宜参考物质;b)参加适宜正确度验证计划或标准化计划;c)与性能可靠的其他系统或方法进行比较。5.3.2若证明是人群原因(如民族、高海拔地区、特殊生活习惯等因素)未通过验证,则应按WS/T402的要求建立或引用适宜参考区间。2
A1参考区间建立的步骤
附录A
(资料性附录)bzxZ.net
参考区间建立过程的相关信息
WS/T404.7—2015
本文件参考区间按WS/T402的要求采用多中心的研究方式建立,主要包括以下步骤:a)选择参考个体,组成参考样本组;b)采集处理血液样品,获得血清样品;c)检测血清样品,获得参考值;d)统计处理参考值,建立参考区间。A.2参考个体选择
A.2.1参考样本组的选择
设计总体参考人群为我国成年健康人群,参考样本组选自东北、华北、西北、华东、华南和西南6地区城乡居民,年龄范围为20~79岁,六地区最终人选的参考个体共计4397人,其中男性为1878人,女性为2519人。
A.2.2参考个体的选择
各中心分别在所在地区募集足够的可能参考个体,征得知情同意,进行参考个体的筛选,组成参考样本组。
通过问卷调查、体格检查、实验室检查筛选参考个体,满足以下要求:a)问卷调查、体格检查:
1)自觉健康;
2)无下列疾病:急慢性感染(急性上呼吸道感染、肺炎、肺结核等)、消化系统疾病(肝硬化、肝炎、脂肪性肝病、胆石病、胆囊炎、慢性腹泻、炎症性肠病等)、肾脏疾病(慢性肾脏病、急性肾损伤等)、代谢和营养疾病(糖尿病、代谢综合征、血脂异常和脂蛋白异常血症、高尿酸血症与痛风等)、风湿性疾病(类风湿性关节炎、系统性红斑狼疮等)、甲状腺疾病(甲状腺功能亢进症、甲状腺功能减退症等)、血液系统疾病(贫血、白血病等)、动脉粥样硬化和血管疾病、心脏病、肌病、恶性肿瘤、烧伤和肌肉损伤、肥胖或消瘦[BMI(体重指数)≥28kg/m或<18.5kg/m2]、高血压收缩压≥140mmHg和(或)舒张压≥90mmHg」:6个月内未进行手术,4个月内未献血、输血或大量失血,2周内未服用药物;3)
4)无营养不良、素食、酗酒(长期饮酒或2周内大量饮酒)、嗜烟(吸烟量>20支/d);5)
近期无剧烈运动或重体力劳动;6)女性未处于妊娠或哺乳期。
b)通过实验室检查排除:
丙氨酸氨基转移酶>80U/L;
甘油三酯≥2.26mmol/L;
总胆固醇≥6.22mmol/L;
WS/T404.7—2015
空腹血糖≥7.0mmol/L
5)血红蛋白:男性<120g/L;女性<110g/L;6)
HBsAg阳性、抗-HCV阳性、抗-HIV阳性。A.3血液样品采集与处理
血液样品采集与处理原则按WS/T225一2002有关要求进行,具体要求如下:a)参考个体准备:采血前3d保持正常生活习惯,不做剧烈运动和重体力劳动。采血前1d晚餐后至第二天上午采血前禁食,禁食时间8h~14h;b)采血:受检者取坐位,使用血清分离胶管,采用真空采血方式,自肘前静脉采血;c)血液样品处理:样品在采集后2h内及时分离血清,检查并剔除溶血、黄疽或乳廉样品,血清分离后2h内进行分析。
A.4血清样品分析
A.4.1分析系统:使用目前我国临床实验室常用的多种分析系统。注:本参考区间建立所使用的分析系统及其检测结果的计量学溯源参见附录B。各分析系统检测结果的正确度验证见A.4.2
A.4.2分析系统性能评估:分析系统应于参考个体血清样品分析前进行分析性能评估。按仪器和试剂说明书规定的操作程序运行分析系统。精密度评估:分析两个水平质控物,每日测定1批,重复测定4次,测定5d;正确度验证:分析中国国家标准物质GBW09177进行正确度验证。精密度和正确度满足WS/T403的有关要求
A.4.3血清样品分析及其质量控制:分析性能符合要求后进行血清样品分析,每份血清样品分析一次精密度控制采用两个水平质控物质,每独立分析批前后进行质控物质分析;每月分析中国国家标准物质GBW09177进行正确度控制。
A.5参考值处理与参考区间建立
A.5.1离群值检查:按照Stromme等的方法检查并剔除各组离群值。A.5.2分组判断:按照nestedANOVA方法对性别、年龄、地区各组参考值进行组-组检验,判断需否分组,将不需分组的参考值合并,确定实际参考样本组。A.5.3参考限和参考区间建立:采用中间95%区间做参考区间。用非参数方法分别计算各实际参考样本组参考值的2.5百分位数和97.5百分位数作为参考下限和参考上限。根据临床意见对参考限进行适当取整形成参考区间。
附录B
(资料性附录)
血清乳酸脱氢酶、肌酸激酶检测方法和检测结果的计量学溯源血清乳酸脱氢酶、肌酸激酶检测方法和检测结果的计量学溯源见表B.1。表B.1
WS/T404.7—2015
血清乳酸脱氢酶、肌酸激酶检测方法和检测结果的计量学溯源测定方法
血清乳酸脱氢酶(LD)
血清肌酸激酶(CK)
速率法(L→P法)
速率法
计量学潮源
IFCC参考测量程序(2002)
IFCC参考测量程序(2002)
WS/T404.7—2015
参考文献
WS/T225一2002临床化学检验血液标本的收集与处理WS/T403一2012临床生物化学检验常规项目分析质量指标[3]
王吉耀.内科学.2版.北京:人民卫生出版社,2010[4]
Donald S.Young.分析前因素对临床检验结果影响.3版.李艳,等,译.北京:人民军医出版社,2009
[5] Clinical and Laboratory Standards Institute (CLSI).Defining,establishing,and verifying ref-erence intervals in the clinical laboratory:Approved Guideline-Third Edition.CLSI document C28-A3c.CLSI.Wayne.PA.USA,2010
[6]Stromme JH,Rustad P,Steensland H.et al.Reference intervals for eight enzymes in bloodof adult females and males measured in accordance with the International Federation of Clinical Chemistry reference system at 37 degrees C:part of the Nordic Reference Interval Project.Scand J Clin LabInvest.2004.64(4):371-384
[7]Ichihara.An appraisal of statistical procedures used in derivation of reference intervals.ClinChemLabMed,2010.48:1537-1551[8]Schumann G,Bonora R, Ceriotti F,Clerc-Renaud P,Ferrero CA,et al. IFCC primaryreference procedures for the measurement of catalytic activity concentrations of enzymes at 37 degreesC.Part 2.Reference procedure for the measurement of catalytic concentration of creatine kinase.ClinChemLabMed.2002,40:635-642
gSchumann GBonora R,CeriottiF,Clerc-RenaudP,FerreroCA,et al.IFCCprimaryreference procedures for the measurement of catalytic activity concentrations of enzymes at 37 degreesC.Part 3.Referenceprocedurefor themeasurement of catalytic concentration of lactatedehydrogenase.ClinChemLabMed.2002.40:643-6486
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。