GB 4789.12-2016
基本信息
标准号: GB 4789.12-2016
中文名称:食品安全国家标准 食品微生物学检验 肉毒梭菌及肉毒毒素检验
标准类别:国家标准(GB)
标准状态:现行
出版语种:简体中文
下载格式:.rar .pdf
下载大小:398KB
相关标签: 食品安全 国家标准 食品 微生物学 检验 梭菌 毒素

标准分类号
关联标准
出版信息
相关单位信息
标准简介
GB 4789.12-2016 食品安全国家标准 食品微生物学检验 肉毒梭菌及肉毒毒素检验
GB4789.12-2016
标准压缩包解压密码:www.bzxz.net
标准图片预览




标准内容
中华人民共和国国家标准
GB4789.12—2016
食品安全国家标准
食品微生物学检验
肉毒梭菌及肉毒毒素检验
2016-12-23发布
2017-06-23实施
中华人民共和国国家卫生和计划生育委员会国家食品药品监督管理总局
本标准代替GB/T4789.12—2003《食品卫生微生物学检验本标准与GB/T4789.12—2003相比,主要变化如下:GB4789.12—2016
肉毒梭菌及肉毒毒素检验》。
标准名称修改为“食品安全国家标准食品微生物学检验增加了PCR鉴定方法;
—增加了结果与报告;
—增加了附录A;
修改了设备和材料;
修改了培养基和试剂;
修改了检验程序;
规范了样品制备过程;
一修改了操作步骤中增菌和分离培养部分试验方法,肉毒梭菌及肉毒毒素检验”;
1范围
食品安全国家标准
食品微生物学检验
肉毒梭菌及肉毒毒素检验
GB 4789.12—2016
本标准规定了食品中肉毒梭菌(Clostridiumbotulinum)及肉毒毒素(botulinumtoxin)的检验方法。
本标准适用于食品中肉毒梭菌及肉毒毒素的检验设备和材料
除微生物实验室常规灭菌及培养设备外,其他设备和材料如下:冰箱:2℃~5℃、20℃。
天平:感量0.1g。
无菌手术剪、镊子、试剂勺。
均质器或无菌乳钵。
离心机:3000r/min、14.000r/min。庆氧培养装置。
恒温培养箱:35℃1℃、28℃±1℃。恒温水浴箱:37℃±1℃、60℃±1℃、80℃±1℃。显微镜:10倍100倍。
PCR仪。
电泳仪或毛细管电泳仪,
凝胶成像系统或紫外检测仪
核酸蛋白分析仪或紫外分光光度计。可调微量移液器:0.2μ~2μ、2μ20μ、20μ200μ、100μ~1000μ。无菌吸管:1.0mL、10.0mL、25.0mL无菌锥形瓶:100mL。
培养Ⅲl:直径90mm。
离心管:50mL、1.5mL。
PCR反应管。
无菌注射器:1.0mL。
小鼠:15g~20g,每一批次试验应使用同一品系的KM或ICR小鼠。3培养基和试剂
除另有规定外,PCR试验所用试剂为分析纯或符合生化试剂标准:水应符合GB/T6682中一级水的要求。
疱肉培养基:见A.1。
胰蛋白酶胰蛋白陈葡萄糖酵母膏肉汤(TPGYT):见A.2。卵黄琼脂培养基:见A.3。
明胶磷酸盐缓冲液:见A.4。
革兰氏染色液:见A.5。
10%胰蛋白酶溶液:见A.6。
磷酸盐缓冲液(PBS)):见A.7。1mol/L氢氧化钠溶液。
1mol/L盐酸溶液
肉毒毒素诊断血清。
无水乙醇和95%乙醇。
10mg/mL溶菌酶溶液。
10mg/mL蛋白酶K溶液。免费标准bzxz.net
3mol/L乙酸钠溶液(pH5.2)。
TE缓冲液。
引物:根据表1中序列合成,临用时用超纯水配制引物浓度为10umol/L。10XPCR缓冲液。
25mmol/LMgCl2。
dNTPs:dATP、dTTP、dCTP、dGTPTaq酶。
琼脂糖:电泳级。
溴化乙锭或Goldview。
5×TBE缓冲液。
6×加样缓冲液。
DNA分子量标准。
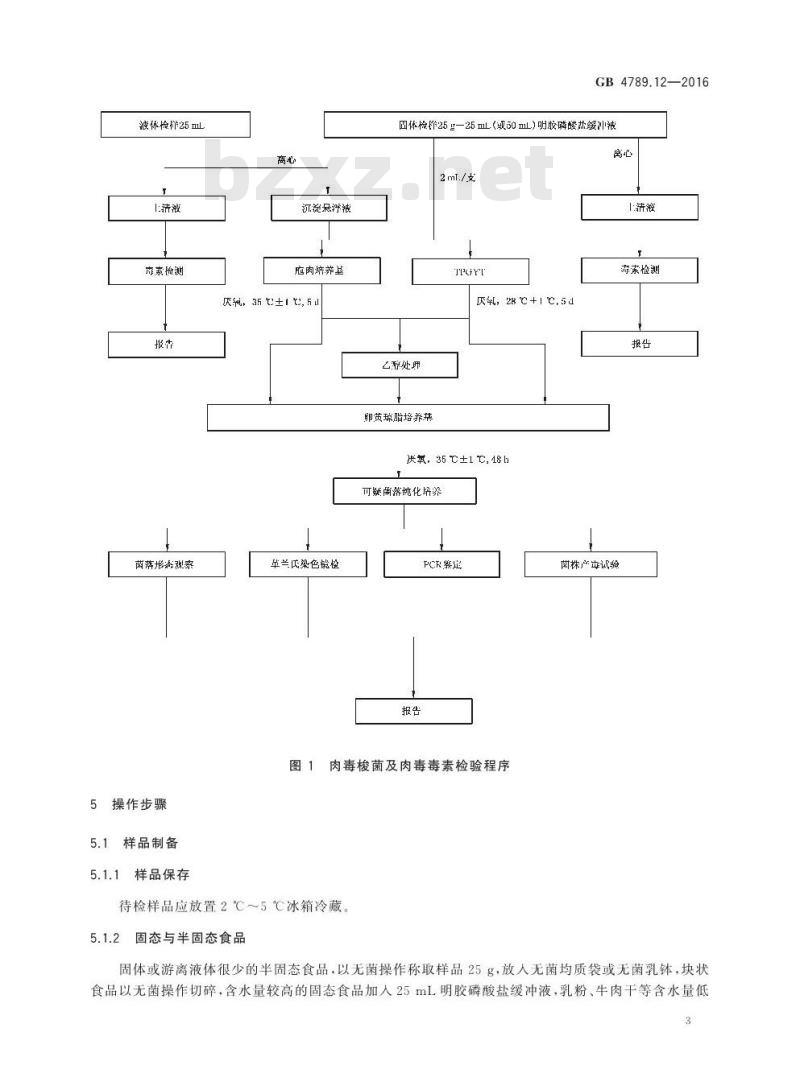
4检验程序
肉毒梭菌及肉毒毒素检验程序见图1。GB4789.12—2016
液休检群25mL
1:清液
声素检测
菌落形源弧索
5操作步骤
5.1样品制备
5.1.1样品保存
沉淀品浮被
庇肉养基
厌然,35 ±1 , 5 d
草兰氏染色镜检
GB4789.122016
固体检25g—25 mL(或50 mL)明胶磷酸热缓冲被离心
1蒲莊
厌,28+1它,
乙醇处师
即黄琼脂培养英
炭氧, 35 ℃±1 ℃, 48 b
可疑菌游纯化培荠
PCR婴足
图1肉毒梭菌及肉毒毒素检验程序待检样品应放置2℃5℃冰箱冷藏。5.1.2固态与半固态食品
森索检测
荫株产年试验
固体或游离液体很少的半固态食品,以无菌操作称取样品25g,放人无菌均质袋或无菌乳钵,块状食品以无菌操作切碎,含水量较高的固态食品加人25mL明胶磷酸盐缓冲液,乳粉、牛肉干等含水量低3
GB4789.12—2016
的食品加入50mL明胶磷酸盐缓冲液,浸泡30min,用拍击式均质器拍打2min或用无菌研杆研磨制备样品匀液,收集备用。
5.1.3液态食品
液态食品摇匀,以无菌操作量取25mL检验。5.1.4剩余样品处理
取样后的剩余样品放2℃~5℃冰箱冷藏,直至检验结果报告发出后,按感染性废弃物要求进行无害化处理,检出阳性的样品应采用压力蒸汽灭菌方式进行无害化处理。5.2肉毒毒素检测
5.2.1毒素液制备
取样品匀液约40mL或均匀液体样品25mL放入离心管,3000r/min离心10min~20min,收集上清液分为两份放入无菌试管中,一份直接用于毒素检测,一份用于胰酶处理后进行毒素检测。液体样品保留底部沉淀及液体约12mL,重悬,制备沉淀浮液备用胰酶处理:用1mol/L氢氧化钠或1mol/L盐酸调节上清液pH至6.2.按9份上清液加1份10%胰酶(活力1:250)水溶液,混匀,37℃孵育60min,期间间或轻轻摇动反应液。5.2.2检出试验
用5号针头注射器分别取离心上清液和胰酶处理上清液腹腔注射小鼠3只,每只0.5mL,观察和记录小鼠48h内的中毒表现。典型肉毒毒素中毒症状多在24h内出现,通常在6h内发病和死亡,其主要表现为竖毛、四肢瘫软,呼吸困难,呈现风箱式呼吸、腰腹部凹陷、宛如峰腰,多因呼吸衰竭而死亡,可初步判定为肉毒毒素所致。若小鼠在24h后发病或死亡,应仔细观察小鼠症状,必要时浓缩上清液重复试验,以排除肉毒毒素中毒。若小鼠出现释死(30min内)导致症状不明显时,应将毒素上清液进行适当稀释,重复试验。
注:毒素检测动物试验应遵循GB15193.2《食品安全国家标准食品毒理学实验室操作规范》的规定。5.2.3确证试验
上清液或(和)胰酶处理上清液的毒素试验阳性者,取相应试验液3份,每份0.5mL,其中第一份加等量多型混合肉毒毒素诊断血清,混匀,37℃孵育30min:第三份加等量明胶磷酸盐缓冲液,混匀后煮沸10min;第三份加等量明胶磷酸盐缓冲液,混匀。将三份混合液分别腹腔注射小鼠各两只,每只0.5mL.观察96h内小鼠的中毒和死亡情况结果判定:若注射第一份和第二份混合液的小鼠未死亡,而第三份混合液小鼠发病死亡,并出现肉毒毒素中毒的特有症状,则判定检测样品中检出肉毒毒素。5.2.4毒力测定(选做项目)
取确证试验阳性的试验液,用明胶磷酸盐缓冲液稀释制备一定倍数稀释液,如10倍、50倍、100倍、500倍等分别腹腔注射小鼠各两只,每只0.5mL,观察和记录小鼠发病与死亡情况至96h,计算最低致死剂量(MLD/mL或MLD/g),评估样品中肉毒毒素毒力,MLD等于小鼠全部死亡的最高稀释倍数乘以样品试验液稀释倍数。例如,样品稀释两倍制备的上清液,再稀释100倍试验液使小鼠全部死亡而500倍稀释液组存活,则该样品毒力为200MLD/g。4
5.2.5定型试验(选做项目)
GB4789.12—2016
根据毒力测定结果,用明胶磷酸盐缓冲液将上清液稀释至10MLD/mL~1000MLD/mL作为定型试验液.分别与各单型肉毒毒素诊断血清等量混合(国产诊断血清一般为冻干血清,用1mL生理盐水溶解),37℃孵育30min,分别腹腔注射小鼠两只,每只0.5mL,观察和记录小鼠发病与死亡情况至96h。同时,用明胶磷酸盐缓冲液代替诊断血清,与试验液等量混合作为小鼠试验对照。结果判定:某一单型诊断血清组动物未发病且正常存活,而对照组和其他单型诊断血清组动物发病死亡,则判定样品中所含肉毒毒素为该型肉毒毒素注:未经胰酶激活处理的样品上清液的毒素检出试验或确证试验为阳性者,则毒力测定和定型试验可省略胰酶激活处理试验。
5.3肉毒梭菌检验
5.3.1增菌培养与检出试验
5.3.1.1取出厄肉培养基4支和TPGY肉汤管2支,隔水煮沸10min~15min,排除溶解氧,迅速冷却,切勿摇动,在TPGY肉汤管中缓慢加人胰酶液至液体石蜡液面下肉汤中,每支1mL,制备成TPGYT。
5.3.1.2吸取样品匀液或毒素制备过程中的离心沉淀悬浮液2mL接种至厄肉培养基中,每份样品接种4支,2支直接放置35℃王1℃厌氧培养至5d,另2支放80℃保温10min,再放置35C土1℃厌氧培养至5d;同样方法接种2支TPGYT肉汤管,28℃土1℃厌氧养至5d。注:接种时,用无菌吸管轻轻吸取样品匀液或离心沉淀悬浮液,将吸管口小心插人肉汤管底部,缓缓放出样液至肉汤中,切勿搅动或吹气。
5.3.1.3检查记录增菌培养物的浊度、产气、肉渣颗粒消化情况,并注意气味。肉毒梭菌培养物为产气、肉汤浑浊(肉培养基中A型和B型肉毒梭菌肉汤变黑)、消化或不消化肉粒、有异臭味。5.3.1.4取增菌培养物进行革兰氏染色镜检,观察菌体形态,注意是否有芽胞、芽胞的相对比例、芽胞在细胞内的位置。
5.3.1.5若增菌培养物5d无菌生长,应延长培养至10d,观察生长情况。5.3.1.6取增菌培养物阳性管的上清液,按5.2方法进行毒素检出和确证试验,必要时进行定型试验,阳性结果可证明样品中有肉毒梭菌存在。注:TPGYT增菌液的毒素试验无需添加胰酶处理。5.3.2分离与纯化培养
5.3.2.1增菌液前处理,吸取1mL增菌液至无菌螺旋帽试管中,加入等体积过滤除菌的无水乙醇,混匀,在室温下放置1h。
5.3.2.2取增菌培养物和经乙醇处理的增菌液分别划线接种至卵黄琼脂平板,35℃土1℃庆氧培养48h。
5.3.2.3观察平板培养物菌落形态,肉毒梭菌菌落隆起或扁平、光滑或粗糙,易成蔓延生长,边缘不规则,在菌落周围形成乳色沉淀晕圈(E型较宽,A型和B型较窄),在斜视光下观察,菌落表面呈现珍珠样虹彩,这种光泽区可随蔓延生长扩散到不规则边缘区外的晕圈5.3.2.4菌株纯化培养,在分离培养平板上选择5个肉毒梭菌可疑菌落,分别接种卵黄琼脂平板,35℃王1℃,厌氧培养48h,按5.3.2.3观察菌落形态及其纯度。5.3.3鉴定试验
5.3.3.1染色镜检
挑取可疑菌落进行涂片、革兰氏染色和镜检,肉毒梭菌菌体形态为革兰氏阳性粗大杆菌、芽胞卵圆5
形、大于菌体、位于次端,菌体呈网球拍状。5.3.3.2毒素基因检测
GB4789.12—2016
菌株活化:挑取可疑菌落或待鉴定菌株接种TPGY.35℃士1℃厌氧培养24h。a)
b)DNA模板制备:吸取TPGY培养液1.4mL至无菌离心管中,14000Xg离心2min,弃上清,加人1.0mLPBS悬浮菌体,14000×g离心2min,弃上清,用400μLPBS重悬沉淀,加人10mg/mL溶菌酶溶液100μL.摇匀,37℃水浴15min,加人10mg/mL蛋白酶K溶液10uL.摇勺,60℃水浴1h,再沸水浴10min,14000Xg离心2min,上清液转移至无菌小离心管中,加人3mol/LNaAc溶液50L和95%乙醇1.0mL,摇匀,一70℃或-20℃放置30min,14000×g离心10min,弃去上清液,沉淀干燥后溶于200uLTE缓冲液,置于一20℃保存备用。
注:根据实验室实际情况,也可采用常规水煮沸法或商品化试剂盒制备DNA模板。核酸浓度测定(必要时):取5uLDNA模板溶液,加超纯水稀释至1mL.用核酸蛋白分析仪或c
紫外分光光度计分别检测260nm和280nm波段的吸光值A26和A280按式(1)计算DNA浓度。当浓度在0.34ug/mL~340μg/mL或A260/A2%比值在1.7~1.9之间时,适宜于PCR扩增。
C=A260XN×50
式中:
-DNA浓度,单位为微克每毫升(μg/mL);A260———260nm处的吸光值;
N核酸稀释倍数。
d)PCR扩增:
1)分别采用针对各型肉毒梭菌毒素基因设计的特异性引物(见表1)进行PCR扩增,包括A型肉毒毒素(botulinumneurotoxinA,bont/A)、B型肉毒毒素(botulinumneurotoxinB,bont/B)、E型肉毒毒素(botulinumneurotoxinE,bont/E)和F型肉毒毒素(botulinumneurotoxinF,bont/F),每个PCR反应管检测一种型别的肉毒梭菌。表1肉毒梭菌毒素基因PCR检测的引物序列及其产物检测肉毒梭菌类型
引物序列
F 5*-GTG ATA CAA CCA GAT GGT AGT TAT AG-3'R5*-AAA AAA CAA GTC CCA ATT ATT AAC TTT-3\F 5'-GAGATG TTT GTG AAT ATT ATG ATC CAG-3'R5'-GTT CAT GCA TTAATA TCAAGG CTGG-3'F5CCAGGCGGTTGTCAAGAATTTTAT-3'R 5'-TCA AAT AAA TCA GGC TCT GCT CCC-3\F 5'-GCT TCA TTA AAG AAC GGA AGC AGT GCT-3R 5'-GTG GCG CCT TTG TACCTT TTC TAG G3扩增长度/bp
2)反应体系配制见表2,反应体系中各试剂的量可根据具体情况或不同的反应总体积进行相应调整。
10XPCR缓冲液
25 mmol/L MgCl2
10 mmol/L dNTPs
10 μmol/L正向引物
10μmol/L反向引物
5U/μLTaq酶
DNA模板
总体积
表2肉毒梭菌毒素基因PCR检测的反应体系终浓度
2.5mmol/L
0.2mmol/L
0.5μmol/L
0.5μmol/L
0.05U/μL
GB4789.12—2016
加人体积/μL
反应程序,预变性95℃5min;循环参数94℃、1min,60℃、1min,72℃、1min;循环数3)
40;后延伸72℃,10min;4℃保存备用。4)
PCR扩增体系应设置阳性对照、阴性对照和空白对照。用含有已知肉毒梭菌菌株或含肉毒毒素基因的质控品作阳性对照、非肉毒梭菌基因组DNA作阴性对照、无菌水作空白对照。
凝胶电泳检测PCR扩增产物,用0.5TBE缓冲液配制1.2%~1.5%的琼脂糖凝胶,凝胶加热e)
融化后冷却至60℃左右加人溴化乙锭至0.5μg/mL或Goldview5μL/100mL制备胶块,取10μLPCR扩增产物与2.0μL6X加样缓冲液混合,点样,其中一孔加人DNA分子量标准。0.5×TBE电泳缓冲液10V/cm恒压电泳,根据溴酚蓝的移动位置确定电泳时间,用紫外检测仪或凝胶成像系统观察和记录结果PCR扩增产物也可采用毛细管电泳仪进行检测。结果判定,阴性对照和空白对照均未出现条带,阳性对照出现预期大小的扩增条带(见表1):f
判定本次PCR检测成立;待测样品出现预期大小的扩增条带,判定为PCR结果阳性,根据表1判定肉毒梭菌菌株型别.待测样品未出现预期大小的扩增条带,判定PCR结果为阴性。注:PCR试验环境条件和过程控制应参照GB/T27403《实验室质量控制规范食品分子生物学检测》规定执行。3菌株产毒试验
将PCR阳性菌株或可疑肉毒梭菌菌株接种疱肉培养基或TPGYT肉汤(用于E型肉毒梭菌),按5.3.1.2条件厌氧培养5d,按5.2方法进行毒素检测和(或)定型试验,毒素确证试验阳性者,判定为肉毒梭菌,根据定型试验结果判定肉毒梭菌型别注:根据PCR阳性菌株型别,可直接用相应型别的肉毒毒素诊断血清进行确证试验。6结果报告
肉毒毒素检测结果报告
根据5.2.2和5.2.3试验结果,报告25g(mL)样品中检出或未检出肉毒毒素。根据5.2.5定型试验结果,报告25g(mL)样品中检出某型肉毒毒素。6.2肉毒梭菌检验结果报告
根据5.3各项试验结果,报告样品中检出或未检出肉毒梭菌或检出某型肉毒梭菌。7
A.1厄肉培养基
新鲜牛肉
蛋白陈
酵母浸膏
磷酸二氢钠
葡萄糖
可溶性淀粉
蒸馏水
附录A
培养基和试剂
GB4789.12—2016
称取新鲜除去脂肪与筋膜的牛肉500.0g,切碎,加人蒸馏水1000mL和1mol/L氢氧化钠溶液25mL,搅拌煮沸15min,充分冷却,除去表层脂肪,纱布过滤并挤出肉渣余液,分别收集肉汤和碎肉渣在肉汤中加人成分表中其他物质并用蒸馏水补足至1000mL,调节pH至7.4土0.1,肉渣凉至半干。在20mm×150mm试管中先加人碎肉渣1cm~2cm高,每管加人还原铁粉0.1g~0.2g或少许铁屑.再加入配制肉汤15mL,最后加人液体石蜡覆盖培养基0.3cm~0.4cm,121℃高压蒸汽灭菌20min。
A.2胰蛋白酶胰蛋白陈葡萄糖酵母膏肉汤(TPGYT)A.2.1
基础成分(TPGY肉汤)
胰酪陈(trypticase)
蛋白陈
酵母浸膏
葡萄糖
硫乙醇酸钠
蒸馏水
胰酶液
称取胰酶(1:250)1.5g,加入100mL蒸馏水中溶解,膜过滤除菌,4℃保存备用3制法
将A.2.1中成分溶于蒸馏水中,调节pH至7.2士0.1.分装20mm×150mm试管,每管15mL,加人液体石蜡覆盖培养基0.3cm~0.4cm,121℃高压蒸汽灭菌10min。冰箱冷藏,两周内使用。临用接种样品时.每管加人胰酶液1.0mL。8
A.3卵黄琼脂培养基
基础培养基成分
酵母浸膏
际陈(proteosepeptone)
氯化钠
蒸馏水
卵黄乳液
GB4789.12—2016
用硬刷清洗鸡蛋2个~3个,沥干,杀菌消毒表面,无菌打开,取出内容物,弃去蛋白,用无菌注射器吸取蛋黄,放人无菌容器中,加等量无菌生理盐水,充分混合调均,4℃保存备用。A.3.3
将A.3.1中成分溶于蒸馏水中,调节pH至7.0士0.2,分装锥形瓶,121℃高压蒸汽灭菌15min.冷却至50℃左右,按每100mL基础培养基加入15mL卵黄乳液,充分混匀.倾注平板,35℃培养24h进行无菌检查后,冷藏备用
明胶磷酸盐缓冲液
1成分
磷酸氢二钠(NazHPO,)
蒸馏水
将A.4.1中成分溶于蒸馏水中,调节pH至6.2.121℃高压蒸汽灭菌15min。A.5革兰氏染色
结晶紫染色液
A.5.1.1成分
结晶紫
95%乙醇
1%草酸铵水溶液
A.5.1.2制法
将结晶紫完全溶于乙醇中,再与草酸铵溶液混合。1.0g
革兰氏碘液
碘化钾
蒸馏水
A.5.2.2制法
GB 4789.12—2016
将碘和碘化钾混合,加入少许蒸馏水充分振摇,待完全溶解后,再加蒸馏水至300mL。A.5.3
沙黄复染液
95%乙醇
蒸馏水
A.5.3.2制法
将沙黄溶于乙醇中,再加蒸馏水至100 mL。A.5.4
染色方法
涂片在酒精灯火焰上固定,滴加结晶紫染色液覆盖,染色1min,水洗;滴加革兰氏碘液覆盖作用1min,水洗;滴加95%乙醇脱色约15s~30s(可将乙醇覆盖整个涂片,立即倾去,再用乙醇覆盖涂片,作用约10s,倾去脱色液,滴加乙醇从涂片流下至出现无色为止),水洗;滴加沙黄复染液覆盖,染色1min,水洗待干、镜检。
胰蛋白酶溶液
1成分
胰蛋白酶(1:250)
蒸馏水
将胰蛋白酶溶于蒸馏水中,膜过滤除菌,4℃保存备用。A.7
磷酸盐缓冲液(PBS)
氯化钠
磷酸氢二钠
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
GB4789.12—2016
食品安全国家标准
食品微生物学检验
肉毒梭菌及肉毒毒素检验
2016-12-23发布
2017-06-23实施
中华人民共和国国家卫生和计划生育委员会国家食品药品监督管理总局
本标准代替GB/T4789.12—2003《食品卫生微生物学检验本标准与GB/T4789.12—2003相比,主要变化如下:GB4789.12—2016
肉毒梭菌及肉毒毒素检验》。
标准名称修改为“食品安全国家标准食品微生物学检验增加了PCR鉴定方法;
—增加了结果与报告;
—增加了附录A;
修改了设备和材料;
修改了培养基和试剂;
修改了检验程序;
规范了样品制备过程;
一修改了操作步骤中增菌和分离培养部分试验方法,肉毒梭菌及肉毒毒素检验”;
1范围
食品安全国家标准
食品微生物学检验
肉毒梭菌及肉毒毒素检验
GB 4789.12—2016
本标准规定了食品中肉毒梭菌(Clostridiumbotulinum)及肉毒毒素(botulinumtoxin)的检验方法。
本标准适用于食品中肉毒梭菌及肉毒毒素的检验设备和材料
除微生物实验室常规灭菌及培养设备外,其他设备和材料如下:冰箱:2℃~5℃、20℃。
天平:感量0.1g。
无菌手术剪、镊子、试剂勺。
均质器或无菌乳钵。
离心机:3000r/min、14.000r/min。庆氧培养装置。
恒温培养箱:35℃1℃、28℃±1℃。恒温水浴箱:37℃±1℃、60℃±1℃、80℃±1℃。显微镜:10倍100倍。
PCR仪。
电泳仪或毛细管电泳仪,
凝胶成像系统或紫外检测仪
核酸蛋白分析仪或紫外分光光度计。可调微量移液器:0.2μ~2μ、2μ20μ、20μ200μ、100μ~1000μ。无菌吸管:1.0mL、10.0mL、25.0mL无菌锥形瓶:100mL。
培养Ⅲl:直径90mm。
离心管:50mL、1.5mL。
PCR反应管。
无菌注射器:1.0mL。
小鼠:15g~20g,每一批次试验应使用同一品系的KM或ICR小鼠。3培养基和试剂
除另有规定外,PCR试验所用试剂为分析纯或符合生化试剂标准:水应符合GB/T6682中一级水的要求。
疱肉培养基:见A.1。
胰蛋白酶胰蛋白陈葡萄糖酵母膏肉汤(TPGYT):见A.2。卵黄琼脂培养基:见A.3。
明胶磷酸盐缓冲液:见A.4。
革兰氏染色液:见A.5。
10%胰蛋白酶溶液:见A.6。
磷酸盐缓冲液(PBS)):见A.7。1mol/L氢氧化钠溶液。
1mol/L盐酸溶液
肉毒毒素诊断血清。
无水乙醇和95%乙醇。
10mg/mL溶菌酶溶液。
10mg/mL蛋白酶K溶液。免费标准bzxz.net
3mol/L乙酸钠溶液(pH5.2)。
TE缓冲液。
引物:根据表1中序列合成,临用时用超纯水配制引物浓度为10umol/L。10XPCR缓冲液。
25mmol/LMgCl2。
dNTPs:dATP、dTTP、dCTP、dGTPTaq酶。
琼脂糖:电泳级。
溴化乙锭或Goldview。
5×TBE缓冲液。
6×加样缓冲液。
DNA分子量标准。
4检验程序
肉毒梭菌及肉毒毒素检验程序见图1。GB4789.12—2016
液休检群25mL
1:清液
声素检测
菌落形源弧索
5操作步骤
5.1样品制备
5.1.1样品保存
沉淀品浮被
庇肉养基
厌然,35 ±1 , 5 d
草兰氏染色镜检
GB4789.122016
固体检25g—25 mL(或50 mL)明胶磷酸热缓冲被离心
1蒲莊
厌,28+1它,
乙醇处师
即黄琼脂培养英
炭氧, 35 ℃±1 ℃, 48 b
可疑菌游纯化培荠
PCR婴足
图1肉毒梭菌及肉毒毒素检验程序待检样品应放置2℃5℃冰箱冷藏。5.1.2固态与半固态食品
森索检测
荫株产年试验
固体或游离液体很少的半固态食品,以无菌操作称取样品25g,放人无菌均质袋或无菌乳钵,块状食品以无菌操作切碎,含水量较高的固态食品加人25mL明胶磷酸盐缓冲液,乳粉、牛肉干等含水量低3
GB4789.12—2016
的食品加入50mL明胶磷酸盐缓冲液,浸泡30min,用拍击式均质器拍打2min或用无菌研杆研磨制备样品匀液,收集备用。
5.1.3液态食品
液态食品摇匀,以无菌操作量取25mL检验。5.1.4剩余样品处理
取样后的剩余样品放2℃~5℃冰箱冷藏,直至检验结果报告发出后,按感染性废弃物要求进行无害化处理,检出阳性的样品应采用压力蒸汽灭菌方式进行无害化处理。5.2肉毒毒素检测
5.2.1毒素液制备
取样品匀液约40mL或均匀液体样品25mL放入离心管,3000r/min离心10min~20min,收集上清液分为两份放入无菌试管中,一份直接用于毒素检测,一份用于胰酶处理后进行毒素检测。液体样品保留底部沉淀及液体约12mL,重悬,制备沉淀浮液备用胰酶处理:用1mol/L氢氧化钠或1mol/L盐酸调节上清液pH至6.2.按9份上清液加1份10%胰酶(活力1:250)水溶液,混匀,37℃孵育60min,期间间或轻轻摇动反应液。5.2.2检出试验
用5号针头注射器分别取离心上清液和胰酶处理上清液腹腔注射小鼠3只,每只0.5mL,观察和记录小鼠48h内的中毒表现。典型肉毒毒素中毒症状多在24h内出现,通常在6h内发病和死亡,其主要表现为竖毛、四肢瘫软,呼吸困难,呈现风箱式呼吸、腰腹部凹陷、宛如峰腰,多因呼吸衰竭而死亡,可初步判定为肉毒毒素所致。若小鼠在24h后发病或死亡,应仔细观察小鼠症状,必要时浓缩上清液重复试验,以排除肉毒毒素中毒。若小鼠出现释死(30min内)导致症状不明显时,应将毒素上清液进行适当稀释,重复试验。
注:毒素检测动物试验应遵循GB15193.2《食品安全国家标准食品毒理学实验室操作规范》的规定。5.2.3确证试验
上清液或(和)胰酶处理上清液的毒素试验阳性者,取相应试验液3份,每份0.5mL,其中第一份加等量多型混合肉毒毒素诊断血清,混匀,37℃孵育30min:第三份加等量明胶磷酸盐缓冲液,混匀后煮沸10min;第三份加等量明胶磷酸盐缓冲液,混匀。将三份混合液分别腹腔注射小鼠各两只,每只0.5mL.观察96h内小鼠的中毒和死亡情况结果判定:若注射第一份和第二份混合液的小鼠未死亡,而第三份混合液小鼠发病死亡,并出现肉毒毒素中毒的特有症状,则判定检测样品中检出肉毒毒素。5.2.4毒力测定(选做项目)
取确证试验阳性的试验液,用明胶磷酸盐缓冲液稀释制备一定倍数稀释液,如10倍、50倍、100倍、500倍等分别腹腔注射小鼠各两只,每只0.5mL,观察和记录小鼠发病与死亡情况至96h,计算最低致死剂量(MLD/mL或MLD/g),评估样品中肉毒毒素毒力,MLD等于小鼠全部死亡的最高稀释倍数乘以样品试验液稀释倍数。例如,样品稀释两倍制备的上清液,再稀释100倍试验液使小鼠全部死亡而500倍稀释液组存活,则该样品毒力为200MLD/g。4
5.2.5定型试验(选做项目)
GB4789.12—2016
根据毒力测定结果,用明胶磷酸盐缓冲液将上清液稀释至10MLD/mL~1000MLD/mL作为定型试验液.分别与各单型肉毒毒素诊断血清等量混合(国产诊断血清一般为冻干血清,用1mL生理盐水溶解),37℃孵育30min,分别腹腔注射小鼠两只,每只0.5mL,观察和记录小鼠发病与死亡情况至96h。同时,用明胶磷酸盐缓冲液代替诊断血清,与试验液等量混合作为小鼠试验对照。结果判定:某一单型诊断血清组动物未发病且正常存活,而对照组和其他单型诊断血清组动物发病死亡,则判定样品中所含肉毒毒素为该型肉毒毒素注:未经胰酶激活处理的样品上清液的毒素检出试验或确证试验为阳性者,则毒力测定和定型试验可省略胰酶激活处理试验。
5.3肉毒梭菌检验
5.3.1增菌培养与检出试验
5.3.1.1取出厄肉培养基4支和TPGY肉汤管2支,隔水煮沸10min~15min,排除溶解氧,迅速冷却,切勿摇动,在TPGY肉汤管中缓慢加人胰酶液至液体石蜡液面下肉汤中,每支1mL,制备成TPGYT。
5.3.1.2吸取样品匀液或毒素制备过程中的离心沉淀悬浮液2mL接种至厄肉培养基中,每份样品接种4支,2支直接放置35℃王1℃厌氧培养至5d,另2支放80℃保温10min,再放置35C土1℃厌氧培养至5d;同样方法接种2支TPGYT肉汤管,28℃土1℃厌氧养至5d。注:接种时,用无菌吸管轻轻吸取样品匀液或离心沉淀悬浮液,将吸管口小心插人肉汤管底部,缓缓放出样液至肉汤中,切勿搅动或吹气。
5.3.1.3检查记录增菌培养物的浊度、产气、肉渣颗粒消化情况,并注意气味。肉毒梭菌培养物为产气、肉汤浑浊(肉培养基中A型和B型肉毒梭菌肉汤变黑)、消化或不消化肉粒、有异臭味。5.3.1.4取增菌培养物进行革兰氏染色镜检,观察菌体形态,注意是否有芽胞、芽胞的相对比例、芽胞在细胞内的位置。
5.3.1.5若增菌培养物5d无菌生长,应延长培养至10d,观察生长情况。5.3.1.6取增菌培养物阳性管的上清液,按5.2方法进行毒素检出和确证试验,必要时进行定型试验,阳性结果可证明样品中有肉毒梭菌存在。注:TPGYT增菌液的毒素试验无需添加胰酶处理。5.3.2分离与纯化培养
5.3.2.1增菌液前处理,吸取1mL增菌液至无菌螺旋帽试管中,加入等体积过滤除菌的无水乙醇,混匀,在室温下放置1h。
5.3.2.2取增菌培养物和经乙醇处理的增菌液分别划线接种至卵黄琼脂平板,35℃土1℃庆氧培养48h。
5.3.2.3观察平板培养物菌落形态,肉毒梭菌菌落隆起或扁平、光滑或粗糙,易成蔓延生长,边缘不规则,在菌落周围形成乳色沉淀晕圈(E型较宽,A型和B型较窄),在斜视光下观察,菌落表面呈现珍珠样虹彩,这种光泽区可随蔓延生长扩散到不规则边缘区外的晕圈5.3.2.4菌株纯化培养,在分离培养平板上选择5个肉毒梭菌可疑菌落,分别接种卵黄琼脂平板,35℃王1℃,厌氧培养48h,按5.3.2.3观察菌落形态及其纯度。5.3.3鉴定试验
5.3.3.1染色镜检
挑取可疑菌落进行涂片、革兰氏染色和镜检,肉毒梭菌菌体形态为革兰氏阳性粗大杆菌、芽胞卵圆5
形、大于菌体、位于次端,菌体呈网球拍状。5.3.3.2毒素基因检测
GB4789.12—2016
菌株活化:挑取可疑菌落或待鉴定菌株接种TPGY.35℃士1℃厌氧培养24h。a)
b)DNA模板制备:吸取TPGY培养液1.4mL至无菌离心管中,14000Xg离心2min,弃上清,加人1.0mLPBS悬浮菌体,14000×g离心2min,弃上清,用400μLPBS重悬沉淀,加人10mg/mL溶菌酶溶液100μL.摇匀,37℃水浴15min,加人10mg/mL蛋白酶K溶液10uL.摇勺,60℃水浴1h,再沸水浴10min,14000Xg离心2min,上清液转移至无菌小离心管中,加人3mol/LNaAc溶液50L和95%乙醇1.0mL,摇匀,一70℃或-20℃放置30min,14000×g离心10min,弃去上清液,沉淀干燥后溶于200uLTE缓冲液,置于一20℃保存备用。
注:根据实验室实际情况,也可采用常规水煮沸法或商品化试剂盒制备DNA模板。核酸浓度测定(必要时):取5uLDNA模板溶液,加超纯水稀释至1mL.用核酸蛋白分析仪或c
紫外分光光度计分别检测260nm和280nm波段的吸光值A26和A280按式(1)计算DNA浓度。当浓度在0.34ug/mL~340μg/mL或A260/A2%比值在1.7~1.9之间时,适宜于PCR扩增。
C=A260XN×50
式中:
-DNA浓度,单位为微克每毫升(μg/mL);A260———260nm处的吸光值;
N核酸稀释倍数。
d)PCR扩增:
1)分别采用针对各型肉毒梭菌毒素基因设计的特异性引物(见表1)进行PCR扩增,包括A型肉毒毒素(botulinumneurotoxinA,bont/A)、B型肉毒毒素(botulinumneurotoxinB,bont/B)、E型肉毒毒素(botulinumneurotoxinE,bont/E)和F型肉毒毒素(botulinumneurotoxinF,bont/F),每个PCR反应管检测一种型别的肉毒梭菌。表1肉毒梭菌毒素基因PCR检测的引物序列及其产物检测肉毒梭菌类型
引物序列
F 5*-GTG ATA CAA CCA GAT GGT AGT TAT AG-3'R5*-AAA AAA CAA GTC CCA ATT ATT AAC TTT-3\F 5'-GAGATG TTT GTG AAT ATT ATG ATC CAG-3'R5'-GTT CAT GCA TTAATA TCAAGG CTGG-3'F5CCAGGCGGTTGTCAAGAATTTTAT-3'R 5'-TCA AAT AAA TCA GGC TCT GCT CCC-3\F 5'-GCT TCA TTA AAG AAC GGA AGC AGT GCT-3R 5'-GTG GCG CCT TTG TACCTT TTC TAG G3扩增长度/bp
2)反应体系配制见表2,反应体系中各试剂的量可根据具体情况或不同的反应总体积进行相应调整。
10XPCR缓冲液
25 mmol/L MgCl2
10 mmol/L dNTPs
10 μmol/L正向引物
10μmol/L反向引物
5U/μLTaq酶
DNA模板
总体积
表2肉毒梭菌毒素基因PCR检测的反应体系终浓度
2.5mmol/L
0.2mmol/L
0.5μmol/L
0.5μmol/L
0.05U/μL
GB4789.12—2016
加人体积/μL
反应程序,预变性95℃5min;循环参数94℃、1min,60℃、1min,72℃、1min;循环数3)
40;后延伸72℃,10min;4℃保存备用。4)
PCR扩增体系应设置阳性对照、阴性对照和空白对照。用含有已知肉毒梭菌菌株或含肉毒毒素基因的质控品作阳性对照、非肉毒梭菌基因组DNA作阴性对照、无菌水作空白对照。
凝胶电泳检测PCR扩增产物,用0.5TBE缓冲液配制1.2%~1.5%的琼脂糖凝胶,凝胶加热e)
融化后冷却至60℃左右加人溴化乙锭至0.5μg/mL或Goldview5μL/100mL制备胶块,取10μLPCR扩增产物与2.0μL6X加样缓冲液混合,点样,其中一孔加人DNA分子量标准。0.5×TBE电泳缓冲液10V/cm恒压电泳,根据溴酚蓝的移动位置确定电泳时间,用紫外检测仪或凝胶成像系统观察和记录结果PCR扩增产物也可采用毛细管电泳仪进行检测。结果判定,阴性对照和空白对照均未出现条带,阳性对照出现预期大小的扩增条带(见表1):f
判定本次PCR检测成立;待测样品出现预期大小的扩增条带,判定为PCR结果阳性,根据表1判定肉毒梭菌菌株型别.待测样品未出现预期大小的扩增条带,判定PCR结果为阴性。注:PCR试验环境条件和过程控制应参照GB/T27403《实验室质量控制规范食品分子生物学检测》规定执行。3菌株产毒试验
将PCR阳性菌株或可疑肉毒梭菌菌株接种疱肉培养基或TPGYT肉汤(用于E型肉毒梭菌),按5.3.1.2条件厌氧培养5d,按5.2方法进行毒素检测和(或)定型试验,毒素确证试验阳性者,判定为肉毒梭菌,根据定型试验结果判定肉毒梭菌型别注:根据PCR阳性菌株型别,可直接用相应型别的肉毒毒素诊断血清进行确证试验。6结果报告
肉毒毒素检测结果报告
根据5.2.2和5.2.3试验结果,报告25g(mL)样品中检出或未检出肉毒毒素。根据5.2.5定型试验结果,报告25g(mL)样品中检出某型肉毒毒素。6.2肉毒梭菌检验结果报告
根据5.3各项试验结果,报告样品中检出或未检出肉毒梭菌或检出某型肉毒梭菌。7
A.1厄肉培养基
新鲜牛肉
蛋白陈
酵母浸膏
磷酸二氢钠
葡萄糖
可溶性淀粉
蒸馏水
附录A
培养基和试剂
GB4789.12—2016
称取新鲜除去脂肪与筋膜的牛肉500.0g,切碎,加人蒸馏水1000mL和1mol/L氢氧化钠溶液25mL,搅拌煮沸15min,充分冷却,除去表层脂肪,纱布过滤并挤出肉渣余液,分别收集肉汤和碎肉渣在肉汤中加人成分表中其他物质并用蒸馏水补足至1000mL,调节pH至7.4土0.1,肉渣凉至半干。在20mm×150mm试管中先加人碎肉渣1cm~2cm高,每管加人还原铁粉0.1g~0.2g或少许铁屑.再加入配制肉汤15mL,最后加人液体石蜡覆盖培养基0.3cm~0.4cm,121℃高压蒸汽灭菌20min。
A.2胰蛋白酶胰蛋白陈葡萄糖酵母膏肉汤(TPGYT)A.2.1
基础成分(TPGY肉汤)
胰酪陈(trypticase)
蛋白陈
酵母浸膏
葡萄糖
硫乙醇酸钠
蒸馏水
胰酶液
称取胰酶(1:250)1.5g,加入100mL蒸馏水中溶解,膜过滤除菌,4℃保存备用3制法
将A.2.1中成分溶于蒸馏水中,调节pH至7.2士0.1.分装20mm×150mm试管,每管15mL,加人液体石蜡覆盖培养基0.3cm~0.4cm,121℃高压蒸汽灭菌10min。冰箱冷藏,两周内使用。临用接种样品时.每管加人胰酶液1.0mL。8
A.3卵黄琼脂培养基
基础培养基成分
酵母浸膏
际陈(proteosepeptone)
氯化钠
蒸馏水
卵黄乳液
GB4789.12—2016
用硬刷清洗鸡蛋2个~3个,沥干,杀菌消毒表面,无菌打开,取出内容物,弃去蛋白,用无菌注射器吸取蛋黄,放人无菌容器中,加等量无菌生理盐水,充分混合调均,4℃保存备用。A.3.3
将A.3.1中成分溶于蒸馏水中,调节pH至7.0士0.2,分装锥形瓶,121℃高压蒸汽灭菌15min.冷却至50℃左右,按每100mL基础培养基加入15mL卵黄乳液,充分混匀.倾注平板,35℃培养24h进行无菌检查后,冷藏备用
明胶磷酸盐缓冲液
1成分
磷酸氢二钠(NazHPO,)
蒸馏水
将A.4.1中成分溶于蒸馏水中,调节pH至6.2.121℃高压蒸汽灭菌15min。A.5革兰氏染色
结晶紫染色液
A.5.1.1成分
结晶紫
95%乙醇
1%草酸铵水溶液
A.5.1.2制法
将结晶紫完全溶于乙醇中,再与草酸铵溶液混合。1.0g
革兰氏碘液
碘化钾
蒸馏水
A.5.2.2制法
GB 4789.12—2016
将碘和碘化钾混合,加入少许蒸馏水充分振摇,待完全溶解后,再加蒸馏水至300mL。A.5.3
沙黄复染液
95%乙醇
蒸馏水
A.5.3.2制法
将沙黄溶于乙醇中,再加蒸馏水至100 mL。A.5.4
染色方法
涂片在酒精灯火焰上固定,滴加结晶紫染色液覆盖,染色1min,水洗;滴加革兰氏碘液覆盖作用1min,水洗;滴加95%乙醇脱色约15s~30s(可将乙醇覆盖整个涂片,立即倾去,再用乙醇覆盖涂片,作用约10s,倾去脱色液,滴加乙醇从涂片流下至出现无色为止),水洗;滴加沙黄复染液覆盖,染色1min,水洗待干、镜检。
胰蛋白酶溶液
1成分
胰蛋白酶(1:250)
蒸馏水
将胰蛋白酶溶于蒸馏水中,膜过滤除菌,4℃保存备用。A.7
磷酸盐缓冲液(PBS)
氯化钠
磷酸氢二钠
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。