GB 4789.41-2016
基本信息
标准号: GB 4789.41-2016
中文名称:食品安全国家标准 食品微生物学检验 肠杆菌科检验
标准类别:国家标准(GB)
标准状态:现行
出版语种:简体中文
下载格式:.rar .pdf
下载大小:394KB

标准分类号
关联标准
出版信息
相关单位信息
标准简介
GB 4789.41-2016 食品安全国家标准 食品微生物学检验 肠杆菌科检验
GB4789.41-2016
标准压缩包解压密码:www.bzxz.net
标准图片预览




标准内容
中华人民共和国国家标准
GB4789.41—2016
食品安全国家标准
食品微生物学检验
2016-08-31发布
肠杆菌科检验
2017-03-01实施
人民共和国
国家卫生和计划生育委员会
1范围
食品安全国家标准
食品微生物学检验
肠杆菌科检验
本标准规定了食品中肠杆菌科(Enterobacteriaceae)的检验方法。GB 4789.41—2016
本标准第一法适用于肠杆菌科含量较高的食品中肠杆菌科的计数;第二法适用于肠杆菌科含量较低食品中肠杆菌科的计数。
术语和定义
Enterobacteriaceae
肠杆菌科
在给定条件下发酵葡萄糖产酸、氧化酶阴性的需氧或兼性厌氧革兰氏阴性无芽胞杆菌。2.2
Enumeration of Enterobacteriaceae肠杆菌科计数
按本标准规定方法,对每克或每毫升检样中的肠杆菌科进行计数。2.3
最可能数
mostprobablenumber;MPN
基于泊松分布的一种间接计数方法。设备和材料
除微生物实验室常规灭菌及培养设备外,其他设备和材料如下:恒温培养箱:36℃士1℃。
冰箱:2℃~5℃。
水浴箱:46℃±1℃。
天平:感量0.1g。
显微镜:10倍100倍。
均质器。
振荡器。
无菌吸管:1mL(具0.01mL刻度)、10mL(具0.1mL刻度)或微量移液器及吸头。无菌锥形瓶或等效容器:容量150mL、500mL。无菌培养皿:直径90mm。
无菌试管:18mmX180mm、15mmX150mmpH计或pH比色管或精密pH试纸,培养基和试剂
缓冲蛋白陈水(BPW):见B.1。1
缓冲葡萄糖煌绿胆盐肉汤(EE肉汤):见B.2结晶紫中性红胆盐葡萄糖琼脂(VRBGA):见B.3。营养琼脂(NA):见B.4。
葡萄糖琼脂:见B.5。
革兰氏染色液:见B.6。
氧化酶试剂:见B.7。
无菌1mol/LNaOH:见B.8。
无菌1mol/LHCl:见B.9。
第一法肠杆菌科平板计数法
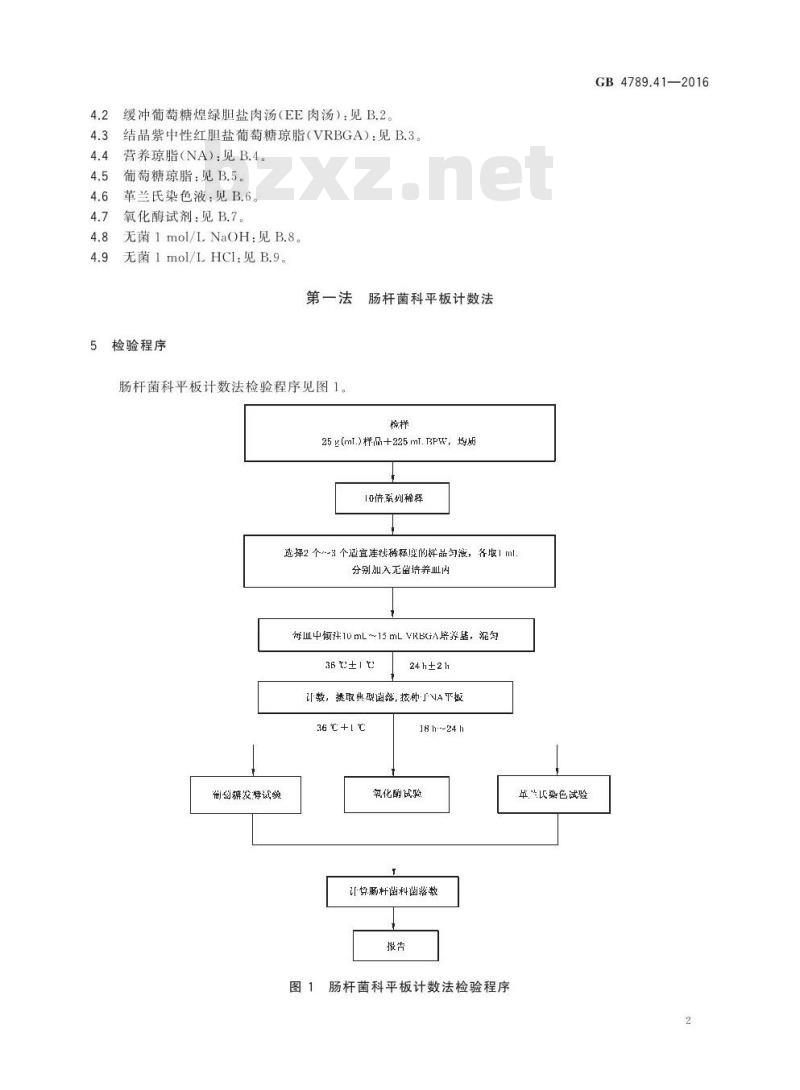
5检验程序
肠杆菌科平板计数法检验程序见图1。梭样
25 g(mT.)样品+225 ml. BPW,均质10倍系列稀秤
选择2个-3个适宜连续稀释度的样品匀滤,各收1ml分别加入无菌培养血内
每血中倾注1UmL~15mLVRBGA培荐基,泥匀36 ±1
24h±21
数,挑取典型菌落,接种」NA平板36 ℃+I℃
制萄摊发酵试验
18 h--24 h
氧化酶试验
亚好肠杆菌科菌落数
图1肠杆菌科平板计数法检验程序革汽长染色试验
GB4789.412016
6操作步骤
6.1样品的稀释
GB4789.41—2016
6.1.1固体和半固体样品:称取25g样品放入盛有225mLBPW的无菌均质杯中,8000r/min~10000r/min均质1min~2min,或放入盛有225mLBPw的无菌均质袋中,用拍击式均质器拍打1min~2min,制成1:10的样品匀液。6.1.2液体样品:以无菌吸管吸取25mL样品放人盛有225mLBPW的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中,充分混匀,制成1:10的样品匀液。6.1.3用1mL无菌吸管或微量移液器吸取1:10样品匀液1mL,沿管壁缓缓注入盛有9mLBPW的无菌试管中(注意吸管或吸头尖端不应触及稀释液面),振摇试管或换用1支1mL无菌吸管反复吹打,使其混合均匀,制成1:100的样品匀液。6.1.4按6.1.3操作程序,依次制成10倍递增系列稀释样品匀液。每递增稀释1次,换用1支1mL无菌吸管或吸头。从制备样品匀液至样品接种完毕,全过程不得超过15min。6.2倾注平板和培养
6.2.1根据对样品污染状况的估计及相关限量要求,选择2个~3个适宜的连续稀释度的样品匀液(液体样品可以选择原液),每个稀释度接种2个无菌平皿。同时,分别吸取1mLBPW加人两个无菌平Ⅲ内作为空白对照。
6.2.2将10mL~15mL冷却至46℃的VRBGA(可放置于46℃士1℃恒温水浴箱中保温)倾注于每个平血中。小心旋转平血,使样品匀液与培养基充分混匀。6.2.3待琼脂凝固后,倾注一薄层同样的培养基覆盖平板表层。防止蔓延生长并使菌落特征更为明显。
6.2.4待VRBGA平板上层琼脂凝固后翻转平板,36℃土1℃培养18h~24h。6.3典型菌落计数和确认
6.3.1肠杆菌科典型菌落为有或无沉淀环的粉红色至红色或紫色菌落。选取典型菌落数在15CFU~150CFU之间、无蔓延菌落生长的平板,只计数典型菌落数。菌落计数以菌落形成单位(colonyformingunits,CFU)表示
6.3.2其中一个平板有较大片状菌落生长时,则不宜采用,而应以无片状菌落生长的平板作为该稀释度的菌落数;若片状菌落不到平板的一半,而其余一半中菌落分布又很均匀,即可计算半个平板后乘以2.代表一个平板菌落数。
6.3.3当平板上出现菌落间无明显界线的链状生长时,则将每条单链作为一个菌落计数。6.3.4从每个平板上至少挑取5个(小于5个全选)典型菌落进行确认,如果有不同形态的典型菌落,则每种形态分别至少挑取1个菌落进行确认。6.3.5典型菌落的确认:
a)分别将所挑选的每一个菌落,划线于营养琼脂平板,36℃士1℃培养18h24h,挑取平板上的菌落进行革兰氏染色镜检、氧化酶试验及葡萄糖发酵试验。b)革兰氏染色镜检:肠杆菌科为革兰氏阴性杆菌,无芽孢,大小为(0.3~1.0)um×(1.0~6.0)μm。
c)氧化酶试验:用铂/铱接种环或玻璃棒(不要用镍铬接种环)挑取单个菌落涂于浸湿氧化酶试剂的滤纸上,滤纸的颜色在10s内变成蓝紫色,判为阳性反应。GB4789.41—2016
葡萄糖发酵试验:用接种针挑取少许氧化酶阴性的同一个菌落,穿刺于葡萄糖琼脂内,于36℃土d
1℃培养24h士2h,若试管内的内容物变为黄色,判为阳性反应。6.4结果的计算
6.4.1一般原则
若有两个连续稀释度的平板典型菌落数在适宜计数范围内,按式(1)计算,示例见A,1、A.2、A.3、A.4。
式中:
N-样品中肠杆菌科菌落数;
确证的肠杆菌科菌落数之和;
(n+0.1n2)d
第一稀释度(低稀释倍数)平板个数(含确证的肠杆菌科菌落);第二稀释度(高稀释倍数)平板个数(含确证的肠杆菌科菌落);稀释因子(第一稀释度)。
其中,a按式(2)计算:
式中:
确证的肠杆菌科菌落数;
某一平板中A个菌落中被确证为肠杆菌科的菌落数,b≤A;A一某一平板中用于确认试验的菌落数;C—某一平板中典型菌落总数。
6.4.2低菌落数
.....(1)
..(2)
若最低稀释度(包括液体样品原液)平板的典型菌落数均小于15CFU.具有确证的肠杆菌科菌落,则以确证的菌落数乘以最低稀释倍数计算若最低稀释度(包括液体样品原液)平板均无菌落生长,或典型菌落数均小于15CFU,且无确证的肠杆菌科菌落,则以小于1乘以最低稀释倍数计算。6.4.3特殊情况
第一稀释度平板上的典型菌落数均大于150CFU,且有确证的肠杆菌科菌落,以及第二稀释度平板上无确证的肠杆菌科菌落或典型菌落数不在15CFU~150CFU之间,则以确证的菌落数乘以第一稀释倍数计算,示例见A.5。
若所有稀释度的平板上典型菌落数均不在适宜计数范围内,且无确证的肠杆菌科菌落,则以小于1乘以最低稀释倍数计算。
7报告
7.1菌落数小于100时,以整数报告。7.2菌落数大于或等于100时,对第3位数字进行修约后,取前2位数字,后面用0代替位数;也可用10的指数形式来表示,采用两位有效数字。7.3数字修约按“四舍五入”原则进行。4
若所有平板上为蔓延菌落而无法计数,则报告菌落蔓延。7.5
若空白对照上有菌落生长,则此次检测结果无效,称重取样以CFU/g为单位报告,体积取样以CFU/mL为单位报告。7.6
第二法
检验程序
肠杆菌科MPN计数法
肠杆菌科MPN计数法检验程序见图2。绮样
25g(25)品+225BP,均质
10倍系列稀择
选择3个适宜连续稀择度的样品匀液,每个稀释度3管,共9管BPW
1ml.BP培荞物Www.bzxZ.net
36 ℃+1℃
10 rmf.T.F.肉汤
24h±2h
接种VRI3iA平板
36 ℃+1℃
24h±2h
疑菌落移[NA板
36 +I℃
简萄糖发酵试验
[ h--24 h
氧化酶试骏
EMPN表
图2肠杆菌科MPN计数法检验程序革兰民染色试验
GB4789.412016
9操作步骤
样品的稀释
按6.1进行。
9.2接种和培养
9.2.1非选择性前增菌
GB4789.41-—2016
根据对样品污染状况的估计及相关限量要求,选择3个适宜连续稀释度的样品匀液,每个稀释度3管,共9管BPW于36℃±1℃培养18h士2h。9.2.2选择性增菌
从BPW各培养管中,分别移取1mL培养物,接种于10mL的EE肉汤中,36℃土1℃培养24h土2h。
9.2.3分离
用接种环从EE各肉汤管中分别取培养物1环,划线接种于VRBGA平板,36℃土1℃培养24h土2h,观察平板上有无典型菌落
典型菌落的确认
典型菌落确认见6.3。
肠杆菌科为革兰氏阴性无芽胞杆菌,发酵葡萄糖产酸、氧化酶阴性。只要有1个菌落确认为肠杆菌科,其所代表的EE管即为肠杆菌科阳性,依据EE阳性管数查MPN表(见附录C),报告每克(毫升)样品中肠杆菌科的MPN值。称重取样以MPN/g为单位报告.体积取样以MPN/mL为单位报告。6
附录A
结果计算示例
GB4789.412016
A.1两个连续稀释度均含适宜的典型菌落数平板,并含有已确证的肠杆菌科菌落,数据见表A,1。表A.1
稀释度
典型菌落数/CFU
用于确认试验的菌落数/CFU
确证的菌落数/CFU
肠杆菌科平板计数结果示例1
等一稀释度)
1:100(第
4/5X126=101
5/5×145=145
101+145+16+14
【2+(0.1×2)×10-2
上述数据按7.2数字修约后,表示为13000或1.3×1041:1000(第二稀释度)
4/5×20=16
=12545
3/5×24=14
A.2两个连续稀释度均含适宜典型菌落数平板,其中某一稀释度的一个平板菌落数不在适宜范围内:或者两个稀释度各有一个平板菌落数不在适宜范围内,则相应的平板不作为计数平板,数据见表A.2。表A.2肠杆菌科平板计数结果示例2稀释度
典型菌落数/CFU
用于确认试验的菌落数/CFU
确证的菌落数/CFU
1:100(第一稀释度)
4/5X126=101
5/8×11874
101+74+16
[2+(0.1×1)]×10-2
上述数据按7.2数字修约后,表示为9100或9.1×103。191
1:1000(第二稀释度)
4/5×20=16
A.3两个连续稀释度均含适宜典型菌落数平板,其中一个平板无已确证的肠杆菌科菌落,则相应的平板不作为计数平板,数据见表A3表A.3
稀释度
典型菌落数/CFU
用于确认试验的菌落数/CFU
确证的菌落数/CFU
肠杆菌科平板计数结果示例3
1:100(第一稀释度)
4/5×126=101
6/6×118=118
101+118+16+0
[2+(0.1×1)]×10-2
上述数据按7.2数字修约后,表示为11000或1.1×10°1:1000(第二稀释度)
4/5×20=16
=11190
GB 4789.41—2016
A.4两个连续稀释度均含适宜典型菌落数平板,但无已确证的肠杆菌科菌落,则以小于1乘以最低稀释倍数计算
A.5第一稀释度平板上的菌落数超过150CFU,且有证实的肠杆菌科菌落,以及第二稀释度平板上无确证的肠杆菌科菌落或典型菌落数不在15CFU~150CFU之间,则以确证的菌落数乘以第一稀释倍数计算,数据见表A.5
稀释度
典型菌落数/CFU
用于确认试验的菌落数/CFU
确证的菌落数/CFU
(176+119)
肠杆菌科平板计数结果示例5
1:100(第一稀释度)
4/5×220=176
×102=14750
3/5X198=119
1:1000(第二稀释度)
缓冲蛋白陈水(BPW)
蛋白陈
氯化钠
磷酸氢二钠
磷酸二氢钾
蒸馏水
附录B
培养基和试剂
GB4789.41—2016
将B.1.1成分加热溶解,于25℃时调节pH至7.2士0.2.分装于500mL广口瓶中,每瓶225mL,121℃高压灭菌15min。
缓冲葡萄糖煌绿胆盐肉汤(EE肉汤)B.2.1成分
蛋白陈
葡萄糖
磷酸氢二钠(无水)
磷酸二氢钾
牛胆盐
蒸馏水
将B.2.1成分溶于水中,加热煮沸至完全溶解,加热不宜超过30min,迅速冷却培养基,于25℃调节pH至7.2土0.2.分装于灭菌的18mm×180mm试管中,每管10mL.不需高压灭菌.5℃土3℃可存放一个月。
结晶紫中性红胆盐葡萄糖琼脂(VRBGA)B.3.1
蛋白陈
酵母浸膏
3号胆盐
葡萄糖
氯化钠
中性红
结晶紫
琼脂粉
蒸馏水
2制法
0.03g(或0.6%酒精溶液5mL)
0.002g(或0.1%水溶液2mL)
10.0g~12.0g
GB4789.41-—2016
将B.3.1成分溶于水中,加热煮沸至完全溶解,25℃时调节pH至7.4土0.2,分装于灭菌的锥形烧瓶中,不需高压灭菌,用前制备。倾注平板,使用前干燥平板。未干燥的平板5℃士3℃可存放两周。B.4
营养琼脂(NA)
牛肉浸膏
蛋白陈
琼脂粉
蒸馏水
10.0g~12.0g
将B.4.1成分溶于水中,加热煮沸,25℃时调节pH至7.3土0.2.121℃高压灭菌15min。倾注平板,使用前干燥平板。未干燥的平板于5℃士3℃可存放两周。B.5
葡萄糖琼脂
胰蛋白陈
酵母浸膏
葡萄糖
氯化钠
溴甲酚紫
琼脂粉
蒸馏水
0.015g(或0.4%溴甲酚紫酒精溶液3.75mL)10.0g~12.0g
将B.5.1成分溶于水中,加热煮沸,25℃时调节pH至7.0士0.2.分装于15mmX150mm试管,每管约5mL,121℃高压灭菌15min后,试管垂直放置。于5℃土3℃可存放1周。为去除培养基中的氧气,使用前可将葡萄糖琼脂试管置于沸水浴中15min,然后迅速冷却,备用。B.6
革兰氏染色液
结晶紫染色液
结晶紫
95%乙醇
1%草酸铵水溶液
B.6.1.2制法
将结晶紫完全溶解于乙醇中,然后与草酸铵溶液混合。B.6.2
革兰氏碘液
碘化钾
蒸馏水
B.6.2.2制法
GB4789.41-—2016
将碘和碘化钾先行混合,加入少许蒸馏水充分振摇,待完全溶解后,再加蒸馏水至300mL。B.6.3
沙黄复染液
B.6.3.1成分
95%乙醇
蒸馏水
将沙黄溶解于乙醇中,然后用蒸馏水稀释。B.6.4
染色方法
将涂片在火焰上固定,滴加结晶紫染色液,染1min,水洗滴加革兰氏碘液,作用1min,水洗。滴加95%乙醇脱色15s30s,直至染色液被洗掉,但不要过分脱色、水洗。加沙黄复染液,复染1min,水洗、干燥、镜检。革兰氏阳性菌呈紫色,革兰氏阴性菌呈红色。氧化酶试剂
N,NN',N'-四甲基对苯二胺盐酸盐蒸馏水
将B.7.1成分溶解于冷水中,少量新鲜配制B.7.3
试验方法
用细玻璃棒或一次性接种针挑去单个菌落,涂布在氧化酶试剂湿润的滤纸上。在10s内呈现粉红11
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
GB4789.41—2016
食品安全国家标准
食品微生物学检验
2016-08-31发布
肠杆菌科检验
2017-03-01实施
人民共和国
国家卫生和计划生育委员会
1范围
食品安全国家标准
食品微生物学检验
肠杆菌科检验
本标准规定了食品中肠杆菌科(Enterobacteriaceae)的检验方法。GB 4789.41—2016
本标准第一法适用于肠杆菌科含量较高的食品中肠杆菌科的计数;第二法适用于肠杆菌科含量较低食品中肠杆菌科的计数。
术语和定义
Enterobacteriaceae
肠杆菌科
在给定条件下发酵葡萄糖产酸、氧化酶阴性的需氧或兼性厌氧革兰氏阴性无芽胞杆菌。2.2
Enumeration of Enterobacteriaceae肠杆菌科计数
按本标准规定方法,对每克或每毫升检样中的肠杆菌科进行计数。2.3
最可能数
mostprobablenumber;MPN
基于泊松分布的一种间接计数方法。设备和材料
除微生物实验室常规灭菌及培养设备外,其他设备和材料如下:恒温培养箱:36℃士1℃。
冰箱:2℃~5℃。
水浴箱:46℃±1℃。
天平:感量0.1g。
显微镜:10倍100倍。
均质器。
振荡器。
无菌吸管:1mL(具0.01mL刻度)、10mL(具0.1mL刻度)或微量移液器及吸头。无菌锥形瓶或等效容器:容量150mL、500mL。无菌培养皿:直径90mm。
无菌试管:18mmX180mm、15mmX150mmpH计或pH比色管或精密pH试纸,培养基和试剂
缓冲蛋白陈水(BPW):见B.1。1
缓冲葡萄糖煌绿胆盐肉汤(EE肉汤):见B.2结晶紫中性红胆盐葡萄糖琼脂(VRBGA):见B.3。营养琼脂(NA):见B.4。
葡萄糖琼脂:见B.5。
革兰氏染色液:见B.6。
氧化酶试剂:见B.7。
无菌1mol/LNaOH:见B.8。
无菌1mol/LHCl:见B.9。
第一法肠杆菌科平板计数法
5检验程序
肠杆菌科平板计数法检验程序见图1。梭样
25 g(mT.)样品+225 ml. BPW,均质10倍系列稀秤
选择2个-3个适宜连续稀释度的样品匀滤,各收1ml分别加入无菌培养血内
每血中倾注1UmL~15mLVRBGA培荐基,泥匀36 ±1
24h±21
数,挑取典型菌落,接种」NA平板36 ℃+I℃
制萄摊发酵试验
18 h--24 h
氧化酶试验
亚好肠杆菌科菌落数
图1肠杆菌科平板计数法检验程序革汽长染色试验
GB4789.412016
6操作步骤
6.1样品的稀释
GB4789.41—2016
6.1.1固体和半固体样品:称取25g样品放入盛有225mLBPW的无菌均质杯中,8000r/min~10000r/min均质1min~2min,或放入盛有225mLBPw的无菌均质袋中,用拍击式均质器拍打1min~2min,制成1:10的样品匀液。6.1.2液体样品:以无菌吸管吸取25mL样品放人盛有225mLBPW的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中,充分混匀,制成1:10的样品匀液。6.1.3用1mL无菌吸管或微量移液器吸取1:10样品匀液1mL,沿管壁缓缓注入盛有9mLBPW的无菌试管中(注意吸管或吸头尖端不应触及稀释液面),振摇试管或换用1支1mL无菌吸管反复吹打,使其混合均匀,制成1:100的样品匀液。6.1.4按6.1.3操作程序,依次制成10倍递增系列稀释样品匀液。每递增稀释1次,换用1支1mL无菌吸管或吸头。从制备样品匀液至样品接种完毕,全过程不得超过15min。6.2倾注平板和培养
6.2.1根据对样品污染状况的估计及相关限量要求,选择2个~3个适宜的连续稀释度的样品匀液(液体样品可以选择原液),每个稀释度接种2个无菌平皿。同时,分别吸取1mLBPW加人两个无菌平Ⅲ内作为空白对照。
6.2.2将10mL~15mL冷却至46℃的VRBGA(可放置于46℃士1℃恒温水浴箱中保温)倾注于每个平血中。小心旋转平血,使样品匀液与培养基充分混匀。6.2.3待琼脂凝固后,倾注一薄层同样的培养基覆盖平板表层。防止蔓延生长并使菌落特征更为明显。
6.2.4待VRBGA平板上层琼脂凝固后翻转平板,36℃土1℃培养18h~24h。6.3典型菌落计数和确认
6.3.1肠杆菌科典型菌落为有或无沉淀环的粉红色至红色或紫色菌落。选取典型菌落数在15CFU~150CFU之间、无蔓延菌落生长的平板,只计数典型菌落数。菌落计数以菌落形成单位(colonyformingunits,CFU)表示
6.3.2其中一个平板有较大片状菌落生长时,则不宜采用,而应以无片状菌落生长的平板作为该稀释度的菌落数;若片状菌落不到平板的一半,而其余一半中菌落分布又很均匀,即可计算半个平板后乘以2.代表一个平板菌落数。
6.3.3当平板上出现菌落间无明显界线的链状生长时,则将每条单链作为一个菌落计数。6.3.4从每个平板上至少挑取5个(小于5个全选)典型菌落进行确认,如果有不同形态的典型菌落,则每种形态分别至少挑取1个菌落进行确认。6.3.5典型菌落的确认:
a)分别将所挑选的每一个菌落,划线于营养琼脂平板,36℃士1℃培养18h24h,挑取平板上的菌落进行革兰氏染色镜检、氧化酶试验及葡萄糖发酵试验。b)革兰氏染色镜检:肠杆菌科为革兰氏阴性杆菌,无芽孢,大小为(0.3~1.0)um×(1.0~6.0)μm。
c)氧化酶试验:用铂/铱接种环或玻璃棒(不要用镍铬接种环)挑取单个菌落涂于浸湿氧化酶试剂的滤纸上,滤纸的颜色在10s内变成蓝紫色,判为阳性反应。GB4789.41—2016
葡萄糖发酵试验:用接种针挑取少许氧化酶阴性的同一个菌落,穿刺于葡萄糖琼脂内,于36℃土d
1℃培养24h士2h,若试管内的内容物变为黄色,判为阳性反应。6.4结果的计算
6.4.1一般原则
若有两个连续稀释度的平板典型菌落数在适宜计数范围内,按式(1)计算,示例见A,1、A.2、A.3、A.4。
式中:
N-样品中肠杆菌科菌落数;
确证的肠杆菌科菌落数之和;
(n+0.1n2)d
第一稀释度(低稀释倍数)平板个数(含确证的肠杆菌科菌落);第二稀释度(高稀释倍数)平板个数(含确证的肠杆菌科菌落);稀释因子(第一稀释度)。
其中,a按式(2)计算:
式中:
确证的肠杆菌科菌落数;
某一平板中A个菌落中被确证为肠杆菌科的菌落数,b≤A;A一某一平板中用于确认试验的菌落数;C—某一平板中典型菌落总数。
6.4.2低菌落数
.....(1)
..(2)
若最低稀释度(包括液体样品原液)平板的典型菌落数均小于15CFU.具有确证的肠杆菌科菌落,则以确证的菌落数乘以最低稀释倍数计算若最低稀释度(包括液体样品原液)平板均无菌落生长,或典型菌落数均小于15CFU,且无确证的肠杆菌科菌落,则以小于1乘以最低稀释倍数计算。6.4.3特殊情况
第一稀释度平板上的典型菌落数均大于150CFU,且有确证的肠杆菌科菌落,以及第二稀释度平板上无确证的肠杆菌科菌落或典型菌落数不在15CFU~150CFU之间,则以确证的菌落数乘以第一稀释倍数计算,示例见A.5。
若所有稀释度的平板上典型菌落数均不在适宜计数范围内,且无确证的肠杆菌科菌落,则以小于1乘以最低稀释倍数计算。
7报告
7.1菌落数小于100时,以整数报告。7.2菌落数大于或等于100时,对第3位数字进行修约后,取前2位数字,后面用0代替位数;也可用10的指数形式来表示,采用两位有效数字。7.3数字修约按“四舍五入”原则进行。4
若所有平板上为蔓延菌落而无法计数,则报告菌落蔓延。7.5
若空白对照上有菌落生长,则此次检测结果无效,称重取样以CFU/g为单位报告,体积取样以CFU/mL为单位报告。7.6
第二法
检验程序
肠杆菌科MPN计数法
肠杆菌科MPN计数法检验程序见图2。绮样
25g(25)品+225BP,均质
10倍系列稀择
选择3个适宜连续稀择度的样品匀液,每个稀释度3管,共9管BPW
1ml.BP培荞物Www.bzxZ.net
36 ℃+1℃
10 rmf.T.F.肉汤
24h±2h
接种VRI3iA平板
36 ℃+1℃
24h±2h
疑菌落移[NA板
36 +I℃
简萄糖发酵试验
[ h--24 h
氧化酶试骏
EMPN表
图2肠杆菌科MPN计数法检验程序革兰民染色试验
GB4789.412016
9操作步骤
样品的稀释
按6.1进行。
9.2接种和培养
9.2.1非选择性前增菌
GB4789.41-—2016
根据对样品污染状况的估计及相关限量要求,选择3个适宜连续稀释度的样品匀液,每个稀释度3管,共9管BPW于36℃±1℃培养18h士2h。9.2.2选择性增菌
从BPW各培养管中,分别移取1mL培养物,接种于10mL的EE肉汤中,36℃土1℃培养24h土2h。
9.2.3分离
用接种环从EE各肉汤管中分别取培养物1环,划线接种于VRBGA平板,36℃土1℃培养24h土2h,观察平板上有无典型菌落
典型菌落的确认
典型菌落确认见6.3。
肠杆菌科为革兰氏阴性无芽胞杆菌,发酵葡萄糖产酸、氧化酶阴性。只要有1个菌落确认为肠杆菌科,其所代表的EE管即为肠杆菌科阳性,依据EE阳性管数查MPN表(见附录C),报告每克(毫升)样品中肠杆菌科的MPN值。称重取样以MPN/g为单位报告.体积取样以MPN/mL为单位报告。6
附录A
结果计算示例
GB4789.412016
A.1两个连续稀释度均含适宜的典型菌落数平板,并含有已确证的肠杆菌科菌落,数据见表A,1。表A.1
稀释度
典型菌落数/CFU
用于确认试验的菌落数/CFU
确证的菌落数/CFU
肠杆菌科平板计数结果示例1
等一稀释度)
1:100(第
4/5X126=101
5/5×145=145
101+145+16+14
【2+(0.1×2)×10-2
上述数据按7.2数字修约后,表示为13000或1.3×1041:1000(第二稀释度)
4/5×20=16
=12545
3/5×24=14
A.2两个连续稀释度均含适宜典型菌落数平板,其中某一稀释度的一个平板菌落数不在适宜范围内:或者两个稀释度各有一个平板菌落数不在适宜范围内,则相应的平板不作为计数平板,数据见表A.2。表A.2肠杆菌科平板计数结果示例2稀释度
典型菌落数/CFU
用于确认试验的菌落数/CFU
确证的菌落数/CFU
1:100(第一稀释度)
4/5X126=101
5/8×11874
101+74+16
[2+(0.1×1)]×10-2
上述数据按7.2数字修约后,表示为9100或9.1×103。191
1:1000(第二稀释度)
4/5×20=16
A.3两个连续稀释度均含适宜典型菌落数平板,其中一个平板无已确证的肠杆菌科菌落,则相应的平板不作为计数平板,数据见表A3表A.3
稀释度
典型菌落数/CFU
用于确认试验的菌落数/CFU
确证的菌落数/CFU
肠杆菌科平板计数结果示例3
1:100(第一稀释度)
4/5×126=101
6/6×118=118
101+118+16+0
[2+(0.1×1)]×10-2
上述数据按7.2数字修约后,表示为11000或1.1×10°1:1000(第二稀释度)
4/5×20=16
=11190
GB 4789.41—2016
A.4两个连续稀释度均含适宜典型菌落数平板,但无已确证的肠杆菌科菌落,则以小于1乘以最低稀释倍数计算
A.5第一稀释度平板上的菌落数超过150CFU,且有证实的肠杆菌科菌落,以及第二稀释度平板上无确证的肠杆菌科菌落或典型菌落数不在15CFU~150CFU之间,则以确证的菌落数乘以第一稀释倍数计算,数据见表A.5
稀释度
典型菌落数/CFU
用于确认试验的菌落数/CFU
确证的菌落数/CFU
(176+119)
肠杆菌科平板计数结果示例5
1:100(第一稀释度)
4/5×220=176
×102=14750
3/5X198=119
1:1000(第二稀释度)
缓冲蛋白陈水(BPW)
蛋白陈
氯化钠
磷酸氢二钠
磷酸二氢钾
蒸馏水
附录B
培养基和试剂
GB4789.41—2016
将B.1.1成分加热溶解,于25℃时调节pH至7.2士0.2.分装于500mL广口瓶中,每瓶225mL,121℃高压灭菌15min。
缓冲葡萄糖煌绿胆盐肉汤(EE肉汤)B.2.1成分
蛋白陈
葡萄糖
磷酸氢二钠(无水)
磷酸二氢钾
牛胆盐
蒸馏水
将B.2.1成分溶于水中,加热煮沸至完全溶解,加热不宜超过30min,迅速冷却培养基,于25℃调节pH至7.2土0.2.分装于灭菌的18mm×180mm试管中,每管10mL.不需高压灭菌.5℃土3℃可存放一个月。
结晶紫中性红胆盐葡萄糖琼脂(VRBGA)B.3.1
蛋白陈
酵母浸膏
3号胆盐
葡萄糖
氯化钠
中性红
结晶紫
琼脂粉
蒸馏水
2制法
0.03g(或0.6%酒精溶液5mL)
0.002g(或0.1%水溶液2mL)
10.0g~12.0g
GB4789.41-—2016
将B.3.1成分溶于水中,加热煮沸至完全溶解,25℃时调节pH至7.4土0.2,分装于灭菌的锥形烧瓶中,不需高压灭菌,用前制备。倾注平板,使用前干燥平板。未干燥的平板5℃士3℃可存放两周。B.4
营养琼脂(NA)
牛肉浸膏
蛋白陈
琼脂粉
蒸馏水
10.0g~12.0g
将B.4.1成分溶于水中,加热煮沸,25℃时调节pH至7.3土0.2.121℃高压灭菌15min。倾注平板,使用前干燥平板。未干燥的平板于5℃士3℃可存放两周。B.5
葡萄糖琼脂
胰蛋白陈
酵母浸膏
葡萄糖
氯化钠
溴甲酚紫
琼脂粉
蒸馏水
0.015g(或0.4%溴甲酚紫酒精溶液3.75mL)10.0g~12.0g
将B.5.1成分溶于水中,加热煮沸,25℃时调节pH至7.0士0.2.分装于15mmX150mm试管,每管约5mL,121℃高压灭菌15min后,试管垂直放置。于5℃土3℃可存放1周。为去除培养基中的氧气,使用前可将葡萄糖琼脂试管置于沸水浴中15min,然后迅速冷却,备用。B.6
革兰氏染色液
结晶紫染色液
结晶紫
95%乙醇
1%草酸铵水溶液
B.6.1.2制法
将结晶紫完全溶解于乙醇中,然后与草酸铵溶液混合。B.6.2
革兰氏碘液
碘化钾
蒸馏水
B.6.2.2制法
GB4789.41-—2016
将碘和碘化钾先行混合,加入少许蒸馏水充分振摇,待完全溶解后,再加蒸馏水至300mL。B.6.3
沙黄复染液
B.6.3.1成分
95%乙醇
蒸馏水
将沙黄溶解于乙醇中,然后用蒸馏水稀释。B.6.4
染色方法
将涂片在火焰上固定,滴加结晶紫染色液,染1min,水洗滴加革兰氏碘液,作用1min,水洗。滴加95%乙醇脱色15s30s,直至染色液被洗掉,但不要过分脱色、水洗。加沙黄复染液,复染1min,水洗、干燥、镜检。革兰氏阳性菌呈紫色,革兰氏阴性菌呈红色。氧化酶试剂
N,NN',N'-四甲基对苯二胺盐酸盐蒸馏水
将B.7.1成分溶解于冷水中,少量新鲜配制B.7.3
试验方法
用细玻璃棒或一次性接种针挑去单个菌落,涂布在氧化酶试剂湿润的滤纸上。在10s内呈现粉红11
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。