GB 4789.42-2016
基本信息
标准号: GB 4789.42-2016
中文名称:食品安全国家标准 食品微生物学检验 诺如病毒检验
标准类别:国家标准(GB)
标准状态:现行
出版语种:简体中文
下载格式:.rar .pdf
下载大小:391KB
相关标签: 食品安全 国家标准 食品 微生物学 检验 诺如 病毒

标准分类号
关联标准
出版信息
相关单位信息
标准简介
GB 4789.42-2016 食品安全国家标准 食品微生物学检验 诺如病毒检验
GB4789.42-2016
标准压缩包解压密码:www.bzxz.net
标准图片预览




标准内容
中华人民共和国国家标准
GB4789.42—2016
食品安全国家标准
食品微生物学检验
2016-12-23发布
诺如病毒检验
2017-06-23实施
中华人民共和国国家卫生和计划生育委员会国家食品药品监督管理总局
GB4789.42—2016
本标准代替SN/T1635—2005《贝类中诺沃克病毒检测方法普通RT-PCR方法和实时荧光RT
PCR方法》。
本标准与SN/T1635—2005相比,主要变化如下:标准名称修改为“食品安全国家标准食品微生物学检验诺如病毒检验”;
—一标准检测范围从“贝类”扩增为“食品”;修改“操作步骤”;
—增加“质量控制要求”,可参见附录C;删除“普通RT-PCR方法”。
1范围
食品安全国家标准
食品微生物学检验
诺如病毒检验
本标准规定了食品中诺如病毒(Norovirus)的实时荧光RT-PCR检测方法GB4789.42—2016
本标准适用于贝类,生食蔬菜.胡萝卜、瓜、坚果等硬质表面食品·草莓、西红柿、葡萄等软质水果等食品中诺如病毒核酸的检测。
设备和材料
除微生物实验室常规灭菌及培养设备外,其他设备和材料如下:2.1
实时荧光PCR仪。
冷冻离心机。
无菌刀片或等效均质器。
涡旋仪。
天平:感量为0.1g。
振荡器。
水浴锅。
离心机。
高压灭菌锅。
低温冰箱:-80℃。
微量移液器。
pH计或精密pH试纸
网状过滤袋:400mL。
无菌棉拭子。
无菌贝类剥刀。
橡胶垫。
无菌剪刀。bZxz.net
无菌钳子。
无菌培养Ⅲ。
无RNase玻璃容器:见E.1.2。
无RNase离心管、无RNase移液器吸嘴、无RNase药匙、无RNasePCR薄壁管:见E.1.3。3试剂
除有特殊说明外,所有实验用试剂均为分析纯;实验用水均为无RNase超纯水:见E.2.1。GI、GI基因型诺如病毒的引物、探针:见A.1。3.1
3.2过程控制病毒的引物、探针:见A.1。1
过程控制病毒:制备见附录C
外加扩增控制RNA:制备见附录D。Tris/甘氨酸/牛肉膏(TGBE)缓冲液:见E.2.2。GB4789.422016
5XPEG/NaCI溶液(500g/L聚乙二醇PEG8000,1.5mol/LNaCI):见E.2.3。磷酸盐缓冲液(PBS):见E.2.4。氯仿/正丁醇的混合液:见E.2.5。蛋白酶K溶液:见E.2.6。
75%乙醇:见E.2.7。
Trizol试剂:见E.2.8。
4检验程序
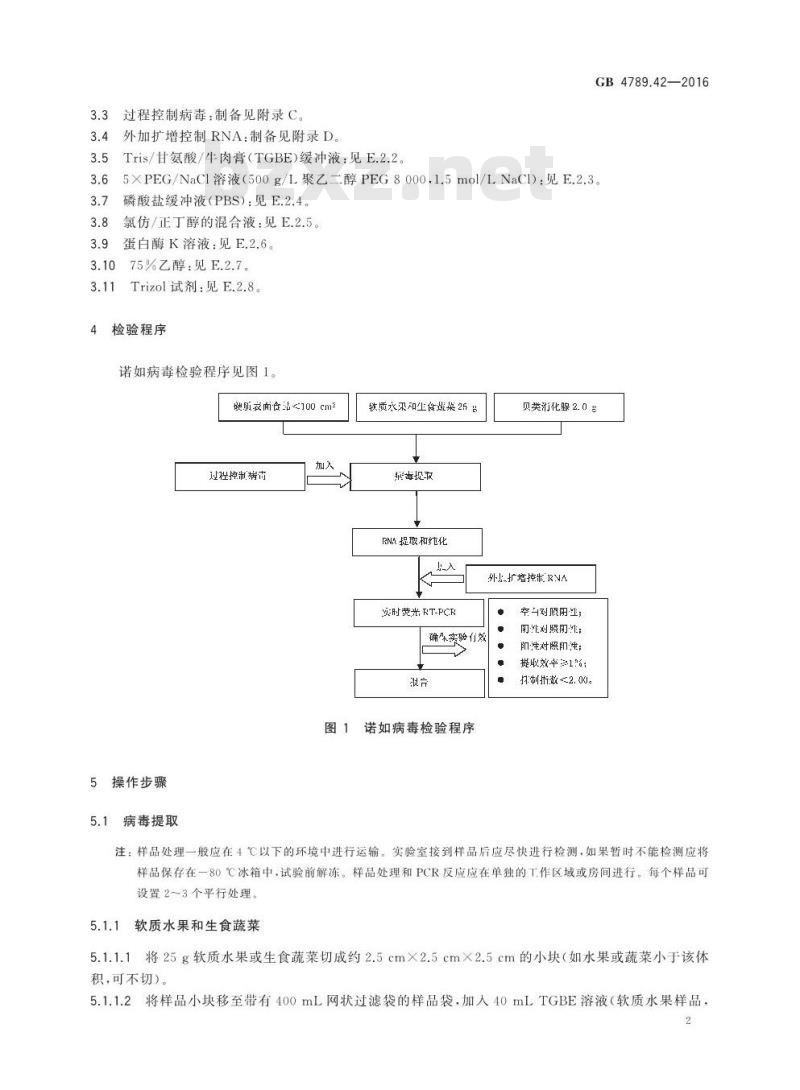
诺如病毒检验程序见图1。
缺所面食品100cm%
过程控制病市
5操作步骤
5.1病毒提取
铁质水采知生食煜果26
英捉斑
RN提取和纯化
实时荧光RT-PCF
确朵实验有效
诺如病毒检验程序
贝类消化腺2.0
外扩增控制RNA
空对限阴;
即注刘照即非:
即注对照即注:
提取效率1%:
扫制折数2.00。
注:样品处理一般应在4℃以下的环境中进行运输。实验室接到样品后应尽快进行检测,如果暂时不能检测应将样品保存在一80C冰箱中,试验前解冻。样品处理和PCR反应应在单独的T作区域或房间进行。每个样品可设置2~3个平行处理。
5.1.1软质水果和生食蔬菜
5.1.1.1将25g软质水果或生食蔬菜切成约2.5cm×2.5cm×2.5cm的小块(如水果或蔬菜小于该体积,可不切)。
5.1.1.2将样品小块移至带有400mL网状过滤袋的样品袋,加人40mLTGBE溶液(软质水果样品,2
GB4789.42—2016
需加人30UA.niger果胶酶,或114oUA.aculeatus果胶酶),加人10uL过程控制病毒5.1.1.3室温,60次/min,振荡20min。酸性软质水果需在振荡过程中,每隔10min检测pH,如pH低于9.0时,使用1mol/LNaOH调pH至9.5,每调整一次pH,延长振荡时间10min。5.1.1.4将振荡液转移至离心管,如体积较大,可使用2根离心管。10.000r/min,4℃.离心30min。取上清至干净试管或三角瓶,用1mol/LHCI调pH至7.0。5.1.1.5加人0.25倍体积5XPEG/NaCI溶液,使终溶液浓度为100g/LPEG.0.3mol/LNaCl。60s摇匀,4℃60次/min,振荡60min。10000r/min,4℃,离心30min,弃上清。10000r/min,4℃,离心5min紧实沉淀,弃上清。
5.1.1.6500uLPBS悬浮沉淀。如食品样品为生食蔬菜,可直接将悬浮液转移至干净试管,测定并记录悬浮液毫升数,用于后续RNA提取。如食品样品为软质水果,将悬浮液转移至耐氯仿试管中。加人500uL氯仿/丁醇混合液,涡旋混匀,室温静置5min。10.000r/min,4℃,离心15min,将液相部分仔细转移至干净试管,测定并记录悬浮液毫升数,用于后续RNA提取。5.1.2硬质表面食品
5.1.2.1将无菌棉拭子使用PBS湿润后,用力擦拭食品表面(<100cm)。记录擦拭面积。将10μL过程控制病毒添加至该棉拭子。5.1.2.2将棉拭子浸人含490μLPBS试管中,紧贴试管一侧挤压出液体。如此重复浸入和挤压3~4次,确保挤压出最大量的病毒,测定并记录液体毫升数,用于后续RNA提取。硬质食品表面过于粗糙,可能会损坏棉子,可使用多个棉拭子。5.1.3贝类
5.1.3.1戴上防护手套,使用无菌贝类剥刀打开至少10个贝类。5.1.3.2使用无菌剪刀、手术钳或其他等效器具在胶垫上解剖出贝类软体组织中的消化腺,置于干净培养血中。收集2.0g。
5.1.3.3使用无菌刀片或等效均质器将消化腺匀浆后,转移至离心管。加人10μL过程控制病毒。加人2.0mL蛋白酶K溶液,混勾。
5.1.3.4使用恒温摇床或等效装置,37℃,320次/min,振荡60min。5.1.3.5将试管放人水浴或等效装置,60℃,15min。室温,3000r/min,5min离心,将上清液转移至干净试管,测定并记录上清液mL数,用于后续RNA提取。5.2病毒RNA提取和纯化
注:病毒RNA可手工提取和纯化,也可使用商品化病毒RNA提取纯化试剂盒。提取完成后,为延长RNA保存时间可选择性加RNase抑制剂。操作过程中应佩戴一次性橡胶或乳胶手套,并经常更换。提取出来的RNA立即进行反应,或保存在4℃小于8h。如果长期储存建议一80℃保存。5.2.1病毒裂解
将病毒提取液加入离心管,加入病毒提取液等体积Trizol试剂,混匀,激烈振荡,室温放置5min,加入0.2倍体积氯仿,涡旋剧烈混匀30s(不能过于强烈,以免产生乳化层,也可用手颠倒混匀),12000r/min,离心5min,上层水相移人新离心管中,不能吸出中间层。5.2.2病毒RNA提取
离心管中加入等体积异丙醇,颠倒混匀,室温放置5min,12000r/min,离心5min,弃上清,倒置于吸水纸上,沾干液体(不同样品须在吸水纸不同地方沾干)。3
5.2.3病毒RNA纯化
5.2.3.1每次加人等体积75%乙醇,颠倒洗涤RNA沉淀2次。GB4789.42—2016
5.2.3.2于4℃,12000r/min,离心10min,小心弃上清.倒置于吸水纸上,活干液体(不同样品须在吸水纸不同地方沾干)。或小心倒去上清液,用微量加样器将其吸干,一份样本换用一个吸头,吸头不要碰到有沉淀.室温干燥3min,不能过于干燥,以免RNA不溶。5.2.3.3加人16uL无RNase超纯水,轻轻混匀,溶解管壁上的RNA,2000r/min,离心5s,冰上保存备用。
5.3质量控制
5.3.1空白对照
以无RNase超纯水作为空白对照(A反应孔)。5.3.2阴性对照
以不含有诺如病毒的贝类,提取RNA,作为阴性对照(B反应孔)。5.3.3阳性对照
以外加扩增控制RNA,作为阳性对照(J反应孔)。5.3.4过程控制病毒
5.3.4.1以食品中过程控制病毒RNA的提取效率表示食品中诺如病毒RNA的提取效率,作为病毒提取过程控制。
5.3.4.2将过程控制病毒按5.2步骤提取和纯化RNA。可大量提取.分装为10uL过程控制病毒的RNA量,一80℃保存,每次检测时取出使用,5.3.4.3将10uL过程控制病毒的RNA进行数次10倍梯度稀释(D~G反应孔),加人过程控制病毒引物、探针,采用与诺如病毒实时荧光RT-PCR反应相同的反应条件确定未稀释和梯度稀释过程病毒RNA的C值。
5.3.4.4以未稀释和梯度稀释过程控制病毒RNA的浓度1g值为X轴,以其C,值为Y轴,建立标准曲线;标准曲线2应≥0.98。未稀释过程控制病毒RNA浓度为1.梯度稀释过程控制RNA浓度分别为10-110-2、10-等。
5.3.4.5将含过程控制病毒食品样品RNA(C反应孔),加人过程控制病毒引物、探针,采用诺如病毒实时荧光RT-PCR反应相同的反应体系和参数,进行实时荧光RT-PCR反应.确定C.值,代人标准曲线,计算经过病毒提取等步骤后的过程控制病毒RNA浓度。5.3.4.6计算提取效率,提取效率=经病毒提取等步骤后的过程控制病毒RNA浓度X100%,即(C反应孔)C.值对应浓度×100%。5.3.5外加扩增控制
5.3.5.1通过外加扩增控制RNA,计算扩增抑制指数,作为扩增控制。5.3.5.2外加扩增控制RNA分别加入含过程控制病毒食品样品RNA(H反应孔)、10稀释的含过程控制病毒食品样品RNA(I反应孔)、无RNaSe超纯水(J反应孔),加人GI或GⅡ型引物探针,采用附录C反应体系和参数,进行实时荧光RT-PCR反应,确定C,值。5.3.5.3计算扩增抑制指数,抑制指数=(含过程控制病毒食品样品RNA十外加扩增控制RNA)C.值GB4789.42—2016
(无RNase超纯水十外加扩增控制RNA)C,值,即抑制指数=(H反应孔)C.值一(J反应孔)C,值。如抑制指数≥2.00,需比较10倍稀释食品样品的抑制指数,即抑制指数=(I反应孔)C,值一(J反应孔)C.值。
5.4实时荧光RT-PCR
实时荧光RT-PCR反应体系和反应参数详见附录B。反应体系中各试剂的量可根据具体情况或不同的反应总体积进行适当调整。可采用商业化实时荧光RT-PCR试剂盒。也可增加调整反应孔,实现一次反应完成GI和GⅡ型诺如病毒的独立检测。将18.5uL实时荧光RT-PCR反应体系添加至反应孔后,不同反应孔加人下述不同物质,检测GI或GⅡ基因型诺如病毒。A反应孔:空白对照,加人5uL无RNase超纯水十1.5uLGI或GⅡ型引物探针;B反应孔:阴性对照,加人5μL阴性提取对照RNA十1.5μLGI或GI型引物探针;C反应孔:病毒提取过程控制1加入5uL含过程控制病毒食品样品RNA十1.5uL过程控制病毒引物探针;
D反应孔:病毒提取过程控制2,加入5μL过程控制病毒RNA+1.5μL过程控制病毒引物探针;E反应孔:病毒提取过程控制3,加人5μL10-1倍稀释过程控制病毒RNA十1.5μL过程控制病毒引物探针;
F反应孔:病毒提取过程控制4.加入5uL.10-2倍稀释过程控制病毒RNA十1.5uL过程控制病毒引物探针;
G反应孔:病毒提取过程控制5.加入5μL10-3倍稀释过程控制病毒RNA十1.5uL过程控制病毒引物探针;
H反应孔:扩增控制1.加入5uL含过程控制病毒食品样品RNA十1μL外加扩增控制RNA+1.5uLGI或GI型引物探针;
I反应孔:扩增控制2,加人5μL10-1倍稀释的含过程控制病毒食品样品RNA+1μL外加扩增控制RNA+1.5LGI或GI型引物探针:J反应孔:扩增控制3/阳性对照,加人5uL无RNase超纯水+1μL外加扩增控制RNA+1.5μLGI或GI型引物探针;
K反应孔:样品1.加人5μL含过程控制病毒食品样品RNA+1.5uLGI或GⅡ型引物探针;L反应孔:样品2,加入5uL10-1倍稀释的含过程控制病毒食品样品RNA+1.5uLGI或GⅡ型引物探针。
6结果与报告
6.1检测有效性判定
6.1.1需满足以下质量控制要求,检测方有效:空白对照阴性(A反应孔);阴性对照阴性(B反应孔);阳性对照(反应孔)阳性
6.1.2过程控制(C~G反应孔)需满足:提取效率≥1%:如提取效率<1%需重新检测;但如提取效率<1%,检测结果为阳性,也可酌情判定为阳性6.1.3扩增控制(H~J反应孔)需满足:抑制指数<2.00;如抑制指数≥2.00,需比较10倍稀释食品样品的抑制指数;如10倍稀释食品样品扩增的抑制指数<2.00,则扩增有效,且需采用10倍稀释食品样品RNA的C,值作为结果;10倍稀释食品样品扩增的抑制指数也2.00时扩增可能无效,需要重新检测;但如抑制指数≥2.00,检测结果为阳性,也可酌情判定为阳性。5
结果判定
GB 4789.42—2016
待测样品的C,值大于等于45时,判定为诺如病毒阴性;待测样品的C,值小于等于38时,判定为诺如病毒阳性;待测样品的C值大于38,小于45时,应重新检测;重新检测结果大于等于45时,判定为诺如病毒阴性;小于等于38时,判定为诺如病毒阳性。6.3报告
根据检测结果,报告“检出诺如病毒基因”或“未检出诺如病毒基因”6
附录A
实时荧光RT-PCR引物和探针
GI、GⅡ型诺如病毒实时荧光RT-PCR引物和探针见表A,1表A.1GI、GI型诺如病毒实时荧光RT-PCR引物和探针病毒
QNIF4(上游引物):5'-CGCTGGATGCGNTTCCAT-3';NVILCR(下游引物):5'-CCT TAG ACG CCA TCA TCA TTT AC-3';NVGGIp(探针):5'-FAM-TGGACAGGAGAYCGCRATCTTAMRA-3
QNIF2(上游引物):5'-ATG TTC AGR TGG ATG AGR TTC TCW GA-3';COG2R(下游引物):5°-TCGACGCCATCTTCATTCACA-3”;QNIFs(探针):5-FAM-AGCACGTGGGAGGGC GATGG
TAMRA-3'
扩增产物
长度/bp
GB4789.42—2016
序列位置
位于诺如病毒(GenBank登
录号m87661)的5291~
位于Lordsdale病毒(GenBank
登录号x86557)的5012~
附录B
实时荧光RT-PCR的反应体系和参数实时荧光RT-PCR反应体系见表B.1。表B.1
RT-PCR缓冲溶液
正义引物
反义引物
转录酶
DNA聚合酶
RNA模板
水(无RNase)
总体积
储存液浓度
25mmol/L
10mmol/L
50μmol/l
50μmol/L
5U/μL
5U/μl
5μmol/L
实时荧光RT-PCR反应体系
终浓度
1mmol/L
0.2mmol/L
1 pemol/L
1umol/L
0.1μmol/L
实时荧光RT-PCR反应参数见表B.2。表B.2
实时荧光RT-PCR反应参数
温度和时间
95℃5min
95℃,15s
退火延伸
60℃.1min
65℃,1min
GB4789.42—2016
加样量/μL
过程控制病毒
循环数
C.1概要
附录C
过程控制病毒培养及引物、探针GB4789.42—2016
本标准使用过程控制病毒进行过程控制,可使用门哥病毒或其他等效,不与诺如病毒交叉反应的病毒。门哥病毒是小核糖核酸病毒科的鼠病毒。门哥病毒株MCO是一种重组病毒,与野生型门哥病毒相比缺乏poly[C].是与野生型门哥病毒具有相似生长特性的无毒表型。门哥病毒株MCO是一种转基因生物,如果检测实验室不允许使用转基因生物,可以使用其他的过程控制病毒。也可使用商业化试剂或试剂盒中的过程控制病毒,
C.2培养试剂和仪器
C.2.1HeLa细胞
推荐使用Eagle最低必需培养液(Eaglesminimumessentialmedium,MEM)培养,并将2mmol/LL-谷氨酸和Earle'sBSS调为1.5g/L碳酸氢钠,0.1mmol/L非必需氨基酸,1.0mmol/L丙酮酸钠1×链霉素/青霉素液,100mL/L(生长)或20mL/L(维持)胎牛血清2仪器
为确保细胞培养和病毒生长,需细胞培养所需的CO,浓度可调培养箱,细菌培养耗材(例如培养血)等。
C.3培养过程
门哥病毒培养在铺满80%~90%单层HeLa(ATCCCCL-2TM)细胞中,置于50mL/LCO的气氛中(开放培养箱)或不可调的气氛中(封闭培养箱),直至75%出现细胞病理效应。细胞培养器皿经过一个冻融循环,将培养物3000r/min离心10min。将细胞培养物离心上清留存用于过程控制C.4引物、探针
过程控制病毒(门哥病毒)实时荧光RT-PCR的引物、探针见表C.1。采用其他等效的过程控制病毒需对应调整引物探针。
表C.1过程控制病毒(门哥病毒)实时荧光RT-PCR的引物、探针病毒
Mengo11o(上游引物):5'-GCGGGTCCTGCCGAAAGT-3Mengo209(下游引物):5-GAAGTAACATATAGACAGACGCACAC-3
Mengo147(探针):5'-FAM-ATCACATTACTGGCCGAAGC-MGBNFQ-3
扩增产物
长度/bp
序列位置
位于门哥病毒缺失毒株
MC0(详见附录D)的110~
209;相当于门哥病毒非缺失
毒株M(GenBank登录号
122089)的序列110~270
D.1概要
附录D
外加扩增控制RNA制备!
GB 4789.42—2016
通过将目标DNA序列连接至合适的质粒载体上,目标序列位于RNA聚合酶启动子序列的下游序列,从而表达出外部扩增控制RNA。GI型外部扩增RNA序列位于诺如病毒(GenBank登录号m87661)的5291~5376。GⅡ型外部扩增RNA序列位于Lordsdale病毒(GenBank登录号x86557)的5012~5100。
试剂和设备
限制性酶:用于连接及相关的缓冲液。DNA纯化试剂。
体外RNA转录试剂(RNA聚合酶,NTPs,缓冲液等)。RNase-free DNase.
RNA纯化试剂。
DNA凝胶电泳试剂和设备。
培养箱:37℃。
质粒DNA连接
添加100ng~500ng纯化的目标DNA和质粒载体加人含有合适的限制酶和缓冲液的反应体系中,限制酶和缓冲液的使用按照酶厂家推荐,并确保目标序列位于质粒中RNA聚合酶启动子序列的下游。37℃培养120min。DNA纯化使用DNA纯化试剂纯化。使用凝胶电泳检查连接情况.比较连接前与连接后目标DNA和质粒情况,外加扩增控制RNA的表达
添加连接后的质粒至转化体系。该体系按照转化体系提供厂家建议配置。使用RNA纯化试剂纯化RNA后,分装,一80℃储存,每次检测前取出备用。可使用等效的商业化检测试剂盒中的外加扩增控制RNA储备液,或者请生物公司代为制备1)
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
GB4789.42—2016
食品安全国家标准
食品微生物学检验
2016-12-23发布
诺如病毒检验
2017-06-23实施
中华人民共和国国家卫生和计划生育委员会国家食品药品监督管理总局
GB4789.42—2016
本标准代替SN/T1635—2005《贝类中诺沃克病毒检测方法普通RT-PCR方法和实时荧光RT
PCR方法》。
本标准与SN/T1635—2005相比,主要变化如下:标准名称修改为“食品安全国家标准食品微生物学检验诺如病毒检验”;
—一标准检测范围从“贝类”扩增为“食品”;修改“操作步骤”;
—增加“质量控制要求”,可参见附录C;删除“普通RT-PCR方法”。
1范围
食品安全国家标准
食品微生物学检验
诺如病毒检验
本标准规定了食品中诺如病毒(Norovirus)的实时荧光RT-PCR检测方法GB4789.42—2016
本标准适用于贝类,生食蔬菜.胡萝卜、瓜、坚果等硬质表面食品·草莓、西红柿、葡萄等软质水果等食品中诺如病毒核酸的检测。
设备和材料
除微生物实验室常规灭菌及培养设备外,其他设备和材料如下:2.1
实时荧光PCR仪。
冷冻离心机。
无菌刀片或等效均质器。
涡旋仪。
天平:感量为0.1g。
振荡器。
水浴锅。
离心机。
高压灭菌锅。
低温冰箱:-80℃。
微量移液器。
pH计或精密pH试纸
网状过滤袋:400mL。
无菌棉拭子。
无菌贝类剥刀。
橡胶垫。
无菌剪刀。bZxz.net
无菌钳子。
无菌培养Ⅲ。
无RNase玻璃容器:见E.1.2。
无RNase离心管、无RNase移液器吸嘴、无RNase药匙、无RNasePCR薄壁管:见E.1.3。3试剂
除有特殊说明外,所有实验用试剂均为分析纯;实验用水均为无RNase超纯水:见E.2.1。GI、GI基因型诺如病毒的引物、探针:见A.1。3.1
3.2过程控制病毒的引物、探针:见A.1。1
过程控制病毒:制备见附录C
外加扩增控制RNA:制备见附录D。Tris/甘氨酸/牛肉膏(TGBE)缓冲液:见E.2.2。GB4789.422016
5XPEG/NaCI溶液(500g/L聚乙二醇PEG8000,1.5mol/LNaCI):见E.2.3。磷酸盐缓冲液(PBS):见E.2.4。氯仿/正丁醇的混合液:见E.2.5。蛋白酶K溶液:见E.2.6。
75%乙醇:见E.2.7。
Trizol试剂:见E.2.8。
4检验程序
诺如病毒检验程序见图1。
缺所面食品100cm%
过程控制病市
5操作步骤
5.1病毒提取
铁质水采知生食煜果26
英捉斑
RN提取和纯化
实时荧光RT-PCF
确朵实验有效
诺如病毒检验程序
贝类消化腺2.0
外扩增控制RNA
空对限阴;
即注刘照即非:
即注对照即注:
提取效率1%:
扫制折数2.00。
注:样品处理一般应在4℃以下的环境中进行运输。实验室接到样品后应尽快进行检测,如果暂时不能检测应将样品保存在一80C冰箱中,试验前解冻。样品处理和PCR反应应在单独的T作区域或房间进行。每个样品可设置2~3个平行处理。
5.1.1软质水果和生食蔬菜
5.1.1.1将25g软质水果或生食蔬菜切成约2.5cm×2.5cm×2.5cm的小块(如水果或蔬菜小于该体积,可不切)。
5.1.1.2将样品小块移至带有400mL网状过滤袋的样品袋,加人40mLTGBE溶液(软质水果样品,2
GB4789.42—2016
需加人30UA.niger果胶酶,或114oUA.aculeatus果胶酶),加人10uL过程控制病毒5.1.1.3室温,60次/min,振荡20min。酸性软质水果需在振荡过程中,每隔10min检测pH,如pH低于9.0时,使用1mol/LNaOH调pH至9.5,每调整一次pH,延长振荡时间10min。5.1.1.4将振荡液转移至离心管,如体积较大,可使用2根离心管。10.000r/min,4℃.离心30min。取上清至干净试管或三角瓶,用1mol/LHCI调pH至7.0。5.1.1.5加人0.25倍体积5XPEG/NaCI溶液,使终溶液浓度为100g/LPEG.0.3mol/LNaCl。60s摇匀,4℃60次/min,振荡60min。10000r/min,4℃,离心30min,弃上清。10000r/min,4℃,离心5min紧实沉淀,弃上清。
5.1.1.6500uLPBS悬浮沉淀。如食品样品为生食蔬菜,可直接将悬浮液转移至干净试管,测定并记录悬浮液毫升数,用于后续RNA提取。如食品样品为软质水果,将悬浮液转移至耐氯仿试管中。加人500uL氯仿/丁醇混合液,涡旋混匀,室温静置5min。10.000r/min,4℃,离心15min,将液相部分仔细转移至干净试管,测定并记录悬浮液毫升数,用于后续RNA提取。5.1.2硬质表面食品
5.1.2.1将无菌棉拭子使用PBS湿润后,用力擦拭食品表面(<100cm)。记录擦拭面积。将10μL过程控制病毒添加至该棉拭子。5.1.2.2将棉拭子浸人含490μLPBS试管中,紧贴试管一侧挤压出液体。如此重复浸入和挤压3~4次,确保挤压出最大量的病毒,测定并记录液体毫升数,用于后续RNA提取。硬质食品表面过于粗糙,可能会损坏棉子,可使用多个棉拭子。5.1.3贝类
5.1.3.1戴上防护手套,使用无菌贝类剥刀打开至少10个贝类。5.1.3.2使用无菌剪刀、手术钳或其他等效器具在胶垫上解剖出贝类软体组织中的消化腺,置于干净培养血中。收集2.0g。
5.1.3.3使用无菌刀片或等效均质器将消化腺匀浆后,转移至离心管。加人10μL过程控制病毒。加人2.0mL蛋白酶K溶液,混勾。
5.1.3.4使用恒温摇床或等效装置,37℃,320次/min,振荡60min。5.1.3.5将试管放人水浴或等效装置,60℃,15min。室温,3000r/min,5min离心,将上清液转移至干净试管,测定并记录上清液mL数,用于后续RNA提取。5.2病毒RNA提取和纯化
注:病毒RNA可手工提取和纯化,也可使用商品化病毒RNA提取纯化试剂盒。提取完成后,为延长RNA保存时间可选择性加RNase抑制剂。操作过程中应佩戴一次性橡胶或乳胶手套,并经常更换。提取出来的RNA立即进行反应,或保存在4℃小于8h。如果长期储存建议一80℃保存。5.2.1病毒裂解
将病毒提取液加入离心管,加入病毒提取液等体积Trizol试剂,混匀,激烈振荡,室温放置5min,加入0.2倍体积氯仿,涡旋剧烈混匀30s(不能过于强烈,以免产生乳化层,也可用手颠倒混匀),12000r/min,离心5min,上层水相移人新离心管中,不能吸出中间层。5.2.2病毒RNA提取
离心管中加入等体积异丙醇,颠倒混匀,室温放置5min,12000r/min,离心5min,弃上清,倒置于吸水纸上,沾干液体(不同样品须在吸水纸不同地方沾干)。3
5.2.3病毒RNA纯化
5.2.3.1每次加人等体积75%乙醇,颠倒洗涤RNA沉淀2次。GB4789.42—2016
5.2.3.2于4℃,12000r/min,离心10min,小心弃上清.倒置于吸水纸上,活干液体(不同样品须在吸水纸不同地方沾干)。或小心倒去上清液,用微量加样器将其吸干,一份样本换用一个吸头,吸头不要碰到有沉淀.室温干燥3min,不能过于干燥,以免RNA不溶。5.2.3.3加人16uL无RNase超纯水,轻轻混匀,溶解管壁上的RNA,2000r/min,离心5s,冰上保存备用。
5.3质量控制
5.3.1空白对照
以无RNase超纯水作为空白对照(A反应孔)。5.3.2阴性对照
以不含有诺如病毒的贝类,提取RNA,作为阴性对照(B反应孔)。5.3.3阳性对照
以外加扩增控制RNA,作为阳性对照(J反应孔)。5.3.4过程控制病毒
5.3.4.1以食品中过程控制病毒RNA的提取效率表示食品中诺如病毒RNA的提取效率,作为病毒提取过程控制。
5.3.4.2将过程控制病毒按5.2步骤提取和纯化RNA。可大量提取.分装为10uL过程控制病毒的RNA量,一80℃保存,每次检测时取出使用,5.3.4.3将10uL过程控制病毒的RNA进行数次10倍梯度稀释(D~G反应孔),加人过程控制病毒引物、探针,采用与诺如病毒实时荧光RT-PCR反应相同的反应条件确定未稀释和梯度稀释过程病毒RNA的C值。
5.3.4.4以未稀释和梯度稀释过程控制病毒RNA的浓度1g值为X轴,以其C,值为Y轴,建立标准曲线;标准曲线2应≥0.98。未稀释过程控制病毒RNA浓度为1.梯度稀释过程控制RNA浓度分别为10-110-2、10-等。
5.3.4.5将含过程控制病毒食品样品RNA(C反应孔),加人过程控制病毒引物、探针,采用诺如病毒实时荧光RT-PCR反应相同的反应体系和参数,进行实时荧光RT-PCR反应.确定C.值,代人标准曲线,计算经过病毒提取等步骤后的过程控制病毒RNA浓度。5.3.4.6计算提取效率,提取效率=经病毒提取等步骤后的过程控制病毒RNA浓度X100%,即(C反应孔)C.值对应浓度×100%。5.3.5外加扩增控制
5.3.5.1通过外加扩增控制RNA,计算扩增抑制指数,作为扩增控制。5.3.5.2外加扩增控制RNA分别加入含过程控制病毒食品样品RNA(H反应孔)、10稀释的含过程控制病毒食品样品RNA(I反应孔)、无RNaSe超纯水(J反应孔),加人GI或GⅡ型引物探针,采用附录C反应体系和参数,进行实时荧光RT-PCR反应,确定C,值。5.3.5.3计算扩增抑制指数,抑制指数=(含过程控制病毒食品样品RNA十外加扩增控制RNA)C.值GB4789.42—2016
(无RNase超纯水十外加扩增控制RNA)C,值,即抑制指数=(H反应孔)C.值一(J反应孔)C,值。如抑制指数≥2.00,需比较10倍稀释食品样品的抑制指数,即抑制指数=(I反应孔)C,值一(J反应孔)C.值。
5.4实时荧光RT-PCR
实时荧光RT-PCR反应体系和反应参数详见附录B。反应体系中各试剂的量可根据具体情况或不同的反应总体积进行适当调整。可采用商业化实时荧光RT-PCR试剂盒。也可增加调整反应孔,实现一次反应完成GI和GⅡ型诺如病毒的独立检测。将18.5uL实时荧光RT-PCR反应体系添加至反应孔后,不同反应孔加人下述不同物质,检测GI或GⅡ基因型诺如病毒。A反应孔:空白对照,加人5uL无RNase超纯水十1.5uLGI或GⅡ型引物探针;B反应孔:阴性对照,加人5μL阴性提取对照RNA十1.5μLGI或GI型引物探针;C反应孔:病毒提取过程控制1加入5uL含过程控制病毒食品样品RNA十1.5uL过程控制病毒引物探针;
D反应孔:病毒提取过程控制2,加入5μL过程控制病毒RNA+1.5μL过程控制病毒引物探针;E反应孔:病毒提取过程控制3,加人5μL10-1倍稀释过程控制病毒RNA十1.5μL过程控制病毒引物探针;
F反应孔:病毒提取过程控制4.加入5uL.10-2倍稀释过程控制病毒RNA十1.5uL过程控制病毒引物探针;
G反应孔:病毒提取过程控制5.加入5μL10-3倍稀释过程控制病毒RNA十1.5uL过程控制病毒引物探针;
H反应孔:扩增控制1.加入5uL含过程控制病毒食品样品RNA十1μL外加扩增控制RNA+1.5uLGI或GI型引物探针;
I反应孔:扩增控制2,加人5μL10-1倍稀释的含过程控制病毒食品样品RNA+1μL外加扩增控制RNA+1.5LGI或GI型引物探针:J反应孔:扩增控制3/阳性对照,加人5uL无RNase超纯水+1μL外加扩增控制RNA+1.5μLGI或GI型引物探针;
K反应孔:样品1.加人5μL含过程控制病毒食品样品RNA+1.5uLGI或GⅡ型引物探针;L反应孔:样品2,加入5uL10-1倍稀释的含过程控制病毒食品样品RNA+1.5uLGI或GⅡ型引物探针。
6结果与报告
6.1检测有效性判定
6.1.1需满足以下质量控制要求,检测方有效:空白对照阴性(A反应孔);阴性对照阴性(B反应孔);阳性对照(反应孔)阳性
6.1.2过程控制(C~G反应孔)需满足:提取效率≥1%:如提取效率<1%需重新检测;但如提取效率<1%,检测结果为阳性,也可酌情判定为阳性6.1.3扩增控制(H~J反应孔)需满足:抑制指数<2.00;如抑制指数≥2.00,需比较10倍稀释食品样品的抑制指数;如10倍稀释食品样品扩增的抑制指数<2.00,则扩增有效,且需采用10倍稀释食品样品RNA的C,值作为结果;10倍稀释食品样品扩增的抑制指数也2.00时扩增可能无效,需要重新检测;但如抑制指数≥2.00,检测结果为阳性,也可酌情判定为阳性。5
结果判定
GB 4789.42—2016
待测样品的C,值大于等于45时,判定为诺如病毒阴性;待测样品的C,值小于等于38时,判定为诺如病毒阳性;待测样品的C值大于38,小于45时,应重新检测;重新检测结果大于等于45时,判定为诺如病毒阴性;小于等于38时,判定为诺如病毒阳性。6.3报告
根据检测结果,报告“检出诺如病毒基因”或“未检出诺如病毒基因”6
附录A
实时荧光RT-PCR引物和探针
GI、GⅡ型诺如病毒实时荧光RT-PCR引物和探针见表A,1表A.1GI、GI型诺如病毒实时荧光RT-PCR引物和探针病毒
QNIF4(上游引物):5'-CGCTGGATGCGNTTCCAT-3';NVILCR(下游引物):5'-CCT TAG ACG CCA TCA TCA TTT AC-3';NVGGIp(探针):5'-FAM-TGGACAGGAGAYCGCRATCTTAMRA-3
QNIF2(上游引物):5'-ATG TTC AGR TGG ATG AGR TTC TCW GA-3';COG2R(下游引物):5°-TCGACGCCATCTTCATTCACA-3”;QNIFs(探针):5-FAM-AGCACGTGGGAGGGC GATGG
TAMRA-3'
扩增产物
长度/bp
GB4789.42—2016
序列位置
位于诺如病毒(GenBank登
录号m87661)的5291~
位于Lordsdale病毒(GenBank
登录号x86557)的5012~
附录B
实时荧光RT-PCR的反应体系和参数实时荧光RT-PCR反应体系见表B.1。表B.1
RT-PCR缓冲溶液
正义引物
反义引物
转录酶
DNA聚合酶
RNA模板
水(无RNase)
总体积
储存液浓度
25mmol/L
10mmol/L
50μmol/l
50μmol/L
5U/μL
5U/μl
5μmol/L
实时荧光RT-PCR反应体系
终浓度
1mmol/L
0.2mmol/L
1 pemol/L
1umol/L
0.1μmol/L
实时荧光RT-PCR反应参数见表B.2。表B.2
实时荧光RT-PCR反应参数
温度和时间
95℃5min
95℃,15s
退火延伸
60℃.1min
65℃,1min
GB4789.42—2016
加样量/μL
过程控制病毒
循环数
C.1概要
附录C
过程控制病毒培养及引物、探针GB4789.42—2016
本标准使用过程控制病毒进行过程控制,可使用门哥病毒或其他等效,不与诺如病毒交叉反应的病毒。门哥病毒是小核糖核酸病毒科的鼠病毒。门哥病毒株MCO是一种重组病毒,与野生型门哥病毒相比缺乏poly[C].是与野生型门哥病毒具有相似生长特性的无毒表型。门哥病毒株MCO是一种转基因生物,如果检测实验室不允许使用转基因生物,可以使用其他的过程控制病毒。也可使用商业化试剂或试剂盒中的过程控制病毒,
C.2培养试剂和仪器
C.2.1HeLa细胞
推荐使用Eagle最低必需培养液(Eaglesminimumessentialmedium,MEM)培养,并将2mmol/LL-谷氨酸和Earle'sBSS调为1.5g/L碳酸氢钠,0.1mmol/L非必需氨基酸,1.0mmol/L丙酮酸钠1×链霉素/青霉素液,100mL/L(生长)或20mL/L(维持)胎牛血清2仪器
为确保细胞培养和病毒生长,需细胞培养所需的CO,浓度可调培养箱,细菌培养耗材(例如培养血)等。
C.3培养过程
门哥病毒培养在铺满80%~90%单层HeLa(ATCCCCL-2TM)细胞中,置于50mL/LCO的气氛中(开放培养箱)或不可调的气氛中(封闭培养箱),直至75%出现细胞病理效应。细胞培养器皿经过一个冻融循环,将培养物3000r/min离心10min。将细胞培养物离心上清留存用于过程控制C.4引物、探针
过程控制病毒(门哥病毒)实时荧光RT-PCR的引物、探针见表C.1。采用其他等效的过程控制病毒需对应调整引物探针。
表C.1过程控制病毒(门哥病毒)实时荧光RT-PCR的引物、探针病毒
Mengo11o(上游引物):5'-GCGGGTCCTGCCGAAAGT-3Mengo209(下游引物):5-GAAGTAACATATAGACAGACGCACAC-3
Mengo147(探针):5'-FAM-ATCACATTACTGGCCGAAGC-MGBNFQ-3
扩增产物
长度/bp
序列位置
位于门哥病毒缺失毒株
MC0(详见附录D)的110~
209;相当于门哥病毒非缺失
毒株M(GenBank登录号
122089)的序列110~270
D.1概要
附录D
外加扩增控制RNA制备!
GB 4789.42—2016
通过将目标DNA序列连接至合适的质粒载体上,目标序列位于RNA聚合酶启动子序列的下游序列,从而表达出外部扩增控制RNA。GI型外部扩增RNA序列位于诺如病毒(GenBank登录号m87661)的5291~5376。GⅡ型外部扩增RNA序列位于Lordsdale病毒(GenBank登录号x86557)的5012~5100。
试剂和设备
限制性酶:用于连接及相关的缓冲液。DNA纯化试剂。
体外RNA转录试剂(RNA聚合酶,NTPs,缓冲液等)。RNase-free DNase.
RNA纯化试剂。
DNA凝胶电泳试剂和设备。
培养箱:37℃。
质粒DNA连接
添加100ng~500ng纯化的目标DNA和质粒载体加人含有合适的限制酶和缓冲液的反应体系中,限制酶和缓冲液的使用按照酶厂家推荐,并确保目标序列位于质粒中RNA聚合酶启动子序列的下游。37℃培养120min。DNA纯化使用DNA纯化试剂纯化。使用凝胶电泳检查连接情况.比较连接前与连接后目标DNA和质粒情况,外加扩增控制RNA的表达
添加连接后的质粒至转化体系。该体系按照转化体系提供厂家建议配置。使用RNA纯化试剂纯化RNA后,分装,一80℃储存,每次检测前取出备用。可使用等效的商业化检测试剂盒中的外加扩增控制RNA储备液,或者请生物公司代为制备1)
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。