GB 5009.210-2016
基本信息
标准号: GB 5009.210-2016
中文名称:食品安全国家标准 食品中泛酸的测定
标准类别:国家标准(GB)
标准状态:现行
出版语种:简体中文
下载格式:.rar .pdf
下载大小:352KB

标准分类号
关联标准
出版信息
相关单位信息
标准简介
GB 5009.210-2016 食品安全国家标准 食品中泛酸的测定
GB5009.210-2016
标准压缩包解压密码:www.bzxz.net
标准图片预览




标准内容
中华人民共和国国家标准
GB5009.210—2016
食品安全国家标准
食品中泛酸的测定
2016-08-31发布
人民共和国
国家卫生和计划生育委员会
2017-03-01实施
本标准代替GB/T5009.210—2008《食品中泛酸的测定》。本标准与GB/T5009.210—2008相比,主要变化如下一标准名称修改为“食品安全国家标准食品中泛酸的测定”;增加了高效液相色谱方法;
修改了食品的前处理方法;
增加了检出限和定量限。
GB5009.210—2016
1范围
食品安全国家标准
食品中泛酸的测定
本标准规定了食品中泛酸和泛酸钙的测定方法GB5009.210—2016
本标准第一法适用于食品中泛酸的测定,第二法适用于营养素补充剂类保健食品和配方食品中泛酸(钙)的测定。
第一法
去微生物法
2原理
泛酸是植物乳杆菌Lactobacillusplantarum(ATCC8014)生长所必需的营养素,在一定控制条件下,将植物乳杆菌液接种至含有试样液的培养液中,培养一定时间后测定透光率(或吸光度值),根据泛酸含量与透光率或吸光度值)的标准曲线计算出试样中泛酸的含量。试剂和材料
除非另有说明,本方法所用试剂均为分析纯,水为GB/T6682规定的二级水3.1试剂
3.1.1盐酸(HCI)。
冰乙酸(C,H,O2)
氢氧化钠(NaOH)。
氯化钠(NaCI)。
碳酸钠(NazCO)。
碳酸氢钾(KHCO)。
磷酸氢二钾(K,HPO4)。
三水合乙酸钠(C,H.O,Na·3H,O)三水合磷酸二氢钾(KH,PO4·3H,O)。七水合硫酸镁(MgSO4·7HzO)。七水合硫酸亚铁(FeSO.·7H,O)。一水合硫酸锰(MnSO·H,O)。
三羟甲基氨基甲烷(C,HnNO,)。葡萄糖(CHiO。)。
甲苯(C,H)。
无水乙醇(C.H.O)。
阴离子交换树脂Dowex1×8:粒度38um~75um。1
3.1.18碱性磷酸酶:酶活力≥23U/g。3.1.19
GB5009.210—2016
鸽子肝脏丙酮提取物干粉(liveracetonepowder,frompigeon):酶活力≥o.1U/g:蛋白陈:含氮量≥10%。
酵母提取物:含氮量》10%。
2琼脂。
试剂配制
乙酸溶液(0.2mol/L):吸取11.8mL冰乙酸,用水稀释至1000mL,混匀。乙酸钠溶液(0.2mol/L):称取27.2g三水合乙酸钠加水溶解并稀释至1000mL.混匀。盐酸溶液(1mol/L):吸取83mL盐酸,加水稀释至1000mL,混匀。盐酸浸泡液:吸取100mL盐酸与50倍水混合。3.2.4
3.2.5氢氧化钠溶液(1mol/L):称取40g氢氧化钠,加水溶解并稀释至1000mL,混匀。3.2.6氢氧化钠溶液(0.1mol/L):称取4g氢氧化钠,加水溶解并稀释至1000mL,混勾。3.2.7Tris缓冲液:称取121.0g三羟甲基氨基甲烷溶于500mL水中,用冰乙酸调pH至8.1士0.1,加水至1000mL.混匀。贮存于2℃~4℃冰箱中,可保存2周。3.2.8生理盐水:称取9g氯化钠,加水溶解并稀释至1000mL,混匀。临用前预先灭菌,于121℃高压灭菌10min后备用。
3.2.9乙醇溶液(20%):量取200mL无水乙醇与800mL水混匀。3.2.10碳酸钠溶液(0.08mol/L):称取8.5g碳酸钠,加水溶解并稀释至1000mL.混匀。3.2.11
预冷。
碳酸氢钾溶液(0.02mol/L):称取2g碳酸氢钾,加水溶解并稀释至1000mL。混匀碱性磷酸酶溶液:称取2g碱性磷酸酶,加水溶解并稀释至100mL临用现配,2℃~4℃冰箱3鸽子肝脏提取液
3.2.13.1活化Dowex1×8:称取100gDowex1X8于锥形瓶中,加人1L盐酸溶液,置于振荡器上充分振摇10min,用铺有滤纸的布氏漏斗过滤。Dowex1×8转回锥形瓶,再加入1L盐酸溶液重复振摇、过滤。Dowex1X8加人1L水振摇10min,过滤,重复用水洗涤10次。逐滴加人Tris缓冲液调节Dowex1×8pH至8.0士0.1。2℃C~4℃冰箱保存2天内用完。3.2.13.2鸽子肝脏提取液:配制此试剂前一天将所用容器放人2℃~4℃冰箱中冷藏过夜。称取30g鸽子肝脏丙酮提取物干粉,放人研钵中,冰浴条件下分两次加入300mL碳酸氢钾溶液研磨至匀浆,转人具塞离心管中,盖好塞后充分振摇,一20℃冷冻10min后以3000r/min离心5min,将上清液转至500mL广口瓶中。加150g活化Dowex1×8.放人冰浴中混匀5min,将混合液倒人离心管中,3000r/min离心5min。将上清液移人另一500mL预冷的广口瓶中,一20℃冷冻10min,再加150g活化Dowex1×8.放人冰浴中混勾5min,将混合液倒入离心管中,3000r/min离心,将上清液分装于具塞试管中(每管大约3mL),一20℃冷冻保存。用前于2℃~4℃冰箱内化冻并保存至用时3.3培养基
3.3.1甲盐溶液:分别称取25g磷酸氢二钾和25g三水合磷酸二氢钾,加水溶解并稀释至500mL,混匀。加人1mL甲苯,2℃~4℃冰箱可保存1年。3.3.2乙盐溶液:分别称取10g七水合硫酸镁、0.5g氯化钠、0.5g七水合硫酸亚铁和0.5g一水合硫酸锰,加水溶解并稀释至500mL。加5滴盐酸,2℃~4℃冰箱可保存1年。3.3.3琼脂培养基:按表1称取或吸取各试剂,加水至100mL,混合,沸水浴加热至琼脂完全溶化。趁热用1mol/L盐酸溶液和/或1mol/L氢氧化钠溶液调节pH至6.8土0.1。尽快分装,根据试管内径粗细加人3mL~5mL,液面高度不得低于2cm。塞上棉塞,121℃高压灭菌15min。取出后试管直立放2
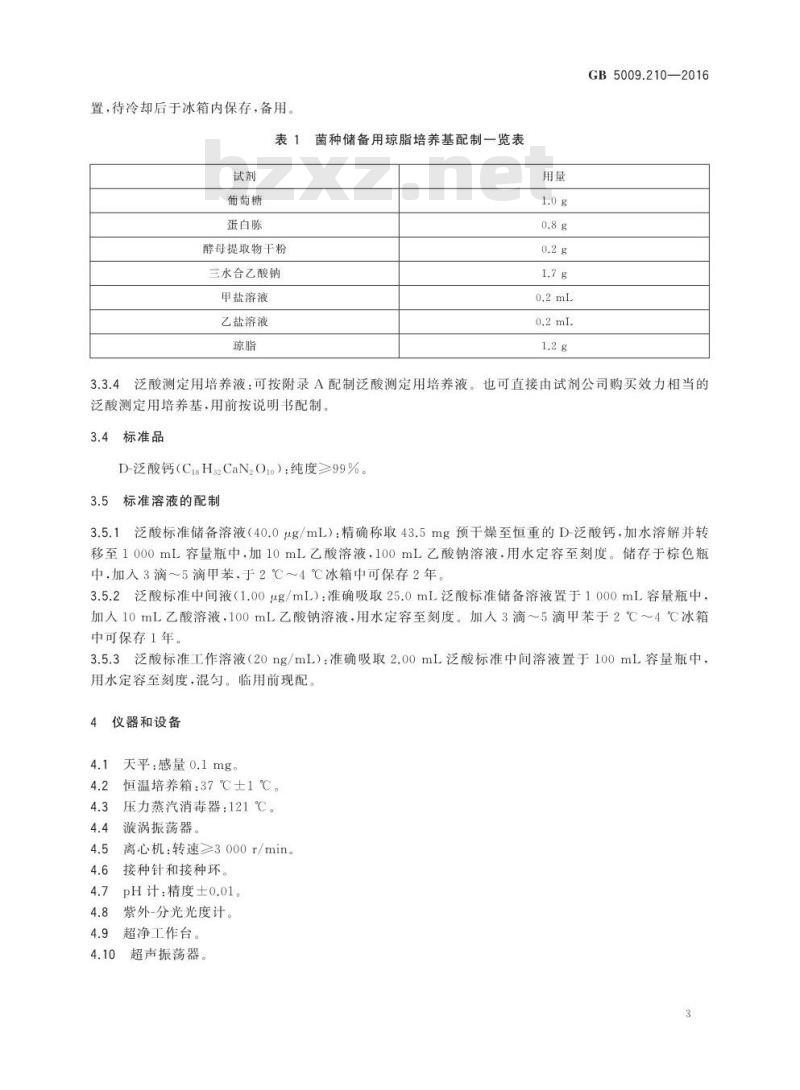
置,待冷却后于冰箱内保存,备用。表1菌种储备用琼脂培养基配制一览表试剂
葡萄糖
蛋白陈
酵母提取物干粉
三水合乙酸钠
甲盐溶液
乙盐溶液
GB5009.210—2016
3.3.4泛酸测定用培养液:可按附录A配制泛酸测定用培养液。也可直接由试剂公司购买效力相当的泛酸测定用培养基,用前按说明书配制。3.4标准品
D-泛酸钙(ClH32CaNzO1。):纯度≥99%。3.5标准溶液的配制
3.5.1泛酸标准储备溶液(40.0μg/mL):精确称取43.5mg预干燥至恒重的D-泛酸钙,加水溶解并转移至1000mL容量瓶中,加10mL乙酸溶液,100mL乙酸钠溶液.用水定容至刻度。储存于棕色瓶中,加入3滴~5滴甲苯,于2℃~4℃冰箱中可保存2年。3.5.2泛酸标准中间液(1.00μg/mL):准确吸取25.0mL泛酸标准储备溶液置于1000mL容量瓶中,加入10mL乙酸溶液,100mL乙酸钠溶液,用水定容至刻度。加人3滴~5滴甲苯于2℃~4℃冰箱中可保存1年。
3.5.3泛酸标准工作溶液(20ng/mL):准确吸取2.00mL泛酸标准中间溶液置于100mL容量瓶中,用水定容至刻度,混匀。临用前现配。4仪器和设备
天平:感量0.1mg。
恒温培养箱:37℃士1℃。
压力蒸汽消毒器:121℃。
漩涡振荡器。
离心机:转速≥3000r/min。
接种针和接种环。
pH计:精度士0.01。
紫外-分光光度计。
超净工作台。
超声振荡器
5菌种的制备与保存
5.1菌种
植物乳杆菌Lactobacillusplantarum(ATCC8014)。5.2储备菌种的制备
GB5009.210—2016
将菌种植物乳杆菌Lactobacillusplantarum(ATCC8014)转接至琼脂培养基中,在37℃土1℃恒温箱中培养20h~24h.连续传种2次~3次。取出后放人2℃~4℃冰箱作为储备菌株保存。每月至少传代一次,不宜超过25代。
试验前将储备菌株接种至琼脂培养基中,37℃士1℃恒温培养箱中培养20h~24h以活化菌株,用于接种液的制备。
注:保存数周以上的储备菌株,不能立即用作接种液制备,试验前宜连续传种2代~3代以保证细菌活力。5.3接种液的制备
试验前一天,取2mL泛酸标准工作溶液和4mL泛酸测定用培养液混勾,分装于2支5mL离心管中,塞好棉塞,于121℃高压灭菌15min后即为种子培养液。冷却后用接种环将活化的菌株转种至2支种子培养液中,于37℃士1℃恒温培养箱中培养20h~24h。取出后3.000r/min离心10min,弃上清液,无菌操作下用已预先灭菌的生理盐水淋洗2次,3000r/min离心10min,弃上清液。再加入3mL灭菌生理盐水,振荡混匀,制成接种液,立即使用。6分析步骤
注:所有操作均需避光进行
6.1试样制备
谷薯类、豆类、乳粉等试样需粉碎、研磨、过筛(筛板孔径0.3mm~0.5mm):肉、蛋、坚果等用勾质器制成食糜;果蔬、半固体食品等试样需匀浆混匀;液体试样用前振摇混合。4℃冰箱可保存1周6.2试样提取
6.2.1直接提取法
形态为颗粒、粉末、片剂、液体的营养素补充剂或强化剂、预混料,添加了泛酸钙的配方食品或保健食品可采用直接提取法。
准确称取适量试样(m)固体试样0.2g~2g:液态试样5g~10g,精确至0.001g,转人100mL锥形瓶中,加入80mL乙醇溶液,具塞,超声振摇提取4h以上至试样完全溶解,用水定容至100mLVi)。
6.2.2酶解法
一般谷薯类、肉蛋乳类、果蔬菌藻类、豆及坚果类等食品试样宜采用酶解提取法。6.2.2.1水解:准确称取适量试样(m,约含0.02mg~0.2mg泛酸),精确至0.001g。一般谷薯类、肉类、蛋类、豆类及其制品称取1g~5g;新鲜果蔬、乳及其制品称取5g~10g。转人至100mL锥形瓶中,加10mLTris缓冲液、40mL水,振荡混匀。于121℃高压条件下水解15min。冷却至室温,转移4
至100mL容量瓶中,用水定容至刻度(V),过滤GB5009.210—2016
6.2.2.2酶解:准确吸取适量试样滤液(1.0mL~10.0mL,V,)至25mL具塞刻度试管底部,补水至10mL,加5mLTris缓冲液。在冰浴条件下,依次小心加入预冷的0.1mL碳酸氢钠溶液,0.4mL碱性磷酸酶溶液、0.2mL鸽子肝脏提取液和0.4mL水。小心混匀试管,避免混合物黏附于试管壁,加1滴甲苯.37℃土1℃温箱中温育过夜(8h以上)。加水至20mL,用冰乙酸调节pH至4.5士0.1.加水定容至25.0mL(V).过滤。调节pH:吸取适量的试样酶解液(2.0mL~20.0mL,V4)于25mL具塞刻度试管中,加水至20mL.用0.1mol/L氢氧化钠溶液调节pH至6.8土0.1,用水定容至25.0mL(V,)。另取一试管加入5mLTris缓冲液和10mL水,同法加人碳酸氢钠溶液、碱性磷酸酶溶液、鸽子肝脏提取液酶液及温育过夜,并调节pH至6.8土0.1,用水定容至25.0mL作为酶空白液注:以谷物、乳粉等为基质的配方食品如需计量基质本底泛酸含量,可采用酶解法提取6.3稀释
根据试样中泛酸含量用水对试样提取液进行适当稀释(F),使稀释后试样提取液中泛酸浓度约为20ng/mLg
6.4测定系列管制备
所用试管使用前洗刷干净,用水煮沸30min,沥干后放人盐酸浸泡液中浸泡2h,经170℃烘3h后使用。
6.4.1试样和酶空白系列管
取4支试管,分别加人1.0mL、2.0mL、3.0mL、4.0mL试样提取液(V),补水至5.0mL.加人5.0mL泛酸测定用培养液,混匀。另取4支试管分别加入1.0mL、2.0mL、3.0mL、4.0mL酶空白液。6.4.2标准系列管
取试管分别加入泛酸标准工作溶液0.00mL、0.50mL、1.00mL、1.50mL、2.00mL、2.50mL、3.00mL3.50mL、4.00mL、4.50mL.5.00ml于试管中,补水至5.0mL,相当于标准系列管中泛酸含量为0ng、10ng、20ng、30ng、40ng、50ng、60ng、70ng、80ng、90ng、100ng泛酸.再加人5.0mL泛酸测定用培养液,混匀。为保证标准曲线的线性关系,应制备2套3套标准系列管,绘制标准曲线时,以每个标准点的均值计算。
6.5灭菌
将所有测定管塞好棉塞,于121℃高压灭菌15min。6.6接种和培养
待测定系列管冷却至室温后,在无菌操作条件下向每支测定管滴加接种液50L。塞好棉塞,置于37℃士1℃恒温培养箱中培养16h~20h,直至达到最大混浊度,即再培养2h后透光率(或吸光度值)无明显变化。另准备一支标准0管(含0ng泛酸)不接种作为0对照管6.7测定
将培养好的标准系列管、试样和酶空白系列管用漩涡混匀器混勾。用厚度为1cm比色杯,于550nm处,以未接种的0对照管调节透光率为100%(或吸光度值为0),依次测定标准系列管、试样和酶空白系列管的透光率(或吸光度值)。如果0对照管有明显的细菌增长,或者与0对照管相比,标准0管透光率在90%以下(或吸光度值在0.2以上);或标准系列管透光率最大变化量<40%(或吸光度值变5
化量04),说明可能有杂菌或不明来源的泛酸混人,需重做试验注:泛酸测定适宜的光谱范围540nm~660nm。6.8分析结果表述
GB5009.210—2016
6.8.1标准曲线:以标准系列管泛酸含量为横坐标,每个标准点透光率(或吸光度值)均值为纵坐标,绘制标准曲线
6.8.2试样结果计算:从标准曲线查得试样和酶空白系列管中泛酸的相应含量(e),如果每个试样的4支试样系列管中有3支以上泛酸含量在10ng~80ng范围内,且按照式(1)计算每毫升试样稀释液中泛酸浓度(),各管之间相对偏差小于15%,则可继续按式(2)或式(3)~式(5)进行结果计算,否则需重新取样测定
试样稀释液中泛酸浓度按式(1)计算:.(1)
式中:
试样稀释液中泛酸浓度.单位为纳克每毫升(ng/mL);从标准曲线上查得测定系列管中泛酸含量,单位为纳克(ng);制备试样系列管时吸取的试样稀释液体积,单位为毫升(mL)。采用直接提取法的试样中泛酸含量按式(2)计算:p×VXF100
式中:
(2)
试样中泛酸含量,固态试样单位为毫克每百克(mg/100g)液态试样为毫克每百毫升(mg/100mL);
试样稀释液泛酸浓度平均值,单位为纳克每毫升(ng/mL);试样提取液的定容体积,单位为毫升(mL):试样提取液稀释倍数;
试样质量,单位为克(g);
换算系数。
采用酶解法的试样中泛酸含量按式(3)~式(5)计算:mo=po×25
(mxm)×Vi×100
式中:
酶空白液中泛酸含量,单位为纳克(ng);酶空白液中泛酸浓度平均值,单位为纳克每毫升(ng/mL);酶空白液总体积,单位为毫升(mL);试样酶解液中泛酸含量,单位为纳克(ng);试样稀释液泛酸浓度平均值.单位为纳克每毫升(ng/mL);试样调pH后的定容体积,单位为毫升(mL):试样酶解液的定容体积,单位为毫升(mL);..(3)
.(4)
·(5)
试样提取液稀释倍数;
试样调pH时吸取的酶解液体积,单位为毫升(mL);GB5009.210—2016
试样中泛酸含量,固态试样单位为毫克每百克(mg100g),液态试样为毫克每百毫升(mg/100mL);
试样水解液的定容体积,单位为毫升(mL);试样质量,单位为克(g);
试样酶解时吸取的水解液体积,单位为毫升(mL);换算系数。
结果如以泛酸钙计量,应乘以1.087。计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留三位有效数字。7精密度
-般食品在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的15%;营养素补充剂和强化食品在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的5%。
8其他
一般食品称样量为5g时,检出限为0.03mg/100g,定量限为0.06mg/100g。营养强化剂类保健食品和配方食品称样量为2g时,检出限为0.025mg/100g,定量限0.05mg/100g。第二法高效液相色谱法
9原理
利用泛酸易溶于水,在弱酸性至中性条件下(pH5.0~7.0)稳定的理化性质.试样用热水在超声波振荡下提取,经C1s反相色谱柱分离,在紫外检测器检测200nm波长处检测,根据色谱峰的保留时间及紫外光谱图定性,外标法定量,计算试样中泛酸含量。10
试剂和材料
除非另有说明,本方法所用试剂均为分析纯,水为GB/T6682规定的一级水10.1试剂
盐酸(HCI)。
磷酸(H,PO)。
磷酸二氢钾(KH,PO.):色谱纯。七水合硫酸锌(ZnSO,·7H,O)。乙腈(CH,CN):色谱纯
淀粉酶:酶活力≥1.5U/mg。
10.2试剂配制
GB5009.210—2016
盐酸(0.1mol/L):吸取8.3mL盐酸至1000mL容量瓶中,加水稀释定容至刻度,混匀10.2.2硫酸锌溶液(0.5mol/L):称取14.4g七水合硫酸锌,加水溶解并定容至100mL。10.2.3磷酸二氢钾溶液(0.02mol/L):称取2.722g磷酸二氢钾,加500mL水溶解.用磷酸调节pH至3.0,用水定容至1000mL,用0.45μm滤膜过滤。10.3泛酸标准溶液
注:D-泛酸钙(CHaCaN,O1):纯度≥99%。10.3.1泛酸标准储备溶液(1.000mg/mL):准确称取泛酸钙1.087g,加水溶解并转人1000mL容量瓶中,定容至刻度,混匀(4℃冰箱中可保存5d)。10.3.2泛酸标准中间溶液(100.0μg/mL):准确吸取标准储备溶液10.0mL于100mL容量瓶中,加水定容至刻度。临用前配制。
10.3.3泛酸标准工作溶液:分别准确吸取泛酸标准中间液1.0mL,2.0mL,4.0mL,8.0mL,16.0mL,32.0mL于100mL容量瓶中,加水定容至刻度,得到浓度分别为1.0μg/mL,2.0μg/mL,4.0μg/mL,8.0pg/mL,16.0μg/mL,32.0μg/mL的泛酸标准工作溶液.临用前配制。11
仪器和设备
天平:感量0.1mg。
11.2恒箱培养箱:55℃±5℃。
11.3超声波振荡器。
11.4pH计:精度±0.01。
高效液相色谱仪:带紫外检测器或三极管阵列检测器。12
分析步骤
12.1试样制备
固态试样粉碎并混合均匀:碳酸饮料需超声波去除二氧化碳,其他液态试样摇匀12.2试样测定液的制备
营养素补充剂类保健食品
准确称取或量取适量试样(m),精确至0.001g,一般固体试样0.2g~2g,液态试样10g~20g,置于50mL锥形瓶中,加入约30mL40℃~50℃温水超声提取20min,用水定容至刻度(V)。转人离心管3000r/min离心5min~10min,取上清液过0.45μm滤膜,滤液待上机测定。12.2.2配方食品
准确称取适量试样(m).精确至0.001g.一般固态试样约5g.液态试样约20g。置于100mL锥形瓶中,加人40℃~50℃温水至30mL。如果试样中含有淀粉,加人淀粉酶0.2g,振摇混匀,盖上瓶塞,在55℃士5℃水浴条件下,振摇酶解120min~240min。如果试样不含淀粉,直接超声提取20min,取出试样液,冷却至室温,用0.1mol/L盐酸调节pH至5.0土0.1,加人5mL0.5mol/L硫酸锌溶液,充分混合。转入50mL容量瓶中,用水定容至刻度并充分混勾后,转人离心管3000r/min离心8
5min~10min,取上清液过0.45um滤膜,滤液待上机测定。12.3稀释
GB5009.210—2016
必要时,试样测定液用水进行适当的稀释(F).使试样测定液中泛酸浓度在1ug/mL~32ug/mL范围内。
12.4参考液相色谱条件
色谱柱:ODS-Cis(粒径5μm,250mmX4.6mm)或具有同等性能的色谱柱。柱温:28℃±0.5℃。
紫外检测器:检测波长:210nm。流动相:0.02mol/L磷酸二氢钾溶液+乙腈=95十5。流速:1.0mL/min。
进样量:10μ或20μL。
12.5测定
标准曲线测定
按照已经确立的色谱条件,将泛酸标准工作液依次进行色谱分析(标准色谱图见附录B),记录标准出峰时间、色谱峰高(或峰面积)。以标准工作液浓度为横坐标,峰高(或峰面积)为纵坐标,绘制标准曲线。
2试样溶液的测定
取试样测定液按照色谱条件进行色谱分析,根据试样峰高(或峰面积)从标准曲线中查得相应的泛酸浓度(p)。
3分析结果的表述
试样中泛酸的含量按式(6)计算:X=exVxF
式中:
试样中泛酸含量,固态试样单位为毫克每百克(mg/100g),液态试样为毫克每百毫升(mg/100mL):
从标准曲线上查得试样测定液中泛酸的浓度,单位为微克每毫升(μg/mL);试样测定液总体积,单位为毫升(mL);试样测定液稀释倍数;
试样质量,单位为克(g);bZxz.net
换算系数。
结果如以泛酸钙计量,应乘以1.087计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留三位有效数字。9
精密度
GB5009.210—2016
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的5%。5其他
当称样量为5g时,检出限为0.025mg/100g,定量限为0.08mg/100g。10
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
GB5009.210—2016
食品安全国家标准
食品中泛酸的测定
2016-08-31发布
人民共和国
国家卫生和计划生育委员会
2017-03-01实施
本标准代替GB/T5009.210—2008《食品中泛酸的测定》。本标准与GB/T5009.210—2008相比,主要变化如下一标准名称修改为“食品安全国家标准食品中泛酸的测定”;增加了高效液相色谱方法;
修改了食品的前处理方法;
增加了检出限和定量限。
GB5009.210—2016
1范围
食品安全国家标准
食品中泛酸的测定
本标准规定了食品中泛酸和泛酸钙的测定方法GB5009.210—2016
本标准第一法适用于食品中泛酸的测定,第二法适用于营养素补充剂类保健食品和配方食品中泛酸(钙)的测定。
第一法
去微生物法
2原理
泛酸是植物乳杆菌Lactobacillusplantarum(ATCC8014)生长所必需的营养素,在一定控制条件下,将植物乳杆菌液接种至含有试样液的培养液中,培养一定时间后测定透光率(或吸光度值),根据泛酸含量与透光率或吸光度值)的标准曲线计算出试样中泛酸的含量。试剂和材料
除非另有说明,本方法所用试剂均为分析纯,水为GB/T6682规定的二级水3.1试剂
3.1.1盐酸(HCI)。
冰乙酸(C,H,O2)
氢氧化钠(NaOH)。
氯化钠(NaCI)。
碳酸钠(NazCO)。
碳酸氢钾(KHCO)。
磷酸氢二钾(K,HPO4)。
三水合乙酸钠(C,H.O,Na·3H,O)三水合磷酸二氢钾(KH,PO4·3H,O)。七水合硫酸镁(MgSO4·7HzO)。七水合硫酸亚铁(FeSO.·7H,O)。一水合硫酸锰(MnSO·H,O)。
三羟甲基氨基甲烷(C,HnNO,)。葡萄糖(CHiO。)。
甲苯(C,H)。
无水乙醇(C.H.O)。
阴离子交换树脂Dowex1×8:粒度38um~75um。1
3.1.18碱性磷酸酶:酶活力≥23U/g。3.1.19
GB5009.210—2016
鸽子肝脏丙酮提取物干粉(liveracetonepowder,frompigeon):酶活力≥o.1U/g:蛋白陈:含氮量≥10%。
酵母提取物:含氮量》10%。
2琼脂。
试剂配制
乙酸溶液(0.2mol/L):吸取11.8mL冰乙酸,用水稀释至1000mL,混匀。乙酸钠溶液(0.2mol/L):称取27.2g三水合乙酸钠加水溶解并稀释至1000mL.混匀。盐酸溶液(1mol/L):吸取83mL盐酸,加水稀释至1000mL,混匀。盐酸浸泡液:吸取100mL盐酸与50倍水混合。3.2.4
3.2.5氢氧化钠溶液(1mol/L):称取40g氢氧化钠,加水溶解并稀释至1000mL,混匀。3.2.6氢氧化钠溶液(0.1mol/L):称取4g氢氧化钠,加水溶解并稀释至1000mL,混勾。3.2.7Tris缓冲液:称取121.0g三羟甲基氨基甲烷溶于500mL水中,用冰乙酸调pH至8.1士0.1,加水至1000mL.混匀。贮存于2℃~4℃冰箱中,可保存2周。3.2.8生理盐水:称取9g氯化钠,加水溶解并稀释至1000mL,混匀。临用前预先灭菌,于121℃高压灭菌10min后备用。
3.2.9乙醇溶液(20%):量取200mL无水乙醇与800mL水混匀。3.2.10碳酸钠溶液(0.08mol/L):称取8.5g碳酸钠,加水溶解并稀释至1000mL.混匀。3.2.11
预冷。
碳酸氢钾溶液(0.02mol/L):称取2g碳酸氢钾,加水溶解并稀释至1000mL。混匀碱性磷酸酶溶液:称取2g碱性磷酸酶,加水溶解并稀释至100mL临用现配,2℃~4℃冰箱3鸽子肝脏提取液
3.2.13.1活化Dowex1×8:称取100gDowex1X8于锥形瓶中,加人1L盐酸溶液,置于振荡器上充分振摇10min,用铺有滤纸的布氏漏斗过滤。Dowex1×8转回锥形瓶,再加入1L盐酸溶液重复振摇、过滤。Dowex1X8加人1L水振摇10min,过滤,重复用水洗涤10次。逐滴加人Tris缓冲液调节Dowex1×8pH至8.0士0.1。2℃C~4℃冰箱保存2天内用完。3.2.13.2鸽子肝脏提取液:配制此试剂前一天将所用容器放人2℃~4℃冰箱中冷藏过夜。称取30g鸽子肝脏丙酮提取物干粉,放人研钵中,冰浴条件下分两次加入300mL碳酸氢钾溶液研磨至匀浆,转人具塞离心管中,盖好塞后充分振摇,一20℃冷冻10min后以3000r/min离心5min,将上清液转至500mL广口瓶中。加150g活化Dowex1×8.放人冰浴中混匀5min,将混合液倒人离心管中,3000r/min离心5min。将上清液移人另一500mL预冷的广口瓶中,一20℃冷冻10min,再加150g活化Dowex1×8.放人冰浴中混勾5min,将混合液倒入离心管中,3000r/min离心,将上清液分装于具塞试管中(每管大约3mL),一20℃冷冻保存。用前于2℃~4℃冰箱内化冻并保存至用时3.3培养基
3.3.1甲盐溶液:分别称取25g磷酸氢二钾和25g三水合磷酸二氢钾,加水溶解并稀释至500mL,混匀。加人1mL甲苯,2℃~4℃冰箱可保存1年。3.3.2乙盐溶液:分别称取10g七水合硫酸镁、0.5g氯化钠、0.5g七水合硫酸亚铁和0.5g一水合硫酸锰,加水溶解并稀释至500mL。加5滴盐酸,2℃~4℃冰箱可保存1年。3.3.3琼脂培养基:按表1称取或吸取各试剂,加水至100mL,混合,沸水浴加热至琼脂完全溶化。趁热用1mol/L盐酸溶液和/或1mol/L氢氧化钠溶液调节pH至6.8土0.1。尽快分装,根据试管内径粗细加人3mL~5mL,液面高度不得低于2cm。塞上棉塞,121℃高压灭菌15min。取出后试管直立放2
置,待冷却后于冰箱内保存,备用。表1菌种储备用琼脂培养基配制一览表试剂
葡萄糖
蛋白陈
酵母提取物干粉
三水合乙酸钠
甲盐溶液
乙盐溶液
GB5009.210—2016
3.3.4泛酸测定用培养液:可按附录A配制泛酸测定用培养液。也可直接由试剂公司购买效力相当的泛酸测定用培养基,用前按说明书配制。3.4标准品
D-泛酸钙(ClH32CaNzO1。):纯度≥99%。3.5标准溶液的配制
3.5.1泛酸标准储备溶液(40.0μg/mL):精确称取43.5mg预干燥至恒重的D-泛酸钙,加水溶解并转移至1000mL容量瓶中,加10mL乙酸溶液,100mL乙酸钠溶液.用水定容至刻度。储存于棕色瓶中,加入3滴~5滴甲苯,于2℃~4℃冰箱中可保存2年。3.5.2泛酸标准中间液(1.00μg/mL):准确吸取25.0mL泛酸标准储备溶液置于1000mL容量瓶中,加入10mL乙酸溶液,100mL乙酸钠溶液,用水定容至刻度。加人3滴~5滴甲苯于2℃~4℃冰箱中可保存1年。
3.5.3泛酸标准工作溶液(20ng/mL):准确吸取2.00mL泛酸标准中间溶液置于100mL容量瓶中,用水定容至刻度,混匀。临用前现配。4仪器和设备
天平:感量0.1mg。
恒温培养箱:37℃士1℃。
压力蒸汽消毒器:121℃。
漩涡振荡器。
离心机:转速≥3000r/min。
接种针和接种环。
pH计:精度士0.01。
紫外-分光光度计。
超净工作台。
超声振荡器
5菌种的制备与保存
5.1菌种
植物乳杆菌Lactobacillusplantarum(ATCC8014)。5.2储备菌种的制备
GB5009.210—2016
将菌种植物乳杆菌Lactobacillusplantarum(ATCC8014)转接至琼脂培养基中,在37℃土1℃恒温箱中培养20h~24h.连续传种2次~3次。取出后放人2℃~4℃冰箱作为储备菌株保存。每月至少传代一次,不宜超过25代。
试验前将储备菌株接种至琼脂培养基中,37℃士1℃恒温培养箱中培养20h~24h以活化菌株,用于接种液的制备。
注:保存数周以上的储备菌株,不能立即用作接种液制备,试验前宜连续传种2代~3代以保证细菌活力。5.3接种液的制备
试验前一天,取2mL泛酸标准工作溶液和4mL泛酸测定用培养液混勾,分装于2支5mL离心管中,塞好棉塞,于121℃高压灭菌15min后即为种子培养液。冷却后用接种环将活化的菌株转种至2支种子培养液中,于37℃士1℃恒温培养箱中培养20h~24h。取出后3.000r/min离心10min,弃上清液,无菌操作下用已预先灭菌的生理盐水淋洗2次,3000r/min离心10min,弃上清液。再加入3mL灭菌生理盐水,振荡混匀,制成接种液,立即使用。6分析步骤
注:所有操作均需避光进行
6.1试样制备
谷薯类、豆类、乳粉等试样需粉碎、研磨、过筛(筛板孔径0.3mm~0.5mm):肉、蛋、坚果等用勾质器制成食糜;果蔬、半固体食品等试样需匀浆混匀;液体试样用前振摇混合。4℃冰箱可保存1周6.2试样提取
6.2.1直接提取法
形态为颗粒、粉末、片剂、液体的营养素补充剂或强化剂、预混料,添加了泛酸钙的配方食品或保健食品可采用直接提取法。
准确称取适量试样(m)固体试样0.2g~2g:液态试样5g~10g,精确至0.001g,转人100mL锥形瓶中,加入80mL乙醇溶液,具塞,超声振摇提取4h以上至试样完全溶解,用水定容至100mLVi)。
6.2.2酶解法
一般谷薯类、肉蛋乳类、果蔬菌藻类、豆及坚果类等食品试样宜采用酶解提取法。6.2.2.1水解:准确称取适量试样(m,约含0.02mg~0.2mg泛酸),精确至0.001g。一般谷薯类、肉类、蛋类、豆类及其制品称取1g~5g;新鲜果蔬、乳及其制品称取5g~10g。转人至100mL锥形瓶中,加10mLTris缓冲液、40mL水,振荡混匀。于121℃高压条件下水解15min。冷却至室温,转移4
至100mL容量瓶中,用水定容至刻度(V),过滤GB5009.210—2016
6.2.2.2酶解:准确吸取适量试样滤液(1.0mL~10.0mL,V,)至25mL具塞刻度试管底部,补水至10mL,加5mLTris缓冲液。在冰浴条件下,依次小心加入预冷的0.1mL碳酸氢钠溶液,0.4mL碱性磷酸酶溶液、0.2mL鸽子肝脏提取液和0.4mL水。小心混匀试管,避免混合物黏附于试管壁,加1滴甲苯.37℃土1℃温箱中温育过夜(8h以上)。加水至20mL,用冰乙酸调节pH至4.5士0.1.加水定容至25.0mL(V).过滤。调节pH:吸取适量的试样酶解液(2.0mL~20.0mL,V4)于25mL具塞刻度试管中,加水至20mL.用0.1mol/L氢氧化钠溶液调节pH至6.8土0.1,用水定容至25.0mL(V,)。另取一试管加入5mLTris缓冲液和10mL水,同法加人碳酸氢钠溶液、碱性磷酸酶溶液、鸽子肝脏提取液酶液及温育过夜,并调节pH至6.8土0.1,用水定容至25.0mL作为酶空白液注:以谷物、乳粉等为基质的配方食品如需计量基质本底泛酸含量,可采用酶解法提取6.3稀释
根据试样中泛酸含量用水对试样提取液进行适当稀释(F),使稀释后试样提取液中泛酸浓度约为20ng/mLg
6.4测定系列管制备
所用试管使用前洗刷干净,用水煮沸30min,沥干后放人盐酸浸泡液中浸泡2h,经170℃烘3h后使用。
6.4.1试样和酶空白系列管
取4支试管,分别加人1.0mL、2.0mL、3.0mL、4.0mL试样提取液(V),补水至5.0mL.加人5.0mL泛酸测定用培养液,混匀。另取4支试管分别加入1.0mL、2.0mL、3.0mL、4.0mL酶空白液。6.4.2标准系列管
取试管分别加入泛酸标准工作溶液0.00mL、0.50mL、1.00mL、1.50mL、2.00mL、2.50mL、3.00mL3.50mL、4.00mL、4.50mL.5.00ml于试管中,补水至5.0mL,相当于标准系列管中泛酸含量为0ng、10ng、20ng、30ng、40ng、50ng、60ng、70ng、80ng、90ng、100ng泛酸.再加人5.0mL泛酸测定用培养液,混匀。为保证标准曲线的线性关系,应制备2套3套标准系列管,绘制标准曲线时,以每个标准点的均值计算。
6.5灭菌
将所有测定管塞好棉塞,于121℃高压灭菌15min。6.6接种和培养
待测定系列管冷却至室温后,在无菌操作条件下向每支测定管滴加接种液50L。塞好棉塞,置于37℃士1℃恒温培养箱中培养16h~20h,直至达到最大混浊度,即再培养2h后透光率(或吸光度值)无明显变化。另准备一支标准0管(含0ng泛酸)不接种作为0对照管6.7测定
将培养好的标准系列管、试样和酶空白系列管用漩涡混匀器混勾。用厚度为1cm比色杯,于550nm处,以未接种的0对照管调节透光率为100%(或吸光度值为0),依次测定标准系列管、试样和酶空白系列管的透光率(或吸光度值)。如果0对照管有明显的细菌增长,或者与0对照管相比,标准0管透光率在90%以下(或吸光度值在0.2以上);或标准系列管透光率最大变化量<40%(或吸光度值变5
化量04),说明可能有杂菌或不明来源的泛酸混人,需重做试验注:泛酸测定适宜的光谱范围540nm~660nm。6.8分析结果表述
GB5009.210—2016
6.8.1标准曲线:以标准系列管泛酸含量为横坐标,每个标准点透光率(或吸光度值)均值为纵坐标,绘制标准曲线
6.8.2试样结果计算:从标准曲线查得试样和酶空白系列管中泛酸的相应含量(e),如果每个试样的4支试样系列管中有3支以上泛酸含量在10ng~80ng范围内,且按照式(1)计算每毫升试样稀释液中泛酸浓度(),各管之间相对偏差小于15%,则可继续按式(2)或式(3)~式(5)进行结果计算,否则需重新取样测定
试样稀释液中泛酸浓度按式(1)计算:.(1)
式中:
试样稀释液中泛酸浓度.单位为纳克每毫升(ng/mL);从标准曲线上查得测定系列管中泛酸含量,单位为纳克(ng);制备试样系列管时吸取的试样稀释液体积,单位为毫升(mL)。采用直接提取法的试样中泛酸含量按式(2)计算:p×VXF100
式中:
(2)
试样中泛酸含量,固态试样单位为毫克每百克(mg/100g)液态试样为毫克每百毫升(mg/100mL);
试样稀释液泛酸浓度平均值,单位为纳克每毫升(ng/mL);试样提取液的定容体积,单位为毫升(mL):试样提取液稀释倍数;
试样质量,单位为克(g);
换算系数。
采用酶解法的试样中泛酸含量按式(3)~式(5)计算:mo=po×25
(mxm)×Vi×100
式中:
酶空白液中泛酸含量,单位为纳克(ng);酶空白液中泛酸浓度平均值,单位为纳克每毫升(ng/mL);酶空白液总体积,单位为毫升(mL);试样酶解液中泛酸含量,单位为纳克(ng);试样稀释液泛酸浓度平均值.单位为纳克每毫升(ng/mL);试样调pH后的定容体积,单位为毫升(mL):试样酶解液的定容体积,单位为毫升(mL);..(3)
.(4)
·(5)
试样提取液稀释倍数;
试样调pH时吸取的酶解液体积,单位为毫升(mL);GB5009.210—2016
试样中泛酸含量,固态试样单位为毫克每百克(mg100g),液态试样为毫克每百毫升(mg/100mL);
试样水解液的定容体积,单位为毫升(mL);试样质量,单位为克(g);
试样酶解时吸取的水解液体积,单位为毫升(mL);换算系数。
结果如以泛酸钙计量,应乘以1.087。计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留三位有效数字。7精密度
-般食品在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的15%;营养素补充剂和强化食品在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的5%。
8其他
一般食品称样量为5g时,检出限为0.03mg/100g,定量限为0.06mg/100g。营养强化剂类保健食品和配方食品称样量为2g时,检出限为0.025mg/100g,定量限0.05mg/100g。第二法高效液相色谱法
9原理
利用泛酸易溶于水,在弱酸性至中性条件下(pH5.0~7.0)稳定的理化性质.试样用热水在超声波振荡下提取,经C1s反相色谱柱分离,在紫外检测器检测200nm波长处检测,根据色谱峰的保留时间及紫外光谱图定性,外标法定量,计算试样中泛酸含量。10
试剂和材料
除非另有说明,本方法所用试剂均为分析纯,水为GB/T6682规定的一级水10.1试剂
盐酸(HCI)。
磷酸(H,PO)。
磷酸二氢钾(KH,PO.):色谱纯。七水合硫酸锌(ZnSO,·7H,O)。乙腈(CH,CN):色谱纯
淀粉酶:酶活力≥1.5U/mg。
10.2试剂配制
GB5009.210—2016
盐酸(0.1mol/L):吸取8.3mL盐酸至1000mL容量瓶中,加水稀释定容至刻度,混匀10.2.2硫酸锌溶液(0.5mol/L):称取14.4g七水合硫酸锌,加水溶解并定容至100mL。10.2.3磷酸二氢钾溶液(0.02mol/L):称取2.722g磷酸二氢钾,加500mL水溶解.用磷酸调节pH至3.0,用水定容至1000mL,用0.45μm滤膜过滤。10.3泛酸标准溶液
注:D-泛酸钙(CHaCaN,O1):纯度≥99%。10.3.1泛酸标准储备溶液(1.000mg/mL):准确称取泛酸钙1.087g,加水溶解并转人1000mL容量瓶中,定容至刻度,混匀(4℃冰箱中可保存5d)。10.3.2泛酸标准中间溶液(100.0μg/mL):准确吸取标准储备溶液10.0mL于100mL容量瓶中,加水定容至刻度。临用前配制。
10.3.3泛酸标准工作溶液:分别准确吸取泛酸标准中间液1.0mL,2.0mL,4.0mL,8.0mL,16.0mL,32.0mL于100mL容量瓶中,加水定容至刻度,得到浓度分别为1.0μg/mL,2.0μg/mL,4.0μg/mL,8.0pg/mL,16.0μg/mL,32.0μg/mL的泛酸标准工作溶液.临用前配制。11
仪器和设备
天平:感量0.1mg。
11.2恒箱培养箱:55℃±5℃。
11.3超声波振荡器。
11.4pH计:精度±0.01。
高效液相色谱仪:带紫外检测器或三极管阵列检测器。12
分析步骤
12.1试样制备
固态试样粉碎并混合均匀:碳酸饮料需超声波去除二氧化碳,其他液态试样摇匀12.2试样测定液的制备
营养素补充剂类保健食品
准确称取或量取适量试样(m),精确至0.001g,一般固体试样0.2g~2g,液态试样10g~20g,置于50mL锥形瓶中,加入约30mL40℃~50℃温水超声提取20min,用水定容至刻度(V)。转人离心管3000r/min离心5min~10min,取上清液过0.45μm滤膜,滤液待上机测定。12.2.2配方食品
准确称取适量试样(m).精确至0.001g.一般固态试样约5g.液态试样约20g。置于100mL锥形瓶中,加人40℃~50℃温水至30mL。如果试样中含有淀粉,加人淀粉酶0.2g,振摇混匀,盖上瓶塞,在55℃士5℃水浴条件下,振摇酶解120min~240min。如果试样不含淀粉,直接超声提取20min,取出试样液,冷却至室温,用0.1mol/L盐酸调节pH至5.0土0.1,加人5mL0.5mol/L硫酸锌溶液,充分混合。转入50mL容量瓶中,用水定容至刻度并充分混勾后,转人离心管3000r/min离心8
5min~10min,取上清液过0.45um滤膜,滤液待上机测定。12.3稀释
GB5009.210—2016
必要时,试样测定液用水进行适当的稀释(F).使试样测定液中泛酸浓度在1ug/mL~32ug/mL范围内。
12.4参考液相色谱条件
色谱柱:ODS-Cis(粒径5μm,250mmX4.6mm)或具有同等性能的色谱柱。柱温:28℃±0.5℃。
紫外检测器:检测波长:210nm。流动相:0.02mol/L磷酸二氢钾溶液+乙腈=95十5。流速:1.0mL/min。
进样量:10μ或20μL。
12.5测定
标准曲线测定
按照已经确立的色谱条件,将泛酸标准工作液依次进行色谱分析(标准色谱图见附录B),记录标准出峰时间、色谱峰高(或峰面积)。以标准工作液浓度为横坐标,峰高(或峰面积)为纵坐标,绘制标准曲线。
2试样溶液的测定
取试样测定液按照色谱条件进行色谱分析,根据试样峰高(或峰面积)从标准曲线中查得相应的泛酸浓度(p)。
3分析结果的表述
试样中泛酸的含量按式(6)计算:X=exVxF
式中:
试样中泛酸含量,固态试样单位为毫克每百克(mg/100g),液态试样为毫克每百毫升(mg/100mL):
从标准曲线上查得试样测定液中泛酸的浓度,单位为微克每毫升(μg/mL);试样测定液总体积,单位为毫升(mL);试样测定液稀释倍数;
试样质量,单位为克(g);bZxz.net
换算系数。
结果如以泛酸钙计量,应乘以1.087计算结果以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留三位有效数字。9
精密度
GB5009.210—2016
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的5%。5其他
当称样量为5g时,检出限为0.025mg/100g,定量限为0.08mg/100g。10
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。