GB 5009.212-2016
基本信息
标准号: GB 5009.212-2016
中文名称:食品安全国家标准 贝类中腹泻性贝类毒素的测定
标准类别:国家标准(GB)
标准状态:现行
出版语种:简体中文
下载格式:.rar .pdf
下载大小:415KB

标准分类号
关联标准
出版信息
相关单位信息
标准简介
GB 5009.212-2016 食品安全国家标准 贝类中腹泻性贝类毒素的测定
GB5009.212-2016
标准压缩包解压密码:www.bzxz.net
标准图片预览




标准内容
中华人民共和国国家标准
GB5009.212—2016
食品安全国家标准
贝类中腹泻性贝类毒素的测定
2016-12-23发布
2017-06-23实施
中华人民共和国国家卫生和计划生育委员会国家食品药品监督管理总局
GB5009.212—2016
本标准代替GB/T5009.212—2008《贝类中腹泻性贝类毒素的测定》、SC/T3024—2004《腹泻性贝类毒素的测定生物法》、SN/T2269—2009《进出口贝肉中大田软海绵酸的检测液相色谱-串联质谱法》、SN/T2131.2—2010《进出口贝类腹泻性贝类毒素检验方法第2部分:小鼠生物法》、
SN/T1996—2007《贝类中腹泻性贝类毒素检验方法法酶联免疫吸附法》、SN/T2131.1-2008《进出口贝类腹泻性贝类毒素检测方法第1部分:荧光磷酸酶抑制法》。本标准与GB/T5009.212—2008相比,主要变化如下:标准名称修改为“食品安全国家标准贝类中腹泻性贝类毒素的测定”;增加了酶联免疫吸附法;
增加了液相色谱-串联质谱法。
1范围
食品安全国家标准
贝类中腹泻性贝类毒素的测定
GB5009.212—2016
本标准规定了贝类中腹泻性贝类毒素测定的小鼠生物法,酶联免疫吸附法和液相色谱-串联质谱法。
本标准中小鼠生物法和酶联免疫吸附法适用于贝类及其制品中腹泻性贝类毒素的测定,液相色谱串联质谱法适用于贝类可食部分及其制品(不包括盐渍制品)中腹泻性贝类毒素大田软海绵酸(OA)、鳍藻毒素-1(DTX-1)和鳍藻毒素-2(DTX-2)的测定。小鼠生物法
2原理
用丙酮提取贝类中腹泻性贝类毒素(DSP),经无水乙醚分配,减压蒸干后,再以含1%吐温-60的生理盐水为分散介质,制成DSP混悬液。将该混悬液注射入小鼠腹腔,观察小鼠存活情况,计算其毒力。3试剂和材料
除非另有说明,本方法所用试剂均为分析纯,水为GB/T6682规定的一级水。3.1试剂
3.1.1丙酮(CH。O)。
3.1.2无水乙醚(C,HO)。
3.1.3吐温-60(C64H126O26)。3.1.4氯化钠(NaCI)。
3.2试剂配制
氯化钠溶液(0.85%):称取0.85gNaCl.加水溶解并定容至100mL3.2.2吐温-60(1%):称取1.0g吐温-60,用氯化钠溶液(0.85%)溶解并定容至100mL3.3材料
小鼠:体重为16g~20g的健康ICR品系雄性小鼠。3.3.1
金属筛网:孔径约2mm。
4仪器和设备
旋转蒸发器。
4.2均质器。
4.3天平:感量为0.1g。
5分析步骤
GB5009.212—2016
注:为避免毒素的危害,应戴手套进行操作。移液管及移液器吸头等用过的器材、废弃的提取液等应在次氯酸钠溶液(5%)浸泡1h以上以使毒素分解。对于动物实验过程中产生的污水、废弃物及动物户体处理,应参照GB14925执行,
5.1样品菜集
采取足够的贝类样品个数,并使贝肉达400g以上。远离实验室不能及时送检的样品,除了在常温下品质不会发生变化的,应将样品置于保温盒中冷冻送检,或采取必要措施保证其处于低温状态(0℃~10℃)送检。如为带壳样品.应开壳,去除水分后冷冻送检。5.2试样制备
5.2.1生鲜带壳样品
用清水彻底洗净贝类样品外表,切断闭壳肌,开壳,用清水淋洗内部去除泥沙及其他异物,取出贝肉。严禁以加热或药物方法开壳。注意不要破环闭壳肌以外的组织,尤其是中肠腺(中肠腺又称消化育囊,组织呈暗绿色或褐绿色)。将去壳贝肉置于孔径约2mm的金属筛网上,沥水5min。将贝肉剪碎。5.2.2冷冻样品
在室温下使冷冻样品融化呈半冷冻状态。带壳冷冻的样品按5.2.1方法清洗、开壳、淋洗取肉,除去贝肉外部附着的冰片,抹去水分。将贝肉剪碎。5.3试样提取
称取200g剪碎的贝肉试样置于均质杯中,按体积比加3倍量丙酮后均质2min以上。将均质好的物质倒入布氏漏斗中抽滤,收集滤液。分别用残渣2倍量的内酮再清洗残渣两次,滤液与上述滤液合并。将滤液移入500mL的圆底烧瓶中,56℃土1℃下,减压浓缩去除丙酮直至在液体表面分离出油状物。
用100mL~200mL无水乙醚溶解油状物,倒人分液漏斗内,再用少量无水乙醚清洗圆底烧瓶,合并倒入分液漏斗内,以少量的水洗下粘壁部分,轻轻振荡(不能生成乳浊液),静置分层后去除水层(下层)。
用相当乙醚半量的水洗乙醚层两次,去除水层,再将乙醚层移人250mL或500mL的圆底烧瓶中,于35℃士1℃减压浓缩去除乙醚。用少量无水乙醚将浓缩物移50mL或100mL圆底烧瓶中,再次减压浓缩去除乙醚。
用1%吐温-60的生理盐水将全部浓缩物转移至刻度试管中稀释到10mL,充分振摇,制成均勾混悬液。1mL该混悬液相当于20g试样,以此混悬液为试验原液。以试验原液注射小鼠,当24h内2只或3只小鼠死亡时,需振荡试验原液使成均匀混悬液,用1%吐温-60生理盐水按表1逐步稀释成4倍或16倍的稀释液,充分混匀,按表1注射小鼠,5.4小鼠试验
选择16g~20g健康ICR雄性小鼠6只,随机分为实验组和溶剂对照组两组,每组3只。实验组将腹腔注射试验原液或其稀释液,溶剂对照组将腹腔注射1%吐温-60生理盐水。2
GB5009.212—2016
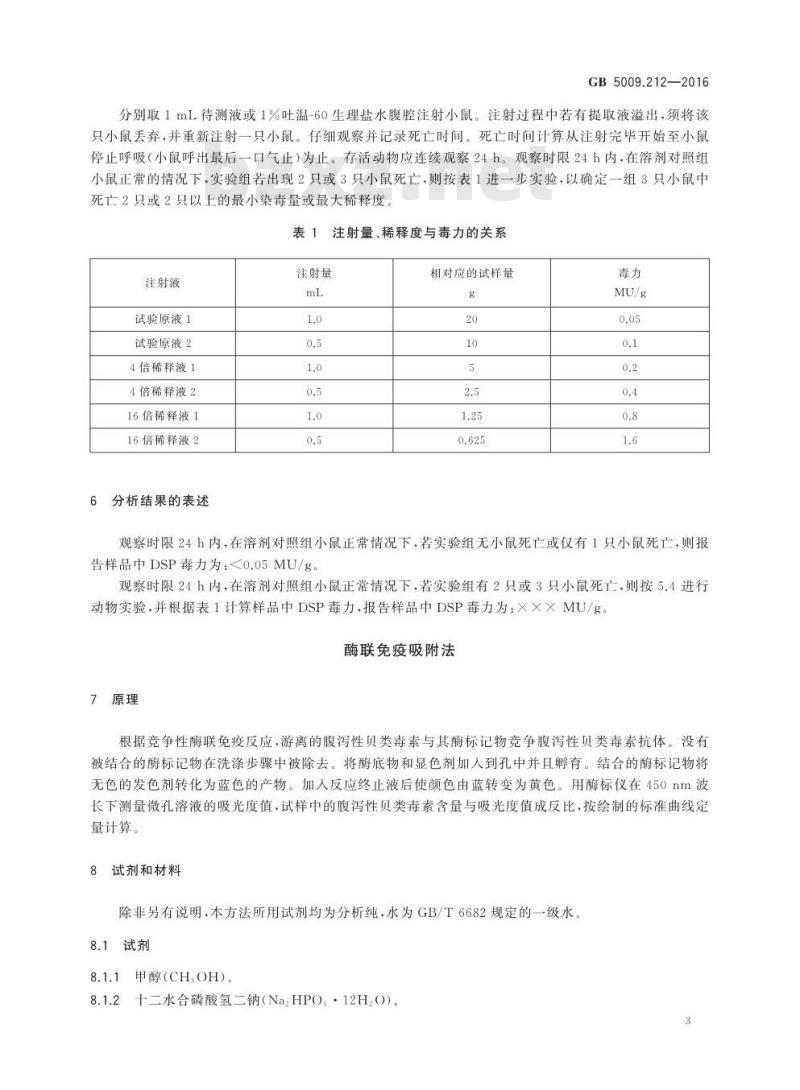
分别取1mL待测液或1%吐温-60生理盐水腹腔注射小鼠。注射过程中若有提取液溢出,须将该只小鼠丢弃,并重新注射一只小鼠。仔细观察并记录死亡时间。死亡时间计算从注射完毕开始至小鼠停止呼吸(小鼠呼出最后一口气止)为止。存活动物应连续观察24h。观察时限24h内,在溶剂对照组小鼠正常的情况下,实验组若出现2只或3只小鼠死亡,则按表1进一步实验,以确定一组3只小鼠中死亡2只或2只以上的最小染毒量或最大稀释度表1注射量、稀释度与毒力的关系注射液
试验原液1
试验原液2
4倍稀释液1
4倍稀释液2
16倍稀释液1
16倍稀释液2
6分析结果的表述
注射量
相对应的试样量
观察时限24h内,在溶剂对照组小鼠正常情况下,若实验组无小鼠死亡或仅有1只小鼠死亡,则报告样品中DSP毒力为:<0.05MU/g。观察时限24h内,在溶剂对照组小鼠正常情况下,若实验组有2只或3只小鼠死亡,则按5.4进行动物实验,并根据表1计算样品中DSP毒力,报告样品中DSP毒力为:XXXMU/g。酶联免疫吸附法下载标准就来标准下载网
7原理
根据竞争性酶联免疫反应,游离的腹泻性贝类毒素与其酶标记物竞争腹泻性贝类毒素抗体。没有被结合的酶标记物在洗涤步骤中被除去。将酶底物和显色剂加入到孔中并且孵育。结合的酶标记物将无色的发色剂转化为蓝色的产物。加入反应终止液后使颜色由蓝转变为黄色。用酶标仪在450nm波长下测量微孔溶液的吸光度值,试样中的腹泻性贝类毒素含量与吸光度值成反比,按绘制的标准曲线定量计算。
8试剂和材料
除非另有说明,本方法所用试剂均为分析纯,水为GB/T6682规定的一级水,8.1试剂
8.1.1甲醇(CH.OH)。
十二水合磷酸氢二钠(Na2HPO,·12H2O)。8.1.2
氯化钠(NaCI)。
8.1.4氯化钾(KCI)。
8.1.5磷酸二氢钾(KH,PO4)。
8.1.6吐温-20(CssHmO2)。
8.1.7牛血清白蛋白(BSA)。
8.1.8酶标记物
8.1.9过氧化氢(H,O2)
3355-四甲基联苯胺(TMB.CHN)。8.1.11
硫酸(H,SO)。
8.2试剂配制
甲醇溶液(90%):量取90mL甲醇,加入10mL水,混合均匀。GB5009.212—2016
8.2.2磷酸盐缓冲液(PBS溶液,pH7.4):分别称取磷酸二氢钾0.20g、十二水合磷酸氢二钠2.90g、氯化钠8.00g、氯化钾0.20g.加水溶解并定容至1000mL。8.2.3酶标记物稀释液:称取1.0gBSA,加PBS溶液溶解并定容至1000mL。8.2.4酶标记物工作液:用酶标记物稀释液将酶标记物稀释至工作浓度。8.2.5洗脱液:吸取0.5mL吐温-20加入PBS溶液中,并稀释至1000mL。8.2.6
硫酸溶液(1mol/L):吸取53.2mL硫酸,缓缓加至900mL水中,并用水稀释至1000mL8.3
3标准品
大田软海绵酸(OAC44HesO13CAS号78111-17-8)标准溶液。8.4
标准溶液配制
标准系列工作液:将大田软海绵酸标准溶液用PBS溶液稀释,配制成浓度分别为0ug/L、5ug/L、10μg/L、25ug/L、50ug/L、100ug/L、150μg/L和200μg/L的DSP标准系列工作液。现用现配8.5材料
包被有腹泻性贝类毒素抗体的微孔板注:商业化试剂盒若评价技术参数达到本标准的要求则也适合于本标准,参见附录A。仪器和设备
酶标仪。
均质器。
离心机:转速≥6000r/min。
分析步骤
样品菜集
同5.1。
10.2试样制备
同5.2。
10.3试样提取
GB5009.212—2016
将剪碎的试样均质,准确称取10g(精确至0.1g),加人50mL甲醇溶液(90%),均质1min~2min,6o00rmin离心10min,转移出上清液,根据上清液体积加人2倍体积的PBS溶液,混合均匀,吸取50uL试样稀释液进行测定。10.4测定
将包被有腹泻性贝类毒素抗体的微孔条插人微孔架并做好标记,其中包括空白对照孔,标准液孔和样液孔,分别做平行孔。向空白对照孔加人50μLPBS溶液,标准液孔加人50μL腹泻性贝类毒素标准系列工作液,样液孔加入50uL样液。加人50uL腹泻性贝类毒素酶标记物至每个微孔,迅速充分混合,22℃~25℃避光孵育10min。孵育结束后,倒去孔中液体,每个微孔注入250μL洗脱液冲洗,翻转微孔板,倾去孔内液体,再重复以上洗板操作4次,在吸水纸上拍干。每孔加50uL过氧化氢和TMB.充分混合,室温避光孵育6min。每孔加人50μL硫酸溶液(1mol/L)迅速混匀,终止反应,在10min内测量并记录450nm波长下的吸光度值若提取液经测定后的质量浓度超出标准曲线的线性范围,应适当稀释后重新测定,10.5标准曲线的制作
以腹泻性贝类毒素标准工作液质量浓度以10为底的对数值为横坐标,以式(1)计算的标准液的百分比吸光度值为纵坐标,绘制标准曲线,腹泻性贝类毒素标准液或样液的百分比吸光度值按式(1)计算:S
×100%
式中:
A—百分比吸光度值;
S——腹泻性贝类毒素标准液或样液的平均吸光度值:-0ug/L的腹泻性贝类毒素标准液的平均吸光度值。So
11分析结果的表述
试样中腹泻性贝类毒素的含量按式(2)计算:X=exvx
式中:
试样中腹泻性贝类毒素的含量,单位为微克每克(ug/g);1)
·(2)
由标准曲线得到的试样待测液中腹泻性贝类毒素的质量浓度,单位为微克每毫升(ug/mL);
试样提取液的体积,单位为毫升(mL);稀释倍数;
试样的称样量,单位为克(g)。注:任何腹泻性贝类毒素含量大于16ug/100g的样品即被认为是有害的,对人类食用不安全。12其他
本方法的定量限为10μg/kg。
13原理
液相色谱-串联质谱法
GB 5009.212—2016
试样经甲醇提取,碱性条件下水解释放出酯化态腹泻性贝类毒素,液相色谱分离,串联质谱法测定,以基质标准曲线进行外标法定量14试剂和材料
除非另有说明,本方法所用试剂均为优级纯,水为GB/T6682规定的一级水14.1试剂
甲醇(CH,OH):色谱纯。
乙腈(CH,CN):色谱纯。
氨水(NH·H,O)。
氢氧化钠(NaOH)。
盐酸(HCI)
甲酸铵(NH,COOH):色谱纯。
甲酸(HCOOH):色谱纯。
试剂配制
甲醇溶液(30%):量取30mL甲醇,用水稀释至100mL。甲醇溶液(20%):量取20mL甲醇,用水稀释至100mL。氨水-甲醇溶液(0.3%):吸取0.3mL氨水,用甲醇稀释至100mL。氢氧化钠溶液(2.5mol/L):准确称取50g氢氧化钠,用水溶解并稀释至500mL。盐酸溶液(2.5mol/L):准确量取104.5mL盐酸,用水稀释至500mL。流动相A[甲酸铵溶液(2mmol/L)]:准确称取126mg甲酸铵.用50mL水将其全部溶解,加人2mL甲酸,加水定容至1000mL,室温下可保存48h。14.2.7流动相B[乙睛-甲酸铵溶液(2mmol/L)(95+5)l:准确称取126mg甲酸铵,用30mL水溶解,加人2mL甲酸,加水稀释至50mL,再加人950mL乙睛,室温下可保存48h14.3标准品
14.3.1大田软海绵酸(OA,CHO1a,CAS号78111-17-8)标准溶液:14.24μg/mL,或经国家认证并授予标准物质证书的一定浓度的OA标准溶液14.3.2鳍藻毒素-1(DTX-1,CsHzO13,CAS号81720-10-7)标准溶液:15.15μg/mL,或经国家认证并授予标准物质证书的一定浓度的DTX-1标准溶液。14.3.3鳍藻毒素-2(DTX-2.CH68Oi3,CAS号139933-46-3)标准溶液:7.80μg/mL,或经国家认证并授予标准物质证书的一定浓度的DTX-2标准溶液。14.4标准溶液配制
1腹泻性贝类毒素混合标准中间液:分别吸取适量的各腹泻性贝类毒素标准溶液于5mL棕色容14.4.1
GB5009.212—2016
量瓶中,用甲醇稀释并定容,使各腹泻性贝类毒素浓度分别为:OA1.0μg/mL,DTX-11.0μg/mL,DTX-21.0μg/mL。一18℃以下避光保存,保存期1个月。14.4.2腹泻性贝类毒素基质标准系列工作液:取5份空白试样,分别加入适量上述各浓度腹泻性贝类毒素混合标准中间液,按与试样相同的分析步骤处理,制成OA、DTX-1、DTX-2的质量浓度为0.8ng/mL、1.6ng/mL、4.0ng/mL.8.0ng/mL和16.0ng/mL的基质标准系列工作液,过0.22um的有机相微孔滤膜后备用。
14.5材料
固相萃取柱:硅胶表面修饰苯乙烯二乙烯基苯聚合物型固相萃取柱,60mg/3mL,或性能相当14.5.1
者。使用前依次用1mL甲醇、1mL甲醇溶液(30%)活化。微孔滤膜:0.22um,有机相。
仪器和设备
液相色谱-串联质谱仪:配电喷雾离子源天平:感量为0.01g。
组织均质器:转速≥10000r/min。涡旋振荡器
离心机:转速≥8000r/min。
超声波清洗器。
恒温干燥箱。
固相萃取装置。
真空泵。
氮吹仪。
pH计。
6分析步骤
16.1样品采集
同5.1。
16.2试样制备
同5.2。
16.3试样提取
16.3.1腹泻性贝类毒素提取
将剪碎的试样均质,准确称取2g(精确至0.01g)于50mL具塞离心管中,加人9mL甲醇,涡旋混合1min,超声提取10min,8000r/min下离心5min,移出上清液于20mL刻度玻璃管中。残渣中加人9mL甲醇,重复提取一次,合并提取液,用甲醇定容至20mL。16.3.2酯化态腹泻性贝类毒素水解释放准确吸取提取液1mL置于螺纹口样品瓶中,加人氢氧化钠溶液(2.5mol/L)125μL,混匀后用密GB5009.212—2016
封膜将瓶密封,于76℃下温育40min,冷至室温后,加人盐酸溶液(2.5mol/L)125μL并混匀,所得水解液(1.25ml相当于0.1g试样)可直接过0.22um有机相微孔滤膜后,供液相色谱-串联质谱测定,或者必要时进行净化处理。
16.4试样净化
所得水解液用3mL水稀释,涡旋混匀后,移人已预活化的聚合物型固相萃取柱,待液体以1mL/min的流速流出后,再用1mL甲醇溶液(20%)淋洗,弃去流出液,保持抽气2min,最后用1mL氨水甲醇溶液(0.3%)洗脱,保持抽气2min,收集洗脱液,用甲醇定容至1mL(相当于0.1g试样),过0.22μm的有机相微孔滤膜后,供液相色谱-串联质谱测定。16.5空白试验
除不加试样外,采用与试样相同的操作步骤,得到空白溶液。16.6
仪器参考条件
液相色谱参考条件:
色谱柱:Cis柱,柱长100mm,内径2.1mm,粒径3.5um,或性能相当者;b)
流速:0.2mL/min;
柱温:35℃;
进样量:10μL;
流动相:流动相A为甲酸铵溶液(2mmol/L),B为乙腈十甲酸铵溶液(2mmol/L)(95+5),梯度洗脱,梯度洗脱条件见表2。
2流动相梯度洗脱条件
时间/min
质谱参考条件
离子源:电喷雾离子源;
扫描模式:负离子扫描;
检测方式:多反应监测模式.OA、DTX-1、DTX-2母离子、子离子及去簇电压和碰撞能见表3;电喷雾电压(IS):-4000V;
雾化气压力(GS1):414kPa;
气帘气压力(CUR):104kPa;
碰撞气压力(CAD):83kPa;
辅助气流速(GS2):70L/min;离子源温度(TEM):550℃。
GB5009.212—2016
腹泻性贝类毒素多反应监测模式下母离子、子离子、去簇电压和碰撞能量目标化合物
大田软海绵酸
鳍藻毒素-1
(DTX-1)
鳍藻毒素-2
(DTX-2)
代表定量离子。
母离子
16.7基质校正标准曲线的制作
子离子
去簇电压
碰撞能量
将基质标准系列工作液分别注入液相色谱-串联质谱仪中,测定相应的峰面积,以标准工作液的质量浓度为横坐标,以峰面积为纵坐标,绘制标准曲线。腹泻性贝类毒素标准溶液的多反应监测色谱图参见图c.1。
16.8试样溶液的测定
将试样溶液注入液相色谱-串联质谱仪中,得到峰面积,根据基质标准曲线得到试样溶液中腹泻性贝类毒素的质量浓度。
在同样测试条件下,试样溶液中腹泻性贝类毒素的保留时间与基质标准工作液中腹泻性贝类毒素的保留时间之间的偏差在士2.5%以内,且试样溶液中腹泻性贝类毒素的定性离子的相对丰度应与质量浓度相近的基质标准工作液中腹泻性贝类毒素的定性离子的相对丰度一致,其丰度比偏差应符合表4要求,则可判定试样溶液中存在被测化合物。表4定性离子相对丰度的最大允许偏差定性离子相对丰度
允许的相对偏差
17分析结果的表述
>20%~50%
17.1试样中腹泻性贝类毒素的含量按式(3)计算:X
式中:
p.xV×1000
mx1000
>10%~20%
试样中腹泻性贝类毒素的含量,单位为微克每千克(ug/kg);≤10%
.(3)
由基质标准曲线得到的试样溶液中腹泻性贝类毒素的质量浓度,单位为纳克每毫升(ng/mL);
试样溶液的体积,单位为毫升(mL);换算因子;
与1mL试样提取液相当的试样质量,单位为克(g)。计算结果应扣除空白值。计算结果保留三位有效数字17.2
总毒力计算
试样中腹泻性贝类毒素总毒力按式(4)计算:OA
式中:
腹泻性贝类毒素总毒力,单位为微克每千克(μg/kg);OA
各种腹泻性贝类毒素的含量单位为微克每千克(μug/kg);毒性因子。
GB5009.212—2016
.(4)
注:试样中各种腹泻性贝类毒素的含量需按照附录B中的毒性因子(TEFs),统一转换为总毒力(OA)。18
精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的15%。其他
本方法中OA、DTX-1和DTX-2的检出限均为10.0μg/kg,OA、DTX-1和DTX-2的定量限均为30.0μg/kg。
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
GB5009.212—2016
食品安全国家标准
贝类中腹泻性贝类毒素的测定
2016-12-23发布
2017-06-23实施
中华人民共和国国家卫生和计划生育委员会国家食品药品监督管理总局
GB5009.212—2016
本标准代替GB/T5009.212—2008《贝类中腹泻性贝类毒素的测定》、SC/T3024—2004《腹泻性贝类毒素的测定生物法》、SN/T2269—2009《进出口贝肉中大田软海绵酸的检测液相色谱-串联质谱法》、SN/T2131.2—2010《进出口贝类腹泻性贝类毒素检验方法第2部分:小鼠生物法》、
SN/T1996—2007《贝类中腹泻性贝类毒素检验方法法酶联免疫吸附法》、SN/T2131.1-2008《进出口贝类腹泻性贝类毒素检测方法第1部分:荧光磷酸酶抑制法》。本标准与GB/T5009.212—2008相比,主要变化如下:标准名称修改为“食品安全国家标准贝类中腹泻性贝类毒素的测定”;增加了酶联免疫吸附法;
增加了液相色谱-串联质谱法。
1范围
食品安全国家标准
贝类中腹泻性贝类毒素的测定
GB5009.212—2016
本标准规定了贝类中腹泻性贝类毒素测定的小鼠生物法,酶联免疫吸附法和液相色谱-串联质谱法。
本标准中小鼠生物法和酶联免疫吸附法适用于贝类及其制品中腹泻性贝类毒素的测定,液相色谱串联质谱法适用于贝类可食部分及其制品(不包括盐渍制品)中腹泻性贝类毒素大田软海绵酸(OA)、鳍藻毒素-1(DTX-1)和鳍藻毒素-2(DTX-2)的测定。小鼠生物法
2原理
用丙酮提取贝类中腹泻性贝类毒素(DSP),经无水乙醚分配,减压蒸干后,再以含1%吐温-60的生理盐水为分散介质,制成DSP混悬液。将该混悬液注射入小鼠腹腔,观察小鼠存活情况,计算其毒力。3试剂和材料
除非另有说明,本方法所用试剂均为分析纯,水为GB/T6682规定的一级水。3.1试剂
3.1.1丙酮(CH。O)。
3.1.2无水乙醚(C,HO)。
3.1.3吐温-60(C64H126O26)。3.1.4氯化钠(NaCI)。
3.2试剂配制
氯化钠溶液(0.85%):称取0.85gNaCl.加水溶解并定容至100mL3.2.2吐温-60(1%):称取1.0g吐温-60,用氯化钠溶液(0.85%)溶解并定容至100mL3.3材料
小鼠:体重为16g~20g的健康ICR品系雄性小鼠。3.3.1
金属筛网:孔径约2mm。
4仪器和设备
旋转蒸发器。
4.2均质器。
4.3天平:感量为0.1g。
5分析步骤
GB5009.212—2016
注:为避免毒素的危害,应戴手套进行操作。移液管及移液器吸头等用过的器材、废弃的提取液等应在次氯酸钠溶液(5%)浸泡1h以上以使毒素分解。对于动物实验过程中产生的污水、废弃物及动物户体处理,应参照GB14925执行,
5.1样品菜集
采取足够的贝类样品个数,并使贝肉达400g以上。远离实验室不能及时送检的样品,除了在常温下品质不会发生变化的,应将样品置于保温盒中冷冻送检,或采取必要措施保证其处于低温状态(0℃~10℃)送检。如为带壳样品.应开壳,去除水分后冷冻送检。5.2试样制备
5.2.1生鲜带壳样品
用清水彻底洗净贝类样品外表,切断闭壳肌,开壳,用清水淋洗内部去除泥沙及其他异物,取出贝肉。严禁以加热或药物方法开壳。注意不要破环闭壳肌以外的组织,尤其是中肠腺(中肠腺又称消化育囊,组织呈暗绿色或褐绿色)。将去壳贝肉置于孔径约2mm的金属筛网上,沥水5min。将贝肉剪碎。5.2.2冷冻样品
在室温下使冷冻样品融化呈半冷冻状态。带壳冷冻的样品按5.2.1方法清洗、开壳、淋洗取肉,除去贝肉外部附着的冰片,抹去水分。将贝肉剪碎。5.3试样提取
称取200g剪碎的贝肉试样置于均质杯中,按体积比加3倍量丙酮后均质2min以上。将均质好的物质倒入布氏漏斗中抽滤,收集滤液。分别用残渣2倍量的内酮再清洗残渣两次,滤液与上述滤液合并。将滤液移入500mL的圆底烧瓶中,56℃土1℃下,减压浓缩去除丙酮直至在液体表面分离出油状物。
用100mL~200mL无水乙醚溶解油状物,倒人分液漏斗内,再用少量无水乙醚清洗圆底烧瓶,合并倒入分液漏斗内,以少量的水洗下粘壁部分,轻轻振荡(不能生成乳浊液),静置分层后去除水层(下层)。
用相当乙醚半量的水洗乙醚层两次,去除水层,再将乙醚层移人250mL或500mL的圆底烧瓶中,于35℃士1℃减压浓缩去除乙醚。用少量无水乙醚将浓缩物移50mL或100mL圆底烧瓶中,再次减压浓缩去除乙醚。
用1%吐温-60的生理盐水将全部浓缩物转移至刻度试管中稀释到10mL,充分振摇,制成均勾混悬液。1mL该混悬液相当于20g试样,以此混悬液为试验原液。以试验原液注射小鼠,当24h内2只或3只小鼠死亡时,需振荡试验原液使成均匀混悬液,用1%吐温-60生理盐水按表1逐步稀释成4倍或16倍的稀释液,充分混匀,按表1注射小鼠,5.4小鼠试验
选择16g~20g健康ICR雄性小鼠6只,随机分为实验组和溶剂对照组两组,每组3只。实验组将腹腔注射试验原液或其稀释液,溶剂对照组将腹腔注射1%吐温-60生理盐水。2
GB5009.212—2016
分别取1mL待测液或1%吐温-60生理盐水腹腔注射小鼠。注射过程中若有提取液溢出,须将该只小鼠丢弃,并重新注射一只小鼠。仔细观察并记录死亡时间。死亡时间计算从注射完毕开始至小鼠停止呼吸(小鼠呼出最后一口气止)为止。存活动物应连续观察24h。观察时限24h内,在溶剂对照组小鼠正常的情况下,实验组若出现2只或3只小鼠死亡,则按表1进一步实验,以确定一组3只小鼠中死亡2只或2只以上的最小染毒量或最大稀释度表1注射量、稀释度与毒力的关系注射液
试验原液1
试验原液2
4倍稀释液1
4倍稀释液2
16倍稀释液1
16倍稀释液2
6分析结果的表述
注射量
相对应的试样量
观察时限24h内,在溶剂对照组小鼠正常情况下,若实验组无小鼠死亡或仅有1只小鼠死亡,则报告样品中DSP毒力为:<0.05MU/g。观察时限24h内,在溶剂对照组小鼠正常情况下,若实验组有2只或3只小鼠死亡,则按5.4进行动物实验,并根据表1计算样品中DSP毒力,报告样品中DSP毒力为:XXXMU/g。酶联免疫吸附法下载标准就来标准下载网
7原理
根据竞争性酶联免疫反应,游离的腹泻性贝类毒素与其酶标记物竞争腹泻性贝类毒素抗体。没有被结合的酶标记物在洗涤步骤中被除去。将酶底物和显色剂加入到孔中并且孵育。结合的酶标记物将无色的发色剂转化为蓝色的产物。加入反应终止液后使颜色由蓝转变为黄色。用酶标仪在450nm波长下测量微孔溶液的吸光度值,试样中的腹泻性贝类毒素含量与吸光度值成反比,按绘制的标准曲线定量计算。
8试剂和材料
除非另有说明,本方法所用试剂均为分析纯,水为GB/T6682规定的一级水,8.1试剂
8.1.1甲醇(CH.OH)。
十二水合磷酸氢二钠(Na2HPO,·12H2O)。8.1.2
氯化钠(NaCI)。
8.1.4氯化钾(KCI)。
8.1.5磷酸二氢钾(KH,PO4)。
8.1.6吐温-20(CssHmO2)。
8.1.7牛血清白蛋白(BSA)。
8.1.8酶标记物
8.1.9过氧化氢(H,O2)
3355-四甲基联苯胺(TMB.CHN)。8.1.11
硫酸(H,SO)。
8.2试剂配制
甲醇溶液(90%):量取90mL甲醇,加入10mL水,混合均匀。GB5009.212—2016
8.2.2磷酸盐缓冲液(PBS溶液,pH7.4):分别称取磷酸二氢钾0.20g、十二水合磷酸氢二钠2.90g、氯化钠8.00g、氯化钾0.20g.加水溶解并定容至1000mL。8.2.3酶标记物稀释液:称取1.0gBSA,加PBS溶液溶解并定容至1000mL。8.2.4酶标记物工作液:用酶标记物稀释液将酶标记物稀释至工作浓度。8.2.5洗脱液:吸取0.5mL吐温-20加入PBS溶液中,并稀释至1000mL。8.2.6
硫酸溶液(1mol/L):吸取53.2mL硫酸,缓缓加至900mL水中,并用水稀释至1000mL8.3
3标准品
大田软海绵酸(OAC44HesO13CAS号78111-17-8)标准溶液。8.4
标准溶液配制
标准系列工作液:将大田软海绵酸标准溶液用PBS溶液稀释,配制成浓度分别为0ug/L、5ug/L、10μg/L、25ug/L、50ug/L、100ug/L、150μg/L和200μg/L的DSP标准系列工作液。现用现配8.5材料
包被有腹泻性贝类毒素抗体的微孔板注:商业化试剂盒若评价技术参数达到本标准的要求则也适合于本标准,参见附录A。仪器和设备
酶标仪。
均质器。
离心机:转速≥6000r/min。
分析步骤
样品菜集
同5.1。
10.2试样制备
同5.2。
10.3试样提取
GB5009.212—2016
将剪碎的试样均质,准确称取10g(精确至0.1g),加人50mL甲醇溶液(90%),均质1min~2min,6o00rmin离心10min,转移出上清液,根据上清液体积加人2倍体积的PBS溶液,混合均匀,吸取50uL试样稀释液进行测定。10.4测定
将包被有腹泻性贝类毒素抗体的微孔条插人微孔架并做好标记,其中包括空白对照孔,标准液孔和样液孔,分别做平行孔。向空白对照孔加人50μLPBS溶液,标准液孔加人50μL腹泻性贝类毒素标准系列工作液,样液孔加入50uL样液。加人50uL腹泻性贝类毒素酶标记物至每个微孔,迅速充分混合,22℃~25℃避光孵育10min。孵育结束后,倒去孔中液体,每个微孔注入250μL洗脱液冲洗,翻转微孔板,倾去孔内液体,再重复以上洗板操作4次,在吸水纸上拍干。每孔加50uL过氧化氢和TMB.充分混合,室温避光孵育6min。每孔加人50μL硫酸溶液(1mol/L)迅速混匀,终止反应,在10min内测量并记录450nm波长下的吸光度值若提取液经测定后的质量浓度超出标准曲线的线性范围,应适当稀释后重新测定,10.5标准曲线的制作
以腹泻性贝类毒素标准工作液质量浓度以10为底的对数值为横坐标,以式(1)计算的标准液的百分比吸光度值为纵坐标,绘制标准曲线,腹泻性贝类毒素标准液或样液的百分比吸光度值按式(1)计算:S
×100%
式中:
A—百分比吸光度值;
S——腹泻性贝类毒素标准液或样液的平均吸光度值:-0ug/L的腹泻性贝类毒素标准液的平均吸光度值。So
11分析结果的表述
试样中腹泻性贝类毒素的含量按式(2)计算:X=exvx
式中:
试样中腹泻性贝类毒素的含量,单位为微克每克(ug/g);1)
·(2)
由标准曲线得到的试样待测液中腹泻性贝类毒素的质量浓度,单位为微克每毫升(ug/mL);
试样提取液的体积,单位为毫升(mL);稀释倍数;
试样的称样量,单位为克(g)。注:任何腹泻性贝类毒素含量大于16ug/100g的样品即被认为是有害的,对人类食用不安全。12其他
本方法的定量限为10μg/kg。
13原理
液相色谱-串联质谱法
GB 5009.212—2016
试样经甲醇提取,碱性条件下水解释放出酯化态腹泻性贝类毒素,液相色谱分离,串联质谱法测定,以基质标准曲线进行外标法定量14试剂和材料
除非另有说明,本方法所用试剂均为优级纯,水为GB/T6682规定的一级水14.1试剂
甲醇(CH,OH):色谱纯。
乙腈(CH,CN):色谱纯。
氨水(NH·H,O)。
氢氧化钠(NaOH)。
盐酸(HCI)
甲酸铵(NH,COOH):色谱纯。
甲酸(HCOOH):色谱纯。
试剂配制
甲醇溶液(30%):量取30mL甲醇,用水稀释至100mL。甲醇溶液(20%):量取20mL甲醇,用水稀释至100mL。氨水-甲醇溶液(0.3%):吸取0.3mL氨水,用甲醇稀释至100mL。氢氧化钠溶液(2.5mol/L):准确称取50g氢氧化钠,用水溶解并稀释至500mL。盐酸溶液(2.5mol/L):准确量取104.5mL盐酸,用水稀释至500mL。流动相A[甲酸铵溶液(2mmol/L)]:准确称取126mg甲酸铵.用50mL水将其全部溶解,加人2mL甲酸,加水定容至1000mL,室温下可保存48h。14.2.7流动相B[乙睛-甲酸铵溶液(2mmol/L)(95+5)l:准确称取126mg甲酸铵,用30mL水溶解,加人2mL甲酸,加水稀释至50mL,再加人950mL乙睛,室温下可保存48h14.3标准品
14.3.1大田软海绵酸(OA,CHO1a,CAS号78111-17-8)标准溶液:14.24μg/mL,或经国家认证并授予标准物质证书的一定浓度的OA标准溶液14.3.2鳍藻毒素-1(DTX-1,CsHzO13,CAS号81720-10-7)标准溶液:15.15μg/mL,或经国家认证并授予标准物质证书的一定浓度的DTX-1标准溶液。14.3.3鳍藻毒素-2(DTX-2.CH68Oi3,CAS号139933-46-3)标准溶液:7.80μg/mL,或经国家认证并授予标准物质证书的一定浓度的DTX-2标准溶液。14.4标准溶液配制
1腹泻性贝类毒素混合标准中间液:分别吸取适量的各腹泻性贝类毒素标准溶液于5mL棕色容14.4.1
GB5009.212—2016
量瓶中,用甲醇稀释并定容,使各腹泻性贝类毒素浓度分别为:OA1.0μg/mL,DTX-11.0μg/mL,DTX-21.0μg/mL。一18℃以下避光保存,保存期1个月。14.4.2腹泻性贝类毒素基质标准系列工作液:取5份空白试样,分别加入适量上述各浓度腹泻性贝类毒素混合标准中间液,按与试样相同的分析步骤处理,制成OA、DTX-1、DTX-2的质量浓度为0.8ng/mL、1.6ng/mL、4.0ng/mL.8.0ng/mL和16.0ng/mL的基质标准系列工作液,过0.22um的有机相微孔滤膜后备用。
14.5材料
固相萃取柱:硅胶表面修饰苯乙烯二乙烯基苯聚合物型固相萃取柱,60mg/3mL,或性能相当14.5.1
者。使用前依次用1mL甲醇、1mL甲醇溶液(30%)活化。微孔滤膜:0.22um,有机相。
仪器和设备
液相色谱-串联质谱仪:配电喷雾离子源天平:感量为0.01g。
组织均质器:转速≥10000r/min。涡旋振荡器
离心机:转速≥8000r/min。
超声波清洗器。
恒温干燥箱。
固相萃取装置。
真空泵。
氮吹仪。
pH计。
6分析步骤
16.1样品采集
同5.1。
16.2试样制备
同5.2。
16.3试样提取
16.3.1腹泻性贝类毒素提取
将剪碎的试样均质,准确称取2g(精确至0.01g)于50mL具塞离心管中,加人9mL甲醇,涡旋混合1min,超声提取10min,8000r/min下离心5min,移出上清液于20mL刻度玻璃管中。残渣中加人9mL甲醇,重复提取一次,合并提取液,用甲醇定容至20mL。16.3.2酯化态腹泻性贝类毒素水解释放准确吸取提取液1mL置于螺纹口样品瓶中,加人氢氧化钠溶液(2.5mol/L)125μL,混匀后用密GB5009.212—2016
封膜将瓶密封,于76℃下温育40min,冷至室温后,加人盐酸溶液(2.5mol/L)125μL并混匀,所得水解液(1.25ml相当于0.1g试样)可直接过0.22um有机相微孔滤膜后,供液相色谱-串联质谱测定,或者必要时进行净化处理。
16.4试样净化
所得水解液用3mL水稀释,涡旋混匀后,移人已预活化的聚合物型固相萃取柱,待液体以1mL/min的流速流出后,再用1mL甲醇溶液(20%)淋洗,弃去流出液,保持抽气2min,最后用1mL氨水甲醇溶液(0.3%)洗脱,保持抽气2min,收集洗脱液,用甲醇定容至1mL(相当于0.1g试样),过0.22μm的有机相微孔滤膜后,供液相色谱-串联质谱测定。16.5空白试验
除不加试样外,采用与试样相同的操作步骤,得到空白溶液。16.6
仪器参考条件
液相色谱参考条件:
色谱柱:Cis柱,柱长100mm,内径2.1mm,粒径3.5um,或性能相当者;b)
流速:0.2mL/min;
柱温:35℃;
进样量:10μL;
流动相:流动相A为甲酸铵溶液(2mmol/L),B为乙腈十甲酸铵溶液(2mmol/L)(95+5),梯度洗脱,梯度洗脱条件见表2。
2流动相梯度洗脱条件
时间/min
质谱参考条件
离子源:电喷雾离子源;
扫描模式:负离子扫描;
检测方式:多反应监测模式.OA、DTX-1、DTX-2母离子、子离子及去簇电压和碰撞能见表3;电喷雾电压(IS):-4000V;
雾化气压力(GS1):414kPa;
气帘气压力(CUR):104kPa;
碰撞气压力(CAD):83kPa;
辅助气流速(GS2):70L/min;离子源温度(TEM):550℃。
GB5009.212—2016
腹泻性贝类毒素多反应监测模式下母离子、子离子、去簇电压和碰撞能量目标化合物
大田软海绵酸
鳍藻毒素-1
(DTX-1)
鳍藻毒素-2
(DTX-2)
代表定量离子。
母离子
16.7基质校正标准曲线的制作
子离子
去簇电压
碰撞能量
将基质标准系列工作液分别注入液相色谱-串联质谱仪中,测定相应的峰面积,以标准工作液的质量浓度为横坐标,以峰面积为纵坐标,绘制标准曲线。腹泻性贝类毒素标准溶液的多反应监测色谱图参见图c.1。
16.8试样溶液的测定
将试样溶液注入液相色谱-串联质谱仪中,得到峰面积,根据基质标准曲线得到试样溶液中腹泻性贝类毒素的质量浓度。
在同样测试条件下,试样溶液中腹泻性贝类毒素的保留时间与基质标准工作液中腹泻性贝类毒素的保留时间之间的偏差在士2.5%以内,且试样溶液中腹泻性贝类毒素的定性离子的相对丰度应与质量浓度相近的基质标准工作液中腹泻性贝类毒素的定性离子的相对丰度一致,其丰度比偏差应符合表4要求,则可判定试样溶液中存在被测化合物。表4定性离子相对丰度的最大允许偏差定性离子相对丰度
允许的相对偏差
17分析结果的表述
>20%~50%
17.1试样中腹泻性贝类毒素的含量按式(3)计算:X
式中:
p.xV×1000
mx1000
>10%~20%
试样中腹泻性贝类毒素的含量,单位为微克每千克(ug/kg);≤10%
.(3)
由基质标准曲线得到的试样溶液中腹泻性贝类毒素的质量浓度,单位为纳克每毫升(ng/mL);
试样溶液的体积,单位为毫升(mL);换算因子;
与1mL试样提取液相当的试样质量,单位为克(g)。计算结果应扣除空白值。计算结果保留三位有效数字17.2
总毒力计算
试样中腹泻性贝类毒素总毒力按式(4)计算:OA
式中:
腹泻性贝类毒素总毒力,单位为微克每千克(μg/kg);OA
各种腹泻性贝类毒素的含量单位为微克每千克(μug/kg);毒性因子。
GB5009.212—2016
.(4)
注:试样中各种腹泻性贝类毒素的含量需按照附录B中的毒性因子(TEFs),统一转换为总毒力(OA)。18
精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的15%。其他
本方法中OA、DTX-1和DTX-2的检出限均为10.0μg/kg,OA、DTX-1和DTX-2的定量限均为30.0μg/kg。
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。