GB 23200.76-2016
基本信息
标准号: GB 23200.76-2016
中文名称:食品安全国家标准 食品中氟苯虫酰胺残留量的测定 液相色谱-质谱 质谱法
标准类别:国家标准(GB)
标准状态:现行
出版语种:简体中文
下载格式:.rar .pdf
下载大小:377KB
相关标签: 食品安全 国家标准 食品 酰胺 残留量 测定 色谱 质谱 质谱法

标准分类号
关联标准
出版信息
相关单位信息
标准简介
GB 23200.76-2016 食品安全国家标准 食品中氟苯虫酰胺残留量的测定 液相色谱-质谱 质谱法
GB23200.76-2016
标准压缩包解压密码:www.bzxz.net
标准图片预览




标准内容
ICS点击此处添加ICS号
点击此处添加中国标准文献分类号GB
中华人民共和国国家标准
GB23200.762016
代替SN/T2581—2010
食品安全国家标准
食品中氟苯虫酰胺残留量的测定液相色谱-质谱/质谱法
Nationalfoodsafetystandards-DeterminationofflubendiamideresidueinfoodsLiquid chromatography - mass spectrometry2016-12-18发布
2017-06-18实施
中华人民共和国国家卫生和计划生育委员会中华人民共和国农业部
国家食品药品监督管理总局
GB×xxx—xxxx
本标准代替SN/T2581-2010《进出口食品中氟虫酰胺残留量的测定液相色谱一质谱/质谱法》本标准与SN/T2581-2010相比,主要变化如下:一标准文本格式修改为食品安全国家标准文本格式:一标准名称中“进出口食品”改为“食品”;一标准范围中增加“其它食品可参照执行”。本标准所代替标准的历次版本发布情况为:—SN/T2581-2010。
食品安全国家标准
GB23200.76-2016
食品中氟苯虫酰胺残留量的测定液相色谱-质谱/质谱法1范围
本标准规定了食品中氟苯虫酰胺残留量测定的液相色谱-质谱/质谱分析方法。本标准适用于葱、萝卜、西红柿、橙、大豆、苹果、茶、核桃、鱼、猪瘦肉、猪肝和牛奶中氟苯虫酰胺残留量的检测和确证,其它食品可参照执行。2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅所注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。GB2763食品安全国家标准食品中农药最大残留限量GB/T6682分析实验室用水规格和试验方法3原理
试样中的氟苯虫酰胺残留用乙提取,提取液经石墨碳-氨基固相萃取柱或弗罗里硅土固相萃取柱净化,液相色谱-质谱/质谱测定,外标法定量。4试剂和材料
所有试剂除特殊注明外,均为分析纯,水为GB/T6682规定的一级水。4.1试剂
4.1.1乙腈(C2H,N):色谱纯。4.1.2甲苯(C,Hg):色谱纯。
4.1.3正已烷(C6H14):色谱纯。4.1.4丙酮(C,H.O):色谱纯。4.1.5氯化钠(NaCI)。
4.1.6无水硫酸钠(Na2SO4):650℃灼烧4h,在干燥器内冷却至室温,贮于密封瓶中备用。4.2溶液配制
4.2.1乙腈饱和正已烷:250mL的分液漏斗中加入150ml正已烷和50mL乙腈混匀震荡5min,取上层备用。
乙睛-甲苯(3+1,V/V):用量筒量取350mL乙和150mL甲苯混匀备用4.2.3丙酮-正已烷(1+1,V/V):用量筒量取200mL正已烷和200mL丙酮混匀备用4.2.4乙腈-水(7+3,V/V):用量筒量取350mL乙睛和150mL水混匀备用。4.3标准品
4.3.1氟苯虫酰胺(Flubendiamide)标准品:纯度大于等于99%,CAS号:272451-65-7,分子式:C23H22FIN204S,分子量为682.39。4.4标准溶液配制
4.4.1氟苯虫酰胺标准储备溶液(100μg/mL):准确称取适量的氟苯虫酰胺标准物质,用乙睛配成浓度为100μg/mL的标准储备液,该标准储备液置于4℃冰箱中避光密封保存。4.4.2氟苯虫酰胺基质标准工作液:使用前根据需要将标准储备溶液用各种样本的空白基质稀释成适当浓度的标准工作液。基质标准工作液应现用现配。4.5材料
GB23200.762016
4.5.1石墨碳-氨基固相萃取柱:500mg/500mg,5mL或相当者。加样前先用5mL乙腈-甲苯预淋洗柱。
4.5.2弗罗里硅土固相萃取柱:1000mg,5mL或相当者。加样前依次用2mL丙酮和4mL正已烷预淋洗柱。
4.5.3微孔滤膜:0.2μm,通用型。5仪器和设备
5.1液相色谱-质谱/质谱仪:配电喷雾离子源(ESI)。5.2分析天平:感量0.01g和0.0001g。5.3组织捣碎机。
5.4均质器:10000r/min。
5.5离心机:4000r/min。
5.6聚四氟乙烯塑料离心管:50mL,具塞。5.7旋转蒸发仪。
5.8氮吹仪。
6试样制备和保存
6.1试样制备
6.1.1茶叶、大豆、核桃
取代表性样品约500g,经组织捣碎机粉碎并通过2.0mm圆孔筛,混匀,装入洁净容器内密封,标明标记。
6.1.2葱、萝卜、西红柿、橙、苹果、鱼、猪瘦肉、猪肝取代表性样品约500g,切碎,经组织捣碎机充分捣碎均匀,装入洁净容器内密封,标明标记。6.1.3牛奶
取代表性样品约500g,装入洁净容器内密封,标明标记。注:以上样品取样部位按GB2763附录A执行。6.2试样保存
茶叶、粮谷、坚果类等试样于0℃~4℃保存:蔬菜、水果、畜、禽类等试样于-18℃冷冻保存。在制样过程中,应防止样品受到污染或发生氟苯虫酰胺残留量的变化。7分析步骤
7.1提取
7.1.1葱、萝卜、西红柿、橙、大豆、苹果、茶、核桃大豆、核桃和茶叶:称取2g(精确至0.01g)试样于50mL离心管中,加5mL水放置0.5h;葱、萝卜、西红柿、橙、苹果:称取2g(精确至0.01g)试样于50mL离心管中。加入20mL乙睛,以10000r/min均质1min,加入2g氯化钠,摇匀,并于4000r/min离心3min。吸取上层有机相于浓缩瓶中,残渣中加入15mL乙睛,重复提取一次,合并上层有机相,在40℃水浴中减压浓缩至近干,待净化。7.1.2鱼、猪瘦肉、猪肝、牛奶
称取粉碎后试样2g(精确至0.01g)于50mL离心管中,加入2g无水硫酸钠,20mL乙睛和10mL乙睛饱和正已烷,以10000r/min均质1min,以4000r/min离心3min,吸取下层有机相于浓缩瓶中,残渣中加入15mL乙睛,重复提取一次,合并下层有机相,在40℃水浴中减压浓缩至近干,待净化。7.2净化
7.2.1葱、萝卜、西红柿、橙、大豆、苹果、茶叶、核桃2bzxZ.net
GB23200.76-2016
以3×2mL乙睛-甲苯洗涤浓缩瓶中残留物并全部转入石墨碳-氨基固相萃取柱中,然后用15mL乙-甲苯淋洗柱子,控制流速不超过2.0mL/min,收集全部流出液,于40℃水浴中减压浓缩,氮吹至近干,用乙睛-水溶解残渣并定容至2.0mL,过滤膜,供分析。7.2.2鱼、猪瘦肉、猪肝、牛奶
以3×2mL正已烷洗涤浓缩瓶中残留物并全部转入弗罗里硅土固相萃取柱中,待溶液全部流出固相萃取柱后加入2mL正已烷淋洗,弃去全部流出液。再以10mL内酮-正已烷洗脱,控制流速不超过2.0mL/min,收集全部洗脱液,于40℃水浴中减压浓缩,氮吹至近干,用乙睛-水溶解残渣并定容至2.0mL,过滤膜,供分析。
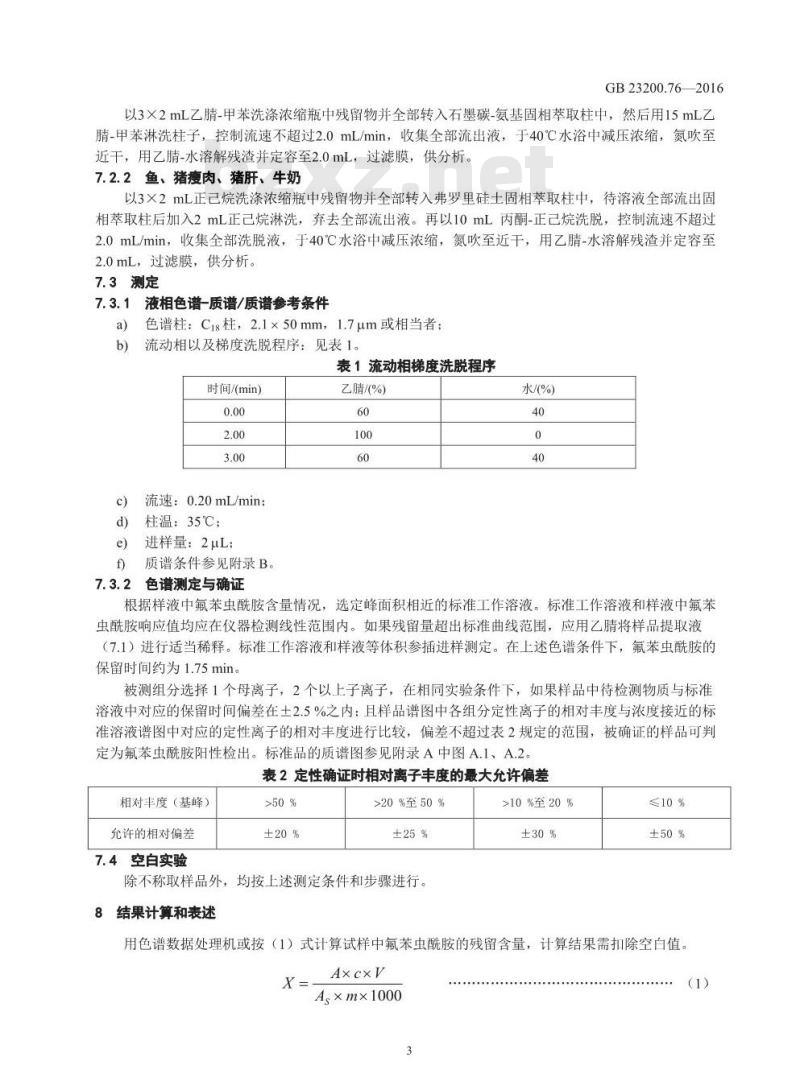
7.3测定
7.3.1液相色谱-质谱/质谱参考条件a)
色谱柱:C8柱,2.1×50mm,1.7um或相当者;流动相以及梯度洗脱程序:见表1。b)
表1流动相梯度洗脱程序
时间/(min)
流速:0.20mL/min;
柱温:35℃:
进样量:2uL;
质谱条件参见附录B。
7.3.2色谱测定与确证
乙晴/(%)
水/%)
根据样液中氟苯虫酰胺含量情况,选定峰面积相近的标准工作溶液。标准工作溶液和样液中氟苯虫酰胺响应值均应在仪器检测线性范围内。如果残留量超出标准曲线范围,应用乙睛将样品提取液(7.1)进行适当稀释。标准工作溶液和样液等体积参插进样测定。在上述色谱条件下,氟苯虫酰胺的保留时间约为1.75min。
被测组分选择1个母离子,2个以上子离子,在相同实验条件下,如果样品中待检测物质与标准溶液中对应的保留时间偏差在土2.5%之内:且样品谱图中各组分定性离子的相对丰度与浓度接近的标准溶液谱图中对应的定性离子的相对丰度进行比较,偏差不超过表2规定的范围,被确证的样品可判定为氟苯虫酰胺阳性检出。标准品的质谱图参见附录A中图A.1、A.2。表2定性确证时相对离子丰度的最大允许偏差相对丰度(基峰)
允许的相对偏差
7.4空白实验
>20%至50%
除不称取样品外,均按上述测定条件和步骤进行。结果计算和表述
>10%至20%
≤10%
用色谱数据处理机或按(1)式计算试样中氟苯虫酰胺的残留含量,计算结果需扣除空白值。X=
A×mx1000
式中:
X一试样中氟苯虫酰胺的残留量,单位为毫克每千克(mg/kg);A一样液中氟苯虫酰胺的峰面积或峰高;As标准工作液中氟苯虫酰胺的峰面积或峰高:c一标准工作液中氟苯虫酰胺的浓度,单位为纳克每毫升(ng/mL):m一最终样液所代表的试样质量,单位为克(g);V一样液最终定容体积,单位为毫升(mL)。注:计算结果须扣除空白值,测定结果用平行测定的算术平均值表示,保留两位有效数字。9精密度
GB23200.762016
9.1在重复性条件下获得的两次独立测定结果的绝对差值与其算术平均值的比值(百分率),应符合附录D的要求,
9.2在再现性条件下获得的两次独立测定结果的绝对差值与其算术平均值的比值(百分率),应符合附录E的要求
10定量限和回收率
1定量限
本方法氟苯虫酰胺的定量限为0.005mg/kg。10.2回收率
氟苯虫酰胺的添加回收率参见附录C。4
JISU 94 (0.892) Cm (85:94)
100120140160180200220240
附录A
(资料性附录)
氟苯虫酰胺标准品LC/MSMS质谱图GB23200.762016
Daughesdes
400.420.240.4o480..500..520.540.ao.58060060406666.zm图A.1氟苯虫酰胺标准品的离子全扫描质谱图(浓度为5ng/mL)090123-083Smooth(Mn.1x2)
MRMof2channels.ES.50hh/k10
681.1>254.1
3.196e+003
0.501001502.002.503.003.504.004.505.00mn
df2taES
图A.2氟苯虫酰胺标准品的多反应监测(MRM)色谱图(浓度为5ng/mL)5
附录B
(资料性附录)
氟苯虫酰胺液相色谱-串联质谱条件离子源:电喷雾离子源(ESI),负离子扫描:检测方式:多反应选择离子检测(MRM):电喷雾电压(IS):2500V:
GB23200.762016
雾化气、气帘气、辅助加热气、碰撞气均为高纯氮气及其它合适气体:使用前应调节各气体流量以使质谱灵敏度达到检测要求;辅助气温度(TEM):250℃:
离子源温度:110℃:
定性离子对、定量离子对、采集时间、去簇电压及碰撞能量见表1。表B.1氟苯虫酰胺监测离子对、定量离子对、去簇电压及碰撞能被测物名称
氟苯虫酰胺
监测离子对
/(m/2)
681.1/254.1
681.1/274.1
定量离子对
/(m/2)
681.1/254.1
驻留时间
去族电压
碰撞能量
(资料性附录)
不同基质中氟苯虫酰胺的添加回收率GB23200.762016
回收率和变异系数
表C.1不同基质中氟苯虫酰胺添加浓度、(n=10)
样品名称
西红柿
猪瘦肉
添加浓度(mg/kg)
回收率范围(%)
70.0~99.6
88.5~98.1
77.6~100.4
68.0~95.6
77.5~107.8
91.0~108.7
92.6~108.9
68.0~86.0
73.0~86.6
61.8~95.3
76.4~109.6
78.6~110.0
68.4~91.2
78.7~100.2
68.4~95.4
71.7~88.4
66.3~72.4
91.1~94.9
68.4~97.8
75.4~91.1
84.0~91.5
74.7~95.8
81.7~100.7
87.8~98.7
88.3-99.4
79.6~109.6
83.6~110.8
82.0~107.1
66.6~83.4
74.6~81.5
70.8~96.1
81.7~94.3
84.3~101.0
87.5~100.8
74.8~89.6
84.0~94.5
被测组分含量
>0.001≤0.01
>0.01s0.1
(规范性附录)
实验室内重复性要求
表D.1实验室内重复性要求
精密度
GB23200.762016
被测组分含量
>0.001≤0.01
>0.01≤0.1
(规范性附录)
实验室间再现性要求
表E.1实验室间再现性要求
精密度
GB23200.762016
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
点击此处添加中国标准文献分类号GB
中华人民共和国国家标准
GB23200.762016
代替SN/T2581—2010
食品安全国家标准
食品中氟苯虫酰胺残留量的测定液相色谱-质谱/质谱法
Nationalfoodsafetystandards-DeterminationofflubendiamideresidueinfoodsLiquid chromatography - mass spectrometry2016-12-18发布
2017-06-18实施
中华人民共和国国家卫生和计划生育委员会中华人民共和国农业部
国家食品药品监督管理总局
GB×xxx—xxxx
本标准代替SN/T2581-2010《进出口食品中氟虫酰胺残留量的测定液相色谱一质谱/质谱法》本标准与SN/T2581-2010相比,主要变化如下:一标准文本格式修改为食品安全国家标准文本格式:一标准名称中“进出口食品”改为“食品”;一标准范围中增加“其它食品可参照执行”。本标准所代替标准的历次版本发布情况为:—SN/T2581-2010。
食品安全国家标准
GB23200.76-2016
食品中氟苯虫酰胺残留量的测定液相色谱-质谱/质谱法1范围
本标准规定了食品中氟苯虫酰胺残留量测定的液相色谱-质谱/质谱分析方法。本标准适用于葱、萝卜、西红柿、橙、大豆、苹果、茶、核桃、鱼、猪瘦肉、猪肝和牛奶中氟苯虫酰胺残留量的检测和确证,其它食品可参照执行。2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅所注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。GB2763食品安全国家标准食品中农药最大残留限量GB/T6682分析实验室用水规格和试验方法3原理
试样中的氟苯虫酰胺残留用乙提取,提取液经石墨碳-氨基固相萃取柱或弗罗里硅土固相萃取柱净化,液相色谱-质谱/质谱测定,外标法定量。4试剂和材料
所有试剂除特殊注明外,均为分析纯,水为GB/T6682规定的一级水。4.1试剂
4.1.1乙腈(C2H,N):色谱纯。4.1.2甲苯(C,Hg):色谱纯。
4.1.3正已烷(C6H14):色谱纯。4.1.4丙酮(C,H.O):色谱纯。4.1.5氯化钠(NaCI)。
4.1.6无水硫酸钠(Na2SO4):650℃灼烧4h,在干燥器内冷却至室温,贮于密封瓶中备用。4.2溶液配制
4.2.1乙腈饱和正已烷:250mL的分液漏斗中加入150ml正已烷和50mL乙腈混匀震荡5min,取上层备用。
乙睛-甲苯(3+1,V/V):用量筒量取350mL乙和150mL甲苯混匀备用4.2.3丙酮-正已烷(1+1,V/V):用量筒量取200mL正已烷和200mL丙酮混匀备用4.2.4乙腈-水(7+3,V/V):用量筒量取350mL乙睛和150mL水混匀备用。4.3标准品
4.3.1氟苯虫酰胺(Flubendiamide)标准品:纯度大于等于99%,CAS号:272451-65-7,分子式:C23H22FIN204S,分子量为682.39。4.4标准溶液配制
4.4.1氟苯虫酰胺标准储备溶液(100μg/mL):准确称取适量的氟苯虫酰胺标准物质,用乙睛配成浓度为100μg/mL的标准储备液,该标准储备液置于4℃冰箱中避光密封保存。4.4.2氟苯虫酰胺基质标准工作液:使用前根据需要将标准储备溶液用各种样本的空白基质稀释成适当浓度的标准工作液。基质标准工作液应现用现配。4.5材料
GB23200.762016
4.5.1石墨碳-氨基固相萃取柱:500mg/500mg,5mL或相当者。加样前先用5mL乙腈-甲苯预淋洗柱。
4.5.2弗罗里硅土固相萃取柱:1000mg,5mL或相当者。加样前依次用2mL丙酮和4mL正已烷预淋洗柱。
4.5.3微孔滤膜:0.2μm,通用型。5仪器和设备
5.1液相色谱-质谱/质谱仪:配电喷雾离子源(ESI)。5.2分析天平:感量0.01g和0.0001g。5.3组织捣碎机。
5.4均质器:10000r/min。
5.5离心机:4000r/min。
5.6聚四氟乙烯塑料离心管:50mL,具塞。5.7旋转蒸发仪。
5.8氮吹仪。
6试样制备和保存
6.1试样制备
6.1.1茶叶、大豆、核桃
取代表性样品约500g,经组织捣碎机粉碎并通过2.0mm圆孔筛,混匀,装入洁净容器内密封,标明标记。
6.1.2葱、萝卜、西红柿、橙、苹果、鱼、猪瘦肉、猪肝取代表性样品约500g,切碎,经组织捣碎机充分捣碎均匀,装入洁净容器内密封,标明标记。6.1.3牛奶
取代表性样品约500g,装入洁净容器内密封,标明标记。注:以上样品取样部位按GB2763附录A执行。6.2试样保存
茶叶、粮谷、坚果类等试样于0℃~4℃保存:蔬菜、水果、畜、禽类等试样于-18℃冷冻保存。在制样过程中,应防止样品受到污染或发生氟苯虫酰胺残留量的变化。7分析步骤
7.1提取
7.1.1葱、萝卜、西红柿、橙、大豆、苹果、茶、核桃大豆、核桃和茶叶:称取2g(精确至0.01g)试样于50mL离心管中,加5mL水放置0.5h;葱、萝卜、西红柿、橙、苹果:称取2g(精确至0.01g)试样于50mL离心管中。加入20mL乙睛,以10000r/min均质1min,加入2g氯化钠,摇匀,并于4000r/min离心3min。吸取上层有机相于浓缩瓶中,残渣中加入15mL乙睛,重复提取一次,合并上层有机相,在40℃水浴中减压浓缩至近干,待净化。7.1.2鱼、猪瘦肉、猪肝、牛奶
称取粉碎后试样2g(精确至0.01g)于50mL离心管中,加入2g无水硫酸钠,20mL乙睛和10mL乙睛饱和正已烷,以10000r/min均质1min,以4000r/min离心3min,吸取下层有机相于浓缩瓶中,残渣中加入15mL乙睛,重复提取一次,合并下层有机相,在40℃水浴中减压浓缩至近干,待净化。7.2净化
7.2.1葱、萝卜、西红柿、橙、大豆、苹果、茶叶、核桃2bzxZ.net
GB23200.76-2016
以3×2mL乙睛-甲苯洗涤浓缩瓶中残留物并全部转入石墨碳-氨基固相萃取柱中,然后用15mL乙-甲苯淋洗柱子,控制流速不超过2.0mL/min,收集全部流出液,于40℃水浴中减压浓缩,氮吹至近干,用乙睛-水溶解残渣并定容至2.0mL,过滤膜,供分析。7.2.2鱼、猪瘦肉、猪肝、牛奶
以3×2mL正已烷洗涤浓缩瓶中残留物并全部转入弗罗里硅土固相萃取柱中,待溶液全部流出固相萃取柱后加入2mL正已烷淋洗,弃去全部流出液。再以10mL内酮-正已烷洗脱,控制流速不超过2.0mL/min,收集全部洗脱液,于40℃水浴中减压浓缩,氮吹至近干,用乙睛-水溶解残渣并定容至2.0mL,过滤膜,供分析。
7.3测定
7.3.1液相色谱-质谱/质谱参考条件a)
色谱柱:C8柱,2.1×50mm,1.7um或相当者;流动相以及梯度洗脱程序:见表1。b)
表1流动相梯度洗脱程序
时间/(min)
流速:0.20mL/min;
柱温:35℃:
进样量:2uL;
质谱条件参见附录B。
7.3.2色谱测定与确证
乙晴/(%)
水/%)
根据样液中氟苯虫酰胺含量情况,选定峰面积相近的标准工作溶液。标准工作溶液和样液中氟苯虫酰胺响应值均应在仪器检测线性范围内。如果残留量超出标准曲线范围,应用乙睛将样品提取液(7.1)进行适当稀释。标准工作溶液和样液等体积参插进样测定。在上述色谱条件下,氟苯虫酰胺的保留时间约为1.75min。
被测组分选择1个母离子,2个以上子离子,在相同实验条件下,如果样品中待检测物质与标准溶液中对应的保留时间偏差在土2.5%之内:且样品谱图中各组分定性离子的相对丰度与浓度接近的标准溶液谱图中对应的定性离子的相对丰度进行比较,偏差不超过表2规定的范围,被确证的样品可判定为氟苯虫酰胺阳性检出。标准品的质谱图参见附录A中图A.1、A.2。表2定性确证时相对离子丰度的最大允许偏差相对丰度(基峰)
允许的相对偏差
7.4空白实验
>20%至50%
除不称取样品外,均按上述测定条件和步骤进行。结果计算和表述
>10%至20%
≤10%
用色谱数据处理机或按(1)式计算试样中氟苯虫酰胺的残留含量,计算结果需扣除空白值。X=
A×mx1000
式中:
X一试样中氟苯虫酰胺的残留量,单位为毫克每千克(mg/kg);A一样液中氟苯虫酰胺的峰面积或峰高;As标准工作液中氟苯虫酰胺的峰面积或峰高:c一标准工作液中氟苯虫酰胺的浓度,单位为纳克每毫升(ng/mL):m一最终样液所代表的试样质量,单位为克(g);V一样液最终定容体积,单位为毫升(mL)。注:计算结果须扣除空白值,测定结果用平行测定的算术平均值表示,保留两位有效数字。9精密度
GB23200.762016
9.1在重复性条件下获得的两次独立测定结果的绝对差值与其算术平均值的比值(百分率),应符合附录D的要求,
9.2在再现性条件下获得的两次独立测定结果的绝对差值与其算术平均值的比值(百分率),应符合附录E的要求
10定量限和回收率
1定量限
本方法氟苯虫酰胺的定量限为0.005mg/kg。10.2回收率
氟苯虫酰胺的添加回收率参见附录C。4
JISU 94 (0.892) Cm (85:94)
100120140160180200220240
附录A
(资料性附录)
氟苯虫酰胺标准品LC/MSMS质谱图GB23200.762016
Daughesdes
400.420.240.4o480..500..520.540.ao.58060060406666.zm图A.1氟苯虫酰胺标准品的离子全扫描质谱图(浓度为5ng/mL)090123-083Smooth(Mn.1x2)
MRMof2channels.ES.50hh/k10
681.1>254.1
3.196e+003
0.501001502.002.503.003.504.004.505.00mn
df2taES
图A.2氟苯虫酰胺标准品的多反应监测(MRM)色谱图(浓度为5ng/mL)5
附录B
(资料性附录)
氟苯虫酰胺液相色谱-串联质谱条件离子源:电喷雾离子源(ESI),负离子扫描:检测方式:多反应选择离子检测(MRM):电喷雾电压(IS):2500V:
GB23200.762016
雾化气、气帘气、辅助加热气、碰撞气均为高纯氮气及其它合适气体:使用前应调节各气体流量以使质谱灵敏度达到检测要求;辅助气温度(TEM):250℃:
离子源温度:110℃:
定性离子对、定量离子对、采集时间、去簇电压及碰撞能量见表1。表B.1氟苯虫酰胺监测离子对、定量离子对、去簇电压及碰撞能被测物名称
氟苯虫酰胺
监测离子对
/(m/2)
681.1/254.1
681.1/274.1
定量离子对
/(m/2)
681.1/254.1
驻留时间
去族电压
碰撞能量
(资料性附录)
不同基质中氟苯虫酰胺的添加回收率GB23200.762016
回收率和变异系数
表C.1不同基质中氟苯虫酰胺添加浓度、(n=10)
样品名称
西红柿
猪瘦肉
添加浓度(mg/kg)
回收率范围(%)
70.0~99.6
88.5~98.1
77.6~100.4
68.0~95.6
77.5~107.8
91.0~108.7
92.6~108.9
68.0~86.0
73.0~86.6
61.8~95.3
76.4~109.6
78.6~110.0
68.4~91.2
78.7~100.2
68.4~95.4
71.7~88.4
66.3~72.4
91.1~94.9
68.4~97.8
75.4~91.1
84.0~91.5
74.7~95.8
81.7~100.7
87.8~98.7
88.3-99.4
79.6~109.6
83.6~110.8
82.0~107.1
66.6~83.4
74.6~81.5
70.8~96.1
81.7~94.3
84.3~101.0
87.5~100.8
74.8~89.6
84.0~94.5
被测组分含量
>0.001≤0.01
>0.01s0.1
(规范性附录)
实验室内重复性要求
表D.1实验室内重复性要求
精密度
GB23200.762016
被测组分含量
>0.001≤0.01
>0.01≤0.1
(规范性附录)
实验室间再现性要求
表E.1实验室间再现性要求
精密度
GB23200.762016
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。