GB 19083-2010
标准分类号
关联标准
出版信息
相关单位信息
标准简介
标准号:GB 19083-2010
标准名称:医用防护口罩技术要求
英文名称:Technical requirements for protective face mask for medical use
标准格式:PDF
发布时间:2010-09-02
实施时间:2011-08-01
标准大小:10.8M
标准介绍:本标准代替GB 19083-2003《医用防护口罩技术要求》
本标准与GB19083-2003标准相比,主要变化内容如下:
修改了标准适用“范围”;
补充和修订了“规范性引用文件”;
增加和编辑性修改了术语和定义;
删除了口罩的尺寸要求;
删除了对鼻夹长度的要求;
增加了“密合性”要求和试验方法;
依据GB/T16886.10-2005修订了“皮肤刺激性”技术要求,明确了试验方法;
删除了标志与使用说明书的技术要求;
环氧乙烷残留量对应试验方法,用GB/T14233.1-2008中的气相色谱法代替了原来的GB159801995中规定的检测方法;
修订了微生物指标的测试方法
本标准的附录B为规范性附录,附录A为资料性附录。
本标准由国家食品药品监督管理局提出。
本标准由全国医用临床检验实验室和体外诊断系统标准化技术委员会归口
本标准起草单位:北京市医疗器械检验所。
本标准主要起草人:苏健、毕春雷、廖晓曼、章兆园。
本标准所代替标准的历次版本发布情况为:
GB19083-2003 1范围
本标准规定了医用防护口罩(以下简称口罩)的技术要求、试验方法、标志与使用说明及包装、运输和贮存。
本标准适用于医疗工作环境下,过滤空气中的颗粒物,阻隔飞沫、血液、体液、分泌物等的自吸过滤式医用防护口罩。
2规范性引用文件
下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括期误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准
GB/T191包装储运图示标志
GB/T24281998成年人头面部尺寸
GB/T4745—1997纺织织物表面抗湿性测定沾水试验
GB/T55491990表面活性剂用拉起液膜法测定表面张力
GB/T14233.1-2008医用输液、输血、注射器具检验方法第1部分:化学分析方法
GB/T14233.2-2005医用输液、输血、注射器具检验方法第2部分:生物学试验方法
GB159792002一次性使用卫生用品卫生标准
GB/T16886.10-2005医疗器械生物学评价第10部分:刺激与迟发型超敏反应试验
GB/T186642002呼吸防护用品的选择、使用与维护
YY/T0691-2008传染性病原体防护装备医用面罩抗合成血穿透性试验方法(固定体积、水平喷射)
YY/T0700-2008血液和体液防护装备防护服材料抗血液和体液穿透性能測试合成血试验
标准名称:医用防护口罩技术要求
英文名称:Technical requirements for protective face mask for medical use
标准格式:PDF
发布时间:2010-09-02
实施时间:2011-08-01
标准大小:10.8M
标准介绍:本标准代替GB 19083-2003《医用防护口罩技术要求》
本标准与GB19083-2003标准相比,主要变化内容如下:
修改了标准适用“范围”;
补充和修订了“规范性引用文件”;
增加和编辑性修改了术语和定义;
删除了口罩的尺寸要求;
删除了对鼻夹长度的要求;
增加了“密合性”要求和试验方法;
依据GB/T16886.10-2005修订了“皮肤刺激性”技术要求,明确了试验方法;
删除了标志与使用说明书的技术要求;
环氧乙烷残留量对应试验方法,用GB/T14233.1-2008中的气相色谱法代替了原来的GB159801995中规定的检测方法;
修订了微生物指标的测试方法
本标准的附录B为规范性附录,附录A为资料性附录。
本标准由国家食品药品监督管理局提出。
本标准由全国医用临床检验实验室和体外诊断系统标准化技术委员会归口
本标准起草单位:北京市医疗器械检验所。
本标准主要起草人:苏健、毕春雷、廖晓曼、章兆园。
本标准所代替标准的历次版本发布情况为:
GB19083-2003 1范围
本标准规定了医用防护口罩(以下简称口罩)的技术要求、试验方法、标志与使用说明及包装、运输和贮存。
本标准适用于医疗工作环境下,过滤空气中的颗粒物,阻隔飞沫、血液、体液、分泌物等的自吸过滤式医用防护口罩。
2规范性引用文件
下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括期误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准
GB/T191包装储运图示标志
GB/T24281998成年人头面部尺寸
GB/T4745—1997纺织织物表面抗湿性测定沾水试验
GB/T55491990表面活性剂用拉起液膜法测定表面张力
GB/T14233.1-2008医用输液、输血、注射器具检验方法第1部分:化学分析方法
GB/T14233.2-2005医用输液、输血、注射器具检验方法第2部分:生物学试验方法
GB159792002一次性使用卫生用品卫生标准
GB/T16886.10-2005医疗器械生物学评价第10部分:刺激与迟发型超敏反应试验
GB/T186642002呼吸防护用品的选择、使用与维护
YY/T0691-2008传染性病原体防护装备医用面罩抗合成血穿透性试验方法(固定体积、水平喷射)
YY/T0700-2008血液和体液防护装备防护服材料抗血液和体液穿透性能測试合成血试验
标准图片预览




标准内容
ICS11.100
iiiKAa~cJouakAa
中华人民共和宝宝标准
GB19083—2010
代替GB190832003
医用防护口罩技术要求
Technical requirements for protective face mask for medical use2010-09-02发布
中华人民共和国国家质量监督检验检疫总局中国国家标准化管理委员会
2011-08-01实施
iiiKAa~cJouaKAa-
本标准的4.10为推荐性,其余的为强制性。本标准代替GB19083—2003《医用防护口罩技术要求》。本标准与GB19083一2003标准相比,主要变化内容如下:修改了标准适用“范围”;
补充和修订了“规范性引用文件”;增加和编辑性修改了术语和定义;删除了口罩的尺寸要求;
删除了对夹长度的要求;
增加了“密合性”要求和试验方法;GB19083—2010
依据GB/T16886.102005修订了“皮肤刺激性”技术要求,明确了试验方法;删除了标志与使用说明书的技术要求环氧乙烷残留量对应试验方法,用GB/T14233.1一2008中的气相色谱法代替了原来的GB159801995中规定的检测方法;修订了微生物指标的测试方法。本标准的附录B为规范性附录,附录A为资料性附录。本标准由国家食品药品监督管理局提出。本标准由全国医用临床检验实验室和体外诊断系统标准化技术委员会归口。本标准起草单位:北京市医疗器械检验所。本标准主要起草人:苏健、毕春雷、廖晓曼、章兆园。本标准所代替标准的历次版本发布情况为:GB19083—2003。
1范围
iiiKAa~cJouaKAa-
医用防护口罩技术要求
GB19083—2010
本标准规定了医用防护口罩(以下简称口罩)的技术要求、试验方法、标志与使用说明及包装、运输和存。
本标准适用于医疗工作环境下,过滤空气中的颗粒物,阻隔飞沫、血液、体液、分泌物等的自吸过滤式医用防护口罩。
2规范性引用文件
下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括期误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。GB/T191包装储运图示标志
GB/T2428—1998成年人头面部尺寸GB/T4745—1997
GB/T55491990
纺织织物表面抗湿性测定沾水试验表面活性剂用拉起液膜法测定表面张力GB/T14233.1—2008
GB/T14233.22005
GB159792002
医用输液、输血、注射器具检验方法第1部分:化学分析方法医用输液、输血、注射器具检验方法第2部分:生物学试验方法一次性使用卫生用品卫生标准
GB/T16886.102005
医疗器械生物学评价第10部分:刺激与迟发型超敏反应试验GB/T18664—2002
YY/T0691—2008
喷射)
YY/T0700—2008
3术语和定义
呼吸防护用品的选择、使用与维护传染性病原体防护装备
医用面罩抗合成血穿透性试验方法(固定体积、水平血液和体液防护装备
下列术语和定义适用于本标准。3.1
过滤效率filteringefficiency
防护服材料抗血液和体液穿透性能测试合成血试验在规定条件下,口罩对空气中的颗粒物滤除的百分数3.2
密合性fit
口罩周边与具体使用者面部的密合程度。3.3
适合因数fitfactor
在人佩戴口罩模拟作业活动过程中,定量测量口罩外部检验剂浓度与漏人内部的浓度的比值。4、技术要求
4.1口罩基本要求
口罩应覆盖佩戴者的口鼻部,应有良好的面部密合性,表面不得有破洞、污渍,不应有呼气阅。GB19083-—2010
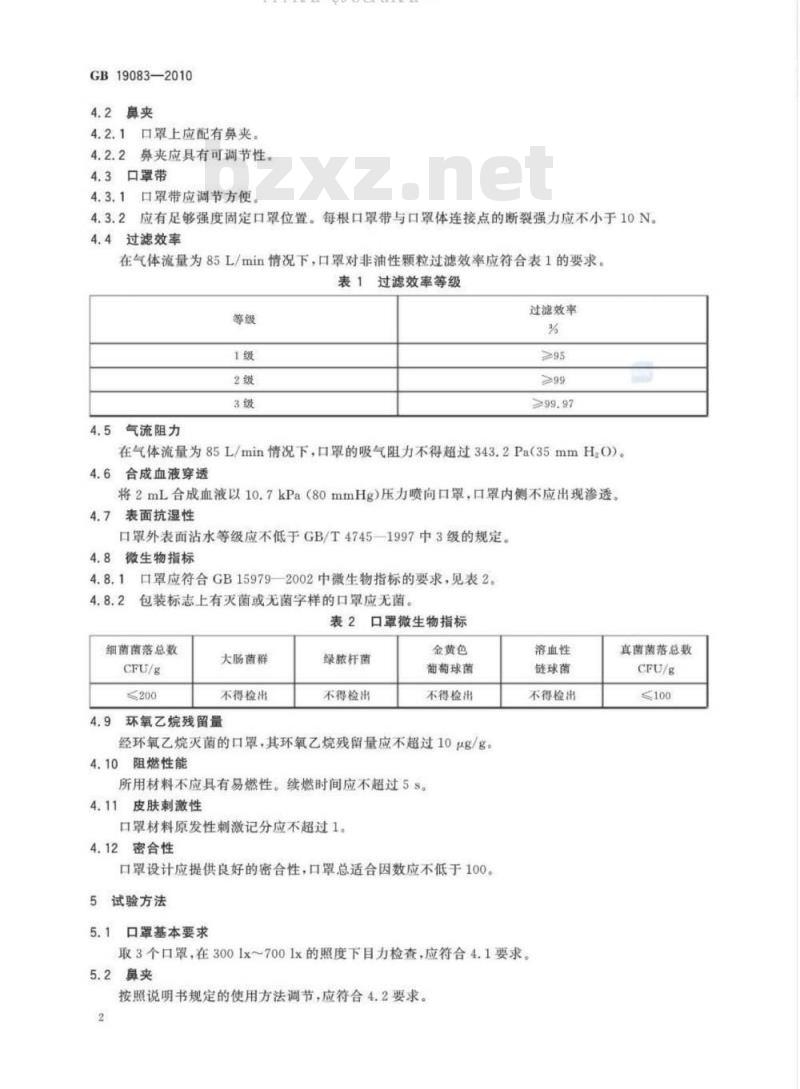
4.2鼻夹
4.2.1口罩上应配有鼻夹。
iiiKAa~cJouaKAa
4.2.2鼻夹应具有可调节性
4.3口罩带
4.3.1口罩带应调节方便
4.3.2应有足够强度固定口罩位置。每根口罩带与口罩体连接点的断裂强力应不小于10N。4.4过滤效率
在气体流量为85L/min情况下,口罩对非油性颗粒过滤效率应符合表1的要求。表1过滤效率等级
气流阻力
过滤效率
在气体流量为85L/min情况下,口罩的吸气阻力不得超过343.2Pa(35mmH,O)。4.6合成血液穿透
将2mL合成血液以10.7kPa(80mmHg)压力喷向口罩,口罩内侧不应出现渗透。4.7表面抗湿性
口罩外表面沾水等级应不低于GB/T47451997中3级的规定4.8微生物指标
口罩应符合GB159792002中微生物指标的要求,见表2。4.8.2
包装标志上有灭菌或无菌字样的口罩应无菌。表2口罩微生物指标
细菌菌落总数
≤200
大肠茵群
不得检出
环氧乙烷残留量
绿脓杆菌
不得检出
金黄色
葡葡球菌
不得检出
经环氧乙烷灭菌的口罩,其环氧乙烷残留量应不超过10ug/g。4.10阻燃性能
所用材料不应具有易燃性。续燃时间应不超过5s。4.11皮肤刺激性
口罩材料原发性刺激记分应不超过1。4.12密合性
口罩设计应提供良好的密合性,口罩总适合因数应不低于100。5
试验方法
口罩基本要求
取3个口罩,在3001x~7001x的照度下目力检查,应符合4.1要求5.2鼻夹
按照说明书规定的使用方法调节,应符合4.2要求。2
溶血性
健球菌
不得检出
真菌菌落总数
≤100
5.3口罩带
iiiKAa~cJouaKa-
GB19083—2010
5.3.1样品数量:取4个口罩,打开包装,其中2个进行温度预处理,2个不进行预处理。5.3.2温度预处理条件:
预处理条件为:
a)70℃士3℃环境试验箱中放置24h;b)-30℃土3℃环境试验箱中放置24h。经温度预处理后应在室温条件下恢复至少4h。5.3.3通过目力检查和拉力试验装置测量,结果均应符合4.3要求。5.4过滤效率与气流阻力试验
5.4.1样品数量:应该使用6个口罩样品进行试验。3个经过温度预处理,3个不经过预处理。5.4.2温度预处理条件:
预处理条件为:
a)70℃士3℃环境试验箱中放置24h;b)-30℃土3℃环境试验箱中放置24h。经温度预处理后应在室温条件下恢复至少4h。5.4.3气体流量应该稳定至85L/min士2L/min。规定试验条件用的氯化钠(NaCI)气溶胶颗粒大小分布应为粒数中值直径(CMD)在0.075μm士0.020μm,儿何标准差不超过1.86(相当于空气动力学质量中值直径(MMAD)0.24μm士0.06μm)。浓度不超过200mg/m
5.4.3.1过滤效率测定结果均应符合4.4的要求。5.4.3.2吸气阻力测定结果均应符合4.5的要求。5.5合成血液穿透
5.5.1样品数量:应该使用5个口罩样品进行试验。5.5.2预处理条件:口罩样品在21℃士5℃,相对湿度85%土5%环境试验箱中预处理至少4h。口罩样品从环境箱中取出1min内作测试。5.5.3按照YY/T0691一2008的试验方法进行试验,其结果应符合4.6的规定。合成血的配制方法见附录A。
5.6表面抗湿性试验
取3个口罩,参照GB/T47451997规定的方法进行测试,其结果均应符合4.7的要求。5.7微生物指标
5.7.1按照GB15979—2002中附录B规定的方法进行试验,结果应符合4.8.1的要求。5.7.2标志为灭菌或无菌的口罩按照GB/T14233.22005规定的方法进行试验,结果应符合4.8.2的要求。
5.8环氧乙烷残留量
5.8.1气相色谱仪条件
气相色谱仪应满足下列条件:
氢焰检定器:灵敏度不小于2×10-g/s(苯,二硫化碳(CS)))。a)
色谱柱:所用色谱柱应能使试样中杂质和环氧乙烷完全分开,并有一定的耐水性。色谱柱可选用表3推荐的条件。
表3色谱柱推荐条件
2mm~3mm
GDX-407177μm~147μm(80日~100日)Porapakg-s
177μm~147μm(80日~100日)
约130℃
约120℃
GB19083—2010
仪器各部件温度bZxz.net
气化室:200℃:
检测室:250℃。
d)气流量
iiiKAacJouakAa
N:15mL/min~30mL/min;
H:30mL/min;
空气:300mL/min
5.8.2测试步骤
按照GB/T14233.1一20089.4GB15980-一1995中附录G规定的极限浸提法,以水为溶剂进行平行试验,按照GB/T14233.1-20089.5.2GB15980—1995中附录G规定的相对含量法进行测定,结果以算术平均值计算,如一份合格,另一份不合格,不得平均计算,应重新测定。结果应符合4.9的要求。
5.9阻燃性能
5.9.1样品数量:应检测4个口罩样品。2个经过温度预处理,2个不经过预处理。5.9.2温度预处理条件:
预处理条件为:
a)70℃±3℃空气中24h;
b)-30℃±3℃空气中24h
在温度预处理后应在室温恢复至少4h5.9.3步骤:
5.9.3.1将口罩戴在金属买模上,燃烧器的顶端和口罩的最低部分当直接对着燃烧器放置时)的距离应设置在20mm士2mm。
5.9.3.2将火焰高度调节在40mm士4mm。在燃烧器顶端上方20mm土2mm处用金属隔离的热电偶探针测量火焰的温度,应为800℃50℃。5.9.3.3将头模以60mm/s土5mm/s运动线速度通过火焰,并记录口罩通过一次火焰后的燃烧状态。结果应符合4.10要求。
5.10皮肤刺激性
按照GB/T16886.102005中规定的原发皮肤刺激方法进行试验,其结果应符合本标准4.11的规定。
5.11密合性
选10名受试者,按照使用说明书佩带好口罩,作6个规定动作,按照附录B中规定方法测试,应至少有8名受试者总适合因数符合要求。6标志与使用说明
6.1标志
6.1.1口罩最小包装的标志
口罩最小包装上至少应有以下清楚易认的标志,如果包装是透明的,应可以透过包装看到标志:a)产品名称、型号:
生产企业或供货商的名称;
执行标准号;
产品注册号:
滤料级别或相应说明;
“使用前请参见使用说明”的文字或符号;g)
iiiKAa~cJouaKAa-
贮存条件及有效期;
一次性使用产品应标明“一次性使用”或相当字样:如为灭菌产品应注明灭菌有效期及灭菌方式。包装箱标志:
包装箱上至少应有以下内容或标志:a)
生产企业或供货商名称和地址;产品名称、型号;
执行标准号;
产品注册号;
规格数量;
生产日期或批号;
防晒,怕湿等字样和标志,标志应符合GB/T191的规定;贮存条件及有效期。
2使用说明
使用说明至少应使用中文,并应至少给出下列内容:a)
用途和使用限制;
产品颜色代码的意义(如适用);使用前需进行的检查;
佩戴适合性;
使用方法;
贮存条件;
所使用的符号和(或)图示的含义;应给出可能会出现的问题及注意事项;有关口罩使用时间的建议;
执行标准号:
产品注册号。
包装和购存
7.1包装
7.1.1口罩的包装应该能够防止机械损坏和使用前的污染7.1.2口罩按数量装箱。
7.2购存
按使用说明的规定进行。
GB19083—2010
GB19083—2010
A.1试剂
iiiKAa~cJouaKAa
附录A
(资料性附录)
合成血液配制方法
按照如下配方制备1L合成血液:羧甲基纤维素钠L例如,CMC-Sigma9004-32-4中粘度聚氧乙烯(20)山梨糖醇酐单月桂酸酯(例如,吐温20[Fluka9377])氯化钠(分析纯)
苋菜红染料[例如,Sigma915-67-3](915-67-3)磷酸二氢钾(KHPO)
磷酸氢二钠(NaHPO)
蒸馏水或去离子水
注1:可在合成血液中加人2-甲基4异壁唑啉-3-酮盐酸盐(MIT)(0.5g/L))以延长溶液的贮存期。2g
加至1L
注2:Sigma9004-32-4,Fluka9377.Sigma915-67-3以及Fluka9377是合适的商用产品举例。给出这一信息是为了方便本标准的使用者,并不代表对该产品的认可。A.2配制方法
将羧甲基纤维素钠溶解在0.5L水中,在磁力搅拌器上混勾60min,在一个小烧杯中称量吐温20,加人水混匀。将吐温20溶液加到羧甲基纤维素钠溶液中,用蒸馏水将烧杯洗儿次加到前溶液中。将NaCI溶解在溶液中。将KHPO,和NaHPO,溶解在溶液中。加人MIT(如使用)和苋菜红染料。用水将溶液稀释近1000mL。
用磷酸盐缓冲液将合成血液的pH调节至7.3士0.1,定容至1000mL。按照GB/T55491990测量合成血液的表面张力,结果应是0.042N/m士0.002N/m。6
B.1试验环境
iiiKAa~cJouakAa
附录B
(规范性附录)
适合性试验方法
GB19083—2010
试验空间大小应能容纳受试者自由进行规定的测试动作。空气中颗粒数应不小于70×10°个/m如颗粒数过少,可使用气溶胶发生器增加环境中的颗粒,气溶胶发生器产生颗粒的粒数中值直径(CMD)在约为0.04μm,儿何标准差约为2.2(相当于空气动力学质量中值直径(MMAD)0.26μm)。如使用氯化钠气落胶,则空气的相对湿度应不天于50%。B.2安装口罩采样管
在口罩接近佩带者口部的“呼吸区域”穿刺,安装采样管。采样管应在受试者颈部佩戴的支持装置上固定以减小试验过程中对口罩的干扰。B.3试验步骤
选10名受试者,男女各半,买型符合GB/T2428一1998中国头型系列。男性刮掉胡须。按照使用说明佩戴好口罩。测试前应进行检查,包括口罩无移动趋势、口罩带不要过松或过紧、鼻夹贴适鼻梁,周边不要漏气等。测试过程进行中不允许再调整。要求受试者做以下6个规定动作,每个动作做1min:正常呼吸一站立姿势,正常呼吸速度,不说话。a
深呼吸一一站立姿势,慢慢深呼吸,注意不要呼气过度。左右转头站立姿势,缓缓向一侧转头到极限位置后再转向另一侧,在每个极限位置都应有e
吸气。
上下活动头部一缓缓低头,再缓缓抬头,在抬头的极限位置应有吸气动作。e
说话大声缓慢说话。让受试者从100倒数或读一段文章。f)正常呼吸同a)。
B.4计算适合因数
B.4.1通过计算测得的口罩外部颗粒的平均浓度和口罩内部平均浓度的比值来计算每个动作的适合因数。
口罩外的颗粒平均浓度可以用试验前后(6个动作)浓度的算术平均值,或每个动作前后浓度的平均值,也可用连续测量的真实平均值。B.4.3口罩内的浓度用下列方法之一计算:平均峰值穿透法:用带状记录仪、积分器或计算机确定进入口罩内的颗粒数量。对每一个动a)
作,通过计算记录纸上平均峰值高度或通过计算机积分来确定颗粒数量。也可用积分器或计算机计算实际进人口罩内颗粒数量。最大峰值穿透法:用带状记录仪确定进人口罩内的颗粒数量。每个给定动作颗粒穿过的最高b)
峰代表该动作进入口罩内的平均进入量。面积积分法:对每个动作峰值下的面积积分计算。包括计算机积分。计算总适合因数:先将每个动作的适合因数转换为穿透值,计算平均值,然后再把结果转换回d)
适合因数。如式(B.1)。
GB19083—2010
式中:
iiiKAa~cJouaKa
FF=17.+1/+1/。+1/。+1/.+1/
总适合因数:
。—正常呼吸的适合因数;
深呼吸的适合因数;
行。左右转头的适合因数;
。——上下活动头部的适合因数;f。
说话的适合因数;
正常呼吸的适合因数。
.....(B.1)
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
iiiKAa~cJouakAa
中华人民共和宝宝标准
GB19083—2010
代替GB190832003
医用防护口罩技术要求
Technical requirements for protective face mask for medical use2010-09-02发布
中华人民共和国国家质量监督检验检疫总局中国国家标准化管理委员会
2011-08-01实施
iiiKAa~cJouaKAa-
本标准的4.10为推荐性,其余的为强制性。本标准代替GB19083—2003《医用防护口罩技术要求》。本标准与GB19083一2003标准相比,主要变化内容如下:修改了标准适用“范围”;
补充和修订了“规范性引用文件”;增加和编辑性修改了术语和定义;删除了口罩的尺寸要求;
删除了对夹长度的要求;
增加了“密合性”要求和试验方法;GB19083—2010
依据GB/T16886.102005修订了“皮肤刺激性”技术要求,明确了试验方法;删除了标志与使用说明书的技术要求环氧乙烷残留量对应试验方法,用GB/T14233.1一2008中的气相色谱法代替了原来的GB159801995中规定的检测方法;修订了微生物指标的测试方法。本标准的附录B为规范性附录,附录A为资料性附录。本标准由国家食品药品监督管理局提出。本标准由全国医用临床检验实验室和体外诊断系统标准化技术委员会归口。本标准起草单位:北京市医疗器械检验所。本标准主要起草人:苏健、毕春雷、廖晓曼、章兆园。本标准所代替标准的历次版本发布情况为:GB19083—2003。
1范围
iiiKAa~cJouaKAa-
医用防护口罩技术要求
GB19083—2010
本标准规定了医用防护口罩(以下简称口罩)的技术要求、试验方法、标志与使用说明及包装、运输和存。
本标准适用于医疗工作环境下,过滤空气中的颗粒物,阻隔飞沫、血液、体液、分泌物等的自吸过滤式医用防护口罩。
2规范性引用文件
下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括期误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。GB/T191包装储运图示标志
GB/T2428—1998成年人头面部尺寸GB/T4745—1997
GB/T55491990
纺织织物表面抗湿性测定沾水试验表面活性剂用拉起液膜法测定表面张力GB/T14233.1—2008
GB/T14233.22005
GB159792002
医用输液、输血、注射器具检验方法第1部分:化学分析方法医用输液、输血、注射器具检验方法第2部分:生物学试验方法一次性使用卫生用品卫生标准
GB/T16886.102005
医疗器械生物学评价第10部分:刺激与迟发型超敏反应试验GB/T18664—2002
YY/T0691—2008
喷射)
YY/T0700—2008
3术语和定义
呼吸防护用品的选择、使用与维护传染性病原体防护装备
医用面罩抗合成血穿透性试验方法(固定体积、水平血液和体液防护装备
下列术语和定义适用于本标准。3.1
过滤效率filteringefficiency
防护服材料抗血液和体液穿透性能测试合成血试验在规定条件下,口罩对空气中的颗粒物滤除的百分数3.2
密合性fit
口罩周边与具体使用者面部的密合程度。3.3
适合因数fitfactor
在人佩戴口罩模拟作业活动过程中,定量测量口罩外部检验剂浓度与漏人内部的浓度的比值。4、技术要求
4.1口罩基本要求
口罩应覆盖佩戴者的口鼻部,应有良好的面部密合性,表面不得有破洞、污渍,不应有呼气阅。GB19083-—2010
4.2鼻夹
4.2.1口罩上应配有鼻夹。
iiiKAa~cJouaKAa
4.2.2鼻夹应具有可调节性
4.3口罩带
4.3.1口罩带应调节方便
4.3.2应有足够强度固定口罩位置。每根口罩带与口罩体连接点的断裂强力应不小于10N。4.4过滤效率
在气体流量为85L/min情况下,口罩对非油性颗粒过滤效率应符合表1的要求。表1过滤效率等级
气流阻力
过滤效率
在气体流量为85L/min情况下,口罩的吸气阻力不得超过343.2Pa(35mmH,O)。4.6合成血液穿透
将2mL合成血液以10.7kPa(80mmHg)压力喷向口罩,口罩内侧不应出现渗透。4.7表面抗湿性
口罩外表面沾水等级应不低于GB/T47451997中3级的规定4.8微生物指标
口罩应符合GB159792002中微生物指标的要求,见表2。4.8.2
包装标志上有灭菌或无菌字样的口罩应无菌。表2口罩微生物指标
细菌菌落总数
≤200
大肠茵群
不得检出
环氧乙烷残留量
绿脓杆菌
不得检出
金黄色
葡葡球菌
不得检出
经环氧乙烷灭菌的口罩,其环氧乙烷残留量应不超过10ug/g。4.10阻燃性能
所用材料不应具有易燃性。续燃时间应不超过5s。4.11皮肤刺激性
口罩材料原发性刺激记分应不超过1。4.12密合性
口罩设计应提供良好的密合性,口罩总适合因数应不低于100。5
试验方法
口罩基本要求
取3个口罩,在3001x~7001x的照度下目力检查,应符合4.1要求5.2鼻夹
按照说明书规定的使用方法调节,应符合4.2要求。2
溶血性
健球菌
不得检出
真菌菌落总数
≤100
5.3口罩带
iiiKAa~cJouaKa-
GB19083—2010
5.3.1样品数量:取4个口罩,打开包装,其中2个进行温度预处理,2个不进行预处理。5.3.2温度预处理条件:
预处理条件为:
a)70℃士3℃环境试验箱中放置24h;b)-30℃土3℃环境试验箱中放置24h。经温度预处理后应在室温条件下恢复至少4h。5.3.3通过目力检查和拉力试验装置测量,结果均应符合4.3要求。5.4过滤效率与气流阻力试验
5.4.1样品数量:应该使用6个口罩样品进行试验。3个经过温度预处理,3个不经过预处理。5.4.2温度预处理条件:
预处理条件为:
a)70℃士3℃环境试验箱中放置24h;b)-30℃土3℃环境试验箱中放置24h。经温度预处理后应在室温条件下恢复至少4h。5.4.3气体流量应该稳定至85L/min士2L/min。规定试验条件用的氯化钠(NaCI)气溶胶颗粒大小分布应为粒数中值直径(CMD)在0.075μm士0.020μm,儿何标准差不超过1.86(相当于空气动力学质量中值直径(MMAD)0.24μm士0.06μm)。浓度不超过200mg/m
5.4.3.1过滤效率测定结果均应符合4.4的要求。5.4.3.2吸气阻力测定结果均应符合4.5的要求。5.5合成血液穿透
5.5.1样品数量:应该使用5个口罩样品进行试验。5.5.2预处理条件:口罩样品在21℃士5℃,相对湿度85%土5%环境试验箱中预处理至少4h。口罩样品从环境箱中取出1min内作测试。5.5.3按照YY/T0691一2008的试验方法进行试验,其结果应符合4.6的规定。合成血的配制方法见附录A。
5.6表面抗湿性试验
取3个口罩,参照GB/T47451997规定的方法进行测试,其结果均应符合4.7的要求。5.7微生物指标
5.7.1按照GB15979—2002中附录B规定的方法进行试验,结果应符合4.8.1的要求。5.7.2标志为灭菌或无菌的口罩按照GB/T14233.22005规定的方法进行试验,结果应符合4.8.2的要求。
5.8环氧乙烷残留量
5.8.1气相色谱仪条件
气相色谱仪应满足下列条件:
氢焰检定器:灵敏度不小于2×10-g/s(苯,二硫化碳(CS)))。a)
色谱柱:所用色谱柱应能使试样中杂质和环氧乙烷完全分开,并有一定的耐水性。色谱柱可选用表3推荐的条件。
表3色谱柱推荐条件
2mm~3mm
GDX-407177μm~147μm(80日~100日)Porapakg-s
177μm~147μm(80日~100日)
约130℃
约120℃
GB19083—2010
仪器各部件温度bZxz.net
气化室:200℃:
检测室:250℃。
d)气流量
iiiKAacJouakAa
N:15mL/min~30mL/min;
H:30mL/min;
空气:300mL/min
5.8.2测试步骤
按照GB/T14233.1一20089.4GB15980-一1995中附录G规定的极限浸提法,以水为溶剂进行平行试验,按照GB/T14233.1-20089.5.2GB15980—1995中附录G规定的相对含量法进行测定,结果以算术平均值计算,如一份合格,另一份不合格,不得平均计算,应重新测定。结果应符合4.9的要求。
5.9阻燃性能
5.9.1样品数量:应检测4个口罩样品。2个经过温度预处理,2个不经过预处理。5.9.2温度预处理条件:
预处理条件为:
a)70℃±3℃空气中24h;
b)-30℃±3℃空气中24h
在温度预处理后应在室温恢复至少4h5.9.3步骤:
5.9.3.1将口罩戴在金属买模上,燃烧器的顶端和口罩的最低部分当直接对着燃烧器放置时)的距离应设置在20mm士2mm。
5.9.3.2将火焰高度调节在40mm士4mm。在燃烧器顶端上方20mm土2mm处用金属隔离的热电偶探针测量火焰的温度,应为800℃50℃。5.9.3.3将头模以60mm/s土5mm/s运动线速度通过火焰,并记录口罩通过一次火焰后的燃烧状态。结果应符合4.10要求。
5.10皮肤刺激性
按照GB/T16886.102005中规定的原发皮肤刺激方法进行试验,其结果应符合本标准4.11的规定。
5.11密合性
选10名受试者,按照使用说明书佩带好口罩,作6个规定动作,按照附录B中规定方法测试,应至少有8名受试者总适合因数符合要求。6标志与使用说明
6.1标志
6.1.1口罩最小包装的标志
口罩最小包装上至少应有以下清楚易认的标志,如果包装是透明的,应可以透过包装看到标志:a)产品名称、型号:
生产企业或供货商的名称;
执行标准号;
产品注册号:
滤料级别或相应说明;
“使用前请参见使用说明”的文字或符号;g)
iiiKAa~cJouaKAa-
贮存条件及有效期;
一次性使用产品应标明“一次性使用”或相当字样:如为灭菌产品应注明灭菌有效期及灭菌方式。包装箱标志:
包装箱上至少应有以下内容或标志:a)
生产企业或供货商名称和地址;产品名称、型号;
执行标准号;
产品注册号;
规格数量;
生产日期或批号;
防晒,怕湿等字样和标志,标志应符合GB/T191的规定;贮存条件及有效期。
2使用说明
使用说明至少应使用中文,并应至少给出下列内容:a)
用途和使用限制;
产品颜色代码的意义(如适用);使用前需进行的检查;
佩戴适合性;
使用方法;
贮存条件;
所使用的符号和(或)图示的含义;应给出可能会出现的问题及注意事项;有关口罩使用时间的建议;
执行标准号:
产品注册号。
包装和购存
7.1包装
7.1.1口罩的包装应该能够防止机械损坏和使用前的污染7.1.2口罩按数量装箱。
7.2购存
按使用说明的规定进行。
GB19083—2010
GB19083—2010
A.1试剂
iiiKAa~cJouaKAa
附录A
(资料性附录)
合成血液配制方法
按照如下配方制备1L合成血液:羧甲基纤维素钠L例如,CMC-Sigma9004-32-4中粘度聚氧乙烯(20)山梨糖醇酐单月桂酸酯(例如,吐温20[Fluka9377])氯化钠(分析纯)
苋菜红染料[例如,Sigma915-67-3](915-67-3)磷酸二氢钾(KHPO)
磷酸氢二钠(NaHPO)
蒸馏水或去离子水
注1:可在合成血液中加人2-甲基4异壁唑啉-3-酮盐酸盐(MIT)(0.5g/L))以延长溶液的贮存期。2g
加至1L
注2:Sigma9004-32-4,Fluka9377.Sigma915-67-3以及Fluka9377是合适的商用产品举例。给出这一信息是为了方便本标准的使用者,并不代表对该产品的认可。A.2配制方法
将羧甲基纤维素钠溶解在0.5L水中,在磁力搅拌器上混勾60min,在一个小烧杯中称量吐温20,加人水混匀。将吐温20溶液加到羧甲基纤维素钠溶液中,用蒸馏水将烧杯洗儿次加到前溶液中。将NaCI溶解在溶液中。将KHPO,和NaHPO,溶解在溶液中。加人MIT(如使用)和苋菜红染料。用水将溶液稀释近1000mL。
用磷酸盐缓冲液将合成血液的pH调节至7.3士0.1,定容至1000mL。按照GB/T55491990测量合成血液的表面张力,结果应是0.042N/m士0.002N/m。6
B.1试验环境
iiiKAa~cJouakAa
附录B
(规范性附录)
适合性试验方法
GB19083—2010
试验空间大小应能容纳受试者自由进行规定的测试动作。空气中颗粒数应不小于70×10°个/m如颗粒数过少,可使用气溶胶发生器增加环境中的颗粒,气溶胶发生器产生颗粒的粒数中值直径(CMD)在约为0.04μm,儿何标准差约为2.2(相当于空气动力学质量中值直径(MMAD)0.26μm)。如使用氯化钠气落胶,则空气的相对湿度应不天于50%。B.2安装口罩采样管
在口罩接近佩带者口部的“呼吸区域”穿刺,安装采样管。采样管应在受试者颈部佩戴的支持装置上固定以减小试验过程中对口罩的干扰。B.3试验步骤
选10名受试者,男女各半,买型符合GB/T2428一1998中国头型系列。男性刮掉胡须。按照使用说明佩戴好口罩。测试前应进行检查,包括口罩无移动趋势、口罩带不要过松或过紧、鼻夹贴适鼻梁,周边不要漏气等。测试过程进行中不允许再调整。要求受试者做以下6个规定动作,每个动作做1min:正常呼吸一站立姿势,正常呼吸速度,不说话。a
深呼吸一一站立姿势,慢慢深呼吸,注意不要呼气过度。左右转头站立姿势,缓缓向一侧转头到极限位置后再转向另一侧,在每个极限位置都应有e
吸气。
上下活动头部一缓缓低头,再缓缓抬头,在抬头的极限位置应有吸气动作。e
说话大声缓慢说话。让受试者从100倒数或读一段文章。f)正常呼吸同a)。
B.4计算适合因数
B.4.1通过计算测得的口罩外部颗粒的平均浓度和口罩内部平均浓度的比值来计算每个动作的适合因数。
口罩外的颗粒平均浓度可以用试验前后(6个动作)浓度的算术平均值,或每个动作前后浓度的平均值,也可用连续测量的真实平均值。B.4.3口罩内的浓度用下列方法之一计算:平均峰值穿透法:用带状记录仪、积分器或计算机确定进入口罩内的颗粒数量。对每一个动a)
作,通过计算记录纸上平均峰值高度或通过计算机积分来确定颗粒数量。也可用积分器或计算机计算实际进人口罩内颗粒数量。最大峰值穿透法:用带状记录仪确定进人口罩内的颗粒数量。每个给定动作颗粒穿过的最高b)
峰代表该动作进入口罩内的平均进入量。面积积分法:对每个动作峰值下的面积积分计算。包括计算机积分。计算总适合因数:先将每个动作的适合因数转换为穿透值,计算平均值,然后再把结果转换回d)
适合因数。如式(B.1)。
GB19083—2010
式中:
iiiKAa~cJouaKa
FF=17.+1/+1/。+1/。+1/.+1/
总适合因数:
。—正常呼吸的适合因数;
深呼吸的适合因数;
行。左右转头的适合因数;
。——上下活动头部的适合因数;f。
说话的适合因数;
正常呼吸的适合因数。
.....(B.1)
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
