SN/T 2010-2007
标准分类号
关联标准
出版信息
相关单位信息
标准简介
SN/T 2010-2007.Method for elimination of phytoplasma.
1范围
SN/T 2010规定了植物种苗、鳞球茎和组培苗的植原体脱除及检测的基本原则和方法。
SN/T 2010适用于进出境植物种苗鱗球茎和组培苗的植原体脱除和检测。
2术语和定义
下列术语和定义适用于本标准。
2.1植原体phytoplasma
宵生于植物韧皮部和介体昆虫体内的、具有三层单位膜结构的无细胞壁的原核生物。一般引起植物叶片的黄化和发育畸形等症状,对四环素族类抗生素敏感,而对青霉素不敏感。
2.2外植体explant
用于植物组织培养的材料称为外植体,其主要形式有器官、胚胎、单细胞和原生质体等。
2.3脱植原体苗phytoplasma -free microplant
应用茎尖组织培养等技术获得再生的试管苗,经检测确认不带该种植物的有害植原体,可认定为脱植原体苗。
3原理
植原体形态一般有球形、椭圆形、长杆形、梭形、带状形和多态不规则形,大小为50nm~1000nm.其结构较病毒复杂,具有细胞结构,但没有细胞壁,被单位膜包裹,单位膜由两层蛋白质膜和中间一层脂膜
组成,厚度约为10 nm.
在植物体内植原体主要分布在韧皮部,根尖和芽尖的分生组织内植原体含量少或不含植原体。在高温下可钝化植原体,明显减弱或抑制植原体在植物体内的繁殖。植原体对四环素族类抗生素敏感,而对青霉素不敏感。
1范围
SN/T 2010规定了植物种苗、鳞球茎和组培苗的植原体脱除及检测的基本原则和方法。
SN/T 2010适用于进出境植物种苗鱗球茎和组培苗的植原体脱除和检测。
2术语和定义
下列术语和定义适用于本标准。
2.1植原体phytoplasma
宵生于植物韧皮部和介体昆虫体内的、具有三层单位膜结构的无细胞壁的原核生物。一般引起植物叶片的黄化和发育畸形等症状,对四环素族类抗生素敏感,而对青霉素不敏感。
2.2外植体explant
用于植物组织培养的材料称为外植体,其主要形式有器官、胚胎、单细胞和原生质体等。
2.3脱植原体苗phytoplasma -free microplant
应用茎尖组织培养等技术获得再生的试管苗,经检测确认不带该种植物的有害植原体,可认定为脱植原体苗。
3原理
植原体形态一般有球形、椭圆形、长杆形、梭形、带状形和多态不规则形,大小为50nm~1000nm.其结构较病毒复杂,具有细胞结构,但没有细胞壁,被单位膜包裹,单位膜由两层蛋白质膜和中间一层脂膜
组成,厚度约为10 nm.
在植物体内植原体主要分布在韧皮部,根尖和芽尖的分生组织内植原体含量少或不含植原体。在高温下可钝化植原体,明显减弱或抑制植原体在植物体内的繁殖。植原体对四环素族类抗生素敏感,而对青霉素不敏感。
标准图片预览




标准内容
中华人民共和国出入境检验检疫行业标准SN/T2010—2007
植原体脱除方法
Method for elimination of phytoplasma2007-12-24发布
数码防伪免费标准bzxz.net
中华人民共和国
国家质量监督检验检疫总局
2008-07-01实施
本标准的附录A、附录B、附录C、附录D均为规范性附录。本标准由国家认证认可监督管理委员会提出并归口。SN/T2010—2007
本标准由中华人民共和国上海出人境检验检疫局负责起草,中国检验检疫科学研究院参加起草。本标准主要起草人:杨翠云、于翠、魏梅生、赵文军、乔艳艳、陶庭典。本标准系首次发布的出入境检验检疫行业标准。1范围
植原体脱除方法
SN/T2010—2007
本标准规定了植物种苗、鳞球茎和组培苗的植原体脱除及检测的基本原则和方法。本标准适用于进出境植物种苗、鳞球茎和组培苗的植原体脱除和检测。2术语和定义
下列术语和定义适用于本标准。2.1
植原体phytoplasma
寄生于植物韧皮部和介体昆虫体内的、具有三层单位膜结构的无细胞壁的原核生物。一般引起植物叶片的黄化和发育畸形等症状,对四环素族类抗生索敏感,而对青霉素不敏感。2.2
外植体explant
用于植物组织培养的材料称为外植体,其主要形式有器官、胚胎,单细胞和原生质体等。2.3
脱植原体苗phytoplasma-freemicroplant应用茎尖组织培养等技术获得再生的试管苗,经检测确认不带该种植物的有害植原体,可认定为脱植原体苗。
3原理
植原体形态一般有球形椭圆形、长杆形、梭形、带状形和多态不规则形,大小为50nm~1000nm+其结构较病毒复杂,具有细胞结构·但没有细胞壁,被单位膜包裹,单位膜由两层蛋白质膜和中间一层脂膜组成,厚度约为10nm。
在植物体内植原体主要分布在韧皮部,根尖和芽尖的分生组织内植原体含量少或不含植原体。在高温下可钝化植原体,明显减弱或抑制植原体在植物体内的繁殖。植原体对四环素族类抗生素敏感,而对青霉素不敏感。
4仪器设备、用具及试剂
仪器设备
超净工作台、光照培养箱、干燥箱、电子天平、微波炉等。4.2用具
镊子、剪刀、酒精灯等。
4.3主要试剂
除另有规定外,所有试剂均为分析纯。乙醇、漂白粉、升汞、MS培养基试剂(见附录A)。5植原体脱除方法
5.1茎尖培养脱除植原体
5.1.1培养材料的灭菌处理
将组织培养材料用流水冲洗于净,在凹凸不平处以及鳞片缝隙处用软刷等将污物彻底清除干净,最1
SN/T20102007
后一次用蒸馏水冲洗,再用无菌纱布或吸水纸将材料上的水分吸干,并用消毒刀片切成小块。在无菌条件下先在70%酒精中浸30s~60s,再将材料移人漂白粉饱和溶液中浸5min~10min或0.1%升汞水中消毒0.5min~3min,最后用无菌水清洗3次~4次,用无菌纸吸T水分。5.1.2植原体脱除的茎尖处理和培养在无菌的环境下,用无菌刀、剪、锻等将已消毒的工具,剥去芽的鳞片,嫩枝的外皮和种皮胚乳等,将含有叶原基的茎尖组织切成0.1mm~1.0mm的小段即外植体。立即将切好的外植体接种到MS培养基(MS培养基制备方法见附录A。培养不同的植物需要在MS培养基制作过程中添加不同比例的生长素和细胞分裂素?pH值为5.05.8)上,每瓶接种4个~10个,接种后的瓶或管用无菌药棉或盖封口,培养血用无菌胶带封口。将接种好的材料放在温度25℃土1℃、光周期16h光照、8h黑暗、光照强度15001x~2000lx的条件下的光照培养箱中进行培养。5.1.3组培苗的生长管理
在组培苗的生长过程中及时进行植原体脱除效果评定,评定方法见第6章。别除含有植原体的幼苗。
5.2茎尖培养结合热处理脱除植原体将待处理的植物材料放人35℃~40℃的温箱内,根据植物不同需要处理儿十分钟,甚至几十天。根据不同种类的植物,植原体脱除的热处理还可以选择50℃士1℃热水处理40min或80℃士1℃热水处理10min。
将热处理好的植物材料取出后进行消毒和茎尖培养,方法同5.1。在组培苗的生长过程中及时检测植原体脱除是否完全,植原体脱除效果评定见第6章,剔除含有植原体的幼苗。5.3茎尖培养结合化学处理脱除植原体茎尖培养结合化学处理的基本方法同5.1,只需在MS培养基中加人100mg/1.~500mg/L四环素。对四环素敏感的植物不可采用该方法。在组培苗的生长过程中及时检测植原体脱除是否完全,植原体脱除效果评定见第6章,剔除含有植原体的幼苗。6植原体脱除效果评定
经脱除植原体的植株,需进行PCR方法检测(见附录B)。如果PCR检测结果为阴性,即可判断植原体脱除完全:如果PCR检测为阳性,再进行荧光显微镜观察(见附录C)或电子显微镜观察(见附录D),如果任一方法观察到植原体的粒体,即可判断该植株的植原体脱除不完全,需进一步进行脱除。7结果记录与资料保存
完整的实验记录要包括:植株的来源、种类,进出境时间,实验的时间、地点、方法和结果等,并要有经手人和实验人员的签字。PCR检测需要有电泳图片,荧光显微镜检查和电镜观察需有植原体的粒体结构照片。
8复核
由国家质量监督检验检疫总局指定的单位或人员负责。主要考察实验记录、照片等资料的完整性和真实性,必要时进行复核实验。2
A.1仪器设备
电子天平、高压灭菌锅等。
A.2试剂
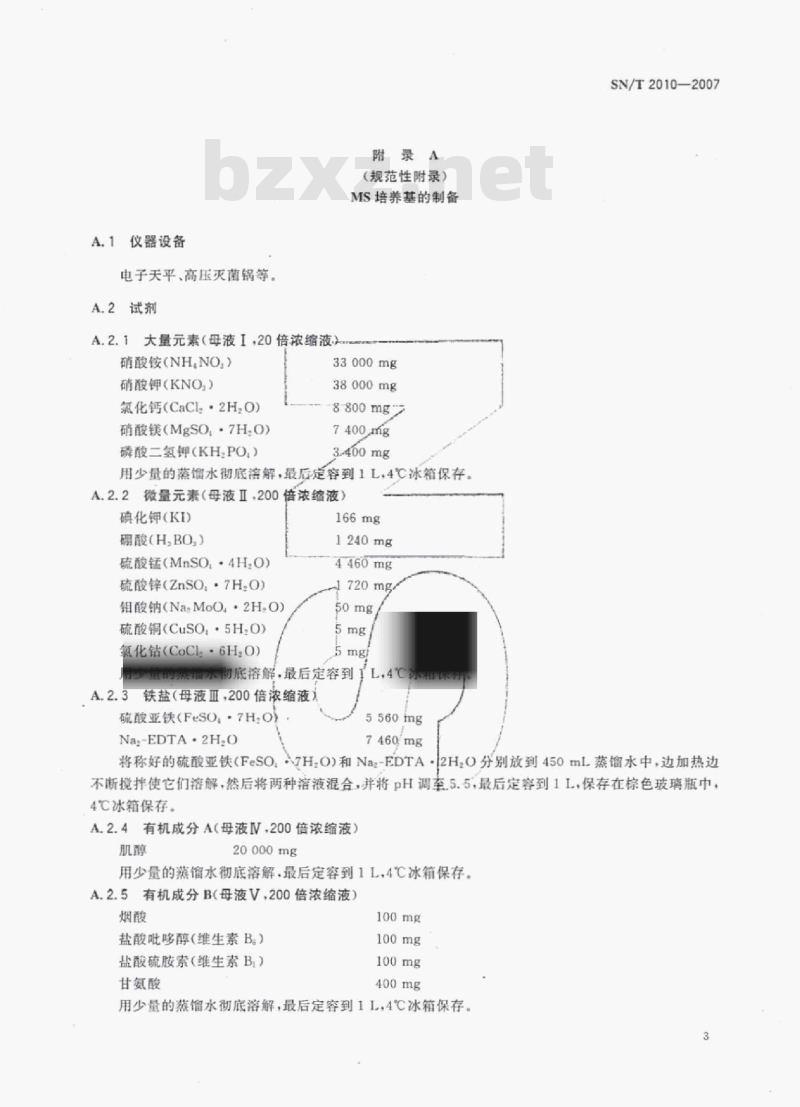
A.2.1大量元素(母液I,20倍浓缩液)硝酸铵(NHNO)
硝酸钾(KNO)
氯化钙(CaClz·2H,O)
硝酸镁(MgSO,·7H.O)
磷酸二氢钾(KHPO)
附录A
(规范性附录)
MS培养基的制备
33000mg
38000mg
8800mg
7400mg
3-400mg
用少量的馏水彻底溶解,最后定容到1L,4℃冰箱保存。A.2.2微量元素(母液Ⅱ.200倍浓缩液)碘化钾(KI)
硼酸(HBO,)
硫酸锰(MnSO,+4H,O)
硫酸锌(ZnSO:7H.O)
钼酸钠(NaMoO·2H.O)
硫酸铜(CuSO·5H.O)
氧化钻(CoCl·6HO)
1240mg
4460mg
1720mg/
韧底溶解,最后定容到L.4%
A.2.3铁盐(母液皿,200倍浓缩液)硫酸亚铁(FeSO,-7H,O)
Na-EDTA-2H.O
5560mg
7460mg
SN/T2010—2007
将称好的硫酸亚铁(FeSO.7HO)和Naz-EDTA·2HO分别放到450mL蒸馏水中,边加热边不断搅使它们溶解,然后将两种溶液混合,并将PH调至5.5,最后定容到1L,保存在棕色玻璃瓶中,4℃冰箱保存。
A.2.4有机成分A(母液V.200倍浓缩液)肌醇
20000mg
用少量的蒸馏水彻底溶解,最后定容到1L,4℃冰箱保存。A.2.5有机成分B(母液V.200倍浓缩液)烟酸
盐酸吡哆醇(维生素B)
盐酸硫胺索(维生素B)
甘氨酸
用少量的蒸馏水彻底溶解,最后定容到1L,4℃冰箱保存。3
SN/T2010—2007
A.2.6琼脂
A.2.7蔗糖
A.3MS培养基的配制
A.3.1混合培养液的配置
用量简或移液器从各种母液中分别取出所需的用量:母液I为50mL,母液Ⅱ,Ⅲ,V和V各5mL,一起放入烧杯中。
A.3.2称量及溶解
分别称取琼脂9g,蔗糖30g.放人1L的大烧杯中,再加人蒸馅水750mL,边加热边用玻璃棒搅拌,直到液体呈半透明状:然后再将配好的混合培养液加人到煮沸的琼脂中,最后加蒸馅水定容至1L搅拌均匀。
A.3.3调节pH
用移液器吸取1mol/L的氢氧化钠(NaOH)溶液,逐滴滴人溶化的培养基中,边滴边搅拌,并随时用精密的pH试纸(5.4~7.0)测试培养基的pH,直到pH5.8。A.3.4分装
溶化的培养基应热分装,及时到盖瓶口。用2块硫酸纸中间夹1层薄牛皮纸封盖瓶口,并用线绳捆扎后贴上标签。
A.3.5灭菌
培养基放在高压灭菌锅中,在103.42kPa(15lbf/in)、121℃条件下灭菌20min。灭菌后取出锥形瓶,使培养基自然冷却凝固。
A.3.6添加植物生长调节物质
培养不同的植物,还应根据需要在MS培养基中加人植物生长调节物质:生长素和细胞分裂素。一般来说根据诱导培养基,幼芽分化培养基和生根培养基等的要求不同,需添加不同的植物生长调节物质。
通常当配制的培养基中生长素/细胞分裂素的比例高时则有利于生根,生长素/细胞分裂素的比例低时则有利于生芽。若两者浓度相当时,既不利于生根,也不利于生芽,面是愈伤组织的产生占优势。常用的生长素:IAA(吲哚乙酸)、IBA(吲哚丁酸)、NAA(乙酸)2,4-D(4-二氯苯氧乙酸)、IPA(吲哚丙酸)、NOA(茶氧乙酸)、BT生根粉等。带用的细胞分裂素:6-BA(6-带基腺呤)ABA(脱落酸),KT(激动素)、ZT(玉米素)等。B.1仪器设备
附录B
(规范性附录)
PCR检测方法
PCR仪、凝胶成像系统、水浴锅、高速冷冻离心机、冰箱、微波炉等B.2用具
可调式移液器、可调式移液器枪头、PCR管等。B.3试剂
B.3.1CTAB提取缓冲液
3%CTAB(十六烷基三乙基溴化铵)100mmol/LTris-HCl
1.4mol/L氧化钠
20 mmol/LEDTA
5%PVP40
0.2%(体积分数)β-巯基乙醇(使用前加人)B.3.2CTAB/NaCI溶液
10%CTAB
0.7mol/L氯化钠
B.3.3TE缓冲液(pH8.0)
1o mmol/LTris-HCI
1mmol/LEDTA
B.3.40.1mol/L磷酸缓冲液(pH7.2)1molmol/L磷酸氢二钠(Na,HPO,)1mol/L.磷酸二氢钠(NaH,PO,)加蒸馏水至1L
B.3.550XTAE
Tris-碱
冰乙酸
EDTA(Na-EDTA-2II.O)
加蒸馏水至1L用时加蒸馏水稀释至1XTAE。B.3.66×加样缓冲液
0.25%溴酚蓝
40%(质量浓度)蔗糖水溶液
B.3.7其他试剂
三氧甲烷-异戊醇(24:1)、丙醇、乙醇、溴化乙锭、琼脂糖等。68.4mL
SN/T2010—2007
SN/T2010—2007
B.4检测方法
B.4.1DNA提取
B.4.1.1取1g新鲜、幼嫩的样品组织,用液氮研磨后,分别置于5mL冰浴的聚丙烯离心管中,用塑料棒研碎,加人2mLCTAB提取缓冲液。B.4.1.260℃水浴中孵育20min,不时摇动。B.4.1.3离心管中加入等体积三氯甲烷-异戊醇(24:1),4℃8000r/min离心10min。B,4.1.4取上层水相,加人经60℃预热的1/10体积的CTAB/NaCI溶液,振荡,再加入等体积的三氯甲烷4℃8000r/min离心10min。
B.4.1.5取上层水相,加人等体积异丙醇,振荡,室温放置1h,室温12000r/min离心10min。B.4.1.6用1mL80%乙醇洗涤,室温10000r/min离心5min小心将乙醇倒出,在吸水纸上控干,用-100LTE(PH8.0)溶解沉淀物.4℃保存。B.4.1.7
注:也可以根据购买的DNA试剂盒的提取方法进行DNA的提取。B.4.2植原体通用引物
利用已报道的植原体16SrRNA-和16S-23SrRNA间隔区序列的通用引物进行引物的合成。可供使用的3对植原体通用引物见表B.1。表B.1植值原体检测的通用引物
引物对名称
R16mF2/R16mR1
R16F2/R16R2
B.4.3PCR扩增
目的DNA
16SrDNA
16S-23SrDNA
16SrDNA
16SrDNA
B.4.3.1反应体系
引物序列(5-3')
AAGAGTTTGATCCTGGCTCAGGATT
CGTCCTTCATCGGCTCTT
CATGCAAGTCGAACGGA
CTTAACCCCAATCATCGAC
ACGACTGCTGCTAAGACTGG
TGACGGGCGGTCTGTACAAACCCCG
反应体系25uL其中模板2ul10倍P9R缓上,下游引物(20umol/L)0.5L、2.U/LT4g酶B.4.3.2PCR反应条件
94℃预变件3min:94℃变性45s.50℃60℃2min,30个~35个循环:72℃延伸10min后保存于4℃B.4.3.3对照设定
产物大小/bp
PCR扩增需设阴性对照(模板为双蒸水)和阳性对照(模板为已知含植原体材料)。B.4.4琼脂糖凝胶检测
B.4.4.1用1×TAE配置1.5%电泳级琼脂糖,在水浴中溶化混勾,冷却至55℃左右。退火温度/℃
B.4.4.2取10mg/mL的漠化乙锭5μL,加人到100mL制备的凝胶中,混匀后倒人凝胶槽中,插上样品梳子。
凝胶凝固后,取掉梳子,将加样缓冲液与样品混合后加人样品孔,并加入分子量标准物。接通电源,根据凝胶的厚度,缓冲液浓度等设置使用的电压,电泳0.5h。B.4.4.4
B.4.4.5电泳结束后用凝胶成像系统记录结果。B.5结果判定
在阳性对照出现与相应引物对应大小的PCR扩增片断,阴性对照未出现对应大小的片断的前提下,如果样品出现对应大小的扩增片断,且经序列分析结果为植原体序列,则判定样品为阳性;如果样品未出现对应大小的扩增片断,样品为阴性。6
C.1仪器设备
荧光显微镜。
C.2试剂
C.2.10.1mol/L磷酸缓冲液(pH7.2)1mol/L磷酸氢二钠(NazHPO.)
1mol/L磷酸二氢钠(NaHPO.)
加蒸馏水至1I。
C.2.2其他试剂
附录C
(规范性附录)
荧光显微镜观察
戊二醛、DAPI(4,6-二胖基-2-苯基吲哚)C.3方法
C.3.1取材
取植物的叶片主脉,幼茎、叶柄或根等组织,进行组织切片,厚度在100um左右。C.3.2染色
SN/T2010—2007
用5%戊二醛固定材料2h:经0:1mol/L磷酸级冲液(pH7:2)洗涤后,用1μg/mLDAPI染色5min。
C.3.3荧光观察
将染色后的材料置于落射荧光显微镜下,检查韧皮部特异性植原体DNA荧光。激发滤光片波长为365nm,阻断滤光片波长为/420nm。C.4结果判定
在荧光显微镜下,如观察倒植原体的DNA荧光,则判定为阳性!SN/T2010—2007
D.1仪器设备
透射电子显微镜。
D.2试剂
D.2.1包埋剂
环氧树脂(Epon-812)
十二烷基琥珀酸酐(DDSA)
邻苯二甲酸二丁醋(D.B.P)
二乙基苯胺(D.M.P-30)
附录D
(规范性附录)
电子显微镜观察
将Epon-812倒人烧杯内,置于80℃温箱内融化,然后加入DDSA,充分揽拌至融化呈透明状。冷却至室温后加人D.B.P,仔细搅拌,然后慢慢逐滴加人D.M.P-30,边加边搅拌,这时包理剂呈棕红色。为避免潮解,操作应在干燥箱内进行。在南方等气候潮湿的地区,包理剂使用spurr树脂,配方如下:VCD树脂
DER736
以上各成分按顺序加上100mL烧杯中,用玻璃棒充分混匀前三者后,最后加人DMAE混匀。该包理剂聚合温度为70℃,时间为16h。D.2.20.2mol/L磷酸缓冲液(pH7.2)1mol/L磷酸氢二钠(NazHPO,)
1mol/L磷酸二氢钠(NaH,PO)
加蒸馅水至500mL。
D.2.3其他试剂
戊二醛、四氧化钱、丙酮、聚乙烯醇缩甲醛、三氯甲烷、二甲苯、柠檬酸铅和醋酸双氧铀。D.3方法
D.3.1预固定
挑选有明显症状的待检样品,将其切成1mm×2mm的小块,用2.5%戊二醛固定液(pH值为7.2).4℃,固定3h。
D.3.2漂洗
样品用0.2mol/L磷酸缓冲液(pH值7.2)漂洗3次。D.3.3后固定
用1.0%的四氧化钱(pH值为7.2)进行后固定,4℃,2h。用0.2mol/L磷酸缓冲液漂洗20min。D.3.4脱水
以20%、50%、70%、90%、100%丙酮逐级脱水,每次15min。D.3.5浸透及包理
将充分脱水干净的组织浸人内酮-包理剂1!1)浸透2h再漫人内酮-包埋剂114)漫透过夜,第8
二天将组织浸人纯包埋剂2h~3h。SN/T20102007
用镊子将组织块放置包埋模板中,倒人包埋液,放上标签,在45℃(3h~6h)和60℃(36h~48h)烤箱内加温,即可聚合硬化,形成包理块。D.3.6Formvar膜制备
将聚乙烯醇缩甲醛(Formvar)溶于三氯甲烷,配成0.2%~0.3%的溶液,贮于冰箱内备用。制膜时取一块干净的玻璃片插人溶液中,取出倾斜待三氯甲烷挥发,用镊尖沿玻璃边划痕,再将玻璃倾斜进人蒸馏水中,薄膜即从玻璃上脱落下来漂浮在水面,取干净的铜网摆上,压紧,再用一块滤纸覆盖其上,捞起后置培养血内干燥备用。
D.3.7切片
将包理块夹在特制的夹持器上,放在解部显微镜下,用锋利的刀片先削去表面的包理剂,露出组织然后在组织的四周以和水平面成45的角度削去包理剂,修成锥体形,于超薄切片机切取样品。选择好的切片用二甲苯蒸发展开,最后用载有Formvar膜的铜网捞起,置培养血内干燥,保存。D.3.8染色及观察
采用柠檬酸铅和乙酸双氧铀双重染色。取染色用蜡盘数个,滴管吸取乙酸双氧铀染液滴人蜡盘上。取带切片的铜网,插人染色液中,染色10min20min后,取出铜网,蒸馅水洗去多余洗液,滤纸吸干将铜网再放人另一蜡盘,滴人柠檬酸铅染液,使铜网翻扣在染色液滴上,切片和染液接触10min一20min后再用0.1mol/L氢氧化钠(NaOH)漂洗干净,滤纸吸干。在透射电子显微镜下观察韧皮部筛管内植原体的形态及数量。
D.4结果判定
在透射电子显微镜下观察到植原体粒体,则判定为阳性。SN/T2010-2007
中华人民共和国出人境检验检疫行业标准
植原体脱除方法
SN/T20102007
中国标准出版社出版
北京复兴门外三里河北街16号
邮政编码:100045
网址spe.net.cn
电话:6852394668517548
中国标准出版社泰皇岛印刷厂印剧开本880×12301/16 印张1字数19千字2008年3月第一版2008年3月第一次印刷印数1-2000
书号:155066·2-18468
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
植原体脱除方法
Method for elimination of phytoplasma2007-12-24发布
数码防伪免费标准bzxz.net
中华人民共和国
国家质量监督检验检疫总局
2008-07-01实施
本标准的附录A、附录B、附录C、附录D均为规范性附录。本标准由国家认证认可监督管理委员会提出并归口。SN/T2010—2007
本标准由中华人民共和国上海出人境检验检疫局负责起草,中国检验检疫科学研究院参加起草。本标准主要起草人:杨翠云、于翠、魏梅生、赵文军、乔艳艳、陶庭典。本标准系首次发布的出入境检验检疫行业标准。1范围
植原体脱除方法
SN/T2010—2007
本标准规定了植物种苗、鳞球茎和组培苗的植原体脱除及检测的基本原则和方法。本标准适用于进出境植物种苗、鳞球茎和组培苗的植原体脱除和检测。2术语和定义
下列术语和定义适用于本标准。2.1
植原体phytoplasma
寄生于植物韧皮部和介体昆虫体内的、具有三层单位膜结构的无细胞壁的原核生物。一般引起植物叶片的黄化和发育畸形等症状,对四环素族类抗生索敏感,而对青霉素不敏感。2.2
外植体explant
用于植物组织培养的材料称为外植体,其主要形式有器官、胚胎,单细胞和原生质体等。2.3
脱植原体苗phytoplasma-freemicroplant应用茎尖组织培养等技术获得再生的试管苗,经检测确认不带该种植物的有害植原体,可认定为脱植原体苗。
3原理
植原体形态一般有球形椭圆形、长杆形、梭形、带状形和多态不规则形,大小为50nm~1000nm+其结构较病毒复杂,具有细胞结构·但没有细胞壁,被单位膜包裹,单位膜由两层蛋白质膜和中间一层脂膜组成,厚度约为10nm。
在植物体内植原体主要分布在韧皮部,根尖和芽尖的分生组织内植原体含量少或不含植原体。在高温下可钝化植原体,明显减弱或抑制植原体在植物体内的繁殖。植原体对四环素族类抗生素敏感,而对青霉素不敏感。
4仪器设备、用具及试剂
仪器设备
超净工作台、光照培养箱、干燥箱、电子天平、微波炉等。4.2用具
镊子、剪刀、酒精灯等。
4.3主要试剂
除另有规定外,所有试剂均为分析纯。乙醇、漂白粉、升汞、MS培养基试剂(见附录A)。5植原体脱除方法
5.1茎尖培养脱除植原体
5.1.1培养材料的灭菌处理
将组织培养材料用流水冲洗于净,在凹凸不平处以及鳞片缝隙处用软刷等将污物彻底清除干净,最1
SN/T20102007
后一次用蒸馏水冲洗,再用无菌纱布或吸水纸将材料上的水分吸干,并用消毒刀片切成小块。在无菌条件下先在70%酒精中浸30s~60s,再将材料移人漂白粉饱和溶液中浸5min~10min或0.1%升汞水中消毒0.5min~3min,最后用无菌水清洗3次~4次,用无菌纸吸T水分。5.1.2植原体脱除的茎尖处理和培养在无菌的环境下,用无菌刀、剪、锻等将已消毒的工具,剥去芽的鳞片,嫩枝的外皮和种皮胚乳等,将含有叶原基的茎尖组织切成0.1mm~1.0mm的小段即外植体。立即将切好的外植体接种到MS培养基(MS培养基制备方法见附录A。培养不同的植物需要在MS培养基制作过程中添加不同比例的生长素和细胞分裂素?pH值为5.05.8)上,每瓶接种4个~10个,接种后的瓶或管用无菌药棉或盖封口,培养血用无菌胶带封口。将接种好的材料放在温度25℃土1℃、光周期16h光照、8h黑暗、光照强度15001x~2000lx的条件下的光照培养箱中进行培养。5.1.3组培苗的生长管理
在组培苗的生长过程中及时进行植原体脱除效果评定,评定方法见第6章。别除含有植原体的幼苗。
5.2茎尖培养结合热处理脱除植原体将待处理的植物材料放人35℃~40℃的温箱内,根据植物不同需要处理儿十分钟,甚至几十天。根据不同种类的植物,植原体脱除的热处理还可以选择50℃士1℃热水处理40min或80℃士1℃热水处理10min。
将热处理好的植物材料取出后进行消毒和茎尖培养,方法同5.1。在组培苗的生长过程中及时检测植原体脱除是否完全,植原体脱除效果评定见第6章,剔除含有植原体的幼苗。5.3茎尖培养结合化学处理脱除植原体茎尖培养结合化学处理的基本方法同5.1,只需在MS培养基中加人100mg/1.~500mg/L四环素。对四环素敏感的植物不可采用该方法。在组培苗的生长过程中及时检测植原体脱除是否完全,植原体脱除效果评定见第6章,剔除含有植原体的幼苗。6植原体脱除效果评定
经脱除植原体的植株,需进行PCR方法检测(见附录B)。如果PCR检测结果为阴性,即可判断植原体脱除完全:如果PCR检测为阳性,再进行荧光显微镜观察(见附录C)或电子显微镜观察(见附录D),如果任一方法观察到植原体的粒体,即可判断该植株的植原体脱除不完全,需进一步进行脱除。7结果记录与资料保存
完整的实验记录要包括:植株的来源、种类,进出境时间,实验的时间、地点、方法和结果等,并要有经手人和实验人员的签字。PCR检测需要有电泳图片,荧光显微镜检查和电镜观察需有植原体的粒体结构照片。
8复核
由国家质量监督检验检疫总局指定的单位或人员负责。主要考察实验记录、照片等资料的完整性和真实性,必要时进行复核实验。2
A.1仪器设备
电子天平、高压灭菌锅等。
A.2试剂
A.2.1大量元素(母液I,20倍浓缩液)硝酸铵(NHNO)
硝酸钾(KNO)
氯化钙(CaClz·2H,O)
硝酸镁(MgSO,·7H.O)
磷酸二氢钾(KHPO)
附录A
(规范性附录)
MS培养基的制备
33000mg
38000mg
8800mg
7400mg
3-400mg
用少量的馏水彻底溶解,最后定容到1L,4℃冰箱保存。A.2.2微量元素(母液Ⅱ.200倍浓缩液)碘化钾(KI)
硼酸(HBO,)
硫酸锰(MnSO,+4H,O)
硫酸锌(ZnSO:7H.O)
钼酸钠(NaMoO·2H.O)
硫酸铜(CuSO·5H.O)
氧化钻(CoCl·6HO)
1240mg
4460mg
1720mg/
韧底溶解,最后定容到L.4%
A.2.3铁盐(母液皿,200倍浓缩液)硫酸亚铁(FeSO,-7H,O)
Na-EDTA-2H.O
5560mg
7460mg
SN/T2010—2007
将称好的硫酸亚铁(FeSO.7HO)和Naz-EDTA·2HO分别放到450mL蒸馏水中,边加热边不断搅使它们溶解,然后将两种溶液混合,并将PH调至5.5,最后定容到1L,保存在棕色玻璃瓶中,4℃冰箱保存。
A.2.4有机成分A(母液V.200倍浓缩液)肌醇
20000mg
用少量的蒸馏水彻底溶解,最后定容到1L,4℃冰箱保存。A.2.5有机成分B(母液V.200倍浓缩液)烟酸
盐酸吡哆醇(维生素B)
盐酸硫胺索(维生素B)
甘氨酸
用少量的蒸馏水彻底溶解,最后定容到1L,4℃冰箱保存。3
SN/T2010—2007
A.2.6琼脂
A.2.7蔗糖
A.3MS培养基的配制
A.3.1混合培养液的配置
用量简或移液器从各种母液中分别取出所需的用量:母液I为50mL,母液Ⅱ,Ⅲ,V和V各5mL,一起放入烧杯中。
A.3.2称量及溶解
分别称取琼脂9g,蔗糖30g.放人1L的大烧杯中,再加人蒸馅水750mL,边加热边用玻璃棒搅拌,直到液体呈半透明状:然后再将配好的混合培养液加人到煮沸的琼脂中,最后加蒸馅水定容至1L搅拌均匀。
A.3.3调节pH
用移液器吸取1mol/L的氢氧化钠(NaOH)溶液,逐滴滴人溶化的培养基中,边滴边搅拌,并随时用精密的pH试纸(5.4~7.0)测试培养基的pH,直到pH5.8。A.3.4分装
溶化的培养基应热分装,及时到盖瓶口。用2块硫酸纸中间夹1层薄牛皮纸封盖瓶口,并用线绳捆扎后贴上标签。
A.3.5灭菌
培养基放在高压灭菌锅中,在103.42kPa(15lbf/in)、121℃条件下灭菌20min。灭菌后取出锥形瓶,使培养基自然冷却凝固。
A.3.6添加植物生长调节物质
培养不同的植物,还应根据需要在MS培养基中加人植物生长调节物质:生长素和细胞分裂素。一般来说根据诱导培养基,幼芽分化培养基和生根培养基等的要求不同,需添加不同的植物生长调节物质。
通常当配制的培养基中生长素/细胞分裂素的比例高时则有利于生根,生长素/细胞分裂素的比例低时则有利于生芽。若两者浓度相当时,既不利于生根,也不利于生芽,面是愈伤组织的产生占优势。常用的生长素:IAA(吲哚乙酸)、IBA(吲哚丁酸)、NAA(乙酸)2,4-D(4-二氯苯氧乙酸)、IPA(吲哚丙酸)、NOA(茶氧乙酸)、BT生根粉等。带用的细胞分裂素:6-BA(6-带基腺呤)ABA(脱落酸),KT(激动素)、ZT(玉米素)等。B.1仪器设备
附录B
(规范性附录)
PCR检测方法
PCR仪、凝胶成像系统、水浴锅、高速冷冻离心机、冰箱、微波炉等B.2用具
可调式移液器、可调式移液器枪头、PCR管等。B.3试剂
B.3.1CTAB提取缓冲液
3%CTAB(十六烷基三乙基溴化铵)100mmol/LTris-HCl
1.4mol/L氧化钠
20 mmol/LEDTA
5%PVP40
0.2%(体积分数)β-巯基乙醇(使用前加人)B.3.2CTAB/NaCI溶液
10%CTAB
0.7mol/L氯化钠
B.3.3TE缓冲液(pH8.0)
1o mmol/LTris-HCI
1mmol/LEDTA
B.3.40.1mol/L磷酸缓冲液(pH7.2)1molmol/L磷酸氢二钠(Na,HPO,)1mol/L.磷酸二氢钠(NaH,PO,)加蒸馏水至1L
B.3.550XTAE
Tris-碱
冰乙酸
EDTA(Na-EDTA-2II.O)
加蒸馏水至1L用时加蒸馏水稀释至1XTAE。B.3.66×加样缓冲液
0.25%溴酚蓝
40%(质量浓度)蔗糖水溶液
B.3.7其他试剂
三氧甲烷-异戊醇(24:1)、丙醇、乙醇、溴化乙锭、琼脂糖等。68.4mL
SN/T2010—2007
SN/T2010—2007
B.4检测方法
B.4.1DNA提取
B.4.1.1取1g新鲜、幼嫩的样品组织,用液氮研磨后,分别置于5mL冰浴的聚丙烯离心管中,用塑料棒研碎,加人2mLCTAB提取缓冲液。B.4.1.260℃水浴中孵育20min,不时摇动。B.4.1.3离心管中加入等体积三氯甲烷-异戊醇(24:1),4℃8000r/min离心10min。B,4.1.4取上层水相,加人经60℃预热的1/10体积的CTAB/NaCI溶液,振荡,再加入等体积的三氯甲烷4℃8000r/min离心10min。
B.4.1.5取上层水相,加人等体积异丙醇,振荡,室温放置1h,室温12000r/min离心10min。B.4.1.6用1mL80%乙醇洗涤,室温10000r/min离心5min小心将乙醇倒出,在吸水纸上控干,用-100LTE(PH8.0)溶解沉淀物.4℃保存。B.4.1.7
注:也可以根据购买的DNA试剂盒的提取方法进行DNA的提取。B.4.2植原体通用引物
利用已报道的植原体16SrRNA-和16S-23SrRNA间隔区序列的通用引物进行引物的合成。可供使用的3对植原体通用引物见表B.1。表B.1植值原体检测的通用引物
引物对名称
R16mF2/R16mR1
R16F2/R16R2
B.4.3PCR扩增
目的DNA
16SrDNA
16S-23SrDNA
16SrDNA
16SrDNA
B.4.3.1反应体系
引物序列(5-3')
AAGAGTTTGATCCTGGCTCAGGATT
CGTCCTTCATCGGCTCTT
CATGCAAGTCGAACGGA
CTTAACCCCAATCATCGAC
ACGACTGCTGCTAAGACTGG
TGACGGGCGGTCTGTACAAACCCCG
反应体系25uL其中模板2ul10倍P9R缓上,下游引物(20umol/L)0.5L、2.U/LT4g酶B.4.3.2PCR反应条件
94℃预变件3min:94℃变性45s.50℃60℃2min,30个~35个循环:72℃延伸10min后保存于4℃B.4.3.3对照设定
产物大小/bp
PCR扩增需设阴性对照(模板为双蒸水)和阳性对照(模板为已知含植原体材料)。B.4.4琼脂糖凝胶检测
B.4.4.1用1×TAE配置1.5%电泳级琼脂糖,在水浴中溶化混勾,冷却至55℃左右。退火温度/℃
B.4.4.2取10mg/mL的漠化乙锭5μL,加人到100mL制备的凝胶中,混匀后倒人凝胶槽中,插上样品梳子。
凝胶凝固后,取掉梳子,将加样缓冲液与样品混合后加人样品孔,并加入分子量标准物。接通电源,根据凝胶的厚度,缓冲液浓度等设置使用的电压,电泳0.5h。B.4.4.4
B.4.4.5电泳结束后用凝胶成像系统记录结果。B.5结果判定
在阳性对照出现与相应引物对应大小的PCR扩增片断,阴性对照未出现对应大小的片断的前提下,如果样品出现对应大小的扩增片断,且经序列分析结果为植原体序列,则判定样品为阳性;如果样品未出现对应大小的扩增片断,样品为阴性。6
C.1仪器设备
荧光显微镜。
C.2试剂
C.2.10.1mol/L磷酸缓冲液(pH7.2)1mol/L磷酸氢二钠(NazHPO.)
1mol/L磷酸二氢钠(NaHPO.)
加蒸馏水至1I。
C.2.2其他试剂
附录C
(规范性附录)
荧光显微镜观察
戊二醛、DAPI(4,6-二胖基-2-苯基吲哚)C.3方法
C.3.1取材
取植物的叶片主脉,幼茎、叶柄或根等组织,进行组织切片,厚度在100um左右。C.3.2染色
SN/T2010—2007
用5%戊二醛固定材料2h:经0:1mol/L磷酸级冲液(pH7:2)洗涤后,用1μg/mLDAPI染色5min。
C.3.3荧光观察
将染色后的材料置于落射荧光显微镜下,检查韧皮部特异性植原体DNA荧光。激发滤光片波长为365nm,阻断滤光片波长为/420nm。C.4结果判定
在荧光显微镜下,如观察倒植原体的DNA荧光,则判定为阳性!SN/T2010—2007
D.1仪器设备
透射电子显微镜。
D.2试剂
D.2.1包埋剂
环氧树脂(Epon-812)
十二烷基琥珀酸酐(DDSA)
邻苯二甲酸二丁醋(D.B.P)
二乙基苯胺(D.M.P-30)
附录D
(规范性附录)
电子显微镜观察
将Epon-812倒人烧杯内,置于80℃温箱内融化,然后加入DDSA,充分揽拌至融化呈透明状。冷却至室温后加人D.B.P,仔细搅拌,然后慢慢逐滴加人D.M.P-30,边加边搅拌,这时包理剂呈棕红色。为避免潮解,操作应在干燥箱内进行。在南方等气候潮湿的地区,包理剂使用spurr树脂,配方如下:VCD树脂
DER736
以上各成分按顺序加上100mL烧杯中,用玻璃棒充分混匀前三者后,最后加人DMAE混匀。该包理剂聚合温度为70℃,时间为16h。D.2.20.2mol/L磷酸缓冲液(pH7.2)1mol/L磷酸氢二钠(NazHPO,)
1mol/L磷酸二氢钠(NaH,PO)
加蒸馅水至500mL。
D.2.3其他试剂
戊二醛、四氧化钱、丙酮、聚乙烯醇缩甲醛、三氯甲烷、二甲苯、柠檬酸铅和醋酸双氧铀。D.3方法
D.3.1预固定
挑选有明显症状的待检样品,将其切成1mm×2mm的小块,用2.5%戊二醛固定液(pH值为7.2).4℃,固定3h。
D.3.2漂洗
样品用0.2mol/L磷酸缓冲液(pH值7.2)漂洗3次。D.3.3后固定
用1.0%的四氧化钱(pH值为7.2)进行后固定,4℃,2h。用0.2mol/L磷酸缓冲液漂洗20min。D.3.4脱水
以20%、50%、70%、90%、100%丙酮逐级脱水,每次15min。D.3.5浸透及包理
将充分脱水干净的组织浸人内酮-包理剂1!1)浸透2h再漫人内酮-包埋剂114)漫透过夜,第8
二天将组织浸人纯包埋剂2h~3h。SN/T20102007
用镊子将组织块放置包埋模板中,倒人包埋液,放上标签,在45℃(3h~6h)和60℃(36h~48h)烤箱内加温,即可聚合硬化,形成包理块。D.3.6Formvar膜制备
将聚乙烯醇缩甲醛(Formvar)溶于三氯甲烷,配成0.2%~0.3%的溶液,贮于冰箱内备用。制膜时取一块干净的玻璃片插人溶液中,取出倾斜待三氯甲烷挥发,用镊尖沿玻璃边划痕,再将玻璃倾斜进人蒸馏水中,薄膜即从玻璃上脱落下来漂浮在水面,取干净的铜网摆上,压紧,再用一块滤纸覆盖其上,捞起后置培养血内干燥备用。
D.3.7切片
将包理块夹在特制的夹持器上,放在解部显微镜下,用锋利的刀片先削去表面的包理剂,露出组织然后在组织的四周以和水平面成45的角度削去包理剂,修成锥体形,于超薄切片机切取样品。选择好的切片用二甲苯蒸发展开,最后用载有Formvar膜的铜网捞起,置培养血内干燥,保存。D.3.8染色及观察
采用柠檬酸铅和乙酸双氧铀双重染色。取染色用蜡盘数个,滴管吸取乙酸双氧铀染液滴人蜡盘上。取带切片的铜网,插人染色液中,染色10min20min后,取出铜网,蒸馅水洗去多余洗液,滤纸吸干将铜网再放人另一蜡盘,滴人柠檬酸铅染液,使铜网翻扣在染色液滴上,切片和染液接触10min一20min后再用0.1mol/L氢氧化钠(NaOH)漂洗干净,滤纸吸干。在透射电子显微镜下观察韧皮部筛管内植原体的形态及数量。
D.4结果判定
在透射电子显微镜下观察到植原体粒体,则判定为阳性。SN/T2010-2007
中华人民共和国出人境检验检疫行业标准
植原体脱除方法
SN/T20102007
中国标准出版社出版
北京复兴门外三里河北街16号
邮政编码:100045
网址spe.net.cn
电话:6852394668517548
中国标准出版社泰皇岛印刷厂印剧开本880×12301/16 印张1字数19千字2008年3月第一版2008年3月第一次印刷印数1-2000
书号:155066·2-18468
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
