GB/T 38505-2020E
基本信息
标准号: GB/T 38505-2020E
中文名称:转基因产品通用检测方法
标准类别:国家标准(GB)
英文名称:General detection methods of genetically modified products
标准状态:现行
发布日期:2020-03-06
实施日期:2020-03-06
出版语种:简体中文
下载格式:.pdf .zip
下载大小:1829596

标准分类号
标准ICS号:数学、自然科学>>07.080生物学、植物学、动物学
中标分类号:综合>>基础学科>>A40基础学科综合
关联标准
出版信息
出版社:中国标准出版社
页数:20页
标准价格:312.0
相关单位信息
起草人:付伟、王晨光、朱鹏宇、杜智欣、魏霜、朱海、洪霞、郑秋月、付辉、何海宁、李飞武、金虹、安小苹、朱水芳、马涛、刘刚、杨光瑞、曹际娟、袁顺捷、黄文胜
起草单位:中国检验检疫科学研究院、深圳市易瑞生物技术股份有限公司、辽宁出入境检验检疫局检验检疫技术中心、甘肃中商食品质量检验检测有限公司等
提出单位:全国生化检测标准化技术委员会(SAC/TC 387)
发布部门:国家市场监督管理总局 国家标准化管理委员会
标准简介
This standard specifies qualitative screening methods for genetically modified products.
This standard is applicable to the real-time fluorescent PCR general screening of genetically modified ingredients in rice, corn, soybean, rape, potato, sugar beet, alfalfa, etc. and their processed products.
The minimum limit of detection of this standard method is 0.1% mass fraction.
标准图片预览




标准内容
ICS.07.080
中华人民共和国国家标准
GB/T385052020
转基因产品通用检测方法
General detection methods of genetically modified products2020-03-06发布
国家市场监督管理总局
国家标准化管理委员会
2020-03-06实施
本标准按照GB/T
1.1—2009给出的规则起草。
本标准由全国生化检测标准化技术委员会(SAC/TC387)提出并归口。GB/T
38505—2020
本标准起草单位:中国检验检疫科学研究院、深圳市易瑞生物技术股份有限公司、辽宁出入境检验检疫局检验检疫技术中心、甘肃中商食品质量检验检测有限公司、广西出入境检验检疫局检验检疫技术中心、吉林省农业科学院、上海市计量测试技术研究院、甘肃省商业科技研究所有限公司。本标准主要起草人:付伟、王晨光、朱鹏宇、杜智欣、魏霜、朱海、洪霞、郑秋月、付辉、何海宁、李飞武金虹、安小苹、朱水芳、马涛、刘刚、杨光瑞、曹际娟、袁顺捷、黄文胜。I
1范围bzxZ.net
转基因产品通用检测方法
本标准规定了转基因产品的定性检测方法。GB/T385052020
本标准适用于水稻、玉米、大豆、油菜、马铃薯、甜菜、首等及其加工产品中转基因成分的实时荧光PCR通用检测。
本标准方法的最低检出限为0.1%(质量分数)。2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。GB/T6682分析实验室用水规格和试验方法GB/T19495.1转基因产品检测通用要求和定义GB/T19495.3
转基因产品检测核酸提取纯化方法GB/T19495.7
3术语和定义
转基因产品检测抽样和制样方法下列术语和定义适用于本文件。3.1
18SrRNA基因
18SrRNAgene
转录自18SrDNA,细胞核糖体的组分之一,作为植物内源基因。3.2
CaMV35S启动子35SpromoterfromCauliflowermosaicvirus来自花椰菜花叶病毒(Cauliflowermosaicvirus,CaMV)的35S启动子。3.3
CaMV35S终止子35SterminatorfromCauliflowermosaicvirus来自花椰菜花叶病毒(Cauliflowermosaicvirus,CaMV)的35S终止子。3.4
NOs终止子terminatorofnopalinesynthasegene来自胭脂碱合成酶基因的终止子。3.5
E9终止子terminatorofribulose-1,5-biphosphatecarboxylasesmallsubunit来自豌豆核酮糖1,5-二磷酸羧化酶小亚基(ribulose-1,5-biphosphatecarboxylasesmall
基因的3'端终止序列。
pat基因
phosphinothricinacetyltransderasegene来自绿产色链霉菌(Streptomcessubunit)
viridochromogenes),编码麟丝菌素乙酰转移酶(phosphinothricinGB/T385052020
acetyltransderase,PAT)
注:pat基因对除草剂草甘麟(glufosinate)具有耐受性。3.7
PinII终止子terminatorofproteinaseinhibitorII来自马铃薯蛋白酶抑制剂ⅡI(proteinaseinhibitor
II,PinII)的终止子。
RbeS4启动子promoterofribulose-1,5-biphosphatecarboxylasesmallsubunit1A来自拟南芥核酮糖-1,5-二磷酸羧化酶/加氧酶小亚基1A(ribulose-1,5-biphosphatecarboxylasesmallsubunit1A,RbeS4)编码基因的启动子。3.9
DAS402785边界序列5'-endevent-specificsequenceofDAS40278DAS40278转化体外源插入片断5°端与玉米基因组的连接区序列。注:该序列包括外源插入片段的部分载体序列和玉米基因组的部分序列。3.10
DP3054233边界序列3'-endevent-specific sequenceofDP305423DP305423转化体外源插入片断3端与大豆基因组的连接区序列。注:该序列包括外源插入片段的部分载体序列和大豆基因组的部分序列。3.11
CV1275边界序列5'-endevent-specificsequenceofCV127CV127转化体外源插入片断5端与大豆基因组的连接区序列。注:该序列包括外源插入片段的部分载体厚列和大豆基因组的部分序列3.12
Ct值cyclethreshold
反应管内的荧光信号达到设定的阅值时所经历的循环数。4试剂与材料
除另有规定外,所有试剂均为分析纯或生化试剂。试验用水符合GB/T6682中一级水的规格。4.1
实时荧光PCR预混液
采用经验证符合实时荧光PCR要求的实时荧光PCR预混液4.2500
mmol/L乙二胺四乙酸二钠溶液(pH8.0))称取18.6g乙二胺四乙酸二钠,加入70mL水中,并用NaOH溶液调pH值至8.0,加水定容至100mL。在103.4kPa(121℃)条件下灭菌20min。4.31
mol/L三羟甲基氨基甲烷-盐溶液(pH8.0)称取121.1g三羟甲基氨基甲烷溶解于800mL水中,用盐酸调pH值至8.0,加水定容至1000mL。在103.4kPa(121℃)条件下灭菌20min。4.4TE缓冲液(pH8.0)
分别量取10mL1
mol/L三羟甲基氨基甲烷-盐溶液(4.3)和2mL500mmol/L乙二胺四乙酸二钠溶液(4.2),加水定容至1000mL。在103.4kPa(121℃)条件下灭菌20min。2
引物和探针
GB/T38505—2020
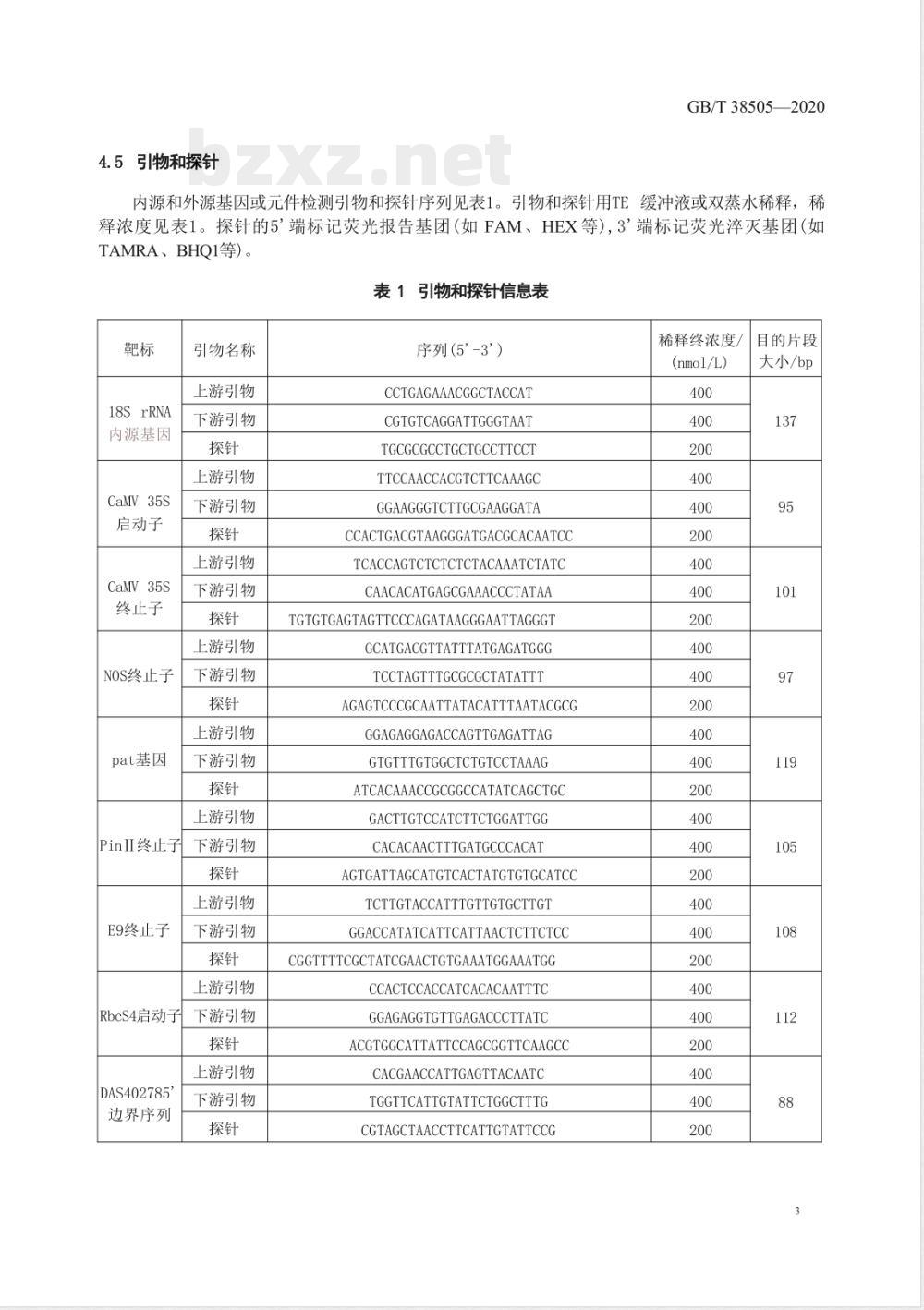
内源和外源基因或元件检测引物和探针序列见表1。引物和探针用TE缓冲液或双蒸水稀释,稀释浓度见表1。探针的5'端标记荧光报告基团(如FAM、HEX等),3'端标记荧光淬灭基团(如TAMRA、BHQ1等)。
引物和探针信息表
18SrRNA
内源基因
CaMV35S
启动子
CaMV35S
终止子
NOS终止子
pat基因
PinI终止子
E9终止子
RbcS4启动子
DAS402785
边界序列
引物名称
上游引物
下游引物
上游引物
下游引物
上游引物
下游引物
上游引物
下游引物
上游引物
下游引物
上游引物
下游引物
上游引物
下游引物
上游引物
下游引物
上游引物
下游引物
序列(5-3\)
CCTGAGAAACGGCTACCAT
CGTGTCAGGATTGGGTAAT
TGCGCGCCTGCTGCCTTCCT
TTCCAACCACGTCTTCAAAGC
GGAAGGGTCTTGCGAAGGATA
CCACTGACGTAAGGGATGACGCACAATCCTCACCAGTCTCTCTCTACAAATCTATC
CAACACATGAGCGAAACCCTATAA
TGTGTGAGTAGTTCCCAGATAAGGGAATTAGGGTGCATGACGTTATTTATGAGATGGG
TCCTAGTTTGCGCGCTATATTT
AGAGTCCCGCAATTATACATTTAATACGCGGGAGAGGAGACCAGTTGAGATTAG
GTGTTTGTGGCTCTGTCCTAAAG
ATCACAAACCGCGGCCATATCAGCTGC
GACTTGTCCATCTTCTGGATTGG
CACACAACTTTGATGCCCACAT
AGTGATTAGCATGTCACTATGTGTGCATCCTCTTGTACCATTTGTTGTGCTTGT
GGACCATATCATTCATTAACTCTTCTCCCGGTTTTCGCTATCGAACTGTGAAATGGAAATGGCCACTCCACCATCACACAATTTC
GGAGAGGTGTTGAGACCCTTATC
ACGTGGCATTATTCCAGCGGTTCAAGCCCACGAACCATTGAGTTACAATC
TGGTTCATTGTATTCTGGCTTTG
CGTAGCTAACCTTCATTGTATTCCG
稀释终浓度/
(nmol/L)
目的片段
大小/bp
GB/T385052020
DP3054233
边界序列
CV1275'
边界序列
引物名称
上游引物
下游引物
上游引物
下游引物
表1(续)
序列(5°-3')
CGTGTTCTCTTTTTGGCTAGC
GTGACCAATGAATACATAACACAAACTATGACACAAATGATTTTCATACAAAAGTCGAGAAACAGAAGTTTCCGTTGAGCTTTAAGACCATTCGTAGCTCGGATCGTGTAC
TTTGGGGAAGCTGTCCCATGCCC
稀释终浓度
(nmol/L)
目的片段
大小/bp
对于不明确是否为转基因产品的样品,应选用上述所有内源和外源基因进行检测。对于确定物种的转基因样品,应根据表2选用基因或元件进行检测。表2确定物种选用基因或元件
大豆及其加工产品
玉米及其加工产品
油菜及其加工产品
水稻及其加工产品
马铃薯及其加工产品
首猎及其加工产品
甜菜及其加工产品
仪器与设备
5.1分析天平:感量0.1mg。
5.2生物安全柜。
5.3实时荧光PCR仪。
5.4纯水仪。
涡旋振荡仪。
微量移液器。
操作步骤
6.1抽样
选用基因/元件
内源基因、CaMV35S启动子、NOS终止子、pat基因、PinII终止子E9终止子、RbcS4启动子、DP3054233'边界序列、CV1275'边界序列内源基因、CaMV35S启动子、CaMV35S终止子、NOS终止子、pat基因、PinII终止子、DAS402785’边界序列内源基因、CaMV35S启动子、CaMV35S终止子、NOS终止子、E9终止子、PinII终止子
内源基因、CaMV35S启动子、CaMV35S终止子、NOS终止子内源基因、NOS终止子、RbcS4启动子内源基因、NOS终止子、E9终止子内源基因、E9终止子
按照GB/T19495.1和GB/T19495.7的规定执行。4
6.2制样
按照GB/T19495.1和GB/T
19495.7的规定执行。
6.3试样预处理
按照GB/T
19495.1和GB/T
DNA模板制备
19495.3的规定执行。
GB/T385052020
按照GB/T19495.1和GB/T19495.3的规定执行。或可采用具有相同效果的植物基因组DNA提取试剂盒进行DNA模板制备。
DNA浓度测定
采用紫外分光光度法测定DNA浓度,将DNA溶液做适当的稀释,于260nm处测定其吸光度,根据测定的OD值计算DNA浓度(260nm处1OD-50μg/mL双链DNA),OD值应该在0.2~0.8的范围内。于280nm处测定其吸光度,根据测定的OD值计算DNA溶液的OD26omm/ODz8omm比值,比值应在1.8~2.0。
实时荧光PCR检测
6.6.1阴性对照、阳性对照和空白对照的设置以非转基因样品为阴性对照,以对应的转基因植物样品品系或含有相应外源基因的转基因植物样品基因组DNA,或含有上述片段的质粒标准分子DNA为阳性对照,以水或TE缓冲液为空白对照。6.6.2
实时荧光PCR反应体系
PCR反应体系见表3或按照经验证符合要求的试剂盒推荐体系进行配制。每个DNA样品做2个
平行管。加样时应使样品DNA溶液完全加入反应液中,不要黏附于管壁上,加样后应尽快盖紧管盖。表3
3实时荧光PCR反应体系
试剂名称
实时荧光PCR预混液
上游引物(10umo1/L)
下游引物(10μmol/L)
探针(10mol/L)
DNA模板(50ng/μL)
补水至
终浓度
0.4umol/L
0.4μmol/L
0.2μmol/
4.0ng/μL
a反应体系中各试剂的量可根据反应体系的总体积进行适当调整。6.6.3仪器设置
加样体积/uL
设置PCR反应管荧光信号收集条件,应与探针标记的报告基团一致。具体设置方法可参照仪器使用说明书。
GB/T385052020
6.6.4PCR反应参数
实时荧光PCR扩增反应参数:50℃/2min;95℃/1040个循环。
min;95℃/15
s,60℃/60s,大于或等于
注:95℃/10min专门适用于化学变构的热启动Tag酶。以上参数可根据不同型号实时荧光PCR仪和所选PCR扩增试剂体系不同做调整。
6.6.5PCR反应运行
将PCR反应管依次摆放至实时荧光PCR仪(上机前注意检查各反应管是否盖紧,以免荧光物质泄漏污染仪器),开始运行仪器进行实时荧光PCR反应。7结果分析
7.1阅值设定
实时荧光PCR反应结束后,设置荧光信号阅值,阈值设定原则根据仪器噪声情况进行调整,以值线刚好超过正常阴性样品扩增曲线的最高点为准。7.2质量控制
空白对照:内参基因检测未出现典型扩增曲线,所有外源基因检测未出现典型扩增曲线,或Ct值大于或等于40。
阴性对照:内参基因检测出现典型扩增曲线,且Ct值小于或等于30,所有外源基因检测未出现典型扩增曲线,或Ct值大于或等于40。阳性对照:内参基因检测出现典型扩增曲线,且Ct值小于或等于30,所有外源基因检测出现典型扩增曲线,且Ct值小于或等于34。8结果判定与表述
8.1结果判定
测试样品全部平行反应外源基因检测未出现典型扩增曲线,或Ct值大于或等于40:内源基因检测出现典型扩增曲线,且Ct值小于或等于30,则可判定该样品不含所检的外源基因。测试样品全部平行反应外源基因检测出现典型扩增曲线,Ct值小于或等于36,内源基因检测出现典型扩增曲线,Ct值小于或等于30,判定该样品含有对应的外源基因。测试样品全部平行反应外源基因检测出现典型扩增曲线,但Ct值在36~40之间,内源基因检测Ct值出现典型扩增曲线,且小于或等手30,应在排除污染的情况下重新处理样品上机检测。再次扩增后的内源基因检测出现典型扩增曲线,且Ct值小于或等于30,外源基因检测出现典型扩增曲线,且Ct值仍小于40,则可判定为该样品含有所检的外源基因。再次扩增后的内源基因检测出现典型扩增曲线,且Ct值小于或等于30,外源基因检测未出现典型扩增曲线,或Ct值大于或等于40,则可判定为该样品不含所检的外源基因。
8.2结果表述
如下所示:
样品未检出××外源基因。
样品检出xx外源基因。
存查样品保存期限
存查样品保存期限按照GB/T19495.1中的规定执行。转化体信息
本标准覆盖的转化体信息参见附录A。GB/T385052020
GB/T385052020
标准覆盖转化体信息见表A.1。
编号物种
MON810
MON89034
MON88017
MON87460
MON87427
MON863
MIR604
MIR162
TC1507
VCO-01981-5
DAS40278
GTS40-3-2
MON89788
MON87701
MON87705
MON87708
MON87769
MON87751
DP305423
DP356043
启动子
附录A
(资料性附录)
标准覆盖转化体信息
标准覆盖转化体信息
终止子
终止子
终止子
启动子
pat基因
终止子
DAS40278DP305423CV127
编号物种
A5547-127
A2704-12
SYHTOH2
DAS44406-6
DAS68416-4
DAS81419
RT73(GT73)
MON88302
Topas19/2
OXY-235
LLRICE62
TT51-1
AM04-1020
EH92-527-1
PH05-026-0048
AV-42-6-G7
启动子
终止子
终止子
表A.1(续)
终止子
启动子
pat基因
终止子
GB/T385052020
DAS40278
DP305423CV122
免费标准下载网
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
中华人民共和国国家标准
GB/T385052020
转基因产品通用检测方法
General detection methods of genetically modified products2020-03-06发布
国家市场监督管理总局
国家标准化管理委员会
2020-03-06实施
本标准按照GB/T
1.1—2009给出的规则起草。
本标准由全国生化检测标准化技术委员会(SAC/TC387)提出并归口。GB/T
38505—2020
本标准起草单位:中国检验检疫科学研究院、深圳市易瑞生物技术股份有限公司、辽宁出入境检验检疫局检验检疫技术中心、甘肃中商食品质量检验检测有限公司、广西出入境检验检疫局检验检疫技术中心、吉林省农业科学院、上海市计量测试技术研究院、甘肃省商业科技研究所有限公司。本标准主要起草人:付伟、王晨光、朱鹏宇、杜智欣、魏霜、朱海、洪霞、郑秋月、付辉、何海宁、李飞武金虹、安小苹、朱水芳、马涛、刘刚、杨光瑞、曹际娟、袁顺捷、黄文胜。I
1范围bzxZ.net
转基因产品通用检测方法
本标准规定了转基因产品的定性检测方法。GB/T385052020
本标准适用于水稻、玉米、大豆、油菜、马铃薯、甜菜、首等及其加工产品中转基因成分的实时荧光PCR通用检测。
本标准方法的最低检出限为0.1%(质量分数)。2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。GB/T6682分析实验室用水规格和试验方法GB/T19495.1转基因产品检测通用要求和定义GB/T19495.3
转基因产品检测核酸提取纯化方法GB/T19495.7
3术语和定义
转基因产品检测抽样和制样方法下列术语和定义适用于本文件。3.1
18SrRNA基因
18SrRNAgene
转录自18SrDNA,细胞核糖体的组分之一,作为植物内源基因。3.2
CaMV35S启动子35SpromoterfromCauliflowermosaicvirus来自花椰菜花叶病毒(Cauliflowermosaicvirus,CaMV)的35S启动子。3.3
CaMV35S终止子35SterminatorfromCauliflowermosaicvirus来自花椰菜花叶病毒(Cauliflowermosaicvirus,CaMV)的35S终止子。3.4
NOs终止子terminatorofnopalinesynthasegene来自胭脂碱合成酶基因的终止子。3.5
E9终止子terminatorofribulose-1,5-biphosphatecarboxylasesmallsubunit来自豌豆核酮糖1,5-二磷酸羧化酶小亚基(ribulose-1,5-biphosphatecarboxylasesmall
基因的3'端终止序列。
pat基因
phosphinothricinacetyltransderasegene来自绿产色链霉菌(Streptomcessubunit)
viridochromogenes),编码麟丝菌素乙酰转移酶(phosphinothricinGB/T385052020
acetyltransderase,PAT)
注:pat基因对除草剂草甘麟(glufosinate)具有耐受性。3.7
PinII终止子terminatorofproteinaseinhibitorII来自马铃薯蛋白酶抑制剂ⅡI(proteinaseinhibitor
II,PinII)的终止子。
RbeS4启动子promoterofribulose-1,5-biphosphatecarboxylasesmallsubunit1A来自拟南芥核酮糖-1,5-二磷酸羧化酶/加氧酶小亚基1A(ribulose-1,5-biphosphatecarboxylasesmallsubunit1A,RbeS4)编码基因的启动子。3.9
DAS402785边界序列5'-endevent-specificsequenceofDAS40278DAS40278转化体外源插入片断5°端与玉米基因组的连接区序列。注:该序列包括外源插入片段的部分载体序列和玉米基因组的部分序列。3.10
DP3054233边界序列3'-endevent-specific sequenceofDP305423DP305423转化体外源插入片断3端与大豆基因组的连接区序列。注:该序列包括外源插入片段的部分载体序列和大豆基因组的部分序列。3.11
CV1275边界序列5'-endevent-specificsequenceofCV127CV127转化体外源插入片断5端与大豆基因组的连接区序列。注:该序列包括外源插入片段的部分载体厚列和大豆基因组的部分序列3.12
Ct值cyclethreshold
反应管内的荧光信号达到设定的阅值时所经历的循环数。4试剂与材料
除另有规定外,所有试剂均为分析纯或生化试剂。试验用水符合GB/T6682中一级水的规格。4.1
实时荧光PCR预混液
采用经验证符合实时荧光PCR要求的实时荧光PCR预混液4.2500
mmol/L乙二胺四乙酸二钠溶液(pH8.0))称取18.6g乙二胺四乙酸二钠,加入70mL水中,并用NaOH溶液调pH值至8.0,加水定容至100mL。在103.4kPa(121℃)条件下灭菌20min。4.31
mol/L三羟甲基氨基甲烷-盐溶液(pH8.0)称取121.1g三羟甲基氨基甲烷溶解于800mL水中,用盐酸调pH值至8.0,加水定容至1000mL。在103.4kPa(121℃)条件下灭菌20min。4.4TE缓冲液(pH8.0)
分别量取10mL1
mol/L三羟甲基氨基甲烷-盐溶液(4.3)和2mL500mmol/L乙二胺四乙酸二钠溶液(4.2),加水定容至1000mL。在103.4kPa(121℃)条件下灭菌20min。2
引物和探针
GB/T38505—2020
内源和外源基因或元件检测引物和探针序列见表1。引物和探针用TE缓冲液或双蒸水稀释,稀释浓度见表1。探针的5'端标记荧光报告基团(如FAM、HEX等),3'端标记荧光淬灭基团(如TAMRA、BHQ1等)。
引物和探针信息表
18SrRNA
内源基因
CaMV35S
启动子
CaMV35S
终止子
NOS终止子
pat基因
PinI终止子
E9终止子
RbcS4启动子
DAS402785
边界序列
引物名称
上游引物
下游引物
上游引物
下游引物
上游引物
下游引物
上游引物
下游引物
上游引物
下游引物
上游引物
下游引物
上游引物
下游引物
上游引物
下游引物
上游引物
下游引物
序列(5-3\)
CCTGAGAAACGGCTACCAT
CGTGTCAGGATTGGGTAAT
TGCGCGCCTGCTGCCTTCCT
TTCCAACCACGTCTTCAAAGC
GGAAGGGTCTTGCGAAGGATA
CCACTGACGTAAGGGATGACGCACAATCCTCACCAGTCTCTCTCTACAAATCTATC
CAACACATGAGCGAAACCCTATAA
TGTGTGAGTAGTTCCCAGATAAGGGAATTAGGGTGCATGACGTTATTTATGAGATGGG
TCCTAGTTTGCGCGCTATATTT
AGAGTCCCGCAATTATACATTTAATACGCGGGAGAGGAGACCAGTTGAGATTAG
GTGTTTGTGGCTCTGTCCTAAAG
ATCACAAACCGCGGCCATATCAGCTGC
GACTTGTCCATCTTCTGGATTGG
CACACAACTTTGATGCCCACAT
AGTGATTAGCATGTCACTATGTGTGCATCCTCTTGTACCATTTGTTGTGCTTGT
GGACCATATCATTCATTAACTCTTCTCCCGGTTTTCGCTATCGAACTGTGAAATGGAAATGGCCACTCCACCATCACACAATTTC
GGAGAGGTGTTGAGACCCTTATC
ACGTGGCATTATTCCAGCGGTTCAAGCCCACGAACCATTGAGTTACAATC
TGGTTCATTGTATTCTGGCTTTG
CGTAGCTAACCTTCATTGTATTCCG
稀释终浓度/
(nmol/L)
目的片段
大小/bp
GB/T385052020
DP3054233
边界序列
CV1275'
边界序列
引物名称
上游引物
下游引物
上游引物
下游引物
表1(续)
序列(5°-3')
CGTGTTCTCTTTTTGGCTAGC
GTGACCAATGAATACATAACACAAACTATGACACAAATGATTTTCATACAAAAGTCGAGAAACAGAAGTTTCCGTTGAGCTTTAAGACCATTCGTAGCTCGGATCGTGTAC
TTTGGGGAAGCTGTCCCATGCCC
稀释终浓度
(nmol/L)
目的片段
大小/bp
对于不明确是否为转基因产品的样品,应选用上述所有内源和外源基因进行检测。对于确定物种的转基因样品,应根据表2选用基因或元件进行检测。表2确定物种选用基因或元件
大豆及其加工产品
玉米及其加工产品
油菜及其加工产品
水稻及其加工产品
马铃薯及其加工产品
首猎及其加工产品
甜菜及其加工产品
仪器与设备
5.1分析天平:感量0.1mg。
5.2生物安全柜。
5.3实时荧光PCR仪。
5.4纯水仪。
涡旋振荡仪。
微量移液器。
操作步骤
6.1抽样
选用基因/元件
内源基因、CaMV35S启动子、NOS终止子、pat基因、PinII终止子E9终止子、RbcS4启动子、DP3054233'边界序列、CV1275'边界序列内源基因、CaMV35S启动子、CaMV35S终止子、NOS终止子、pat基因、PinII终止子、DAS402785’边界序列内源基因、CaMV35S启动子、CaMV35S终止子、NOS终止子、E9终止子、PinII终止子
内源基因、CaMV35S启动子、CaMV35S终止子、NOS终止子内源基因、NOS终止子、RbcS4启动子内源基因、NOS终止子、E9终止子内源基因、E9终止子
按照GB/T19495.1和GB/T19495.7的规定执行。4
6.2制样
按照GB/T19495.1和GB/T
19495.7的规定执行。
6.3试样预处理
按照GB/T
19495.1和GB/T
DNA模板制备
19495.3的规定执行。
GB/T385052020
按照GB/T19495.1和GB/T19495.3的规定执行。或可采用具有相同效果的植物基因组DNA提取试剂盒进行DNA模板制备。
DNA浓度测定
采用紫外分光光度法测定DNA浓度,将DNA溶液做适当的稀释,于260nm处测定其吸光度,根据测定的OD值计算DNA浓度(260nm处1OD-50μg/mL双链DNA),OD值应该在0.2~0.8的范围内。于280nm处测定其吸光度,根据测定的OD值计算DNA溶液的OD26omm/ODz8omm比值,比值应在1.8~2.0。
实时荧光PCR检测
6.6.1阴性对照、阳性对照和空白对照的设置以非转基因样品为阴性对照,以对应的转基因植物样品品系或含有相应外源基因的转基因植物样品基因组DNA,或含有上述片段的质粒标准分子DNA为阳性对照,以水或TE缓冲液为空白对照。6.6.2
实时荧光PCR反应体系
PCR反应体系见表3或按照经验证符合要求的试剂盒推荐体系进行配制。每个DNA样品做2个
平行管。加样时应使样品DNA溶液完全加入反应液中,不要黏附于管壁上,加样后应尽快盖紧管盖。表3
3实时荧光PCR反应体系
试剂名称
实时荧光PCR预混液
上游引物(10umo1/L)
下游引物(10μmol/L)
探针(10mol/L)
DNA模板(50ng/μL)
补水至
终浓度
0.4umol/L
0.4μmol/L
0.2μmol/
4.0ng/μL
a反应体系中各试剂的量可根据反应体系的总体积进行适当调整。6.6.3仪器设置
加样体积/uL
设置PCR反应管荧光信号收集条件,应与探针标记的报告基团一致。具体设置方法可参照仪器使用说明书。
GB/T385052020
6.6.4PCR反应参数
实时荧光PCR扩增反应参数:50℃/2min;95℃/1040个循环。
min;95℃/15
s,60℃/60s,大于或等于
注:95℃/10min专门适用于化学变构的热启动Tag酶。以上参数可根据不同型号实时荧光PCR仪和所选PCR扩增试剂体系不同做调整。
6.6.5PCR反应运行
将PCR反应管依次摆放至实时荧光PCR仪(上机前注意检查各反应管是否盖紧,以免荧光物质泄漏污染仪器),开始运行仪器进行实时荧光PCR反应。7结果分析
7.1阅值设定
实时荧光PCR反应结束后,设置荧光信号阅值,阈值设定原则根据仪器噪声情况进行调整,以值线刚好超过正常阴性样品扩增曲线的最高点为准。7.2质量控制
空白对照:内参基因检测未出现典型扩增曲线,所有外源基因检测未出现典型扩增曲线,或Ct值大于或等于40。
阴性对照:内参基因检测出现典型扩增曲线,且Ct值小于或等于30,所有外源基因检测未出现典型扩增曲线,或Ct值大于或等于40。阳性对照:内参基因检测出现典型扩增曲线,且Ct值小于或等于30,所有外源基因检测出现典型扩增曲线,且Ct值小于或等于34。8结果判定与表述
8.1结果判定
测试样品全部平行反应外源基因检测未出现典型扩增曲线,或Ct值大于或等于40:内源基因检测出现典型扩增曲线,且Ct值小于或等于30,则可判定该样品不含所检的外源基因。测试样品全部平行反应外源基因检测出现典型扩增曲线,Ct值小于或等于36,内源基因检测出现典型扩增曲线,Ct值小于或等于30,判定该样品含有对应的外源基因。测试样品全部平行反应外源基因检测出现典型扩增曲线,但Ct值在36~40之间,内源基因检测Ct值出现典型扩增曲线,且小于或等手30,应在排除污染的情况下重新处理样品上机检测。再次扩增后的内源基因检测出现典型扩增曲线,且Ct值小于或等于30,外源基因检测出现典型扩增曲线,且Ct值仍小于40,则可判定为该样品含有所检的外源基因。再次扩增后的内源基因检测出现典型扩增曲线,且Ct值小于或等于30,外源基因检测未出现典型扩增曲线,或Ct值大于或等于40,则可判定为该样品不含所检的外源基因。
8.2结果表述
如下所示:
样品未检出××外源基因。
样品检出xx外源基因。
存查样品保存期限
存查样品保存期限按照GB/T19495.1中的规定执行。转化体信息
本标准覆盖的转化体信息参见附录A。GB/T385052020
GB/T385052020
标准覆盖转化体信息见表A.1。
编号物种
MON810
MON89034
MON88017
MON87460
MON87427
MON863
MIR604
MIR162
TC1507
VCO-01981-5
DAS40278
GTS40-3-2
MON89788
MON87701
MON87705
MON87708
MON87769
MON87751
DP305423
DP356043
启动子
附录A
(资料性附录)
标准覆盖转化体信息
标准覆盖转化体信息
终止子
终止子
终止子
启动子
pat基因
终止子
DAS40278DP305423CV127
编号物种
A5547-127
A2704-12
SYHTOH2
DAS44406-6
DAS68416-4
DAS81419
RT73(GT73)
MON88302
Topas19/2
OXY-235
LLRICE62
TT51-1
AM04-1020
EH92-527-1
PH05-026-0048
AV-42-6-G7
启动子
终止子
终止子
表A.1(续)
终止子
启动子
pat基因
终止子
GB/T385052020
DAS40278
DP305423CV122
免费标准下载网
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。