GB 15193.29-2020
基本信息
标准号: GB 15193.29-2020
中文名称:食品安全国家标准 扩展一代生殖毒性试验
标准类别:国家标准(GB)
标准状态:现行
发布日期:2020-09-11
实施日期:2021-03-11
出版语种:简体中文
下载格式:.pdf .zip
下载大小:3530811
相关标签: 食品安全 国家标准 扩展 一代 生殖 毒性 试验

标准分类号
中标分类号:食品>>食品综合>>X09卫生、安全、劳动保护
关联标准
出版信息
出版社:中国标准出版社
页数:16页
标准价格:31.0
相关单位信息
发布部门:国家卫生健康委员会 国家市场监督管理总局
标准简介
本标准规定了扩展一代生殖毒性的基本试验方法和技术要求。
本标准适用于评价受试物的生殖发育毒性作用。
标准图片预览




标准内容
中华人民共和国国家标准
GB15193.29—2020
食品安全国家标准
扩展一代生殖毒性试验
2020-09-11发布
2021-03-11实施
中华人民共和国国家卫生健康委员会国家市场监督管理总局
1范围
食品安全国家标准
扩展一代生殖毒性试验
本标准规定了扩展一代生殖毒性的基本试验方法和技术要求。本标准适用于评价受试物的生殖发育毒性作用。2术语和定义
2.1生殖毒性
GB15193.29—2020
对雄性和雌性生殖功能或能力的损害和对后代的有害影响。生殖毒性既可发生于雌性妊娠期,也可发生于妊前期和哺乳期。表现为外源化学物对生殖过程的影响,如生殖器官及内分泌系统的变化,对性周期和性行为的影响,以及对生育力和妊娠结局的影响等。2.2发育毒性
个体在出生前暴露于受试物、发育成为成体之前(包括胚期、胎期以及出生后)出现的有害效应,表现为发育生物体的结构异常、生长改变、功能缺陷和死亡。2.3神经发育毒性
个体在发育过程中暴露于受试物后引起的神经系统结构和功能的异常改变,这种改变可以发生在生命周期的任何阶段。
2.4发育免疫毒性
个体在其生命早期发育过程中(尤其是出生前后)暴露于受试物后导致的免疫系统发育受到影响、功能出现障碍,而这些影响在成年个体暴露时未被发现或持续时间较短。2.5每体毒性
受试物引起亲代雌性妊娠动物直接或间接的健康损害效应,表现为增重减少、功能异常、中毒体征,甚至死亡等。
2.6未观察到有害作用剂量
通过动物试验,以现有的技术手段和检测指标未观察到任何与受试物有关的毒性作用的最大剂量。2.7最小观察到有害作用剂量
在规定的条件下,受试物引起实验动物组织形态、功能、生长发育等有害效应的最小作用剂量3试验自的
本试验用于评价受试物对亲代(FO代)及子代(F1代等)实验动物生殖和发育的影响。提供关于受GB15193.292020
试物对亲代雄、雌性动物生殖系统完整性和功能,如性腺功能、发情周期、附睾精子成熟、交配行为、受孕、妊娠、分娩和哺乳等影响的信息,同时获得受试物对子代动物的生长、发育,包括性成熟、生殖器官完整性和功能,神经发育以及免疫发育等作用的资料。4试验方法
4.1受试物
受试物应首先考虑使用原始样品,若不能使用原始样品,应按照受试物处理原则对受试物进行适当处理。将受试物掺入饲料、饮用水或灌胃给予。4.2实验动物
4.2.1动物选择
实验动物的选择应符合GB14922.1和GB14922.2的有关规定。选择已有资料证明对受试物敏感的动物物种和品系,一般啮齿类动物首选大鼠,避免选用生殖率低或发育缺陷发生率高的品系。本标准中的原则和建议均是以大鼠为基础的。为了正确地评价受试物对动物生殖和发育能力的影响,两种性别的动物均应使用。所选动物应注明物种、品系、性别、体重和周龄。同性别实验动物个体间体重相差不超过平均体重的土20%。选用的亲代实验动物试验开始时需性成熟,至交配时需日龄相近(大鼠至少为13周龄),而且其中雌性动物应为非经产、非孕动物。4.2.2实验动物数量
为了获得具有统计学要求的基本试验数据,正确地评价受试物对动物生殖和发育过程(包括FO代动物生殖、妊娠和哺育的过程,F1代动物从出生到成熟过程中的生长发育情况)的毒性作用,需保证受试物每个剂量组和对照组均至少获得20只孕鼠。一般在试验开始时,建议每组两种性别亲代(F0代)大鼠各准备30只左右。
4.2.3动物准备
试验前动物在实验动物房至少应进行3d~5d的环境适应和检疫观察。4.2.4动物饲养环境
实验动物饲养条件、饮用水、饲料应符合GB14925、GB5749、GB14924的有关规定。实验动物单笼或按性别分笼饲养,自由饮食、饮水。孕鼠临近分娩时,应单独饲养在分娩笼中,需要时笼中放置合适的造窝垫料。
4.3剂量及分组
动物按体重随机分组,至少设3个受试物剂量组和1个对照组。如果受试物使用溶剂,对照组应给予溶剂的最大使用量。某些受试物的高剂量受试物组设计应考虑其对营养素平衡的影响,对于非营养成分受试物剂量不应超过饲料的5%。在受试物理化和生物特性允许的条件下,最高剂量应使FO和F1代动物出现明显的毒性反应,但不引起动物死亡:中间剂量可引起轻微的毒性反应:低剂量应不引起任何毒性反应。剂量组间距以2倍或4倍为最佳。
4.4受试物给予
4.4.1根据受试物的特性或试验目的,可将受试物掺入饲料、饮水或灌胃给予实验动物。首选掺入饲2
料,若受试物加入饲料或饮水中影响动物的适口性,则考虑选择灌胃给予。GB15193.292020
4.4.2试验期间,所有动物应采用相同的方式给予受试物;如受试物经灌胃给予,每天一次。各代大鼠给予的受试物剂量、饲料和饮水相同。4.4.3受试物掺入饲料或饮水给予,要将受试物与饲料(或饮水)充分混匀并保证该受试物配制的稳定性和均一性,以不影响动物摄食、营养平衡和饮水量为原则,受试物掺人饲料比例一般小于质量分数5%,若超过5%(最大不应超过10%),调整对照组饲料营养素水平,若受试物无热量或营养成分,且添加比例大于5%时,对照组饲料应填充甲基纤维素等,掺入量等同高剂量,使其与剂量组饲料营养素水平保持一致:亦可视受试物热量或营养成分的状况调整剂量组饲料营养素水平,使其与对照组饲料营养素水平保持一致。受试物剂量单位是每千克体重所摄入受试物的毫克(或克)数,即mg/kg体重(或g/kg体重),当受试物掺入饲料,其剂量单位亦可表示为mg/kg(或g/kg)饲料,掺入饮水则表示为mg/mL水。受试物掺入饲料时,需将受试物剂量(mg/kg体重)按动物每100g体重的摄食量折算为受试物饲料含量(mg/kg饲料)。扩展一代生殖毒性试验大鼠每日摄食量一般可按体重的8%折算。
4.4.4受试物选择灌胃方式给予时,要将受试物溶解或悬浮于合适的溶媒中,建议优先考虑使用水溶液或态浮液,其次考虑使用植物油(如橄榄油、玉米油等)溶液或态浮液,不溶于水或油的受试物亦可使用羧甲基纤维素、淀粉等配成混悬液或糊状物等。溶媒或其他的添加剂增强受试物溶解性应考虑以下特点:是否影响受试物的吸收、分布、代谢和蓄留;是否影响受试物的化学特性,以致改变其毒性特征:是否影响动物食物和水的消耗量并影响动物的营养水平。另外,除水外必须清楚溶剂的毒性特征,避免使用原本具有潜在毒性的溶剂(如丙酮、二甲基亚砜)。受试物应现用现配,有资料表明其溶液或混悬液储存稳定著除外。
4.4.5受试物以灌胃方式给予,如溶媒为水溶液时,灌胃体积一般不超过10mL/kg体重,最大灌胃体积不超过20mL/kg体重;如为油性液体,灌胃体积应不超过4mL/kg体重:各组灌胃体积均应一致。应每日在同一时间灌胃1次,每周至少称体重2次,根据体重调整灌胃体积。在分娩当天建议不对母鼠进行灌胃或采取其他处理措施。4.5试验方法
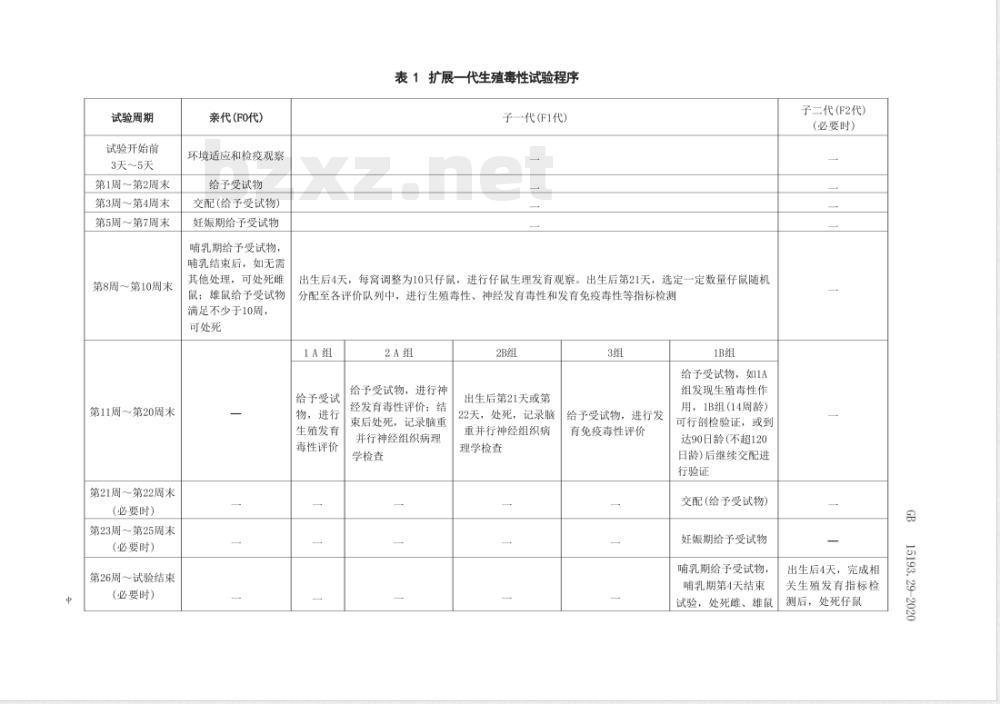
推荐选用10周龄以上的雌、雄性大鼠作为F0代,至少适应3d~5d后开始给予受试物。各组F0代雕、雄性大鼠采用的处理方式均应相同,每天给予受试物,期限从交配前2周开始并涵盖交配期、娠期直到F1代断乳的整个试验期间。F1代断乳后,可对FO代雌、雄性大鼠进行大体解剖和生殖指标等检测,但需要保证F0代雄鼠解剖前受试物暴露给予时间应不少于10周(至少1个完整的生精过程)。各组断乳后的F1代雌、雄仔鼠,根据检测目的随机分配至该组各评价队列中,并给予受试物直到相应队列指标完成检测。各评价队列的测定指标的检测时间、使用动物的数量及检测内容等见表1和表2。试验周期
试验开始前
3天~5天
第1周第2周末
第3周第4周末
第5周一第7周末
第8周~第10周末
第11周~第20周末
第21周~第22周末
(必要时)
第23周第25周末
(必要时)
第26周~试验结束
(必要时)
亲代(FO代)
环境适应和检疫观票
给予受试物
交配(给予受试物)
妊娠期给子受试物
明乳期给予受试物,
哺乳结束后,如无需
其他处理,可处死雎
鼠:维鼠给予受试物
满足不少于10周,
可处死
表1扩展一代生殖毒性试验程序
手一代(FI代)
出生后4天,每高调整为10只仔鼠,进行仔鼠生理发育观察。出生后第21天,选定一定数量存鼠随机分配至各评价队列中,进行生殖毒性、神经发育毒性和发育免疫毒性等指标检测1A租
给予受试
物,进行
生验发育
毒性评价
给予受试物,进行神
经发育毒性评价:结
束后处死,记录脑重
并行神经组织病理
学检查
出生后第21天或第
22天,处死,记录脑
重并行神经组织病
理学检查
给予受试物,进行发
育免疫毒性评价
给于受试物,如1A
组发现生殖毒性作
用,1B组(14周龄)
可行剖检验证。或到
达90日龄(不超120
日龄)后维续交配进
行验证
交配(给予受试物)
妊娠期给于受试物
哺乳期给子受试物,
哺乳期第4天结束
试验,处死雕、维鼠
子二代(F2代)
(必要时)
出生后4天,完成相
关生殖发有指标检
测后,处死仔鼠
15193.29-2020
各队列中从每窝选
用存鼠数目/只
4.6交配此内容来自标准下载网
表2扩展一代生殖毒性试验F1代各队列实验动物使用情况各剂量组
中评价
各队列的
试验目的
生殖毒性
神经发育
发育免疫
4.6.1采用1:1(1雄:1雌)方式交配。各项指标使用
动物数量/只
是否性
GB15193.292020
各队列指标检测结束时F1
代仔鼠剖检时间(周龄)
如1A组发现可能的对生殖的毒性影响,1B组(14周龄)行剖检给予验证:或1B组到达90日龄(不超120日龄)后继续交配,通过繁殖F2代进一步开展生殖毒性观察;试验可于F2代大鼠出生后4天时结
束(即20周~24周龄左右)
4.6.2交配时,在同一剂量组中随机选择雌雄大鼠各1只合笼,合笼的雌、雄性大鼠均应作标记。所有雕性大鼠在交配期应每天检查阴栓或精子,直到证明已交配为止,并在证明已交配后尽快将雌性动物分开。查到精子或阴栓的当天为受孕od。4.6.3如经过3个发情期或2周仍未交配成功,可终止合笼,并尽快对上述雌、雄大鼠进行相应检查以分析原因,并在必要时进行生殖器官的病理组织学、发情周期的检查。另外,也可将未成功交配的动物与证实过生育功能正常的动物重新配对,并在需要时进行生殖器官的病理组织学、发情周期的检查,4.6.4F0代大鼠不推荐进行第二次交配,因为这样会失去重要生殖毒性信息(如着床点数目等),建议可以通过F1代的继续交配来观察受试物对雌性动物产生的影响。尽管如此,如果已在FO代第一次交配中发现受试物对生殖产生影响或存在可疑结果,仍可通过选择将FO代大鼠进行第二次交配加以证实。第二次交配时,推荐使用未交配的雌(雄)性动物与已交配过的雄(雌)性动物进行,一般在第一次交配所产子代动物断乳后1周进行。4.7每窝仔鼠数量的标准化
F1代动物在出生后第4天时,采用随机的方式(而不是以体重为依据)将每窝子代大鼠数目进行调整,剔除多余的动物,达到每窝性别和数目的统一。每窝尽可能选5只雌性大鼠和5只雄性大鼠,也可根据实际情况进行调整(如6雄4雌)。5观察指标
5.1临床观察
GB15193.292020
对于F0代和选定的F1代动物,试验期间一般每天在相同时间进行一般临床观察一次,如出现相关的动物毒性反应、发病、死亡以及行为变化(如中毒、难产或延期分娩等症状)需记录。此外,所有的F0代和F1代动物(断乳后)每周需进行一次详细观察并记录,观察的体征应包括皮肤、被毛、分泌物和排泄物的产生和植物神经活动的变化(如流泪、毛发直立、不寻常的呼吸模式)等,以及步态、姿势的变化,对触摸的反应:另外,如发现阵挛或强直动作、机械性重复行为(如过度理毛、重复转圈)或怪异行为(如自残、倒退)等也需要记录。5.2体重和进食量
FO代和F1代大鼠体重称量的频次和相关要求见表3表3各代大鼠体重称量频次和相关要求动物
雄、雕鼠
交配前
试验阶段
哺乳期
给予受试物的第一天称重,并在之后每周至少称重1次,直至受试物给予不少于10周结束给予受试物的第一天称重,
并在之后每周至少称重1次
于分娩后第0(或1)
4、7、14和21天称重
于仔鼠出生后第0(或1)、
4、7、14天时称窝重,至第21天断乳时按只称重
断乳后
每周至少称重1次,
直至相应试验结束
需要指出,各代所有大鼠完成相关试验指标测定后处死时都需要称重。此外,实验中FO代和F1代1A组动物在进行体重称量的同时需记录饲料消耗量(交配和哺乳期间除外)。5.3血液、生化和尿液检测
5.3.1样本采集
FO代大鼠相关试验结束时,每个剂量组分别随机选择雄鼠和雌鼠各10只,按程序采集血液样本后可进行血液学、血液生化、血清中甲状腺素(T4)、促甲状腺激素(TSH)、性激素等检测或由受试物已知作用特性提示的其他检测。如果FO代动物需要保留进行第二次交配,为了不影响交配,血液样本的采集需提前进行。
F1代大鼠队列1相关试验结束时,每个剂量组分别随机选择1A组的雄鼠和雌鼠各10只,按程序采集血液样本后可进行血液学、血液生化、T4、TSH、性激素检测或由受试物已知作用特性提示的其他检测,并开展尿液检测。
5.3.2血液学检测指标
包括血细胞比容、血红蛋白浓度、红细胞计数、白细胞总数和分类计数、血小板计数和凝血时间/潜在凝血时间等检测。
5.3.3血液生化检测指标
GB15193.292020
包括血糖、总胆固醇、尿素、肌酐、总蛋白、白蛋白和至少有两个表示肝细胞损伤的酶(如丙氨酸氨基转移酶、天门冬氨酸转氨酶、碱性磷酸酶、Y谷氨酰转和山梨醇脱氢酶)等。必要时,可进行T4、TSH和性激素水平等的检测。
5.3.4尿液检测指标
包括外观、体积、渗透压或比重、pH、蛋白质、尿糖、血细胞等检测。5.4精子检测
5.4.1样品采集
所有F0代和F1代1A队列中的雄性大鼠在所对应的试验结束时,摘取附罩尾(或输精管)收集精子,进行精子活力和形态等参数的检测。需要注意的是精子指标的检测需在大鼠处死后立即进行,且收集过程应尽量减少精子损失。
5.4.2精子检测指标
精子形态的评价,每只动物至少检查200个精子,从而区分精子形态为正常(头部和中段尾均正常)或者异常【精子形态异常包括精子头的融合、分离,精子头和(或)尾的异常]。另外,进行性运动精子的百分比等可通过仪器辅助分析。5.5发情周期检查
FO代雌性大鼠在开始给予受试物后即可对其进行发情周期的评价(阴道细胞学检查),可持续到确认交配成功或2周的交配期结束。如果F0代雌性大鼠在开始给予受试物后出现一些与生殖毒性无关的效应(如摄食量明显减少等),那么可以考虑将交配前受试物给予时间延长2周(即交配前给予受试物4周),以便雕性大鼠更好地适应受试物,同时对应的F0代雄性大鼠交配前受试物给予时间也做相应的延长(但F0代雄鼠处死前受试物给予总的时间不变,仍为不少于10周即可)。F1代发情周期的评价主要通过队列1的检查完成。1A组的雌性大鼠,首先可在确定阴道开放日期后,每天对其进行阴道涂片检查,记录第一次发现典型角质化上皮细胞的时间,进而获得相应的间隔日期:其后,自出生后75天左右开始,还可以再次对其进行发情周期的检查和记录,检查为期2周。另外,如果1B组大鼠需要继续进行交配以获得F2代,对其发情周期也需进行检查,时间从配对开始到确认交配成功即可。
5.6子代发育毒性指标检测
5.6.1分娩后(出生后第0关或第1关)应该尽快地检查每窝仔鼠,以记录仔鼠的数量、性别、死胎数、活胎数,以及出现的外观异常(外部可见的畸形,包括聘裂、皮下出血、异常皮肤颜色或纹理、有脐带、有干性分泌物),其中死亡的仔鼠需检查并记录可能存在的缺陷或死亡的原因。5.6.2存鼠体重称量和临床观察可同时开展,分别在出生后第0(或1)、4、7、14和21天进行,如有特殊情况可增加临床观察的频次。临床观察内容包括外部结构异常,皮肤、被毛的改变、分泌物和排泄物的出现和自主活动的改变,另外如发现步态、姿势、对触摸的反应发生改变,以及出现阵挛或强直动作、刻板或怪异的行为也需记录。
5.6.3以窝为单位,检查并记录F1代各剂量组仔鼠生理发育指标。生理发育指标包括:耳廓分离、静眼、张耳、出毛、门齿萌出时间等:雌性阴道张开和雄性睾丸下降的时间:出生后第4天,测量肛门与生殖器的距离(AGD);出生后第12天或第13天,所有雄性仔鼠检查乳头/乳晕。7
5.7子代神经发育毒性指标检测
GB15193.292020
5.7.1各剂量组队列2的大鼠用于神经发育毒性评价,其中2A队列大鼠(10只雄鼠和10只雌鼠)开展听觉惊吓、功能观察、活动度测试和神经病理学检查,2B队列大鼠(10只雄鼠和10只雌鼠)在出生后第21天(或第22天)处死后进行神经病理学检查。5.7.2听觉惊吓检测
在出生后第24士1天时,对2A队列的大鼠进行听觉惊吓测试。在进行听觉惊吓测试时,需使实验条件优化到每次测试条件较为稳定。受试物组和对照组交叉进行测试,所有检测的动物均需测试50次,10次为一组,共5组,记录每组测试动物的平均反应振幅。5.7.3神经系统功能观察组合检测出生后第63天至第75天间适当的时间,2A队列大鼠进行神经系统功能观察组合检测。功能观察组合包括试验对象外观的详细的描述、行为和功能的协调性,具体观察项目和指标见表4。上述观察可在自由移动的活动场所(开阔场地)或居住的笼内进行,实验动物按照最少互动到最多互动的顺序来进行。
表4神经系统功能观察组合的项目及指标观察项目
笼内一般状况观察
运动活动/共济失调
中枢兴奋
肌张力
心血管/呼吸系统
自主体征
检测指标
动物进食、饮水、睡觉、无运动活动/清醒、绕笼内运动、竖毛、攻击同笼动物、发声、理毛唤醒反应、手指逼近、头部触摸、僵住症、异常行为、视觉位置感、被动体位反应畏惧、理毛行为、攻击性/应激性、易怒、异常发声体态、自主活动、共济失调步态、直立抽搐、癫痫、震颤、惊恐反应、对扶按尾部的敏感性低肌张力步态、握力、身体张力、腹部张力、肢体张力脸闭反射、耳廓反射、后肢反射、地面翻正反射、空中翻正反射呼吸、心率、皮肤颜色、发结
扭体症状、尾巴体位、竖毛、流泪、血泪、流涎、眼晴张开、突眼、排尿、排便、类便黏稠度、尿液颜色、动物死亡
5.7.4神经行为指标检测
可根据文献报道和前期的研究结果:有针对性地选择相关学习和记忆的测试方法对2A队列大鼠学习记忆能力进行检测。如果无上述信息的提供,推荐使用主动回避试验、被动回避试验或Morris水迷宫试验等作为试验方法进行检测。5.8子代发育免疫毒性指标检测
5.8.1各剂量组队列3的大鼠(10只雄性和10只雌性动物),在出生后第56土3天时进行对T细胞依赖抗原[如绵羊红细胞(SRBC)或钥孔戚血蓝蛋白(KLH))的主要IgM抗体反应(TDAR)的检测。5.8.2TDAR可采用抗体生成细胞检测或特异性IgM抗体检测的方法进行。5.8.2.1抗体生成细胞检测
空斑形成细胞(PFC)计数检测是通过腹腔注射免疫SRBC4天后,将大鼠脾细胞悬液与一定量的8
GB15193.29—2020
SRBC混合,在补体的参与下,使分泌抗体的脾细胞周围的SRBC溶解,形成肉眼可见的空斑,溶血空斑数可以反映抗体生成细胞数。PFC检测可以分亚组在不同日期进行检测,但需要满足下列条件:a)确定亚组动物的免疫和处死时间,以保证检测时达到了反应峰值:b)每个亚组包含了不同组别间数量相同的雄性和雌性动物:c)亚组动物处死时日龄应相同。5.8.2.2特异性IgM抗体检测
腹腔注射SRBC或KLH5天后,采用酶联免疫吸附试验(ELISA)方法测定血清中的特异性IgM抗体效价。
5.9潜在生殖毒性的继续评价
如果F1代1A组大鼠的试验结果提示受试物可能存在生殖毒性作用,各剂量组1B队列的雄雌大鼠(13周龄)除可以通过处死后进行病理检查给予证明外,还可以通过持续给予受试物至少到出生后第90天(但不超过120天),再进行雌雄交配(避免同窝的雌雄大鼠进行交配)以获得F2代动物的方式对潜在的生殖毒性作用进行评价,处理方式与F0代动物相同。在F2代仔鼠到达出生后第4天时,如获得的试验数据能够说明问题时即可结束实验,而无需继续喂养至断乳或更久。6病理学检查
6.1大体解部
在试验终止时或试验期间出现死亡时,所有的FO代和F1代动物都要进行大体解剖,观察分析任何结构异常情况或病理性改变,其中应特别关注生殖系统器官是否存在异常。已死亡的或死情况下处死的仔鼠,应进行大体解剖并分析可能的缺陷和(或)死亡的原因,并放入固定液保存。对于成年FO代和F1代雌性大鼠进行大体解剖时,一方面,解剖当天可进行阴道涂片来确定发情周期的倩况,并与其生殖器官组织病理学检查结果结合考虑:另一方面,还可通过硫化铵染色等方法检查所有F0代雌鼠(如果F1代1B组需继续交配,则也需检查)子宫着床点是否存在并计数。6.2器官摘取、称重及保存
6.2.1所有F0代和F1代相关队列中成年雌雄大鼠相应试验终止时,解后根据试验需要可考虑摘取下列脏器,称重(除非有特殊要求,成对脏器可以单独或合并称重)后选取合适固定液进行保存。组织或器官的摘取及称重的内容和要求见表5。表5组织或器官摘取和称重的内容及要求项目类别
需称重并计算脏
器系数的器官
组织病理学
检查的脏器
需进行组织病理学
检查的组织或器官
必要时,需进行组织
病理学检查的
组织或器官
脑、肝脏、肾脏、心脏、脾脏、胸腺、垂体、甲状腺(含甲状旁腺)、肾上腺、子宫(包括输卵管和子宫颈)、率丸、附睾(用于精子计数的尾部和整体)脑、肝脏、肾脏、心脏、脾脏、胸腺、肾上腺、子宫(包括输卵管和子宫颈)、率丸、附睾(用于精子计数的尾部和整体)、卵巢、前列腺、精囊、淋巴结未梢神经、肌肉、脊髓、眼球及视神经、胃肠道、膀胱、肺、垂体、甲状腺(含甲状旁腺)、气管、骨髓、输精管、乳腺(雄性和雌性)以及阴道9
GB15193.292020
6.2.2必要时,F1代大鼠队列1A相关试验结束时,可从每个剂量组分别随机选择雄鼠和雌鼠各10只,进行出生前或出生后暴露导致的免疫效应评价,包括对淋巴结进行称重,对脾脏细胞进行表型分析(T细胞、B细胞、NK细胞)。
6.2.3F1代2A组的大鼠在行为测试结束后处死,需进行灌注固定后再摘取脑,称重后开展神经组织病理学检查:F1代2B组大鼠在出生后第21天(或第22天)处死,在摘取脑时灌注固定可选择性开展称量后进行神经组织病理学检查。6.2.4F1代未入选相应队列剩余的存鼠,可在出生后第22天(断乳后)处死,除非试验结果表明需利用这部分动物开展进一步的评价。上述处死的仔鼠均需进行大体解剖,并对生殖器官进行评价。另外,从尽可能多的窝中得到每组每个性别10只仔鼠,对其脑、脾脏和胸腺称重并保存。6.3组织病理学检查
6.3.1F0代
FO代大鼠试验结束时所摘取器官应进行组织病理学检查,可先进行高剂量组和对照组检查,如发现与受试物有关的有意义的组织病理学改变时,需进一步检查所有较低的剂量组的动物。此外,对出现未能成功进行交配、受孕,相应子代大鼠出现一定发育毒性表现的FO代大鼠,需对其生殖器官进行全面组织病理学的评价。
6.3.2F1代
6.3.2.1队列1
1A队列全部高剂量组和对照组成年动物的器官需进行组织病理学检查,每窝至少有1只仔鼠。如发现脏器出现与受试物有关的有意义的病理改变后,需进一步检查所有中、低剂量组的动物,以确定NOAEL。另外,如果从1A队列动物得到的结果仍存在可疑,需进行IB队列动物的组织学检查加以验证。
6.3.2.2队列2
在完成神经行为测试之后(在出生75天后,但不超过90天),2A队列全部高剂量组和对照组大鼠摘取脑等组织后进行神经组织病理学检查。在出生后第21天(或第22天),2B队列全部高剂量组和对照组的大鼠摘取脑等组织后进行脑组织病理学检查。当发现脏器出现与受试物有关的有意义的病理改变后,需进一步检查所有中、低剂量组的动物,以确定NOAEL对于2A和2B队列的大鼠,通过脑多切面的方式,可全面检查大脑膜球、大脑皮层、海马体、基底神经节、丘脑、下丘脑、中脑(被囊、被盖和大脑脚)、脑干和小脑。另外,在上述检查基础上,2A队列大鼠可增加眼(视网膜和视神经)和周围神经标本、肌肉和脊髓检查。7数据处理和结果评价
7.1数据处理
将所有的数据和结果以表格形式进行总结,数据可以用表格进行统计,表中应显示每组的实验动物数、交配的雄性动物数、受孕的雌性动物数、各种毒性反应及其出现动物百分数。生殖、生理发育指标数据,应以窝为单位统计。结果应以适当的方法进行统计学分析,计量资料采用方差分析,进行多个试验组与对照组之间均数比较,分类资料采用Fisher精确分布检验、卡方检验、秩和检验,等级资料采用Ridit分析、秩和检验等
7.2结果评价
GB15193.292020
比较受试物组动物与对照组动物观察指标和病理学检查结果是否有显著性差异及剂量反应关系,以评定受试物有无生殖发育毒性,进而确定其生殖发育毒性作用的NOAEL和LOAEL。同时,还可根据出现统计学差异的指标(如体重、生理发育指标、神经功能观察、神经发育毒性、发育免疫毒性、大体解剖和病理组织学检查结果等),进一步估计生殖发育毒性的作用特点。8试验报告
8.1试验名称、试验单位名称和联系方式、报告编号。8.2试验委托单位名称和联系方式、样品受理日期。8.3试验开始和结束日期、试验项目负责人、试验单位技术负责人、签发日期。8.4试验摘要。
8.5受试物:名称、批号、剂型、状态(包括感官、性状、包装完整性、标识)、数量、前处理方法、溶媒。8.6实验动物:物种、品系、级别、数量、体重、性别、来源(供应商名称、实验动物生产许可证号)、动物检疫、适应情况、饲养环境(温度、相对湿度、实验动物设施使用许可证号)、饲料来源(供应商名称、实验动物饲料生产许可证号)。
8.7试验方法:试验分组、每组动物数、剂量选择依据、受试物给予途径及期限、观察指标、统计学方法。8.8试验结果
生殖毒性检测结果:
实验动物的体重、摄食量、食物利用率(除了交配和哺乳期间);所选择断乳后F1代动物的体重:在研究过程中死亡的时间或者是否在试验结束有存活的动物;d)
临床观察症状的性质、严重程度和持续时间(是否是可逆的);血液、生化(包括TSH和T4、性激素)和尿液分析的结果;脾脏细胞的表型分析结果(T细胞、B细胞、NK细胞):正常或异常发情周期的FO代和F1代雌性动物的数目;交配的时间(开始交配至交配成功的天数);对生殖的毒性或其他影响,包括完成交配、妊娠、分娩和哺乳的动物数目以及百分比,成功交配的雄性的数目和百分比,有难产/延长或难分娩症状的雌性数目和百分比孕期、分娩期(可以记录的话)的时长:着床数量、窝大小和仔鼠性别比:k)
着床后流产的数量,活胎和死胎的数目和百分比:仔鼠窝重量:
肉眼观察明显的异常幼仔的数量:仔鼠生理发育指标结果;
代大鼠动物性成熟指标的数据:代和F1代大鼠宰杀时的体重、绝对和相对器官重量数据;q)F0
大体解剖和组织病理学检查结果;s)F0
代和F1代雄性附睾尾部精子活性和形态分析结果。8.8.2神经发育毒性检测结果:
听觉惊吓测试的分析结果:
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
GB15193.29—2020
食品安全国家标准
扩展一代生殖毒性试验
2020-09-11发布
2021-03-11实施
中华人民共和国国家卫生健康委员会国家市场监督管理总局
1范围
食品安全国家标准
扩展一代生殖毒性试验
本标准规定了扩展一代生殖毒性的基本试验方法和技术要求。本标准适用于评价受试物的生殖发育毒性作用。2术语和定义
2.1生殖毒性
GB15193.29—2020
对雄性和雌性生殖功能或能力的损害和对后代的有害影响。生殖毒性既可发生于雌性妊娠期,也可发生于妊前期和哺乳期。表现为外源化学物对生殖过程的影响,如生殖器官及内分泌系统的变化,对性周期和性行为的影响,以及对生育力和妊娠结局的影响等。2.2发育毒性
个体在出生前暴露于受试物、发育成为成体之前(包括胚期、胎期以及出生后)出现的有害效应,表现为发育生物体的结构异常、生长改变、功能缺陷和死亡。2.3神经发育毒性
个体在发育过程中暴露于受试物后引起的神经系统结构和功能的异常改变,这种改变可以发生在生命周期的任何阶段。
2.4发育免疫毒性
个体在其生命早期发育过程中(尤其是出生前后)暴露于受试物后导致的免疫系统发育受到影响、功能出现障碍,而这些影响在成年个体暴露时未被发现或持续时间较短。2.5每体毒性
受试物引起亲代雌性妊娠动物直接或间接的健康损害效应,表现为增重减少、功能异常、中毒体征,甚至死亡等。
2.6未观察到有害作用剂量
通过动物试验,以现有的技术手段和检测指标未观察到任何与受试物有关的毒性作用的最大剂量。2.7最小观察到有害作用剂量
在规定的条件下,受试物引起实验动物组织形态、功能、生长发育等有害效应的最小作用剂量3试验自的
本试验用于评价受试物对亲代(FO代)及子代(F1代等)实验动物生殖和发育的影响。提供关于受GB15193.292020
试物对亲代雄、雌性动物生殖系统完整性和功能,如性腺功能、发情周期、附睾精子成熟、交配行为、受孕、妊娠、分娩和哺乳等影响的信息,同时获得受试物对子代动物的生长、发育,包括性成熟、生殖器官完整性和功能,神经发育以及免疫发育等作用的资料。4试验方法
4.1受试物
受试物应首先考虑使用原始样品,若不能使用原始样品,应按照受试物处理原则对受试物进行适当处理。将受试物掺入饲料、饮用水或灌胃给予。4.2实验动物
4.2.1动物选择
实验动物的选择应符合GB14922.1和GB14922.2的有关规定。选择已有资料证明对受试物敏感的动物物种和品系,一般啮齿类动物首选大鼠,避免选用生殖率低或发育缺陷发生率高的品系。本标准中的原则和建议均是以大鼠为基础的。为了正确地评价受试物对动物生殖和发育能力的影响,两种性别的动物均应使用。所选动物应注明物种、品系、性别、体重和周龄。同性别实验动物个体间体重相差不超过平均体重的土20%。选用的亲代实验动物试验开始时需性成熟,至交配时需日龄相近(大鼠至少为13周龄),而且其中雌性动物应为非经产、非孕动物。4.2.2实验动物数量
为了获得具有统计学要求的基本试验数据,正确地评价受试物对动物生殖和发育过程(包括FO代动物生殖、妊娠和哺育的过程,F1代动物从出生到成熟过程中的生长发育情况)的毒性作用,需保证受试物每个剂量组和对照组均至少获得20只孕鼠。一般在试验开始时,建议每组两种性别亲代(F0代)大鼠各准备30只左右。
4.2.3动物准备
试验前动物在实验动物房至少应进行3d~5d的环境适应和检疫观察。4.2.4动物饲养环境
实验动物饲养条件、饮用水、饲料应符合GB14925、GB5749、GB14924的有关规定。实验动物单笼或按性别分笼饲养,自由饮食、饮水。孕鼠临近分娩时,应单独饲养在分娩笼中,需要时笼中放置合适的造窝垫料。
4.3剂量及分组
动物按体重随机分组,至少设3个受试物剂量组和1个对照组。如果受试物使用溶剂,对照组应给予溶剂的最大使用量。某些受试物的高剂量受试物组设计应考虑其对营养素平衡的影响,对于非营养成分受试物剂量不应超过饲料的5%。在受试物理化和生物特性允许的条件下,最高剂量应使FO和F1代动物出现明显的毒性反应,但不引起动物死亡:中间剂量可引起轻微的毒性反应:低剂量应不引起任何毒性反应。剂量组间距以2倍或4倍为最佳。
4.4受试物给予
4.4.1根据受试物的特性或试验目的,可将受试物掺入饲料、饮水或灌胃给予实验动物。首选掺入饲2
料,若受试物加入饲料或饮水中影响动物的适口性,则考虑选择灌胃给予。GB15193.292020
4.4.2试验期间,所有动物应采用相同的方式给予受试物;如受试物经灌胃给予,每天一次。各代大鼠给予的受试物剂量、饲料和饮水相同。4.4.3受试物掺入饲料或饮水给予,要将受试物与饲料(或饮水)充分混匀并保证该受试物配制的稳定性和均一性,以不影响动物摄食、营养平衡和饮水量为原则,受试物掺人饲料比例一般小于质量分数5%,若超过5%(最大不应超过10%),调整对照组饲料营养素水平,若受试物无热量或营养成分,且添加比例大于5%时,对照组饲料应填充甲基纤维素等,掺入量等同高剂量,使其与剂量组饲料营养素水平保持一致:亦可视受试物热量或营养成分的状况调整剂量组饲料营养素水平,使其与对照组饲料营养素水平保持一致。受试物剂量单位是每千克体重所摄入受试物的毫克(或克)数,即mg/kg体重(或g/kg体重),当受试物掺入饲料,其剂量单位亦可表示为mg/kg(或g/kg)饲料,掺入饮水则表示为mg/mL水。受试物掺入饲料时,需将受试物剂量(mg/kg体重)按动物每100g体重的摄食量折算为受试物饲料含量(mg/kg饲料)。扩展一代生殖毒性试验大鼠每日摄食量一般可按体重的8%折算。
4.4.4受试物选择灌胃方式给予时,要将受试物溶解或悬浮于合适的溶媒中,建议优先考虑使用水溶液或态浮液,其次考虑使用植物油(如橄榄油、玉米油等)溶液或态浮液,不溶于水或油的受试物亦可使用羧甲基纤维素、淀粉等配成混悬液或糊状物等。溶媒或其他的添加剂增强受试物溶解性应考虑以下特点:是否影响受试物的吸收、分布、代谢和蓄留;是否影响受试物的化学特性,以致改变其毒性特征:是否影响动物食物和水的消耗量并影响动物的营养水平。另外,除水外必须清楚溶剂的毒性特征,避免使用原本具有潜在毒性的溶剂(如丙酮、二甲基亚砜)。受试物应现用现配,有资料表明其溶液或混悬液储存稳定著除外。
4.4.5受试物以灌胃方式给予,如溶媒为水溶液时,灌胃体积一般不超过10mL/kg体重,最大灌胃体积不超过20mL/kg体重;如为油性液体,灌胃体积应不超过4mL/kg体重:各组灌胃体积均应一致。应每日在同一时间灌胃1次,每周至少称体重2次,根据体重调整灌胃体积。在分娩当天建议不对母鼠进行灌胃或采取其他处理措施。4.5试验方法
推荐选用10周龄以上的雌、雄性大鼠作为F0代,至少适应3d~5d后开始给予受试物。各组F0代雕、雄性大鼠采用的处理方式均应相同,每天给予受试物,期限从交配前2周开始并涵盖交配期、娠期直到F1代断乳的整个试验期间。F1代断乳后,可对FO代雌、雄性大鼠进行大体解剖和生殖指标等检测,但需要保证F0代雄鼠解剖前受试物暴露给予时间应不少于10周(至少1个完整的生精过程)。各组断乳后的F1代雌、雄仔鼠,根据检测目的随机分配至该组各评价队列中,并给予受试物直到相应队列指标完成检测。各评价队列的测定指标的检测时间、使用动物的数量及检测内容等见表1和表2。试验周期
试验开始前
3天~5天
第1周第2周末
第3周第4周末
第5周一第7周末
第8周~第10周末
第11周~第20周末
第21周~第22周末
(必要时)
第23周第25周末
(必要时)
第26周~试验结束
(必要时)
亲代(FO代)
环境适应和检疫观票
给予受试物
交配(给予受试物)
妊娠期给子受试物
明乳期给予受试物,
哺乳结束后,如无需
其他处理,可处死雎
鼠:维鼠给予受试物
满足不少于10周,
可处死
表1扩展一代生殖毒性试验程序
手一代(FI代)
出生后4天,每高调整为10只仔鼠,进行仔鼠生理发育观察。出生后第21天,选定一定数量存鼠随机分配至各评价队列中,进行生殖毒性、神经发育毒性和发育免疫毒性等指标检测1A租
给予受试
物,进行
生验发育
毒性评价
给予受试物,进行神
经发育毒性评价:结
束后处死,记录脑重
并行神经组织病理
学检查
出生后第21天或第
22天,处死,记录脑
重并行神经组织病
理学检查
给予受试物,进行发
育免疫毒性评价
给于受试物,如1A
组发现生殖毒性作
用,1B组(14周龄)
可行剖检验证。或到
达90日龄(不超120
日龄)后维续交配进
行验证
交配(给予受试物)
妊娠期给于受试物
哺乳期给子受试物,
哺乳期第4天结束
试验,处死雕、维鼠
子二代(F2代)
(必要时)
出生后4天,完成相
关生殖发有指标检
测后,处死仔鼠
15193.29-2020
各队列中从每窝选
用存鼠数目/只
4.6交配此内容来自标准下载网
表2扩展一代生殖毒性试验F1代各队列实验动物使用情况各剂量组
中评价
各队列的
试验目的
生殖毒性
神经发育
发育免疫
4.6.1采用1:1(1雄:1雌)方式交配。各项指标使用
动物数量/只
是否性
GB15193.292020
各队列指标检测结束时F1
代仔鼠剖检时间(周龄)
如1A组发现可能的对生殖的毒性影响,1B组(14周龄)行剖检给予验证:或1B组到达90日龄(不超120日龄)后继续交配,通过繁殖F2代进一步开展生殖毒性观察;试验可于F2代大鼠出生后4天时结
束(即20周~24周龄左右)
4.6.2交配时,在同一剂量组中随机选择雌雄大鼠各1只合笼,合笼的雌、雄性大鼠均应作标记。所有雕性大鼠在交配期应每天检查阴栓或精子,直到证明已交配为止,并在证明已交配后尽快将雌性动物分开。查到精子或阴栓的当天为受孕od。4.6.3如经过3个发情期或2周仍未交配成功,可终止合笼,并尽快对上述雌、雄大鼠进行相应检查以分析原因,并在必要时进行生殖器官的病理组织学、发情周期的检查。另外,也可将未成功交配的动物与证实过生育功能正常的动物重新配对,并在需要时进行生殖器官的病理组织学、发情周期的检查,4.6.4F0代大鼠不推荐进行第二次交配,因为这样会失去重要生殖毒性信息(如着床点数目等),建议可以通过F1代的继续交配来观察受试物对雌性动物产生的影响。尽管如此,如果已在FO代第一次交配中发现受试物对生殖产生影响或存在可疑结果,仍可通过选择将FO代大鼠进行第二次交配加以证实。第二次交配时,推荐使用未交配的雌(雄)性动物与已交配过的雄(雌)性动物进行,一般在第一次交配所产子代动物断乳后1周进行。4.7每窝仔鼠数量的标准化
F1代动物在出生后第4天时,采用随机的方式(而不是以体重为依据)将每窝子代大鼠数目进行调整,剔除多余的动物,达到每窝性别和数目的统一。每窝尽可能选5只雌性大鼠和5只雄性大鼠,也可根据实际情况进行调整(如6雄4雌)。5观察指标
5.1临床观察
GB15193.292020
对于F0代和选定的F1代动物,试验期间一般每天在相同时间进行一般临床观察一次,如出现相关的动物毒性反应、发病、死亡以及行为变化(如中毒、难产或延期分娩等症状)需记录。此外,所有的F0代和F1代动物(断乳后)每周需进行一次详细观察并记录,观察的体征应包括皮肤、被毛、分泌物和排泄物的产生和植物神经活动的变化(如流泪、毛发直立、不寻常的呼吸模式)等,以及步态、姿势的变化,对触摸的反应:另外,如发现阵挛或强直动作、机械性重复行为(如过度理毛、重复转圈)或怪异行为(如自残、倒退)等也需要记录。5.2体重和进食量
FO代和F1代大鼠体重称量的频次和相关要求见表3表3各代大鼠体重称量频次和相关要求动物
雄、雕鼠
交配前
试验阶段
哺乳期
给予受试物的第一天称重,并在之后每周至少称重1次,直至受试物给予不少于10周结束给予受试物的第一天称重,
并在之后每周至少称重1次
于分娩后第0(或1)
4、7、14和21天称重
于仔鼠出生后第0(或1)、
4、7、14天时称窝重,至第21天断乳时按只称重
断乳后
每周至少称重1次,
直至相应试验结束
需要指出,各代所有大鼠完成相关试验指标测定后处死时都需要称重。此外,实验中FO代和F1代1A组动物在进行体重称量的同时需记录饲料消耗量(交配和哺乳期间除外)。5.3血液、生化和尿液检测
5.3.1样本采集
FO代大鼠相关试验结束时,每个剂量组分别随机选择雄鼠和雌鼠各10只,按程序采集血液样本后可进行血液学、血液生化、血清中甲状腺素(T4)、促甲状腺激素(TSH)、性激素等检测或由受试物已知作用特性提示的其他检测。如果FO代动物需要保留进行第二次交配,为了不影响交配,血液样本的采集需提前进行。
F1代大鼠队列1相关试验结束时,每个剂量组分别随机选择1A组的雄鼠和雌鼠各10只,按程序采集血液样本后可进行血液学、血液生化、T4、TSH、性激素检测或由受试物已知作用特性提示的其他检测,并开展尿液检测。
5.3.2血液学检测指标
包括血细胞比容、血红蛋白浓度、红细胞计数、白细胞总数和分类计数、血小板计数和凝血时间/潜在凝血时间等检测。
5.3.3血液生化检测指标
GB15193.292020
包括血糖、总胆固醇、尿素、肌酐、总蛋白、白蛋白和至少有两个表示肝细胞损伤的酶(如丙氨酸氨基转移酶、天门冬氨酸转氨酶、碱性磷酸酶、Y谷氨酰转和山梨醇脱氢酶)等。必要时,可进行T4、TSH和性激素水平等的检测。
5.3.4尿液检测指标
包括外观、体积、渗透压或比重、pH、蛋白质、尿糖、血细胞等检测。5.4精子检测
5.4.1样品采集
所有F0代和F1代1A队列中的雄性大鼠在所对应的试验结束时,摘取附罩尾(或输精管)收集精子,进行精子活力和形态等参数的检测。需要注意的是精子指标的检测需在大鼠处死后立即进行,且收集过程应尽量减少精子损失。
5.4.2精子检测指标
精子形态的评价,每只动物至少检查200个精子,从而区分精子形态为正常(头部和中段尾均正常)或者异常【精子形态异常包括精子头的融合、分离,精子头和(或)尾的异常]。另外,进行性运动精子的百分比等可通过仪器辅助分析。5.5发情周期检查
FO代雌性大鼠在开始给予受试物后即可对其进行发情周期的评价(阴道细胞学检查),可持续到确认交配成功或2周的交配期结束。如果F0代雌性大鼠在开始给予受试物后出现一些与生殖毒性无关的效应(如摄食量明显减少等),那么可以考虑将交配前受试物给予时间延长2周(即交配前给予受试物4周),以便雕性大鼠更好地适应受试物,同时对应的F0代雄性大鼠交配前受试物给予时间也做相应的延长(但F0代雄鼠处死前受试物给予总的时间不变,仍为不少于10周即可)。F1代发情周期的评价主要通过队列1的检查完成。1A组的雌性大鼠,首先可在确定阴道开放日期后,每天对其进行阴道涂片检查,记录第一次发现典型角质化上皮细胞的时间,进而获得相应的间隔日期:其后,自出生后75天左右开始,还可以再次对其进行发情周期的检查和记录,检查为期2周。另外,如果1B组大鼠需要继续进行交配以获得F2代,对其发情周期也需进行检查,时间从配对开始到确认交配成功即可。
5.6子代发育毒性指标检测
5.6.1分娩后(出生后第0关或第1关)应该尽快地检查每窝仔鼠,以记录仔鼠的数量、性别、死胎数、活胎数,以及出现的外观异常(外部可见的畸形,包括聘裂、皮下出血、异常皮肤颜色或纹理、有脐带、有干性分泌物),其中死亡的仔鼠需检查并记录可能存在的缺陷或死亡的原因。5.6.2存鼠体重称量和临床观察可同时开展,分别在出生后第0(或1)、4、7、14和21天进行,如有特殊情况可增加临床观察的频次。临床观察内容包括外部结构异常,皮肤、被毛的改变、分泌物和排泄物的出现和自主活动的改变,另外如发现步态、姿势、对触摸的反应发生改变,以及出现阵挛或强直动作、刻板或怪异的行为也需记录。
5.6.3以窝为单位,检查并记录F1代各剂量组仔鼠生理发育指标。生理发育指标包括:耳廓分离、静眼、张耳、出毛、门齿萌出时间等:雌性阴道张开和雄性睾丸下降的时间:出生后第4天,测量肛门与生殖器的距离(AGD);出生后第12天或第13天,所有雄性仔鼠检查乳头/乳晕。7
5.7子代神经发育毒性指标检测
GB15193.292020
5.7.1各剂量组队列2的大鼠用于神经发育毒性评价,其中2A队列大鼠(10只雄鼠和10只雌鼠)开展听觉惊吓、功能观察、活动度测试和神经病理学检查,2B队列大鼠(10只雄鼠和10只雌鼠)在出生后第21天(或第22天)处死后进行神经病理学检查。5.7.2听觉惊吓检测
在出生后第24士1天时,对2A队列的大鼠进行听觉惊吓测试。在进行听觉惊吓测试时,需使实验条件优化到每次测试条件较为稳定。受试物组和对照组交叉进行测试,所有检测的动物均需测试50次,10次为一组,共5组,记录每组测试动物的平均反应振幅。5.7.3神经系统功能观察组合检测出生后第63天至第75天间适当的时间,2A队列大鼠进行神经系统功能观察组合检测。功能观察组合包括试验对象外观的详细的描述、行为和功能的协调性,具体观察项目和指标见表4。上述观察可在自由移动的活动场所(开阔场地)或居住的笼内进行,实验动物按照最少互动到最多互动的顺序来进行。
表4神经系统功能观察组合的项目及指标观察项目
笼内一般状况观察
运动活动/共济失调
中枢兴奋
肌张力
心血管/呼吸系统
自主体征
检测指标
动物进食、饮水、睡觉、无运动活动/清醒、绕笼内运动、竖毛、攻击同笼动物、发声、理毛唤醒反应、手指逼近、头部触摸、僵住症、异常行为、视觉位置感、被动体位反应畏惧、理毛行为、攻击性/应激性、易怒、异常发声体态、自主活动、共济失调步态、直立抽搐、癫痫、震颤、惊恐反应、对扶按尾部的敏感性低肌张力步态、握力、身体张力、腹部张力、肢体张力脸闭反射、耳廓反射、后肢反射、地面翻正反射、空中翻正反射呼吸、心率、皮肤颜色、发结
扭体症状、尾巴体位、竖毛、流泪、血泪、流涎、眼晴张开、突眼、排尿、排便、类便黏稠度、尿液颜色、动物死亡
5.7.4神经行为指标检测
可根据文献报道和前期的研究结果:有针对性地选择相关学习和记忆的测试方法对2A队列大鼠学习记忆能力进行检测。如果无上述信息的提供,推荐使用主动回避试验、被动回避试验或Morris水迷宫试验等作为试验方法进行检测。5.8子代发育免疫毒性指标检测
5.8.1各剂量组队列3的大鼠(10只雄性和10只雌性动物),在出生后第56土3天时进行对T细胞依赖抗原[如绵羊红细胞(SRBC)或钥孔戚血蓝蛋白(KLH))的主要IgM抗体反应(TDAR)的检测。5.8.2TDAR可采用抗体生成细胞检测或特异性IgM抗体检测的方法进行。5.8.2.1抗体生成细胞检测
空斑形成细胞(PFC)计数检测是通过腹腔注射免疫SRBC4天后,将大鼠脾细胞悬液与一定量的8
GB15193.29—2020
SRBC混合,在补体的参与下,使分泌抗体的脾细胞周围的SRBC溶解,形成肉眼可见的空斑,溶血空斑数可以反映抗体生成细胞数。PFC检测可以分亚组在不同日期进行检测,但需要满足下列条件:a)确定亚组动物的免疫和处死时间,以保证检测时达到了反应峰值:b)每个亚组包含了不同组别间数量相同的雄性和雌性动物:c)亚组动物处死时日龄应相同。5.8.2.2特异性IgM抗体检测
腹腔注射SRBC或KLH5天后,采用酶联免疫吸附试验(ELISA)方法测定血清中的特异性IgM抗体效价。
5.9潜在生殖毒性的继续评价
如果F1代1A组大鼠的试验结果提示受试物可能存在生殖毒性作用,各剂量组1B队列的雄雌大鼠(13周龄)除可以通过处死后进行病理检查给予证明外,还可以通过持续给予受试物至少到出生后第90天(但不超过120天),再进行雌雄交配(避免同窝的雌雄大鼠进行交配)以获得F2代动物的方式对潜在的生殖毒性作用进行评价,处理方式与F0代动物相同。在F2代仔鼠到达出生后第4天时,如获得的试验数据能够说明问题时即可结束实验,而无需继续喂养至断乳或更久。6病理学检查
6.1大体解部
在试验终止时或试验期间出现死亡时,所有的FO代和F1代动物都要进行大体解剖,观察分析任何结构异常情况或病理性改变,其中应特别关注生殖系统器官是否存在异常。已死亡的或死情况下处死的仔鼠,应进行大体解剖并分析可能的缺陷和(或)死亡的原因,并放入固定液保存。对于成年FO代和F1代雌性大鼠进行大体解剖时,一方面,解剖当天可进行阴道涂片来确定发情周期的倩况,并与其生殖器官组织病理学检查结果结合考虑:另一方面,还可通过硫化铵染色等方法检查所有F0代雌鼠(如果F1代1B组需继续交配,则也需检查)子宫着床点是否存在并计数。6.2器官摘取、称重及保存
6.2.1所有F0代和F1代相关队列中成年雌雄大鼠相应试验终止时,解后根据试验需要可考虑摘取下列脏器,称重(除非有特殊要求,成对脏器可以单独或合并称重)后选取合适固定液进行保存。组织或器官的摘取及称重的内容和要求见表5。表5组织或器官摘取和称重的内容及要求项目类别
需称重并计算脏
器系数的器官
组织病理学
检查的脏器
需进行组织病理学
检查的组织或器官
必要时,需进行组织
病理学检查的
组织或器官
脑、肝脏、肾脏、心脏、脾脏、胸腺、垂体、甲状腺(含甲状旁腺)、肾上腺、子宫(包括输卵管和子宫颈)、率丸、附睾(用于精子计数的尾部和整体)脑、肝脏、肾脏、心脏、脾脏、胸腺、肾上腺、子宫(包括输卵管和子宫颈)、率丸、附睾(用于精子计数的尾部和整体)、卵巢、前列腺、精囊、淋巴结未梢神经、肌肉、脊髓、眼球及视神经、胃肠道、膀胱、肺、垂体、甲状腺(含甲状旁腺)、气管、骨髓、输精管、乳腺(雄性和雌性)以及阴道9
GB15193.292020
6.2.2必要时,F1代大鼠队列1A相关试验结束时,可从每个剂量组分别随机选择雄鼠和雌鼠各10只,进行出生前或出生后暴露导致的免疫效应评价,包括对淋巴结进行称重,对脾脏细胞进行表型分析(T细胞、B细胞、NK细胞)。
6.2.3F1代2A组的大鼠在行为测试结束后处死,需进行灌注固定后再摘取脑,称重后开展神经组织病理学检查:F1代2B组大鼠在出生后第21天(或第22天)处死,在摘取脑时灌注固定可选择性开展称量后进行神经组织病理学检查。6.2.4F1代未入选相应队列剩余的存鼠,可在出生后第22天(断乳后)处死,除非试验结果表明需利用这部分动物开展进一步的评价。上述处死的仔鼠均需进行大体解剖,并对生殖器官进行评价。另外,从尽可能多的窝中得到每组每个性别10只仔鼠,对其脑、脾脏和胸腺称重并保存。6.3组织病理学检查
6.3.1F0代
FO代大鼠试验结束时所摘取器官应进行组织病理学检查,可先进行高剂量组和对照组检查,如发现与受试物有关的有意义的组织病理学改变时,需进一步检查所有较低的剂量组的动物。此外,对出现未能成功进行交配、受孕,相应子代大鼠出现一定发育毒性表现的FO代大鼠,需对其生殖器官进行全面组织病理学的评价。
6.3.2F1代
6.3.2.1队列1
1A队列全部高剂量组和对照组成年动物的器官需进行组织病理学检查,每窝至少有1只仔鼠。如发现脏器出现与受试物有关的有意义的病理改变后,需进一步检查所有中、低剂量组的动物,以确定NOAEL。另外,如果从1A队列动物得到的结果仍存在可疑,需进行IB队列动物的组织学检查加以验证。
6.3.2.2队列2
在完成神经行为测试之后(在出生75天后,但不超过90天),2A队列全部高剂量组和对照组大鼠摘取脑等组织后进行神经组织病理学检查。在出生后第21天(或第22天),2B队列全部高剂量组和对照组的大鼠摘取脑等组织后进行脑组织病理学检查。当发现脏器出现与受试物有关的有意义的病理改变后,需进一步检查所有中、低剂量组的动物,以确定NOAEL对于2A和2B队列的大鼠,通过脑多切面的方式,可全面检查大脑膜球、大脑皮层、海马体、基底神经节、丘脑、下丘脑、中脑(被囊、被盖和大脑脚)、脑干和小脑。另外,在上述检查基础上,2A队列大鼠可增加眼(视网膜和视神经)和周围神经标本、肌肉和脊髓检查。7数据处理和结果评价
7.1数据处理
将所有的数据和结果以表格形式进行总结,数据可以用表格进行统计,表中应显示每组的实验动物数、交配的雄性动物数、受孕的雌性动物数、各种毒性反应及其出现动物百分数。生殖、生理发育指标数据,应以窝为单位统计。结果应以适当的方法进行统计学分析,计量资料采用方差分析,进行多个试验组与对照组之间均数比较,分类资料采用Fisher精确分布检验、卡方检验、秩和检验,等级资料采用Ridit分析、秩和检验等
7.2结果评价
GB15193.292020
比较受试物组动物与对照组动物观察指标和病理学检查结果是否有显著性差异及剂量反应关系,以评定受试物有无生殖发育毒性,进而确定其生殖发育毒性作用的NOAEL和LOAEL。同时,还可根据出现统计学差异的指标(如体重、生理发育指标、神经功能观察、神经发育毒性、发育免疫毒性、大体解剖和病理组织学检查结果等),进一步估计生殖发育毒性的作用特点。8试验报告
8.1试验名称、试验单位名称和联系方式、报告编号。8.2试验委托单位名称和联系方式、样品受理日期。8.3试验开始和结束日期、试验项目负责人、试验单位技术负责人、签发日期。8.4试验摘要。
8.5受试物:名称、批号、剂型、状态(包括感官、性状、包装完整性、标识)、数量、前处理方法、溶媒。8.6实验动物:物种、品系、级别、数量、体重、性别、来源(供应商名称、实验动物生产许可证号)、动物检疫、适应情况、饲养环境(温度、相对湿度、实验动物设施使用许可证号)、饲料来源(供应商名称、实验动物饲料生产许可证号)。
8.7试验方法:试验分组、每组动物数、剂量选择依据、受试物给予途径及期限、观察指标、统计学方法。8.8试验结果
生殖毒性检测结果:
实验动物的体重、摄食量、食物利用率(除了交配和哺乳期间);所选择断乳后F1代动物的体重:在研究过程中死亡的时间或者是否在试验结束有存活的动物;d)
临床观察症状的性质、严重程度和持续时间(是否是可逆的);血液、生化(包括TSH和T4、性激素)和尿液分析的结果;脾脏细胞的表型分析结果(T细胞、B细胞、NK细胞):正常或异常发情周期的FO代和F1代雌性动物的数目;交配的时间(开始交配至交配成功的天数);对生殖的毒性或其他影响,包括完成交配、妊娠、分娩和哺乳的动物数目以及百分比,成功交配的雄性的数目和百分比,有难产/延长或难分娩症状的雌性数目和百分比孕期、分娩期(可以记录的话)的时长:着床数量、窝大小和仔鼠性别比:k)
着床后流产的数量,活胎和死胎的数目和百分比:仔鼠窝重量:
肉眼观察明显的异常幼仔的数量:仔鼠生理发育指标结果;
代大鼠动物性成熟指标的数据:代和F1代大鼠宰杀时的体重、绝对和相对器官重量数据;q)F0
大体解剖和组织病理学检查结果;s)F0
代和F1代雄性附睾尾部精子活性和形态分析结果。8.8.2神经发育毒性检测结果:
听觉惊吓测试的分析结果:
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。