GB/T 4789.10-2003
基本信息
标准号: GB/T 4789.10-2003
中文名称:食品卫生微生物学检验 金黄色葡萄球菌检验
标准类别:国家标准(GB)
英文名称: Microbiological examination of food hygiene - Examination of Staphylococcus aureus
标准状态:已作废
发布日期:2003-08-11
实施日期:2004-01-01
作废日期:2009-03-01
出版语种:简体中文
下载格式:.rar.pdf
下载大小:235512

标准分类号
标准ICS号:数学、自然科学>>微生物学>>07.100.30
中标分类号:医药、卫生、劳动保护>>卫生>>C53食品卫生
关联标准
出版信息
出版社:中国标准出版社
页数:10页
标准价格:12.0 元
出版日期:2004-01-01
相关单位信息
首发日期:1984-12-25
复审日期:2004-10-14
起草人:刘以贤、冉陆、付萍、姚景会
起草单位:北京市卫生防疫站、中国疾病预防控制中心营养与食品安全所
提出单位:中华人民共和国卫生部
发布部门:中华人民共和国卫生部 中国国家标准化管理委员会
主管部门:卫生部
标准简介
本标准规定了食品中金黄色葡萄球菌的检验方法。本标准适用于各类食品和食物吕毒样品中金黄色葡萄球菌的检验。 GB/T 4789.10-2003 食品卫生微生物学检验 金黄色葡萄球菌检验 GB/T4789.10-2003 标准下载解压密码:www.bzxz.net
标准图片预览




标准内容
ICS 07.100.30
中华人民共和国国家标准
GB/T4789.10—2003
代替GB/T4789.10-—1994
食品卫生微生物学检验
金黄色葡萄球菌检验
Microbiological examination of food hygiene-Examination of Staphylococcus aureus2003-08-11发布
中华人民共和国卫生部
中国国家标准化管理委员会
2004-01-01实施
GB/T4789.10—2003
本标准对GB/T4789.10—1994《食品卫生微生物学检验金黄色葡萄球菌检验》进行修订。本标准与GB/T4789.10—1994相比主要修改如下:按照GB/T1.1一2000对标准文本的格式和文字进行修改。修改并规范原标准中的“设备和材料”。附录A中A.2.15试剂浓度由0.008mol/L修改为0.2mol/L。本标准自实施之日起,GB/T4789.10—1994同时废止。本标准的附录A是规范性附录。
本标准由中华人民共和国卫生部提出并归口。本标准起草单位:北京市卫生防疫站、中国疾病预防控制中心营养与食品安全所。本标准主要起草人:刘以、冉陆、付萍、姚景会。本标准于1984年首次发布,1994年第一次修订,本次为第二次修订。66
1范围
食品卫生微生物学检验
金黄色葡萄球菌检验
本标准规定了食品中金黄色葡葡球菌的检验方法。本标准适用于各类食品和食物中毒样品中金黄色葡葡球菌的检验。规范性引用文件
GB/T4789.10—2003
下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。GB/T4789.28一2003食品卫生微生物学检验染色法、培养基和试剂3设备和材料
3.1冰箱:0℃~4℃。
3.2恒温培养箱:36℃士1℃。
3.3显微镜:10×100×。
3.4均质器或灭菌乳钵。
3.5架盘药物天乎:0g~500g,精确至0.5g。3.6灭菌试管:10mm×100mm,16mm×160mm。3.7灭菌吸管:1mL(具0.01mL刻度)、10mL(具0.1mL刻度)。3.8灭菌锥形瓶:500mL、100mL。3.9灭菌培养Ⅲ:直径90mm。
3.10注射器:0.5mL。
灭菌L型涂布棒。
灭菌刀、剪子、镊子等。
培养基和试剂
胰酪陈大豆肉汤:按GB/T4789.28-2003中4.59规定。4.27.5%氯化钠肉汤:按GB/T4789.28一2003中4.61规定。4.3血琼脂平板:按GB/T4789.28—2003中4.6规定。4.4Baird-Parker琼脂平板:按GB/T4789.28—2003中4.60规定。4.5肉浸液肉汤:按GB/T4789.28—2003中4.1规定。4.60.85%灭菌生理盐水。
4.7兔血浆:按GB/T4789.28—2003中4.63规定。检验程序
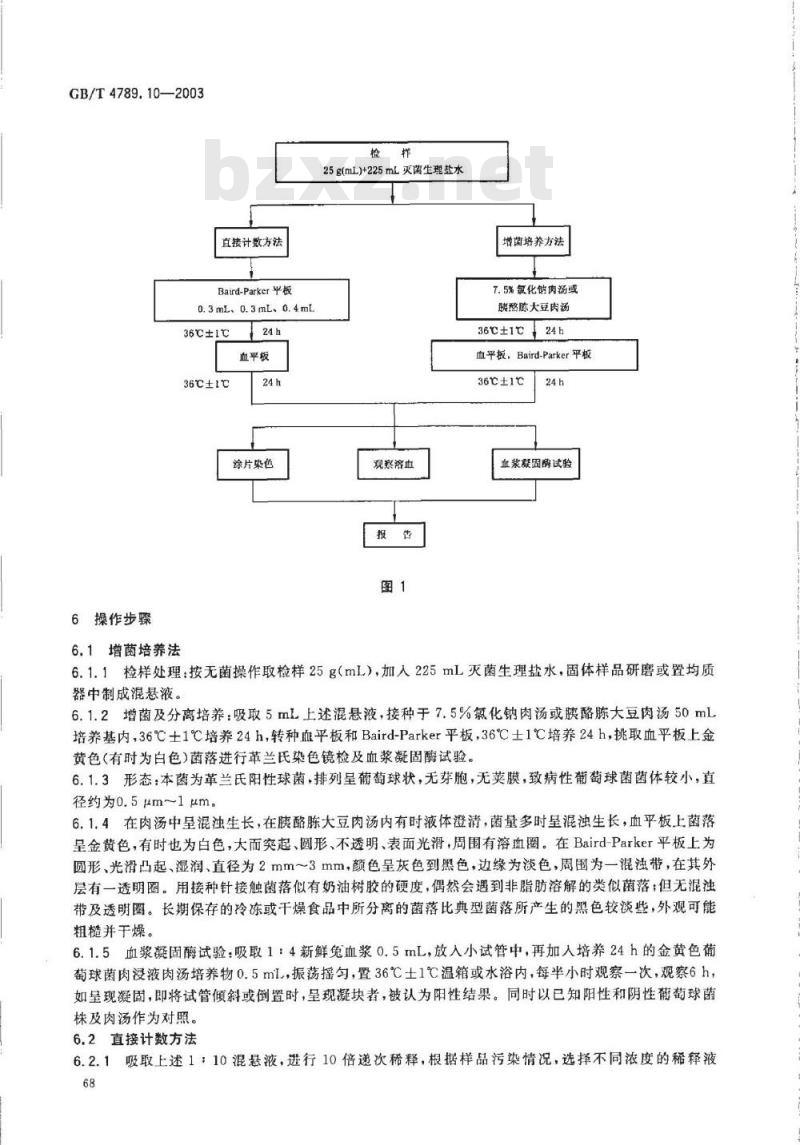
金黄色葡萄球菌检验程序见图1。67
GB/T4789.10—2003
直接计数方法
Baird-Parker平板
0.3mL、0.3mL、0.4mL
36℃±1℃
血平板
除片染色
6操作步骤
6.1增菌培养法
25g(mL)+225mL灭菌生理盐水
观察落血
增菌培养方法
7.5%氯化钠肉汤或
胰酪陈大豆肉汤
36c+1c24h
血平板,Baird-Parker平板
36±1℃
血浆凝固酶试验
6.1.1检样处理:按无菌操作取检样25g(mL),加人225mL灭菌生理盐水,固体样品研磨或置均质器中制成混悬液。
6.1.2增菌及分离培养:吸取5mL上述混悬液,接种于7.5%氯化钠肉汤或蕨酪陈大豆肉汤50mL培养基内,36℃土1℃培养24h,转种血平板和Baird-Parker平板,36℃士1℃培养24h,挑取血平板上金黄色(有时为白色)菌落进行革兰氏染色镜检及血浆凝固酶试验。6.1.3形态:本菌为革兰氏阳性球菌,排列呈葡萄球状,无芽胞,无荚膜,致病性葡萄球菌菌体较小,直径约为0.5μm~1 μm。
6.1.4在肉汤中呈混浊生长,在胰酪陈大豆肉汤内有时液体澄清,菌量多时呈混浊生长,血平板上菌落呈金黄色,有时也为白色,大而突起、圆形、不透明、表面光滑,周围有溶血圈。在Baird-Parker平板上为圆形、光滑凸起、湿润、直径为2mm~3mm,颜色呈灰色到黑色,边缘为淡色,周围为一混浊带,在其外层有一透明圈。用接种针接触菌落似有奶油树胶的硬度,偶然会遇到非脂肪溶解的类似菌落;但无混浊带及透明图。长期保存的冷冻或干燥食品中所分离的菌落比典型菌落所产生的黑色较淡些,外观可能粗糙并干燥。
6.1.5血浆凝固酶试验:吸取1:4新鲜免血浆0.5mL,放入小试管中,再加入培养24h的金黄色葡萄球菌肉浸液肉汤培养物0.5mL,振荡摇匀,置36℃土1℃温箱或水浴内,每半小时观察一次,观察6h,如呈现凝固,即将试管倾斜或倒置时,呈现凝块者,被认为阳性结果。同时以已知阳性和阴性葡萄球菌株及肉汤作为对照。
6.2直接计数方法
6.2.1吸取上述1:10混悬液,进行10倍递次稀释,根据样品污染情况,选择不同浓度的稀释液68
GB/T4789.10—2003
1mL,分别加人三块Baird-Parker平板,每个平板接种量分别为0.3mL、0.3mL.0.4mL,然后用灭菌L棒涂布整个平板。如水分多不易吸收,可将平板放在36℃士1℃1h,等水分蒸发后反转平血置36℃1℃培养。
6.2.2在三个平板上点数周围有混浊带的黑色菌落,并从中任选五个菌落,分别接种血平板,36℃士1℃24h培养后进行染色镜检、血浆凝固酶试验,步骤同增菌培养法。6.2.3菌落计数:将三个平板中疑似金黄色葡萄球菌黑色菌落数相加,乘以血浆凝固酶阳性数,除以5,再乘以稀释倍数,即可求出每克样品中金黄色葡萄球菌数。69
GB/T4789.10—2003
A.1设备和材料
A.1.1冰箱:0℃~4℃。
A,1.2恒温培养箱:36℃士1℃。附录A
(规范性附录)
葡萄球菌肠毒素检验
A.1.3振荡培养箱或普通培养箱:36℃土1℃。A.1.4酶标仪。bzxz.net
A.1.5离心机:8000r/min。
A.1.6均质器或灭菌乳钵。
层析柱:40mm×(20mm~25mm)。A.1.7
微量加样器:200μL、50μL。
A,1t.9细滴管。
分液漏斗。
透析袋。
2洗瓶。
灭菌吸管:1mL(具0.01mL刻度)、10mL(具0.1mL刻度)。A.1.13
灭菌培养Ⅲ:直径150mm(或带盖糖瓷盘)。灭菌锥形瓶:250mL
有机玻璃模板。
打孔器:直径2.5mm。
载玻片、橡皮圈。
灭菌玻璃纸、三角棒、锻子等
A.2培养基和试剂
A.2.1肠毒素产毒培养基:按GB/T4789.28-2003中4.86规定。A.2.2营养琼脂:按GB/T4789.28--2003中规定。A.2.31%琼脂糖(0.9%生理盐水配制)溶液。A.2.40.2mol/LpH7.5磷酸盐缓冲液。A.2.5三氟甲烷。
A.2.66mol/L盐酸溶液。
A.2.75mol/L氢氧化钠。
A.2.80.85%生理盐水。
A.2.91%乙酸溶液。
00.1%噻嗪红R或氨基黑B。
A.2.11硅胶或凡士林。
A.2.12A、B、C、D型葡萄球菌肠毒素和抗血清。A.2.13
羧甲基纤维素(CM22或CM11Whatman)A.2.14
0.2mol/LpH6.8磷酸盐缓冲液。
酶标记A,B、C、D肠毒素抗血清或酶联免疫试剂盒。0.1mol/LpH9.5碳酸盐缓冲液。
0.05%0.02mo1/LpH7.2吐温-20缓冲液。邻苯二胺酶底物。
2 mol/L硫酸。
检验程序
从菌株中检测肠毒素
从菌株中检测肠毒素程序见图A,1。抹
营养琼脂斜面36±1℃,18h24h
用盐水洗下菌苔,放入产毒培养基周体培养法:36℃土1℃培养48h液体培养法:36℃士1℃振荡培养48h8000r/min离心20min,取上清液,加热100C10min8000/min离心10min,浓缩双相琼脂扩散:微玻片法或玻片法检测肠毒素报告
A.3.2从食物检样中提取和检测肠毒素A.3.2.1微玻片法检测肠毒素(浓缩法和层析法)程序见图A.2。GB/T4789.10-—2003
GB/T4789.10—2003
固体检样100g加入0.2mol/LpH7.5磷酸盐缓冲液100mL,4C没泡18h~24h:液体检样直接吸取100mL固体检样用纱布过滤
液体检样:离心8000t/min20min取上消液固体检样:离心8000r/min20min取上清液加入三氧甲烷10mL~15mL,报10min,静置,弃去二氮甲烷加入6mol/L盐酸溶液调pH至4.5,8000r/min20min,取上清液加入5mol/L氢氧化钠溶液,调pH至7.5.8000r/min,20min取上清液,放入透析袋内,放多聚乙二醇或用电风扇吹于,浓缩到1mL2mL用微玻片法检测肠毒素
浓缩法
用蒸增水洗下浓缩物
装入透析袋,以 0. 008mol/LpH5. 6 磷酸盐缓冲被平衡过CM层析柱(流速1mL/min~2mL/min)用0.008mol/LpH5.6磷酸盐缓冲液约100mL洗脱用0.2mol/LpH6.8磷酸盐缓冲液洗脱出肠毒素用微玻片法检测肠毒素
层析法
酶联免疫法检测肠毒素程序见图A,3。用0.1mol/LpH9.5碳酸盐级冲液帮释血清,加入苯乙烯叫孔板0.2mL,36℃±1℃30min弃去上液,用0.05%0.02mol/LpH7.2灶温-20缓冲渡洗涤五次液体检样直接加入板孔0.2mL;固体检样100g+100mL0.2mol/LpH7.5磷酸盐缓冲液,均质后取滤液0.2mL,36±1℃30min奔去上液,用0.05%0.02mo/LpH7.2吐温-20缓冲液洗涤五次加入酶抗体0.2mL,36℃±1℃30min弃去上液,用0.05%0.02mol/LpH7.2吐温-20缓冲液洗涤五次加入邻苯二胺醇底物0.2mL,置室温30min加入2mol/L硫酸0.05mL,立即比色报
A.4肠毒素检测
A.4.1从菌株中提取肠毒素方法
GB/T4789.10-2003
A.4.1.1液体透析培养法:用宽2.5cm、长80cm的透析袋装人60mL产毒培养基,两端扎紧,将透析袋装人250mL锥形瓶内,加人15mL灭菌生理盐水,透析袋两端留在瓶口,用棉塞塞好,121℃高压灭菌30min,待测菌株接种营养琼脂斜面(试管18mmX180mm),37℃培养24h,用5mL生理盐水洗下菌落,倾入上述培养瓶中,每个菌种种一瓶,37℃振荡培养48h,振速为100次/min,吸出菌液离心,8000r/min30min,取上清液做双相琼脂扩散,如为阴性,再装入透析袋内,用电风扇吹,或用多聚乙二醇,浓缩至1mL~2mL,再做琼脂扩散。A.4.1.2固体透析培养法:向直径150mm的灭菌平皿或带盖据瓷盘中倾人灭菌产毒培养基约100mL~120mL,凝固后表面铺一灭菌玻璃纸,待测菌株接种在营养琼脂上,37℃培养24h,用约3mL灭菌盐水洗下菌苔,倾在玻璃纸上,用灭菌三角棒涂满平血,37℃培养48h,加人10mL~20mL灭菌生理盐水,用灭菌三角棒刮取菌苔,吸取菌液离心,以下步骤同液体透析培养法。A.4.2从食品中提取肠毒素方法
A.4.2.1直接浓缩法:取食品样品100g,加人无菌0.2mol/LpH7.5磷酸盐缓冲液,均质成匀浆,置4℃浸泡18h24h,用纱布过滤将滤液离心8000r/min20min,取上清液,放人分液漏斗中,加人73
GB/T4789.10—2003
10mL三氯甲烷,振摇10min,静置,将底层三氯甲烷弃去(如不分层,可8000r/min离心20min)。加人6mol/L盐酸溶液调pH至4.5,8000r/min离心20min,取上清液,加5mol/L氢氧化钠溶液,调pH至7.5,离心取上清液,装入透析袋或玻璃纸,用电扇吹干,或放多聚乙二醇浓缩至1mL~2mL,做微玻片双向琼脂扩散。
A.4.2.2层析法:如需提取较纯肠毒素,可将上述浓缩液用蒸馏水洗下,装入透析袋,以0.008mol/LpH5.6磷酸盐缓冲液平衡,加人CM层析柱内,流速1mL/min~2mL/min,用0.008mol/LpH5.6磷酸盐缓冲液洗脱,再用0.2mol/LpH6.8磷酸盐缓冲液洗脱出肠毒素。洗脱液装人透析袋内,用电扇或多聚乙二醇浓缩至1mL,做微玻片双向琼脂扩散,检测肠毒素。A.4.3双向琼脂扩散检测肠毒素
A.4.3.1微玻片法:将在95%乙醇中浸泡的载片用洁净纱布擦干,吸取溶化的0.2%琼脂糖(蒸馏水配制)滴在载玻片上,使剩余的琼脂糖流下,放在无尘的环境中干燥,先将一层薄塑料板放在载玻片上,然后将带孔的有机玻璃模板边缘涂一层薄的硅胶或凡士林,放在塑料板上,两边用橡皮圈系紧固定,吸取1%琼脂糖,立即从模板中间孔加入载玻片和模板之间,直至充满琼脂糖,凝固后再将孔中琼脂糖用注射器针头挑去,在中间孔滴加抗血清,四周滴加菌株产毒液或食品提取液,放人加有湿棉球的容器内,放25℃~30℃、18h~24h观察结果。可在灯光上,并对着暗的背景观察,在抗血清和提取液之间呈现明显沉淀线。如沉淀线只能微弱可见时,可进行染色。具体内容见图A,4。?
对照肠毒素
被检样
抗血消
被检样
A——被检样无肠毒素,为阴性
被检样
被检样3、5含肠毒素,为阳性:4无肠毒素,为阴性。B
对照肠毒素
被检样
抗血清
被检样
截检样
A.4.3.2玻片法:吸取溶化的1%琼脂糖2.5mL,铺在洁净载玻片上,凝固后用直径2.5mm的金属打孔器打成幅射型,孔距为2.5mm,中心孔加人肠毒素抗血清,周围六个孔加人菌株或食品的肠毒素提取液,放入有滴加2/10000三氮化钠湿棉球的容器内,以保持混度。置25℃~30℃、18h~20h,观察结果,在抗血清的提取物之间有明显沉淀线即为阳性。A.4.3.3染色法:用微玻片法取下胶带和有机玻璃模板,玻片法可直接将玻片放入蒸馏水中浸泡4h~8h,中间换2次3次水,在下述各液中浸10min,10%乙酸中含1%噻嗪红R(或氨基黑)1%乙酸;1%乙酸含1%甘油,如脱色不净,可继续浸泡。取出后盖一滤纸,吸去多余液体,在室温或35℃烘干。阳性者沉淀被染上颜色,可长期保存。A,4.4酶联免疫法检测肠毒素(双抗体法)A,4.4.1包被抗体:用0.1mol/LpH9.5碳酸盐缓冲液稀释肠毒素抗血清使成5μg/mL,加人洗净的苯乙烯凹孔板内,每孔0.2mL,置36℃士1℃30min,弃去上液。A.4.4.2洗涤:用0.05%0.02mol/LpH7.2吐温-20缓冲液洗涤五次。A.4.4.3加入检样:如为液体,可直接加入0.2mL,固体样品取100g,加人0.2mol/LpH7.5磷酸盐缓冲液100mL,均质后取过滤液0.2mL。A.4.4.4洗涤:同A.4.4.2。
GB/T4789.10—2003
每孔内加入酶抗体0.2mL,置36℃士1℃30min,同时做阳性和阴性对照。弃去上液。A.4.4.5
A.4.4.6洗涤:同A.4.4.2。
A.4.4.7每孔内加人邻苯二胺酶底物溶液0.2mL,室温放置30min。每孔内加入2mol/L硫酸0.05mL,立即放酶标仪比色。A,4.4.8
结果判定:样品OD值比阴性对照,比值大于2为阳性,小于2为阴性。A.4.4.9
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
中华人民共和国国家标准
GB/T4789.10—2003
代替GB/T4789.10-—1994
食品卫生微生物学检验
金黄色葡萄球菌检验
Microbiological examination of food hygiene-Examination of Staphylococcus aureus2003-08-11发布
中华人民共和国卫生部
中国国家标准化管理委员会
2004-01-01实施
GB/T4789.10—2003
本标准对GB/T4789.10—1994《食品卫生微生物学检验金黄色葡萄球菌检验》进行修订。本标准与GB/T4789.10—1994相比主要修改如下:按照GB/T1.1一2000对标准文本的格式和文字进行修改。修改并规范原标准中的“设备和材料”。附录A中A.2.15试剂浓度由0.008mol/L修改为0.2mol/L。本标准自实施之日起,GB/T4789.10—1994同时废止。本标准的附录A是规范性附录。
本标准由中华人民共和国卫生部提出并归口。本标准起草单位:北京市卫生防疫站、中国疾病预防控制中心营养与食品安全所。本标准主要起草人:刘以、冉陆、付萍、姚景会。本标准于1984年首次发布,1994年第一次修订,本次为第二次修订。66
1范围
食品卫生微生物学检验
金黄色葡萄球菌检验
本标准规定了食品中金黄色葡葡球菌的检验方法。本标准适用于各类食品和食物中毒样品中金黄色葡葡球菌的检验。规范性引用文件
GB/T4789.10—2003
下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。GB/T4789.28一2003食品卫生微生物学检验染色法、培养基和试剂3设备和材料
3.1冰箱:0℃~4℃。
3.2恒温培养箱:36℃士1℃。
3.3显微镜:10×100×。
3.4均质器或灭菌乳钵。
3.5架盘药物天乎:0g~500g,精确至0.5g。3.6灭菌试管:10mm×100mm,16mm×160mm。3.7灭菌吸管:1mL(具0.01mL刻度)、10mL(具0.1mL刻度)。3.8灭菌锥形瓶:500mL、100mL。3.9灭菌培养Ⅲ:直径90mm。
3.10注射器:0.5mL。
灭菌L型涂布棒。
灭菌刀、剪子、镊子等。
培养基和试剂
胰酪陈大豆肉汤:按GB/T4789.28-2003中4.59规定。4.27.5%氯化钠肉汤:按GB/T4789.28一2003中4.61规定。4.3血琼脂平板:按GB/T4789.28—2003中4.6规定。4.4Baird-Parker琼脂平板:按GB/T4789.28—2003中4.60规定。4.5肉浸液肉汤:按GB/T4789.28—2003中4.1规定。4.60.85%灭菌生理盐水。
4.7兔血浆:按GB/T4789.28—2003中4.63规定。检验程序
金黄色葡萄球菌检验程序见图1。67
GB/T4789.10—2003
直接计数方法
Baird-Parker平板
0.3mL、0.3mL、0.4mL
36℃±1℃
血平板
除片染色
6操作步骤
6.1增菌培养法
25g(mL)+225mL灭菌生理盐水
观察落血
增菌培养方法
7.5%氯化钠肉汤或
胰酪陈大豆肉汤
36c+1c24h
血平板,Baird-Parker平板
36±1℃
血浆凝固酶试验
6.1.1检样处理:按无菌操作取检样25g(mL),加人225mL灭菌生理盐水,固体样品研磨或置均质器中制成混悬液。
6.1.2增菌及分离培养:吸取5mL上述混悬液,接种于7.5%氯化钠肉汤或蕨酪陈大豆肉汤50mL培养基内,36℃土1℃培养24h,转种血平板和Baird-Parker平板,36℃士1℃培养24h,挑取血平板上金黄色(有时为白色)菌落进行革兰氏染色镜检及血浆凝固酶试验。6.1.3形态:本菌为革兰氏阳性球菌,排列呈葡萄球状,无芽胞,无荚膜,致病性葡萄球菌菌体较小,直径约为0.5μm~1 μm。
6.1.4在肉汤中呈混浊生长,在胰酪陈大豆肉汤内有时液体澄清,菌量多时呈混浊生长,血平板上菌落呈金黄色,有时也为白色,大而突起、圆形、不透明、表面光滑,周围有溶血圈。在Baird-Parker平板上为圆形、光滑凸起、湿润、直径为2mm~3mm,颜色呈灰色到黑色,边缘为淡色,周围为一混浊带,在其外层有一透明圈。用接种针接触菌落似有奶油树胶的硬度,偶然会遇到非脂肪溶解的类似菌落;但无混浊带及透明图。长期保存的冷冻或干燥食品中所分离的菌落比典型菌落所产生的黑色较淡些,外观可能粗糙并干燥。
6.1.5血浆凝固酶试验:吸取1:4新鲜免血浆0.5mL,放入小试管中,再加入培养24h的金黄色葡萄球菌肉浸液肉汤培养物0.5mL,振荡摇匀,置36℃土1℃温箱或水浴内,每半小时观察一次,观察6h,如呈现凝固,即将试管倾斜或倒置时,呈现凝块者,被认为阳性结果。同时以已知阳性和阴性葡萄球菌株及肉汤作为对照。
6.2直接计数方法
6.2.1吸取上述1:10混悬液,进行10倍递次稀释,根据样品污染情况,选择不同浓度的稀释液68
GB/T4789.10—2003
1mL,分别加人三块Baird-Parker平板,每个平板接种量分别为0.3mL、0.3mL.0.4mL,然后用灭菌L棒涂布整个平板。如水分多不易吸收,可将平板放在36℃士1℃1h,等水分蒸发后反转平血置36℃1℃培养。
6.2.2在三个平板上点数周围有混浊带的黑色菌落,并从中任选五个菌落,分别接种血平板,36℃士1℃24h培养后进行染色镜检、血浆凝固酶试验,步骤同增菌培养法。6.2.3菌落计数:将三个平板中疑似金黄色葡萄球菌黑色菌落数相加,乘以血浆凝固酶阳性数,除以5,再乘以稀释倍数,即可求出每克样品中金黄色葡萄球菌数。69
GB/T4789.10—2003
A.1设备和材料
A.1.1冰箱:0℃~4℃。
A,1.2恒温培养箱:36℃士1℃。附录A
(规范性附录)
葡萄球菌肠毒素检验
A.1.3振荡培养箱或普通培养箱:36℃土1℃。A.1.4酶标仪。bzxz.net
A.1.5离心机:8000r/min。
A.1.6均质器或灭菌乳钵。
层析柱:40mm×(20mm~25mm)。A.1.7
微量加样器:200μL、50μL。
A,1t.9细滴管。
分液漏斗。
透析袋。
2洗瓶。
灭菌吸管:1mL(具0.01mL刻度)、10mL(具0.1mL刻度)。A.1.13
灭菌培养Ⅲ:直径150mm(或带盖糖瓷盘)。灭菌锥形瓶:250mL
有机玻璃模板。
打孔器:直径2.5mm。
载玻片、橡皮圈。
灭菌玻璃纸、三角棒、锻子等
A.2培养基和试剂
A.2.1肠毒素产毒培养基:按GB/T4789.28-2003中4.86规定。A.2.2营养琼脂:按GB/T4789.28--2003中规定。A.2.31%琼脂糖(0.9%生理盐水配制)溶液。A.2.40.2mol/LpH7.5磷酸盐缓冲液。A.2.5三氟甲烷。
A.2.66mol/L盐酸溶液。
A.2.75mol/L氢氧化钠。
A.2.80.85%生理盐水。
A.2.91%乙酸溶液。
00.1%噻嗪红R或氨基黑B。
A.2.11硅胶或凡士林。
A.2.12A、B、C、D型葡萄球菌肠毒素和抗血清。A.2.13
羧甲基纤维素(CM22或CM11Whatman)A.2.14
0.2mol/LpH6.8磷酸盐缓冲液。
酶标记A,B、C、D肠毒素抗血清或酶联免疫试剂盒。0.1mol/LpH9.5碳酸盐缓冲液。
0.05%0.02mo1/LpH7.2吐温-20缓冲液。邻苯二胺酶底物。
2 mol/L硫酸。
检验程序
从菌株中检测肠毒素
从菌株中检测肠毒素程序见图A,1。抹
营养琼脂斜面36±1℃,18h24h
用盐水洗下菌苔,放入产毒培养基周体培养法:36℃土1℃培养48h液体培养法:36℃士1℃振荡培养48h8000r/min离心20min,取上清液,加热100C10min8000/min离心10min,浓缩双相琼脂扩散:微玻片法或玻片法检测肠毒素报告
A.3.2从食物检样中提取和检测肠毒素A.3.2.1微玻片法检测肠毒素(浓缩法和层析法)程序见图A.2。GB/T4789.10-—2003
GB/T4789.10—2003
固体检样100g加入0.2mol/LpH7.5磷酸盐缓冲液100mL,4C没泡18h~24h:液体检样直接吸取100mL固体检样用纱布过滤
液体检样:离心8000t/min20min取上消液固体检样:离心8000r/min20min取上清液加入三氧甲烷10mL~15mL,报10min,静置,弃去二氮甲烷加入6mol/L盐酸溶液调pH至4.5,8000r/min20min,取上清液加入5mol/L氢氧化钠溶液,调pH至7.5.8000r/min,20min取上清液,放入透析袋内,放多聚乙二醇或用电风扇吹于,浓缩到1mL2mL用微玻片法检测肠毒素
浓缩法
用蒸增水洗下浓缩物
装入透析袋,以 0. 008mol/LpH5. 6 磷酸盐缓冲被平衡过CM层析柱(流速1mL/min~2mL/min)用0.008mol/LpH5.6磷酸盐缓冲液约100mL洗脱用0.2mol/LpH6.8磷酸盐缓冲液洗脱出肠毒素用微玻片法检测肠毒素
层析法
酶联免疫法检测肠毒素程序见图A,3。用0.1mol/LpH9.5碳酸盐级冲液帮释血清,加入苯乙烯叫孔板0.2mL,36℃±1℃30min弃去上液,用0.05%0.02mol/LpH7.2灶温-20缓冲渡洗涤五次液体检样直接加入板孔0.2mL;固体检样100g+100mL0.2mol/LpH7.5磷酸盐缓冲液,均质后取滤液0.2mL,36±1℃30min奔去上液,用0.05%0.02mo/LpH7.2吐温-20缓冲液洗涤五次加入酶抗体0.2mL,36℃±1℃30min弃去上液,用0.05%0.02mol/LpH7.2吐温-20缓冲液洗涤五次加入邻苯二胺醇底物0.2mL,置室温30min加入2mol/L硫酸0.05mL,立即比色报
A.4肠毒素检测
A.4.1从菌株中提取肠毒素方法
GB/T4789.10-2003
A.4.1.1液体透析培养法:用宽2.5cm、长80cm的透析袋装人60mL产毒培养基,两端扎紧,将透析袋装人250mL锥形瓶内,加人15mL灭菌生理盐水,透析袋两端留在瓶口,用棉塞塞好,121℃高压灭菌30min,待测菌株接种营养琼脂斜面(试管18mmX180mm),37℃培养24h,用5mL生理盐水洗下菌落,倾入上述培养瓶中,每个菌种种一瓶,37℃振荡培养48h,振速为100次/min,吸出菌液离心,8000r/min30min,取上清液做双相琼脂扩散,如为阴性,再装入透析袋内,用电风扇吹,或用多聚乙二醇,浓缩至1mL~2mL,再做琼脂扩散。A.4.1.2固体透析培养法:向直径150mm的灭菌平皿或带盖据瓷盘中倾人灭菌产毒培养基约100mL~120mL,凝固后表面铺一灭菌玻璃纸,待测菌株接种在营养琼脂上,37℃培养24h,用约3mL灭菌盐水洗下菌苔,倾在玻璃纸上,用灭菌三角棒涂满平血,37℃培养48h,加人10mL~20mL灭菌生理盐水,用灭菌三角棒刮取菌苔,吸取菌液离心,以下步骤同液体透析培养法。A.4.2从食品中提取肠毒素方法
A.4.2.1直接浓缩法:取食品样品100g,加人无菌0.2mol/LpH7.5磷酸盐缓冲液,均质成匀浆,置4℃浸泡18h24h,用纱布过滤将滤液离心8000r/min20min,取上清液,放人分液漏斗中,加人73
GB/T4789.10—2003
10mL三氯甲烷,振摇10min,静置,将底层三氯甲烷弃去(如不分层,可8000r/min离心20min)。加人6mol/L盐酸溶液调pH至4.5,8000r/min离心20min,取上清液,加5mol/L氢氧化钠溶液,调pH至7.5,离心取上清液,装入透析袋或玻璃纸,用电扇吹干,或放多聚乙二醇浓缩至1mL~2mL,做微玻片双向琼脂扩散。
A.4.2.2层析法:如需提取较纯肠毒素,可将上述浓缩液用蒸馏水洗下,装入透析袋,以0.008mol/LpH5.6磷酸盐缓冲液平衡,加人CM层析柱内,流速1mL/min~2mL/min,用0.008mol/LpH5.6磷酸盐缓冲液洗脱,再用0.2mol/LpH6.8磷酸盐缓冲液洗脱出肠毒素。洗脱液装人透析袋内,用电扇或多聚乙二醇浓缩至1mL,做微玻片双向琼脂扩散,检测肠毒素。A.4.3双向琼脂扩散检测肠毒素
A.4.3.1微玻片法:将在95%乙醇中浸泡的载片用洁净纱布擦干,吸取溶化的0.2%琼脂糖(蒸馏水配制)滴在载玻片上,使剩余的琼脂糖流下,放在无尘的环境中干燥,先将一层薄塑料板放在载玻片上,然后将带孔的有机玻璃模板边缘涂一层薄的硅胶或凡士林,放在塑料板上,两边用橡皮圈系紧固定,吸取1%琼脂糖,立即从模板中间孔加入载玻片和模板之间,直至充满琼脂糖,凝固后再将孔中琼脂糖用注射器针头挑去,在中间孔滴加抗血清,四周滴加菌株产毒液或食品提取液,放人加有湿棉球的容器内,放25℃~30℃、18h~24h观察结果。可在灯光上,并对着暗的背景观察,在抗血清和提取液之间呈现明显沉淀线。如沉淀线只能微弱可见时,可进行染色。具体内容见图A,4。?
对照肠毒素
被检样
抗血消
被检样
A——被检样无肠毒素,为阴性
被检样
被检样3、5含肠毒素,为阳性:4无肠毒素,为阴性。B
对照肠毒素
被检样
抗血清
被检样
截检样
A.4.3.2玻片法:吸取溶化的1%琼脂糖2.5mL,铺在洁净载玻片上,凝固后用直径2.5mm的金属打孔器打成幅射型,孔距为2.5mm,中心孔加人肠毒素抗血清,周围六个孔加人菌株或食品的肠毒素提取液,放入有滴加2/10000三氮化钠湿棉球的容器内,以保持混度。置25℃~30℃、18h~20h,观察结果,在抗血清的提取物之间有明显沉淀线即为阳性。A.4.3.3染色法:用微玻片法取下胶带和有机玻璃模板,玻片法可直接将玻片放入蒸馏水中浸泡4h~8h,中间换2次3次水,在下述各液中浸10min,10%乙酸中含1%噻嗪红R(或氨基黑)1%乙酸;1%乙酸含1%甘油,如脱色不净,可继续浸泡。取出后盖一滤纸,吸去多余液体,在室温或35℃烘干。阳性者沉淀被染上颜色,可长期保存。A,4.4酶联免疫法检测肠毒素(双抗体法)A,4.4.1包被抗体:用0.1mol/LpH9.5碳酸盐缓冲液稀释肠毒素抗血清使成5μg/mL,加人洗净的苯乙烯凹孔板内,每孔0.2mL,置36℃士1℃30min,弃去上液。A.4.4.2洗涤:用0.05%0.02mol/LpH7.2吐温-20缓冲液洗涤五次。A.4.4.3加入检样:如为液体,可直接加入0.2mL,固体样品取100g,加人0.2mol/LpH7.5磷酸盐缓冲液100mL,均质后取过滤液0.2mL。A.4.4.4洗涤:同A.4.4.2。
GB/T4789.10—2003
每孔内加入酶抗体0.2mL,置36℃士1℃30min,同时做阳性和阴性对照。弃去上液。A.4.4.5
A.4.4.6洗涤:同A.4.4.2。
A.4.4.7每孔内加人邻苯二胺酶底物溶液0.2mL,室温放置30min。每孔内加入2mol/L硫酸0.05mL,立即放酶标仪比色。A,4.4.8
结果判定:样品OD值比阴性对照,比值大于2为阳性,小于2为阴性。A.4.4.9
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。