GB/T 5009.17-2003
基本信息
标准号: GB/T 5009.17-2003
中文名称:食品中总汞及有机汞的测定
标准类别:国家标准(GB)
英文名称: Determination of total mercury and organic mercury in food
标准状态:现行
发布日期:2003-08-01
实施日期:2004-01-01
出版语种:简体中文
下载格式:.rar.pdf
下载大小:555781

标准分类号
标准ICS号:食品技术>>67.040食品综合
中标分类号:医药、卫生、劳动保护>>卫生>>C53食品卫生
关联标准
出版信息
页数:14页
标准价格:12.0 元
相关单位信息
首发日期:1985-05-16
复审日期:2004-10-14
起草单位:卫生部食品卫生监督检验所
发布部门:中华人民共和国卫生部 中国国家标准化管理委员会
主管部门:卫生部
标准简介
本标准规定了各类食品中总汞的测定方法。本标准适用于各类食品中总汞的测定。原子荧光光谱分析法:检出限0.15μg/kg,标准曲线最佳线性范围0μg/L~60μg/L;冷原子吸收法的检出限:压力消解法为0.4μg/kg,其他消解法为10μg/kg;比色法为25μg/kg。 GB/T 5009.17-2003 食品中总汞及有机汞的测定 GB/T5009.17-2003 标准下载解压密码:www.bzxz.net
标准图片预览




标准内容
ICS 67.040
中华人民共和国国家标准
GB/T 5009.17—2003
代替GB/T5009.17--1996,部分代替GB/T5009.45--1996食品中总汞及有机汞的测定
Determination of total mercury and organic-mercury in foods2003-08-11发布
中华人民共和国卫生部
中国国家标准化管理委员会
2004-01-01实施
GB/T 5009.17-2003
本标准代替GB/T5009.17—1996《食品中总汞的测定方法》和GB/T5009.45-1996《水产品卫生标准的分析方法》中4.6甲基汞。本标准与GB/T5009.17—1996和GB/T5009.45—1996《水产品卫生标准的分析方法》中4.6甲基汞相比主要修改如下:
修改了标准的中文名称,标准中文名称改为《食品中总汞及有机汞的测定》;-按照GB/T20001.42001《标准编写规则第4部分:化学分析方法》对原标准的结构进行了修改;
一增加了氢化物原子荧光光谱法作为总汞的测定中的第一法;将GB/T5009.45—1996《水产品卫生标准的分析方法》中4.6甲基汞作为甲基汞的测定。本标推由中华人民共和国卫生部提出并归口。本标准总汞的测定第一法由卫生部食品卫生监督检验所,北京市食品卫生监督检验所、四川省食品卫生监督检验所、北京进口食品卫生监督检验所参加起草。本标准总汞的测定第二法(一)由上海市食品卫生监督检验所、中国预防医学科学院营养与食品卫生研究所、卫生部食品卫生监督检验所负责起草。本标准总汞的测定第二法(二)由卫生部食品卫生监督检验所负责起草。本标准总汞的测定第三法由江苏省卫生防疫站负责起草。本标准甲基汞的测定由上海市食品卫生监督检验所、江苏省卫生防疫站、杭州市卫生防疫站、卫生部食品卫生监督检验所、青海省卫生防疫站、福建省卫生学校负责起草。本标准总汞的测定第一法主要起草人:杨惠芬、黄流生、毛红、强卫国、闫军。本标准于1985年首次发布,于1996年第一次修订,本次为第二次修订。130
1范围
食品中总汞及有机汞的测定
总汞的测定
本标准规定了各类食品中总汞的测定方法。本标准适用于各类食品中总汞的测定GB/T 5009.17--2003
原子荧光光谱分析法:检出限0.15ug/kg,标准曲线最佳线性范围0ug/L~60μg/L;冷原子吸收法的检出限:压力消解法为0.4μg/kg,其他消解法为10μg/kg;比色法为25μg/kg。第一法原子荧光光谱分析法
2原理
试样经酸加热消解后,在酸性介质中,试样中汞被硼氢化钾(KBH)或硼氢化钠(NaBH.)还原成原子态汞,由载气(氩气)带人原子化器中,在特制汞空心阴极灯照射下,基态汞原子被激发至高能态,在去活化回到基态时,发射出特征波长的荧光,其荧光强度与汞含量成正比,与标准系列比较定量。3试剂
3.1硝酸(优级纯)。
3.230%过氧化氢。
3.3硫酸(优级纯)。
3.4硫酸+硝酸+水(1+1+8):量取10mL硝酸和10mL硫酸,缓缓倒入80mL水中,冷却后小心混匀。
3.5硝酸溶液(1+9):量取50mL硝酸,缓缓倒人450mL水中,混勾。3.6氢氧化钾溶液(5g/L):称取5.0g氢氧化钾,溶于水中,稀释至1000mL,混匀。3.7硼氢化钾溶液(5g/L):称取5.0g硼氢化钾,溶于5.0g/L的氢氧化钾溶液中,并稀释至1000mL,混匀,现用现配。
3.8汞标准储备溶液:精密称取0.1354g于干燥过的二氯化汞,加硫酸+硝酸十水混合酸(1十1十8)溶解后移入100mL容量瓶中,并稀释至刻度,混匀,此溶液每毫升相当于1mg汞。3.9汞标准使用溶液:用移液管吸取汞标准储备液(1mg/mL)1mL于100mL容量瓶中,用硝酸溶液(1+9)稀释至刻度,混匀,此溶液浓度为10μg/mL。在分别吸取10μg/mL汞标准溶液1mL和5mL于两个100mL容量瓶中,用硝酸溶液(1+9)稀释至刻度,混匀,溶液浓度分别为100ng/mL和500ng/mL,分别用于测定低浓度试样和高浓度试样,制作标准曲线。4仪器
4.1双道原子荧光光度计。
4.2高压消解罐(100mL容量)。4.3微波消解炉。
GB/T5009.17—2003
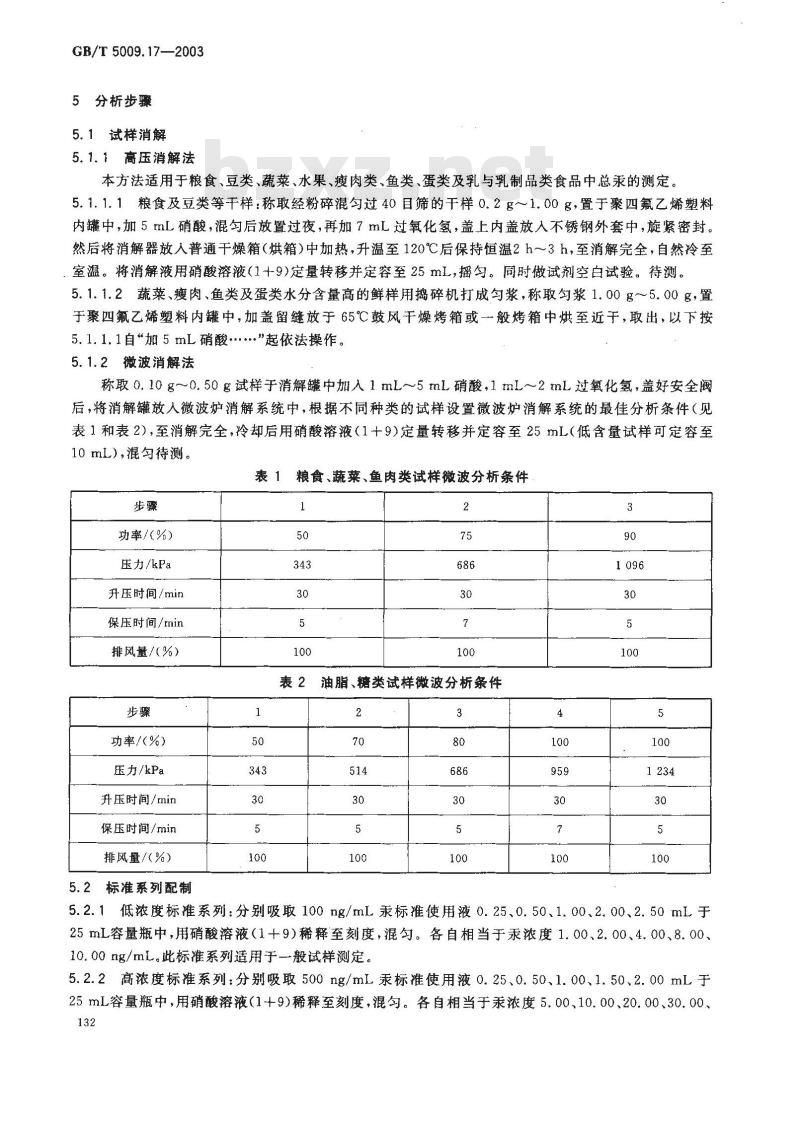
5分析步骤
5.1试样消解
5.1.1高压消解法
本方法适用于粮食、豆类、蔬菜、水果、瘦肉类、鱼类、蛋类及乳与乳制品类食品中总汞的测定。5.1.1.1粮食及豆类等干样:称取经粉碎混匀过40目筛的干样0.2g~1.00g,置于聚四氟乙烯塑料内罐中,加5mL硝酸,混勾后放置过夜,再加7mL过氧化氢,盖上内盖放人不锈钢外套中,旋紧密封。然后将消解器放人普通于燥箱(烘箱)中加热,升温至120℃后保持恒温2h~3h,至消解完全,自然冷至室温。将消解液用硝酸溶液(1十9)定量转移并定容至25mL,摇勾。同时做试剂空白试验。待测。5.1.1.2蔬菜、瘦肉、鱼类及蛋类水分含量高的鲜样用捣碎机打成勾浆,称取匀浆1.00g~5.00g,置于聚四氟乙烯塑料内罐中,加盖留缝放于65℃鼓风干燥烤箱或一般烤箱中烘至近于,取出,以下按5.1.1.1自“加5mL硝酸.\起依法操作。5.1.2微波消解法
称取0.10g~0.50g试样于消解罐中加入1mL~~5mL硝酸,1mL~2mL过氧化氢,盖好安全阀后,将消解罐放人微波炉消解系统中,根据不同种类的试样设置微波炉消解系统的最佳分析条件(见表1和表2),至消解完全,冷却后用硝酸溶液(1十9)定量转移并定容至25mL(低含量试样可定容至10 mL),混勾待测。
表1粮食、蔬菜、鱼肉类试样微波分析条件步骤bZxz.net
功率/(%)
压力/kPa
升压时间 /min
保压时间/min
排风量/(%)
功率/(%)
压力/kPa
升压时间/min
保压时间/min
排风量/%)
5.2标准系列配制
表2油脂、糖类试样微波分析条件2
5.2.1低浓度标准系列:分别吸取100ng/mL汞标准使用液0.25、0.50、1.00、2.00、2.50mL于25mL容量瓶中,用硝酸溶液(1+9)稀释至刻度,混匀。各自相当于汞浓度1.00、2.00、4.00、8.00、10.00ng/mL。此标准系列适用于一般试样测定。5.2.2高浓度标准系列:分别吸取500ng/mL汞标准使用液0.25、0.50、1.00、1.50、2.00mL于25mL容量瓶中,用硝酸溶液(1+9)稀释至刻度,混勾。各自相当于汞浓度5.00、10.00、20.00、30.00、132
40.00ng/mL。此标准系列适用于鱼及含汞量偏高的试样测定。5.3测定
GB/T 5009.17—2003
5.3.1仪器参考条件:光电倍增管负高压:240V;汞空心阴极灯电流:30mA;原子化器:温度:300℃,高度8.0mm;氩气流速:载气500mL/min,屏蔽气1000mL/min;测量方式:标准曲线法,读数方式:峰面积,读数延迟时间:1.0s;读数时间:10.0s;硼氢化钾溶液加液时间:8.0s;标液或样液加液体积:2 mL。
注:AFS系列原子荧光仪如:230、230a、2202、2202a、2201等仪器属于全自动或断序流动的仪器,都附有本仪器的操作软件,仪器分析条件应设置本仪器所提示的分析条件,仪器稳定后,测标准系列,至标准曲线的相关系数r》0.999后测试样。试样前处理可适用任何型号的原子荧光仪。5.3.2测定方法:根据情况任选以下一种方法。5.3.2.1浓度测定方式测量:设定好仪器最佳条件,逐步将炉温升至所需温度后,稳定10min~20min后开始测量。连续用硝酸溶液(1十9)进样,待读数稳定之后,转入标准系列测量,绘制标准曲线。转人试样测量,先用硝酸溶液(1十9)进样,使读数基本回零,再分别测定试样空白和试样消化液,每测不同的试样前都应清洗进样器。试样测定结果按公式(1)计算。5.3.2.2仪器自动计算结果方式测量:设定好仪器最佳条件,在试样参数画面输人以下参数:试样质量(g或mL),稀释体积(mL),并选择结果的浓度单位,逐步将炉温升至所需温度,稳定后测量。连续用硝酸溶液(1+9)进样,待读数稳定之后,转人标准系列测量,绘制标准曲线。在转入试样测定之前,再进人空白值测量状态,用试样空白消化液进样,让仪器取其均值作为扣底的空白值。随后即可依法测定试样。测定完毕后,选择“打印报告”即可将测定结果自动打印。6结果计算
试样中汞的含量按式(1)进行计算。X (c=co)XV×1 000
m×1000 ×1000
式中:
X一一试样中汞的含量,单位为毫克每千克或毫克每升(mg/kg或mg/L);c-一试样消化液中汞的含量,单位为纳克每毫升(ng/mL);co——试剂空白液中汞的含量,单位为纳克每毫升(ng/mL);V—一试样消化液总体积,单位为毫升(mL);m—试样质量或体积,单位为克或毫升(g或mL)。计算结果保留三位有效数字。
7精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。第二法冷原子吸收光谱法
8原理
汞蒸气对波长253.7nm的共振线具有强烈的吸收作用。试样经过酸消解或催化酸消解使汞转为离子状态,在强酸性介质中以氯化亚锡还原成元素汞,以氮气或干燥空气作为载体,将元素汞吹人汞测定仪,进行冷原子吸收测定,在一定浓度范围其吸收值与汞含量成正比,与标准系列比较定量。133
GB/T5009.17--2003
9试剂
9.1硝酸。
9.2盐酸。
9.3过氧化氢(30%)。
(—)压力消解法
9.4硝酸(0.5十99.5):取0.5mL硝酸慢慢加入50mL水中,然后加水稀释至100mL。9.5高锰酸钾溶液(50g/L):称取5.0g高锰酸钾置于100mL棕色瓶中,以水溶解稀释至100mL。9.6硝酸-重铬酸钾溶液:称取0.05g重铬酸钾溶于水中,加人5mL硝酸,用水稀释至100mL。9.7氯化亚锡溶液(100g/L):称取10g氟化亚锡溶于20mL盐酸中,以水稀释至100mL,临用时现配。
9.8无水氯化钙。
9.9汞标准储备液:准确称取0.1354g经于燥器干燥过的二氧化汞溶于硝酸-重铬酸钾溶液中,移100mL容量瓶中,以硝酸-重铬酸钾溶稀释至刻度。混匀。此溶液每毫升含1,0mg汞。9.10汞标准使用液:由1.0mg/mL汞标准储备液经硝酸-重铬酸钾溶液稀释成2.0ng/mL,4.0ng/mL,6.0ng/mL,8.0ng/mL,10.0ng/mL的汞标准使用液。临用时现配。10仪器
所用玻璃仪器均需以硝酸(1十5)浸泡过夜,用水反复冲洗,最后用去离子水冲洗干净。10.1双光束测汞仪(附气体循环泵、气体干燥装置、汞蒸气发生装置及汞蒸气吸收瓶)。10.2恒温干燥箱。
10.3压力消解器、压力消解罐或压力溶弹。11分析步骤
11.1试样预处理
11.1.1在采样和制备过程中,应注意不使试样污染。11.1.2粮食、豆类去杂质后,磨碎,过20目筛,储于塑料瓶中,保存备用。11.1.3蔬菜、水果、鱼类、肉类及蛋类等水分含量高的鲜样用食品加工机或匀浆机打成勾浆,储于塑料瓶中,保存备用。
11.2试样消解(可根据实验室条件选用以下任何一种方法消解)压力消解罐消解法:称取1.00g~3.00g试样(干样、含脂肪高的试样<1.00g,鲜样<3.00g或按压力消解罐使用说明书称取试样)于聚四氟乙烯内罐,加硝酸2mL~4ml.浸泡过夜。再加过氧化氢(30%)2mL~3mL总量不能超过罐容积的三分之一)。盖好内盖,旋紧不锈钢外套,放入恒温燥箱,120℃140℃保持3h~4h,在箱内自然冷却至室温,用滴管将消化液洗人或过滤人(视消化后试样的盐分而定)10.0mL容量瓶中,用水少量多次洗涤罐,洗液合并于容量瓶中并定容至刻度,混勾备用;同时作试剂空白。
11.3测定
11.3.1仪器条件:打开测汞仪,预热1h~2h,并将仪器性能调至最佳状态。11.3.2标准曲线绘制:吸取上面配制的汞标准使用液2.0、4.0.6.0、8.0、10.0ng/mL各5.0mL(相当于10.0ng、20.0ng、30.0ng、40.0ng、50.0ng)置于测录仪的汞蒸气发生器的还原瓶中,分别加人1.0mL还原剂氯化亚锡(100名/1),迅速盖紧瓶塞,随后有气泡产生,从仪器读数显示的最高点测得其吸收值,然后,打开吸收瓶上的三通阀将产生的汞蒸气吸收于高锰酸钾溶液(50g/L)中,待测汞仪上的读数达到零点时进行下一次测定。并求得吸光值与汞质量关系的一元线性回归方程。134
GB/T 5009.17---2003
11.3.3试样测定:分别吸取样液和试剂空白液各5.0mL置于测汞仪的汞蒸气发生器的还原瓶中,以下按11.3.2自“分别加人1.0mL还原剂氯化亚锡..”起进行。将所测得其吸收值,代人标准系列的元线性回归方程中求得样液中汞含量。12结果计算
试样中汞含量按式(2)进行计算。X - (A1- A)×(V//V2) ×1 000m×1000
式中:
试样中汞含量,单位为微克每千克或微克每升(pg/kg或μg/L);A,——测定试样消化液中汞质量,单位纳克(ng);A2--试剂空白液中汞质量,单位纳克(ng);Vi--—试样消化液总体积,单位为毫升(mL);V,—测定用试样消化液体积,单位为毫升(mL);m
试样质量或体积,单位为克或毫升(g或mL)。计算结果保留两位有效数字。
13精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的20%。(二)其他消化法
14试剂
14.1硝酸。
14.2硫酸。
14.3氯化亚锡溶液(300g/L):称取30g氯化亚锡(SnCl2·2H.O),加少量水,并加2mL硫酸使溶解后,加水稀释至100mL,放置冰箱保存。14.4无水氯化钙:干燥用。
14.5混合酸(1+1+8):量取10mL硫酸,再加人10mL硝酸,慢慢倒人50mL水中,冷后加水稀释至100 mL
14.6五氧化二钒。
14.7高锰酸钾溶液(50g/L):配好后煮沸10min,静置过夜,过滤,贮于棕色瓶中。14.8盐酸羟胺溶液(200g/1)。14.9汞标准储备溶液:准确称取0.1354g于干燥器干燥过的二氯化汞,加混合酸(1+1十8)溶解后移人100mL容量瓶中,并稀释至刻度,混匀,此溶液每毫升相当于1.0mg汞。14.10汞标准使用液:吸取1.0mL汞标准储备溶液,置于100mL容量瓶中,加混合酸(1+1+8)稀释至刻度,此溶液每毫升相当于10.0μg汞。再吸取此液1.0mL置100mL容量瓶中,加混合酸(1+1十8)稀释至刻度,此溶液每毫升相当于0.10μg汞,临用时现配。15仪器
15.1消化装置。
15.2测汞仪,附气体干燥和抽气装置。15.3汞蒸气发生器,见图1。
GB/T5009.17—2003
16分析步骤
16.1试样消化
16.1.1回流消化法
图160mL汞蒸气发生器
16.1.1.1粮食或水分少的食品:称取10.00g试样,置于消化装置锥形瓶中,加玻璃珠数粒,加45mL硝酸、10mL硫酸,转动锥形瓶防止局部炭化。装上冷凝管后,小火加热,待开始发泡即停止加热,发泡停正后,加热回流2h。如加热过程中溶液变棕色,再加5mL硝酸,继续回流2h,放冷后从冷凝管上端小心加20mL水,继续加热回流10min,放冷,用适量水冲洗冷凝管,洗液并入消化液中,将消化液经玻璃棉过滤于100mL容量瓶内,用少量水洗锥形瓶、滤器,洗液并入容量瓶内,加水至刻度,混匀。按同一方法做试剂空白试验。
16.1.1.2植物油及动物油脂:称取5.00g试样,置于消化装置锥形瓶中,加玻璃珠数粒,加人7mL硫酸,小心混勾至溶液颜色变为棕色,然后加40mL硝酸,装上冷凝管后,以下按16.1.1.1自“小火加热”起依法操作。
16.1.1.3薯类、豆制品:称取20.00g捣碎混匀的试样(薯类须预先洗净晾干),置于消化装置锥形瓶中,加玻璃珠数粒及30mL硝酸、5mI硫酸,转动锥形瓶防止局部炭化。装上冷凝管后,以下按16.1.1.1自“小火加热”起依法操作。16.1.1.4肉、蛋类:称取10.00g捣碎混勾的试样,置于消化装置锥形瓶中,加玻璃珠数粒及30mL硝酸、5mL硫酸,转动锥形瓶防止局部炭化。装上冷凝管后,以下按16.1.1.1自“小火加热.”起依法操作。
16.1.1.5牛乳及乳制品:称取20.00g牛乳或酸牛乳,或相当于20.00g牛乳的乳制品(2.4g全脂乳粉、8g甜炼乳,5g淡炼乳),置于消化装置锥形瓶中,加玻璃珠数粒及30mL硝酸,牛乳或酸牛乳加10mL硫酸,乳制品加5mL硫酸,转动形瓶防止局部炭化。装上冷凝管后,以下按16.1.1.1自“小火加热··”起依法操作。
16.1.2五氧化二钒消化法
本法适用于水产品、蔬菜、水果。16.1.2.1取可食部分,洗净,晾于,切碎,混勺。取2.50g水产品或10.00g蔬菜,水果,置于50mL~~100ml锥形瓶中,加50mg五氧化二钒粉末,再加8mL硝酸,振摇,放置4h,加5mL硫酸,混匀,然后移至140℃砂浴上加热,开始作用较猛烈,以后渐渐缓慢,待瓶口基本上无棕色气体逸出时,用少量水冲136
GB/T5009.17—2003
洗瓶口,再加热5min,放冷,加5mL高锰酸钾溶液(50g/L),放置4h(或过夜),滴加盐酸羟胺溶液(200g/L)使紫色褪去,振摇,放置数分钟,移人容量瓶中,并稀释至刻度。蔬菜、水果为25mL,水产品为100mL。
16.1.2.2按同一方法进行试剂空白试验。16.2测定
16.2.1用回流消化法制备的试样消化液16.2.1.1吸取10.0mL试样消化液,置于汞蒸气发生器内,连接抽气装置,沿壁迅速加人3mL氯化亚锡溶液(300g/L),立即通过流速为1.0I./min的氮气或经活性炭处理的空气,使汞蒸气经过氯化钙干燥管进人测汞仪中,读取测汞仪上最大读数,同时做试剂空白试验。16.2.1.2吸取0、0.10、0.20、0.30、0.40、0.50mL汞标准使用液(相当0、0.01、0.02、0.03、0.04、0.05μg汞),置于试管中,各加10mL混合酸(1十1+8),以下按16.2.1.1自“置于汞蒸气发生器内”起依法操作,绘制标准曲线。16.2.2用五氧化二钒消化法制备的试样消化液16.2.2.1吸取10.0mL试样消化液,以下按16.2.1.1的方法操作。16.2.2.2吸取0、1.0、2.0、3.0、4.0、5.0mL汞标准使用液(相当0、0.1、0.2、0.3、0.4、0.5μg汞),置于6个50mL容量瓶中,各加1mL硫酸(1+1)、1mL高锰酸钾溶液(50g/L),加20mL水,混匀,滴加盐酸羟胺溶液(200g/L)使紫色褪去,加水至刻度混匀,分别吸取10.0mL(相当0、0.02、0.04、0.06、0.08、0.10μg汞),以下按16.2.1.1自“置于汞蒸气发生器内...”起依法操作,绘制标准曲线。17 结果计算
试样中汞的含量按式(3)进行计算。(A —A2) ×1 000
mX(V2/V) X 1 000
式中:
试样中汞的含量,单位为毫克每千克(mg/kg);测定用试样消化液中汞的质量,单位为微克(μg);试剂空白液中汞的质量,单位为微克(μg);试样质量,单位为克(g);
试样消化液总体积,单位为毫升(mL);测定用试样消化液体积,单位为毫升(mL)。计算结果保留两位有效数字。
18精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的15%。第三法、二硫皖比色法
19原理
·(3)
试样经消化后,汞离子在酸性溶液中可与二硫生成橙红色络合物,溶于三氯甲烷,与标准系列比较定量。
20试剂
20.1硝酸。
GB/T 5009.17--2003
20.2硫酸。
20.3氨水。
20.4三氯甲烷:不应含有氧化物。20.5硫酸(1+35):量取5mL硫酸,缓缓倒人150mL水中,冷后加水至180mL。20.6硫酸(1十19):量取5mL硫酸,缓缓倒人水中,冷后加水至100mL。盐酸羟胺溶液(200g/L):吹清洁空气,除去溶液中含有的微量汞。20.7
20.8溴香草酚蓝-乙醇指示液(1g/L)。20.9二硫腺-三氟甲烷溶液(0.5g/L),保存冰箱中,必要时用下述方法纯化。称取0.5g研细的二硫腺,溶于50mL三氯甲烷中,如不全溶,可用滤纸过滤于250mL分液漏斗中,用氨水(1+99)提取三次,每次100mL,将提取液用棉花过滤至500mL分液漏斗中,用盐酸(1+1)调至酸性,将沉淀出的二硫腺用三氯甲烷提取2次~3次,每次20mL,合并三氯甲烷层,用等量水洗涤两次,弃去洗涤液,在50℃水浴上蒸去三氯甲烷。精制的二硫腺置硫酸干燥器中,干燥备用,或将沉淀出的二硫腺用200、200、100mL三氯甲烷提取三次,合并三氯甲烷层为二硫腺溶液。20.10二硫腺使用液:吸取1.0mL二硫腺溶液,加三氯甲烷至10mL,混勾。用1cm比色杯,以三氯甲烧调节零点,于波长510nm处测吸光度(A),用式(4)算出配制100mL二硫踪使用液(70%透光率)所需二硫腺溶液的毫升数(V)。V 10(2 = g70) 1. 55
+....-( 4 )
20.11汞标准溶液:准确称取0.1354g经于燥器干燥过的二氯化汞,加硫酸(1十35)使其溶解后,移人100mL容量瓶中,并稀释至刻度,此溶液每毫升相当于1.0mg汞。20.12汞标准使用液:吸取1.0mL汞标准溶液,置于100mL容量瓶中,加硫酸(1+35)稀释至刻度,此溶液每毫升相当于10.0μg汞。再吸取此液5.0mL于50mL容量瓶中,加硫酸(1十35)稀释至刻度,此溶液每毫升相当于1.0g汞。21仪器
21.1消化装置。
21.2可见分光光度计。
22分析步骤
22.1试样消化
22.1.1粮食或水分少的食品:称取20.00g试样,置于消化装置锥形瓶中,加玻璃珠数粒及80mL硝酸、15mL硫酸,转动锥形瓶,防止局部炭化。装上冷凝管后,小火加热,待开始发泡即停止加热,发泡停止后加热回流2h。如加热过程中溶液变棕色,再加5mL硝酸,继续回流2h,放冷,用适量水洗涤冷凝管,洗液并人消化液中,取下锥形瓶,加水至总体积为150mL。按同一方法做试剂空白试验。22.1.2植物油及动物油脂:称取10.00g试样,置于消化装置锥形瓶中,加玻璃珠数粒及15mL硫酸,小心混勾至溶液变棕色,然后加人45mL硝酸,装上冷凝管后,以下按22.1.1自小火加热·...”起依法操作。
22.1.3蔬菜、水果、薯类、豆制品:称取50.00g捣碎、混匀的试样(豆制品直接取样,其他试样取可食部分洗净、晾干),置于消化装置锥形瓶中,加玻璃珠数粒及45mL硝酸、15mL硫酸,转动锥形瓶,防止局部炭化。装上冷凝管后,以下按22.1.1自小火加热”起依法操作。22.1.4肉、蛋、水产品:称取20.00g捣碎混匀试样,置于消化装置锥形瓶中,加玻璃珠数粒及45mL硝酸、15mL硫酸,装上冷凝管后,以下按21.1.1自“小火加热.”起依法操作。22.1.5牛乳及乳制品:称取50.00g牛乳、酸牛乳,或相当于50.00g牛乳的乳制品(6g全脂乳粉,138
GB/T5009.17—2003
20g甜炼乳,12.5g淡炼乳),置于消化装置锥形瓶中,加玻璃珠数粒及45mL硝酸,牛乳、酸牛乳加15mL硫酸,乳制品加10mL硫酸,装上冷凝管,以下按22.1.1自“小火加热…”起依法操作。22.2测定
22.2.1取21.1.1~21.1.5消化液(全量),加20mL水,在电炉上煮沸10min,除去二氧化氮等,放冷。
22.2.2于试样消化液及试剂空白液中各加高锰酸钾溶液(50g/L)至溶液呈紫色,然后再加盐酸羟胺溶液(200g/L)使紫色褪去,加2滴麝香草酚蓝指示液,用氨水调节pH,使橙红色变为橙黄色(pH1~2)。定量转移至125mL分液漏斗中。22.2.3吸取0、0.5、1.0、2.0、3.0、4.0、5.0、6.0uL汞标准使用液(相当于0、0.5、1.0、2.0、3.0、4.0、5.0、6.0μg汞),分别置于125mL分液漏斗中,加10mL硫酸(1+19),再加水至40mL,混勾。再各加1mL盐酸羟胺溶液(200g/L),放置20min,并时时振摇。22.2.4于试样消化液、试剂空白液及标准液振摇放冷后的分液漏斗中加5.0mL二硫腺使用液,剧烈振摇2min,静置分层后,经脱脂棉将三氯甲烷层滤入1cm比色杯中,以三氯甲烷调节零点,在波长490nm处测吸光度,标准管吸光度减去零管吸光度,绘制标准曲线。23结果计算
试样中汞的含量按式(5)进行计算。X-(At-A,)X1 000
mX 1 000
式中:
X—试样中汞的含量,单位为毫克每千克(mg/kg);A,——试样消化液中汞的质量,单位为微克(μg);A—试剂空白液中汞的质量,单位为微克(μg);m一—试样质量,单位为克(g)。计算结果保留两位有效数字。
24精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。甲基汞的测定
25范围
本标准规定了水产品中甲基汞的测定方法。本标准适用于水产品中甲基汞的测定。气相色谱法(酸提取巯基棉法)26原理
·(5)
试样中的甲基汞,用氯化钠研磨后加入含有Cu2+的盐酸(1十11),(Cu2+与组织中结合的CH,Hg交换)完全萃取后,经离心或过滤,将上清液调试至一定的酸度,用巯基棉吸附,再用盐酸(1十5)洗脱,最后以苯萃取甲基汞,用带电子捕获鉴定器的气相色谱仪分析。27试剂
27.1氯化钠。
GB/T5009.17—2003
27.2苯:色谱上无杂峰,否则应重蒸馏纯化。27.3无水硫酸钠:用苯提取,浓缩液在色谱上无杂峰。27.4盐酸(1+5):取优级纯盐酸,加等体积水,恒沸蒸馏,蒸出盐酸为(1+1),稀释配制。27.5氯化铜溶液(42.5g/L)。
27.6氢氧化钠溶液(40g/L):称取40g氢氧化钠加水稀释至1000mL。27.7盐酸(1+11):取83.3mL盐酸(优级纯)加水稀释至1000mL。27.8淋洗液(pH3.0~3.5):用盐酸(1+11)调节水的pH为3.0~3.5。27.9巯基棉:在250mL具塞锥形瓶中依次加人35mL乙酸酐,16mL冰乙酸、50mL硫代乙醇酸、0.15mI.硫酸、5mL水,混匀,冷却后,加人14g脱脂棉,不断翻压,使棉花完全浸透,将塞盖好,置于恒温培养箱中,在(37士0.5℃保温4天(注意切勿超过40℃),取出后用水洗至近中性,除去水分后平铺于瓷盘中,再在(37士0.5)℃恒温箱中烘于,成品放人棕色瓶中,放置冰箱保存备用(使用前,应先测定统基棉对甲基汞的吸附效率为95%以上方可使用)。注:所有试剂用苯萃取,萃取液不应在气相色谱上出现甲基汞的峰。27.10甲基汞标准溶液:准确称取0.1252g氯化甲基汞,用苯溶解于100mL容量瓶中,加苯稀释至刻度,此溶液每毫升相当于1.0mg甲基汞。放置冰箱保存。27.11甲基汞标准使用液:吸取1.0mL甲基汞标准溶液,置于100mL容量瓶中,用苯稀释至刻度。此溶液每毫升相当于10μg甲基汞。取此溶液1.0mL,置于100mL容量瓶中,用盐酸(1+5)稀释至刻度,此溶液每毫升相当于0.10pg甲基汞,临用时新配。27.12甲基橙指示液(1g/L)。
28仪器
28.1气相色谱仪:附3Ni电子捕获鉴定器或氙源电子捕获检定器。28.2酸度计。
28.3离心机:带50mL~~80mL离心管。28.4统基棉管:用内径6mm、长度20cm,一端拉细(内径2mm)的玻璃滴管内装0.1g~0.15g巯基棉,均匀填塞,临用现装。
28.5玻璃仪器:均用硝酸(1+20)浸泡一昼夜,用水冲洗干净。29分析步骤
29.1气相色谱参考条件
29.1.163Ni电子捕获鉴定器:柱温185℃,鉴定器温度为260℃,汽化室温度215℃。29.1.2氙源电子捕获鉴定器:柱温185℃,鉴定器温度为190℃,汽化室温度185℃。29.1.3载气:高纯氮,流量为60mL/min(选择仪器的最佳条件)。29.1.4色谱柱:内径3mm,长1.5m的玻璃柱,内装涂有质量分数为7%的丁二酸乙二醇聚酯(PEGS)或涂质量分数为1.5%的0V-17和1.95%QF-1或质量分数为5%的丁二乙酸二乙二醇酯(DEGS)固定液的60目~80目chromosorb WAWDMCS。29.2测定
29.2.1称取1.00g~2.00g去皮去刺绞碎混匀的鱼肉(称取5g虾仁,研碎),加人等量氯化钠,在乳钵中研成糊状,加入0.5mL氯化铜溶液(42.5g/1.),轻轻研匀,用30mL盐酸(1+11)分次完全转人100mL带塞锥形瓶中,剧烈振摇5min,放置30min(也可用振荡器振摇30min),样液全部转人50mL离心管中,用5mL盐酸(1十11)淋洗锥形瓶,洗液与样液合并,离心10min(转速为2000r/min),将上清液全部转人100ml.分液漏斗中,于残渣中再加10mI.盐酸(1十11),用玻璃棒搅拌均勾后再离心,合并两份离心溶液。
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
中华人民共和国国家标准
GB/T 5009.17—2003
代替GB/T5009.17--1996,部分代替GB/T5009.45--1996食品中总汞及有机汞的测定
Determination of total mercury and organic-mercury in foods2003-08-11发布
中华人民共和国卫生部
中国国家标准化管理委员会
2004-01-01实施
GB/T 5009.17-2003
本标准代替GB/T5009.17—1996《食品中总汞的测定方法》和GB/T5009.45-1996《水产品卫生标准的分析方法》中4.6甲基汞。本标准与GB/T5009.17—1996和GB/T5009.45—1996《水产品卫生标准的分析方法》中4.6甲基汞相比主要修改如下:
修改了标准的中文名称,标准中文名称改为《食品中总汞及有机汞的测定》;-按照GB/T20001.42001《标准编写规则第4部分:化学分析方法》对原标准的结构进行了修改;
一增加了氢化物原子荧光光谱法作为总汞的测定中的第一法;将GB/T5009.45—1996《水产品卫生标准的分析方法》中4.6甲基汞作为甲基汞的测定。本标推由中华人民共和国卫生部提出并归口。本标准总汞的测定第一法由卫生部食品卫生监督检验所,北京市食品卫生监督检验所、四川省食品卫生监督检验所、北京进口食品卫生监督检验所参加起草。本标准总汞的测定第二法(一)由上海市食品卫生监督检验所、中国预防医学科学院营养与食品卫生研究所、卫生部食品卫生监督检验所负责起草。本标准总汞的测定第二法(二)由卫生部食品卫生监督检验所负责起草。本标准总汞的测定第三法由江苏省卫生防疫站负责起草。本标准甲基汞的测定由上海市食品卫生监督检验所、江苏省卫生防疫站、杭州市卫生防疫站、卫生部食品卫生监督检验所、青海省卫生防疫站、福建省卫生学校负责起草。本标准总汞的测定第一法主要起草人:杨惠芬、黄流生、毛红、强卫国、闫军。本标准于1985年首次发布,于1996年第一次修订,本次为第二次修订。130
1范围
食品中总汞及有机汞的测定
总汞的测定
本标准规定了各类食品中总汞的测定方法。本标准适用于各类食品中总汞的测定GB/T 5009.17--2003
原子荧光光谱分析法:检出限0.15ug/kg,标准曲线最佳线性范围0ug/L~60μg/L;冷原子吸收法的检出限:压力消解法为0.4μg/kg,其他消解法为10μg/kg;比色法为25μg/kg。第一法原子荧光光谱分析法
2原理
试样经酸加热消解后,在酸性介质中,试样中汞被硼氢化钾(KBH)或硼氢化钠(NaBH.)还原成原子态汞,由载气(氩气)带人原子化器中,在特制汞空心阴极灯照射下,基态汞原子被激发至高能态,在去活化回到基态时,发射出特征波长的荧光,其荧光强度与汞含量成正比,与标准系列比较定量。3试剂
3.1硝酸(优级纯)。
3.230%过氧化氢。
3.3硫酸(优级纯)。
3.4硫酸+硝酸+水(1+1+8):量取10mL硝酸和10mL硫酸,缓缓倒入80mL水中,冷却后小心混匀。
3.5硝酸溶液(1+9):量取50mL硝酸,缓缓倒人450mL水中,混勾。3.6氢氧化钾溶液(5g/L):称取5.0g氢氧化钾,溶于水中,稀释至1000mL,混匀。3.7硼氢化钾溶液(5g/L):称取5.0g硼氢化钾,溶于5.0g/L的氢氧化钾溶液中,并稀释至1000mL,混匀,现用现配。
3.8汞标准储备溶液:精密称取0.1354g于干燥过的二氯化汞,加硫酸+硝酸十水混合酸(1十1十8)溶解后移入100mL容量瓶中,并稀释至刻度,混匀,此溶液每毫升相当于1mg汞。3.9汞标准使用溶液:用移液管吸取汞标准储备液(1mg/mL)1mL于100mL容量瓶中,用硝酸溶液(1+9)稀释至刻度,混匀,此溶液浓度为10μg/mL。在分别吸取10μg/mL汞标准溶液1mL和5mL于两个100mL容量瓶中,用硝酸溶液(1+9)稀释至刻度,混匀,溶液浓度分别为100ng/mL和500ng/mL,分别用于测定低浓度试样和高浓度试样,制作标准曲线。4仪器
4.1双道原子荧光光度计。
4.2高压消解罐(100mL容量)。4.3微波消解炉。
GB/T5009.17—2003
5分析步骤
5.1试样消解
5.1.1高压消解法
本方法适用于粮食、豆类、蔬菜、水果、瘦肉类、鱼类、蛋类及乳与乳制品类食品中总汞的测定。5.1.1.1粮食及豆类等干样:称取经粉碎混匀过40目筛的干样0.2g~1.00g,置于聚四氟乙烯塑料内罐中,加5mL硝酸,混勾后放置过夜,再加7mL过氧化氢,盖上内盖放人不锈钢外套中,旋紧密封。然后将消解器放人普通于燥箱(烘箱)中加热,升温至120℃后保持恒温2h~3h,至消解完全,自然冷至室温。将消解液用硝酸溶液(1十9)定量转移并定容至25mL,摇勾。同时做试剂空白试验。待测。5.1.1.2蔬菜、瘦肉、鱼类及蛋类水分含量高的鲜样用捣碎机打成勾浆,称取匀浆1.00g~5.00g,置于聚四氟乙烯塑料内罐中,加盖留缝放于65℃鼓风干燥烤箱或一般烤箱中烘至近于,取出,以下按5.1.1.1自“加5mL硝酸.\起依法操作。5.1.2微波消解法
称取0.10g~0.50g试样于消解罐中加入1mL~~5mL硝酸,1mL~2mL过氧化氢,盖好安全阀后,将消解罐放人微波炉消解系统中,根据不同种类的试样设置微波炉消解系统的最佳分析条件(见表1和表2),至消解完全,冷却后用硝酸溶液(1十9)定量转移并定容至25mL(低含量试样可定容至10 mL),混勾待测。
表1粮食、蔬菜、鱼肉类试样微波分析条件步骤bZxz.net
功率/(%)
压力/kPa
升压时间 /min
保压时间/min
排风量/(%)
功率/(%)
压力/kPa
升压时间/min
保压时间/min
排风量/%)
5.2标准系列配制
表2油脂、糖类试样微波分析条件2
5.2.1低浓度标准系列:分别吸取100ng/mL汞标准使用液0.25、0.50、1.00、2.00、2.50mL于25mL容量瓶中,用硝酸溶液(1+9)稀释至刻度,混匀。各自相当于汞浓度1.00、2.00、4.00、8.00、10.00ng/mL。此标准系列适用于一般试样测定。5.2.2高浓度标准系列:分别吸取500ng/mL汞标准使用液0.25、0.50、1.00、1.50、2.00mL于25mL容量瓶中,用硝酸溶液(1+9)稀释至刻度,混勾。各自相当于汞浓度5.00、10.00、20.00、30.00、132
40.00ng/mL。此标准系列适用于鱼及含汞量偏高的试样测定。5.3测定
GB/T 5009.17—2003
5.3.1仪器参考条件:光电倍增管负高压:240V;汞空心阴极灯电流:30mA;原子化器:温度:300℃,高度8.0mm;氩气流速:载气500mL/min,屏蔽气1000mL/min;测量方式:标准曲线法,读数方式:峰面积,读数延迟时间:1.0s;读数时间:10.0s;硼氢化钾溶液加液时间:8.0s;标液或样液加液体积:2 mL。
注:AFS系列原子荧光仪如:230、230a、2202、2202a、2201等仪器属于全自动或断序流动的仪器,都附有本仪器的操作软件,仪器分析条件应设置本仪器所提示的分析条件,仪器稳定后,测标准系列,至标准曲线的相关系数r》0.999后测试样。试样前处理可适用任何型号的原子荧光仪。5.3.2测定方法:根据情况任选以下一种方法。5.3.2.1浓度测定方式测量:设定好仪器最佳条件,逐步将炉温升至所需温度后,稳定10min~20min后开始测量。连续用硝酸溶液(1十9)进样,待读数稳定之后,转入标准系列测量,绘制标准曲线。转人试样测量,先用硝酸溶液(1十9)进样,使读数基本回零,再分别测定试样空白和试样消化液,每测不同的试样前都应清洗进样器。试样测定结果按公式(1)计算。5.3.2.2仪器自动计算结果方式测量:设定好仪器最佳条件,在试样参数画面输人以下参数:试样质量(g或mL),稀释体积(mL),并选择结果的浓度单位,逐步将炉温升至所需温度,稳定后测量。连续用硝酸溶液(1+9)进样,待读数稳定之后,转人标准系列测量,绘制标准曲线。在转入试样测定之前,再进人空白值测量状态,用试样空白消化液进样,让仪器取其均值作为扣底的空白值。随后即可依法测定试样。测定完毕后,选择“打印报告”即可将测定结果自动打印。6结果计算
试样中汞的含量按式(1)进行计算。X (c=co)XV×1 000
m×1000 ×1000
式中:
X一一试样中汞的含量,单位为毫克每千克或毫克每升(mg/kg或mg/L);c-一试样消化液中汞的含量,单位为纳克每毫升(ng/mL);co——试剂空白液中汞的含量,单位为纳克每毫升(ng/mL);V—一试样消化液总体积,单位为毫升(mL);m—试样质量或体积,单位为克或毫升(g或mL)。计算结果保留三位有效数字。
7精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。第二法冷原子吸收光谱法
8原理
汞蒸气对波长253.7nm的共振线具有强烈的吸收作用。试样经过酸消解或催化酸消解使汞转为离子状态,在强酸性介质中以氯化亚锡还原成元素汞,以氮气或干燥空气作为载体,将元素汞吹人汞测定仪,进行冷原子吸收测定,在一定浓度范围其吸收值与汞含量成正比,与标准系列比较定量。133
GB/T5009.17--2003
9试剂
9.1硝酸。
9.2盐酸。
9.3过氧化氢(30%)。
(—)压力消解法
9.4硝酸(0.5十99.5):取0.5mL硝酸慢慢加入50mL水中,然后加水稀释至100mL。9.5高锰酸钾溶液(50g/L):称取5.0g高锰酸钾置于100mL棕色瓶中,以水溶解稀释至100mL。9.6硝酸-重铬酸钾溶液:称取0.05g重铬酸钾溶于水中,加人5mL硝酸,用水稀释至100mL。9.7氯化亚锡溶液(100g/L):称取10g氟化亚锡溶于20mL盐酸中,以水稀释至100mL,临用时现配。
9.8无水氯化钙。
9.9汞标准储备液:准确称取0.1354g经于燥器干燥过的二氧化汞溶于硝酸-重铬酸钾溶液中,移100mL容量瓶中,以硝酸-重铬酸钾溶稀释至刻度。混匀。此溶液每毫升含1,0mg汞。9.10汞标准使用液:由1.0mg/mL汞标准储备液经硝酸-重铬酸钾溶液稀释成2.0ng/mL,4.0ng/mL,6.0ng/mL,8.0ng/mL,10.0ng/mL的汞标准使用液。临用时现配。10仪器
所用玻璃仪器均需以硝酸(1十5)浸泡过夜,用水反复冲洗,最后用去离子水冲洗干净。10.1双光束测汞仪(附气体循环泵、气体干燥装置、汞蒸气发生装置及汞蒸气吸收瓶)。10.2恒温干燥箱。
10.3压力消解器、压力消解罐或压力溶弹。11分析步骤
11.1试样预处理
11.1.1在采样和制备过程中,应注意不使试样污染。11.1.2粮食、豆类去杂质后,磨碎,过20目筛,储于塑料瓶中,保存备用。11.1.3蔬菜、水果、鱼类、肉类及蛋类等水分含量高的鲜样用食品加工机或匀浆机打成勾浆,储于塑料瓶中,保存备用。
11.2试样消解(可根据实验室条件选用以下任何一种方法消解)压力消解罐消解法:称取1.00g~3.00g试样(干样、含脂肪高的试样<1.00g,鲜样<3.00g或按压力消解罐使用说明书称取试样)于聚四氟乙烯内罐,加硝酸2mL~4ml.浸泡过夜。再加过氧化氢(30%)2mL~3mL总量不能超过罐容积的三分之一)。盖好内盖,旋紧不锈钢外套,放入恒温燥箱,120℃140℃保持3h~4h,在箱内自然冷却至室温,用滴管将消化液洗人或过滤人(视消化后试样的盐分而定)10.0mL容量瓶中,用水少量多次洗涤罐,洗液合并于容量瓶中并定容至刻度,混勾备用;同时作试剂空白。
11.3测定
11.3.1仪器条件:打开测汞仪,预热1h~2h,并将仪器性能调至最佳状态。11.3.2标准曲线绘制:吸取上面配制的汞标准使用液2.0、4.0.6.0、8.0、10.0ng/mL各5.0mL(相当于10.0ng、20.0ng、30.0ng、40.0ng、50.0ng)置于测录仪的汞蒸气发生器的还原瓶中,分别加人1.0mL还原剂氯化亚锡(100名/1),迅速盖紧瓶塞,随后有气泡产生,从仪器读数显示的最高点测得其吸收值,然后,打开吸收瓶上的三通阀将产生的汞蒸气吸收于高锰酸钾溶液(50g/L)中,待测汞仪上的读数达到零点时进行下一次测定。并求得吸光值与汞质量关系的一元线性回归方程。134
GB/T 5009.17---2003
11.3.3试样测定:分别吸取样液和试剂空白液各5.0mL置于测汞仪的汞蒸气发生器的还原瓶中,以下按11.3.2自“分别加人1.0mL还原剂氯化亚锡..”起进行。将所测得其吸收值,代人标准系列的元线性回归方程中求得样液中汞含量。12结果计算
试样中汞含量按式(2)进行计算。X - (A1- A)×(V//V2) ×1 000m×1000
式中:
试样中汞含量,单位为微克每千克或微克每升(pg/kg或μg/L);A,——测定试样消化液中汞质量,单位纳克(ng);A2--试剂空白液中汞质量,单位纳克(ng);Vi--—试样消化液总体积,单位为毫升(mL);V,—测定用试样消化液体积,单位为毫升(mL);m
试样质量或体积,单位为克或毫升(g或mL)。计算结果保留两位有效数字。
13精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的20%。(二)其他消化法
14试剂
14.1硝酸。
14.2硫酸。
14.3氯化亚锡溶液(300g/L):称取30g氯化亚锡(SnCl2·2H.O),加少量水,并加2mL硫酸使溶解后,加水稀释至100mL,放置冰箱保存。14.4无水氯化钙:干燥用。
14.5混合酸(1+1+8):量取10mL硫酸,再加人10mL硝酸,慢慢倒人50mL水中,冷后加水稀释至100 mL
14.6五氧化二钒。
14.7高锰酸钾溶液(50g/L):配好后煮沸10min,静置过夜,过滤,贮于棕色瓶中。14.8盐酸羟胺溶液(200g/1)。14.9汞标准储备溶液:准确称取0.1354g于干燥器干燥过的二氯化汞,加混合酸(1+1十8)溶解后移人100mL容量瓶中,并稀释至刻度,混匀,此溶液每毫升相当于1.0mg汞。14.10汞标准使用液:吸取1.0mL汞标准储备溶液,置于100mL容量瓶中,加混合酸(1+1+8)稀释至刻度,此溶液每毫升相当于10.0μg汞。再吸取此液1.0mL置100mL容量瓶中,加混合酸(1+1十8)稀释至刻度,此溶液每毫升相当于0.10μg汞,临用时现配。15仪器
15.1消化装置。
15.2测汞仪,附气体干燥和抽气装置。15.3汞蒸气发生器,见图1。
GB/T5009.17—2003
16分析步骤
16.1试样消化
16.1.1回流消化法
图160mL汞蒸气发生器
16.1.1.1粮食或水分少的食品:称取10.00g试样,置于消化装置锥形瓶中,加玻璃珠数粒,加45mL硝酸、10mL硫酸,转动锥形瓶防止局部炭化。装上冷凝管后,小火加热,待开始发泡即停止加热,发泡停正后,加热回流2h。如加热过程中溶液变棕色,再加5mL硝酸,继续回流2h,放冷后从冷凝管上端小心加20mL水,继续加热回流10min,放冷,用适量水冲洗冷凝管,洗液并入消化液中,将消化液经玻璃棉过滤于100mL容量瓶内,用少量水洗锥形瓶、滤器,洗液并入容量瓶内,加水至刻度,混匀。按同一方法做试剂空白试验。
16.1.1.2植物油及动物油脂:称取5.00g试样,置于消化装置锥形瓶中,加玻璃珠数粒,加人7mL硫酸,小心混勾至溶液颜色变为棕色,然后加40mL硝酸,装上冷凝管后,以下按16.1.1.1自“小火加热”起依法操作。
16.1.1.3薯类、豆制品:称取20.00g捣碎混匀的试样(薯类须预先洗净晾干),置于消化装置锥形瓶中,加玻璃珠数粒及30mL硝酸、5mI硫酸,转动锥形瓶防止局部炭化。装上冷凝管后,以下按16.1.1.1自“小火加热”起依法操作。16.1.1.4肉、蛋类:称取10.00g捣碎混勾的试样,置于消化装置锥形瓶中,加玻璃珠数粒及30mL硝酸、5mL硫酸,转动锥形瓶防止局部炭化。装上冷凝管后,以下按16.1.1.1自“小火加热.”起依法操作。
16.1.1.5牛乳及乳制品:称取20.00g牛乳或酸牛乳,或相当于20.00g牛乳的乳制品(2.4g全脂乳粉、8g甜炼乳,5g淡炼乳),置于消化装置锥形瓶中,加玻璃珠数粒及30mL硝酸,牛乳或酸牛乳加10mL硫酸,乳制品加5mL硫酸,转动形瓶防止局部炭化。装上冷凝管后,以下按16.1.1.1自“小火加热··”起依法操作。
16.1.2五氧化二钒消化法
本法适用于水产品、蔬菜、水果。16.1.2.1取可食部分,洗净,晾于,切碎,混勺。取2.50g水产品或10.00g蔬菜,水果,置于50mL~~100ml锥形瓶中,加50mg五氧化二钒粉末,再加8mL硝酸,振摇,放置4h,加5mL硫酸,混匀,然后移至140℃砂浴上加热,开始作用较猛烈,以后渐渐缓慢,待瓶口基本上无棕色气体逸出时,用少量水冲136
GB/T5009.17—2003
洗瓶口,再加热5min,放冷,加5mL高锰酸钾溶液(50g/L),放置4h(或过夜),滴加盐酸羟胺溶液(200g/L)使紫色褪去,振摇,放置数分钟,移人容量瓶中,并稀释至刻度。蔬菜、水果为25mL,水产品为100mL。
16.1.2.2按同一方法进行试剂空白试验。16.2测定
16.2.1用回流消化法制备的试样消化液16.2.1.1吸取10.0mL试样消化液,置于汞蒸气发生器内,连接抽气装置,沿壁迅速加人3mL氯化亚锡溶液(300g/L),立即通过流速为1.0I./min的氮气或经活性炭处理的空气,使汞蒸气经过氯化钙干燥管进人测汞仪中,读取测汞仪上最大读数,同时做试剂空白试验。16.2.1.2吸取0、0.10、0.20、0.30、0.40、0.50mL汞标准使用液(相当0、0.01、0.02、0.03、0.04、0.05μg汞),置于试管中,各加10mL混合酸(1十1+8),以下按16.2.1.1自“置于汞蒸气发生器内”起依法操作,绘制标准曲线。16.2.2用五氧化二钒消化法制备的试样消化液16.2.2.1吸取10.0mL试样消化液,以下按16.2.1.1的方法操作。16.2.2.2吸取0、1.0、2.0、3.0、4.0、5.0mL汞标准使用液(相当0、0.1、0.2、0.3、0.4、0.5μg汞),置于6个50mL容量瓶中,各加1mL硫酸(1+1)、1mL高锰酸钾溶液(50g/L),加20mL水,混匀,滴加盐酸羟胺溶液(200g/L)使紫色褪去,加水至刻度混匀,分别吸取10.0mL(相当0、0.02、0.04、0.06、0.08、0.10μg汞),以下按16.2.1.1自“置于汞蒸气发生器内...”起依法操作,绘制标准曲线。17 结果计算
试样中汞的含量按式(3)进行计算。(A —A2) ×1 000
mX(V2/V) X 1 000
式中:
试样中汞的含量,单位为毫克每千克(mg/kg);测定用试样消化液中汞的质量,单位为微克(μg);试剂空白液中汞的质量,单位为微克(μg);试样质量,单位为克(g);
试样消化液总体积,单位为毫升(mL);测定用试样消化液体积,单位为毫升(mL)。计算结果保留两位有效数字。
18精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的15%。第三法、二硫皖比色法
19原理
·(3)
试样经消化后,汞离子在酸性溶液中可与二硫生成橙红色络合物,溶于三氯甲烷,与标准系列比较定量。
20试剂
20.1硝酸。
GB/T 5009.17--2003
20.2硫酸。
20.3氨水。
20.4三氯甲烷:不应含有氧化物。20.5硫酸(1+35):量取5mL硫酸,缓缓倒人150mL水中,冷后加水至180mL。20.6硫酸(1十19):量取5mL硫酸,缓缓倒人水中,冷后加水至100mL。盐酸羟胺溶液(200g/L):吹清洁空气,除去溶液中含有的微量汞。20.7
20.8溴香草酚蓝-乙醇指示液(1g/L)。20.9二硫腺-三氟甲烷溶液(0.5g/L),保存冰箱中,必要时用下述方法纯化。称取0.5g研细的二硫腺,溶于50mL三氯甲烷中,如不全溶,可用滤纸过滤于250mL分液漏斗中,用氨水(1+99)提取三次,每次100mL,将提取液用棉花过滤至500mL分液漏斗中,用盐酸(1+1)调至酸性,将沉淀出的二硫腺用三氯甲烷提取2次~3次,每次20mL,合并三氯甲烷层,用等量水洗涤两次,弃去洗涤液,在50℃水浴上蒸去三氯甲烷。精制的二硫腺置硫酸干燥器中,干燥备用,或将沉淀出的二硫腺用200、200、100mL三氯甲烷提取三次,合并三氯甲烷层为二硫腺溶液。20.10二硫腺使用液:吸取1.0mL二硫腺溶液,加三氯甲烷至10mL,混勾。用1cm比色杯,以三氯甲烧调节零点,于波长510nm处测吸光度(A),用式(4)算出配制100mL二硫踪使用液(70%透光率)所需二硫腺溶液的毫升数(V)。V 10(2 = g70) 1. 55
+....-( 4 )
20.11汞标准溶液:准确称取0.1354g经于燥器干燥过的二氯化汞,加硫酸(1十35)使其溶解后,移人100mL容量瓶中,并稀释至刻度,此溶液每毫升相当于1.0mg汞。20.12汞标准使用液:吸取1.0mL汞标准溶液,置于100mL容量瓶中,加硫酸(1+35)稀释至刻度,此溶液每毫升相当于10.0μg汞。再吸取此液5.0mL于50mL容量瓶中,加硫酸(1十35)稀释至刻度,此溶液每毫升相当于1.0g汞。21仪器
21.1消化装置。
21.2可见分光光度计。
22分析步骤
22.1试样消化
22.1.1粮食或水分少的食品:称取20.00g试样,置于消化装置锥形瓶中,加玻璃珠数粒及80mL硝酸、15mL硫酸,转动锥形瓶,防止局部炭化。装上冷凝管后,小火加热,待开始发泡即停止加热,发泡停止后加热回流2h。如加热过程中溶液变棕色,再加5mL硝酸,继续回流2h,放冷,用适量水洗涤冷凝管,洗液并人消化液中,取下锥形瓶,加水至总体积为150mL。按同一方法做试剂空白试验。22.1.2植物油及动物油脂:称取10.00g试样,置于消化装置锥形瓶中,加玻璃珠数粒及15mL硫酸,小心混勾至溶液变棕色,然后加人45mL硝酸,装上冷凝管后,以下按22.1.1自小火加热·...”起依法操作。
22.1.3蔬菜、水果、薯类、豆制品:称取50.00g捣碎、混匀的试样(豆制品直接取样,其他试样取可食部分洗净、晾干),置于消化装置锥形瓶中,加玻璃珠数粒及45mL硝酸、15mL硫酸,转动锥形瓶,防止局部炭化。装上冷凝管后,以下按22.1.1自小火加热”起依法操作。22.1.4肉、蛋、水产品:称取20.00g捣碎混匀试样,置于消化装置锥形瓶中,加玻璃珠数粒及45mL硝酸、15mL硫酸,装上冷凝管后,以下按21.1.1自“小火加热.”起依法操作。22.1.5牛乳及乳制品:称取50.00g牛乳、酸牛乳,或相当于50.00g牛乳的乳制品(6g全脂乳粉,138
GB/T5009.17—2003
20g甜炼乳,12.5g淡炼乳),置于消化装置锥形瓶中,加玻璃珠数粒及45mL硝酸,牛乳、酸牛乳加15mL硫酸,乳制品加10mL硫酸,装上冷凝管,以下按22.1.1自“小火加热…”起依法操作。22.2测定
22.2.1取21.1.1~21.1.5消化液(全量),加20mL水,在电炉上煮沸10min,除去二氧化氮等,放冷。
22.2.2于试样消化液及试剂空白液中各加高锰酸钾溶液(50g/L)至溶液呈紫色,然后再加盐酸羟胺溶液(200g/L)使紫色褪去,加2滴麝香草酚蓝指示液,用氨水调节pH,使橙红色变为橙黄色(pH1~2)。定量转移至125mL分液漏斗中。22.2.3吸取0、0.5、1.0、2.0、3.0、4.0、5.0、6.0uL汞标准使用液(相当于0、0.5、1.0、2.0、3.0、4.0、5.0、6.0μg汞),分别置于125mL分液漏斗中,加10mL硫酸(1+19),再加水至40mL,混勾。再各加1mL盐酸羟胺溶液(200g/L),放置20min,并时时振摇。22.2.4于试样消化液、试剂空白液及标准液振摇放冷后的分液漏斗中加5.0mL二硫腺使用液,剧烈振摇2min,静置分层后,经脱脂棉将三氯甲烷层滤入1cm比色杯中,以三氯甲烷调节零点,在波长490nm处测吸光度,标准管吸光度减去零管吸光度,绘制标准曲线。23结果计算
试样中汞的含量按式(5)进行计算。X-(At-A,)X1 000
mX 1 000
式中:
X—试样中汞的含量,单位为毫克每千克(mg/kg);A,——试样消化液中汞的质量,单位为微克(μg);A—试剂空白液中汞的质量,单位为微克(μg);m一—试样质量,单位为克(g)。计算结果保留两位有效数字。
24精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。甲基汞的测定
25范围
本标准规定了水产品中甲基汞的测定方法。本标准适用于水产品中甲基汞的测定。气相色谱法(酸提取巯基棉法)26原理
·(5)
试样中的甲基汞,用氯化钠研磨后加入含有Cu2+的盐酸(1十11),(Cu2+与组织中结合的CH,Hg交换)完全萃取后,经离心或过滤,将上清液调试至一定的酸度,用巯基棉吸附,再用盐酸(1十5)洗脱,最后以苯萃取甲基汞,用带电子捕获鉴定器的气相色谱仪分析。27试剂
27.1氯化钠。
GB/T5009.17—2003
27.2苯:色谱上无杂峰,否则应重蒸馏纯化。27.3无水硫酸钠:用苯提取,浓缩液在色谱上无杂峰。27.4盐酸(1+5):取优级纯盐酸,加等体积水,恒沸蒸馏,蒸出盐酸为(1+1),稀释配制。27.5氯化铜溶液(42.5g/L)。
27.6氢氧化钠溶液(40g/L):称取40g氢氧化钠加水稀释至1000mL。27.7盐酸(1+11):取83.3mL盐酸(优级纯)加水稀释至1000mL。27.8淋洗液(pH3.0~3.5):用盐酸(1+11)调节水的pH为3.0~3.5。27.9巯基棉:在250mL具塞锥形瓶中依次加人35mL乙酸酐,16mL冰乙酸、50mL硫代乙醇酸、0.15mI.硫酸、5mL水,混匀,冷却后,加人14g脱脂棉,不断翻压,使棉花完全浸透,将塞盖好,置于恒温培养箱中,在(37士0.5℃保温4天(注意切勿超过40℃),取出后用水洗至近中性,除去水分后平铺于瓷盘中,再在(37士0.5)℃恒温箱中烘于,成品放人棕色瓶中,放置冰箱保存备用(使用前,应先测定统基棉对甲基汞的吸附效率为95%以上方可使用)。注:所有试剂用苯萃取,萃取液不应在气相色谱上出现甲基汞的峰。27.10甲基汞标准溶液:准确称取0.1252g氯化甲基汞,用苯溶解于100mL容量瓶中,加苯稀释至刻度,此溶液每毫升相当于1.0mg甲基汞。放置冰箱保存。27.11甲基汞标准使用液:吸取1.0mL甲基汞标准溶液,置于100mL容量瓶中,用苯稀释至刻度。此溶液每毫升相当于10μg甲基汞。取此溶液1.0mL,置于100mL容量瓶中,用盐酸(1+5)稀释至刻度,此溶液每毫升相当于0.10pg甲基汞,临用时新配。27.12甲基橙指示液(1g/L)。
28仪器
28.1气相色谱仪:附3Ni电子捕获鉴定器或氙源电子捕获检定器。28.2酸度计。
28.3离心机:带50mL~~80mL离心管。28.4统基棉管:用内径6mm、长度20cm,一端拉细(内径2mm)的玻璃滴管内装0.1g~0.15g巯基棉,均匀填塞,临用现装。
28.5玻璃仪器:均用硝酸(1+20)浸泡一昼夜,用水冲洗干净。29分析步骤
29.1气相色谱参考条件
29.1.163Ni电子捕获鉴定器:柱温185℃,鉴定器温度为260℃,汽化室温度215℃。29.1.2氙源电子捕获鉴定器:柱温185℃,鉴定器温度为190℃,汽化室温度185℃。29.1.3载气:高纯氮,流量为60mL/min(选择仪器的最佳条件)。29.1.4色谱柱:内径3mm,长1.5m的玻璃柱,内装涂有质量分数为7%的丁二酸乙二醇聚酯(PEGS)或涂质量分数为1.5%的0V-17和1.95%QF-1或质量分数为5%的丁二乙酸二乙二醇酯(DEGS)固定液的60目~80目chromosorb WAWDMCS。29.2测定
29.2.1称取1.00g~2.00g去皮去刺绞碎混匀的鱼肉(称取5g虾仁,研碎),加人等量氯化钠,在乳钵中研成糊状,加入0.5mL氯化铜溶液(42.5g/1.),轻轻研匀,用30mL盐酸(1+11)分次完全转人100mL带塞锥形瓶中,剧烈振摇5min,放置30min(也可用振荡器振摇30min),样液全部转人50mL离心管中,用5mL盐酸(1十11)淋洗锥形瓶,洗液与样液合并,离心10min(转速为2000r/min),将上清液全部转人100ml.分液漏斗中,于残渣中再加10mI.盐酸(1十11),用玻璃棒搅拌均勾后再离心,合并两份离心溶液。
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。