GB/T 16294-1996
基本信息
标准号: GB/T 16294-1996
中文名称:医药工业洁净室(区)沉降菌的测试方法
标准类别:国家标准(GB)
标准状态:现行
发布日期:1996-04-10
实施日期:1996-10-01
出版语种:简体中文
下载格式:.rar.pdf
下载大小:183457

标准分类号
标准ICS号:环保、保健与安全>>空气质量>>13.040.30工作场所空气
中标分类号:医药、卫生、劳动保护>>医药>>C10医药综合
关联标准
采标情况:≠NASA NHB 5340-2
出版信息
出版社:中国标准出版社
页数:平装16开, 页数:9, 字数:12000
标准价格:10.0 元
出版日期:1996-10-01
相关单位信息
首发日期:1996-04-10
复审日期:2004-10-14
起草单位:上海市医药管理局
发布部门:国家技术监督局
主管部门:国家食品药品监督管理局
标准简介
本标准规定了医药工业洁净室和洁净区中沉降菌的测试条件、测试方法。本标准适用于医药工业洁净室和洁净区,无菌室和无菌区域(包括洁净工作台)的沉降菌的测定和环境的验证。 GB/T 16294-1996 医药工业洁净室(区)沉降菌的测试方法 GB/T16294-1996 标准下载解压密码:www.bzxz.net
标准图片预览




标准内容
GB/T16294-1996
本标准依照国内外《药品生产管理规范》(GMP)的要求,非等效采用美国国家航空及宇宙航行局NASA标准NHB5340-2《关于洁净室和洁净工作台微生物的控制标准》,并参考JGJ71-一90《洁净室施工验收规范》制定。
悬浮粒子和微生物的测试是评价医药工业洁净室和洁净区空气洁净度的主要指标。本标准用沉降菌评价洁净室和洁净区空气中的微生物。医药工业洁净室(区)沉降菌的测试应采用本标准的规定。本标准的附录A、附录B、附录C都是标准的附录。本标准的附录D是提示的附录。
本标准由国家医药管理局提出并归口。本标准起草单位:上海市医药管理局药品测试所。本标准主要起草人:钱周、步伯荪、沈建华、顾锋、唐小珍。16
1范围
中华人民共和国国家标准
医药工业洁净室(区)沉降菌的测试方法
Test method for settling microbe in cleanroom(area)ofthepharmaceutical industryGB/T16294--1996
本标准规定了医药工业洁净室和洁净区中沉降菌的测试条件、测试方法。本标准适用于医药工业洁净室和洁净区,无菌室或无菌区域(包括洁净工作台)的沉降菌的测定和环境的验证。
2引用标准
下列标准所包含的条文,通过在本标准中引用而构成为本标准的条文。本标准出版时,所示版本均为有效。所有标准都会被修订,使用本标准的各方应探讨使用下列标准最新版本的可能性。YY/T0188.6—1995药品检验操作规程第6部分:药品生物测定法3定义
本标准采用下列定义。
3.1洁净室(区)cleanroom(area)对尘粒及微生物污染规定需进行环境控制的房间或区域。其建筑结构、装备及其使用均具有减少对该区域内污染源的介入、产生和滞留的功能。3.2洁净工作台cleaningworkstation一种工作台或者与之类似的一个封闭围挡工作区。其特点是自身能够供给经过过滤的空气或气体,如垂直层流罩、水平层流罩、垂直层流洁净工作台、水平层流洁净工作台、自净器等。3.3洁净度cleanliness
洁净环境内单位体积空气中含大于或等于某一粒径的悬浮粒子的允许统计数。3.4茵落colonyformingunits
细菌培养后,由一个或几个细菌繁殖而形成的一细菌集落,简称CFU。通常用个数表示。3.5沉降菌settlingmicrobe
用本标准提及的方法收集到的活微生物粒子,通过专用的培养基,在适宜的生长条件下繁殖到可见的菌落数。
3.6悬浮粒子airbornepartical
可悬浮在空气中的尺寸-般在0.001μm~1000um之间的固体,液体或两者的混合物质,包括生物性粒子和非生物性粒子。
3.7单向流unidirectionalairflow(曾称为层流laminarflow)沿着平行流线,以单一通路以一定流速向单一方向流动的气流。国家技术监督局1996-04-10批准1996-10-01实施
GB/T16294-—1996
3.8非单向流nonunidirectional airflow(曾称为乱流turbulentflow)具有多个通路循环特性或气流方向不平行的,不满足单向流定义的气流。3.9静态测试at-resttest
洁净室(区)净化空气调节系统已处于正常运行状态,工艺设备已安装,洁净室(区)内没有生产人员的情况下进行的测试。
3.10动态测试operationaltest
洁净室(区)已处于正常生产状态下进行的测试。4测试方法
4.1方法概述
本测试方法采用沉降法,即通过自然沉降原理收集在空气中的生物粒子于培养基平,经若干时间,在适宜的条件下让其繁殖到可见的菌落进行计数,以平板培养Ⅲ中的菌落数来判定洁净环境内的活微生物数,并以此来评定洁净室(区)的洁净度。4.2所用的仪器和设备
4.2.1高压消毒锅
使用时应严格按照仪器说明书操作。4.2.2恒温培养箱
必须定期对培养箱的温度计进行检定。4.2.3培养Ⅲ
一般采用90mm×15mm的硼硅酸玻璃培养皿。4.2.4培养基
普通肉汤琼脂培养基或其他药典认可的培养基。其配制方法见附录A(标准的附录)。4.3测试步骤
4.3.1采样方法
将已制备好的培养Ⅲ按5.4.1.2的要求放置,打开培养Ⅲ盖,使培养基表面暴露0.5h,再将培养盖盖上后倒置。
4.3.2培养
4.3.2.1全部采样结束后,将培养血倒置于恒温培养箱中培养。4.3.2.2在30℃~35℃培养箱中培养,时间不少于48h。4.3.2.3每批培养基应有对照试验,检验培养基本身是否污染。可每批选定3只培养血作对照培养。4.3.3菌落计数
4.3.3.1用内眼直接计数,标记或在菌落计数器上点计,然后用5~10倍放大镜检查,有否遗漏。4.3.3.2若培养Ⅲ上有2个或2个以上的菌落重叠,可分辨时仍以2个或2个以上菌落计数。4.4注意事项
4.4.1测试用具要作灭菌处理,以确保测试的可靠性、正确性。4.4.2采取一切措施防止人为对样本的污染。4.4.3对培养基、培养条件及其他参数作详细的记录。4.4.4由于细菌种类繁多,差别甚大,计数时一般用透射光于培养咀背面或正面仔细观察,不要漏计培养血边缘生长的菌落,并须注意细菌菌落与培养基沉淀物的区别,必要时用显微镜鉴别。4.4.5采样前应仔细检查每个培养血的质量,如发现变质、破损或污染的应剔除。5测试规则
5.1测试状态
GB/T16294-1996
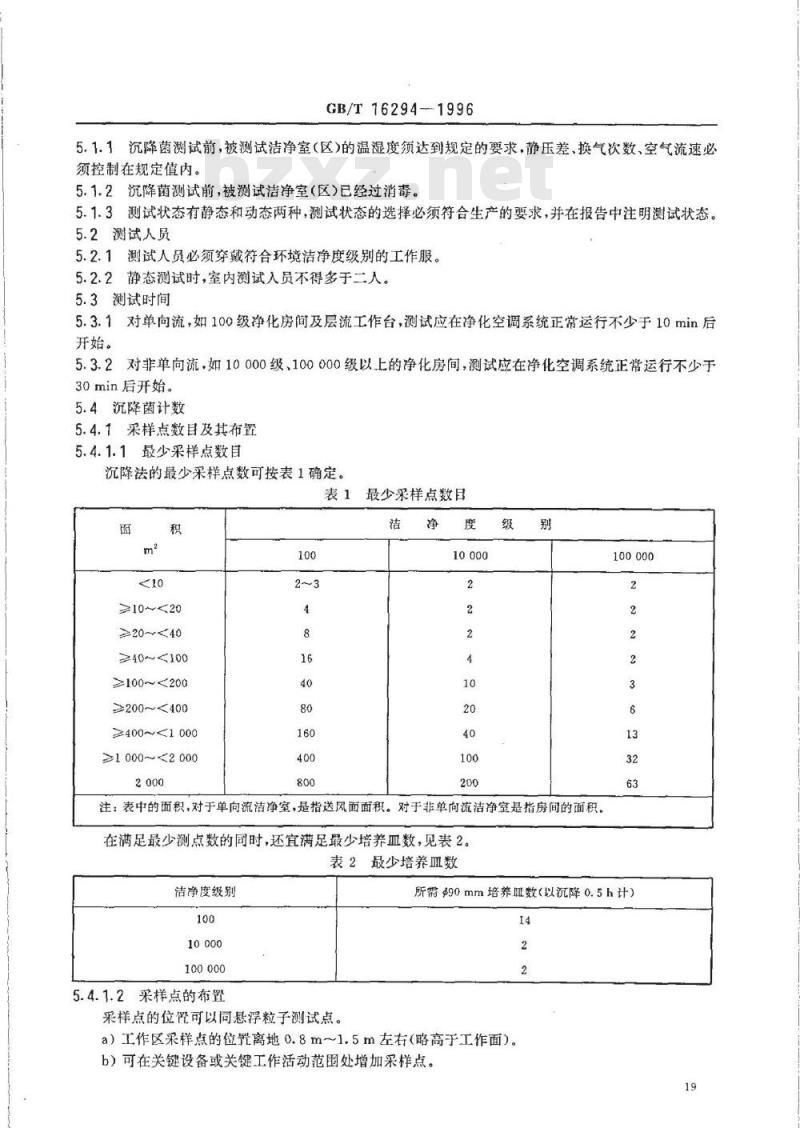
5.1.1沉降菌测试前,被测试洁净室(区)的温湿度须达到规定的要求,静压差,换气次数、空气流速必须控制在规定值内。
5.1.2沉降菌测试前,被测试洁净室(区)已经过消毒。5.1.3测试状态有静态和动态两种,测试状态的选择必须符合生产的要求,并在报告中注明测试状态。5.2测试人员
5.2.1测试人员必须穿戴符合环境洁净度级别的工作服。5.2.2静态测试时,室内测试入员不得多于二人。5.3测试时间
5.3.1对单向流,如100级净化房间及层流工作台,测试应在净化空调系统正常运行不少于10min后开始。
5.3.2对非单向流,如10000级、100000级以上的净化房间,测试应在净化空调系统正常运行不少于30min后开始。
5.4沉降菌计数
5.4.1采样点数目及其布置
5.4.1.1最少采样点数目
沉降法的最少采样点数可按表1确定。表1Www.bzxZ.net
≥10~20
>20~40
240~100
≥100~200
≥200~400
≥400~<1000
≥1000~2000
最少采样点数目
注:表中的面积,对于单向流洁净,是指送风面面积。对于非单向流洁净室是指房间的面积。在满足最少测点数的同时,还宜满足最少培养血数,见表2。表2最少培养皿数
洁净度级别
100000
5.4.1.2采样点的布置
采样点的位置可以同悬浮粒子测试点。所需$90mm培养Ⅲ数(以沉降0.5h计)14
a)工作区采样点的位置离地0.8m~1.5m左右(略高于工作面)。b)可在关键设备或关键工作活动范围处增加采样点。19
GB/T16294—1996
采样点位的详细规则见附录B(标准的附录)。5.5记录
测试报告中应记录房间温度、相对湿度、压差及测试状态。测试报告的编写见附录C(标准的附录)。5.6结果计算
5.6.1用计数方法得出各个培养Ⅲ的菌落数。5.6.2平均菌落数的计算,见式(1)。平均菌落数M-M+M,+..M.
式中:M——平均菌落数;
M—-1号培养皿菌落数;
M,—2号培养Ⅲ菌落数;
M.-n号培养血菌落数
一培养血总数。
5.7结果评定
用平均菌落数判断洁净室(区)空气中的微生物。5.7.1洁净室(区)内的平均菌落数必须低于所选定的评定标准。(1)
5.7.2若某洁净室(区)内的平均菌落数超过评定标准,则必须对此区域先进行消毒,然后重新采样两次,测试结果均须合格。
A1培养基的准备
GB/T16294—1996
附录A
(标准的附录)
培养基的准备及灭菌
培养基可以外购或自行配制。自行配制方法见YY/T0188.6—1995第6章无菌检查部分中关于此类培养基的配方和操作步骤。其他符合药典灵敏度要求的培养基亦可以自行配制。A2培养基平皿的制备
A2.1将90mm的培养血置于121℃湿热灭菌20min或180℃干热灭菌2h。A2.2将培养基加热溶化,冷至45℃时,在无菌操作要求下将培养基注入培养血,每血约15mLA2.3待琼脂凝固后,将培养基平皿倒罩于30℃~35℃恒温培养箱中培养48h,若培养基平Ⅲ上确无菌落生长,即可供采样用。
注:制备好的培养基平血宜在2℃~8℃的环境中存放。附录B
(标准的附录)
采样点布置
洁净室和洁净区采样点的布置力求均匀,避免采样点在某局部区域过于集中,某局部区域过于稀疏蔬。下列采样点布置的图示可作参考。注:·为采样点。
试依据
环境温度
培养基批号
检测日期
菌落数
评定标准
检验者
洁净度级别
100000
GB/T16294—1996
附录C
(标准的附录)
沉降菌测试报告
测试单位
测试状态
相对湿度
培养温度
报告日期
复核者
附录D
(提示的附录)
国内外有关沉降菌测定的标准
美国NASA标准
NHB5340-2
个/($90mm1h)
日本制药协会
个/(μ90mm·1h))
%静压差
平均数
中国化学制药工业协会
个/(±90mm0.5h)
中华人民共和国
国家标准
医药工业洁净室(区)悬浮粒子、浮游菌和沉降菌的测试方法
GB/T16292~16294—1996
中国标准出版社出版
北京复兴门外三里河北街16号
邮政编码:100045
话:68522112
中国标准出版社秦皇岛印刷厂印刷新华书店北京发行所发行各地新华书店经售版权专有不得翻印
开本880×12301/16
印张1%字数44千字
1996年9月第一版
1996年9月第一次印刷
印数1-6000
书号:155066·1-13165
标目297-74
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
本标准依照国内外《药品生产管理规范》(GMP)的要求,非等效采用美国国家航空及宇宙航行局NASA标准NHB5340-2《关于洁净室和洁净工作台微生物的控制标准》,并参考JGJ71-一90《洁净室施工验收规范》制定。
悬浮粒子和微生物的测试是评价医药工业洁净室和洁净区空气洁净度的主要指标。本标准用沉降菌评价洁净室和洁净区空气中的微生物。医药工业洁净室(区)沉降菌的测试应采用本标准的规定。本标准的附录A、附录B、附录C都是标准的附录。本标准的附录D是提示的附录。
本标准由国家医药管理局提出并归口。本标准起草单位:上海市医药管理局药品测试所。本标准主要起草人:钱周、步伯荪、沈建华、顾锋、唐小珍。16
1范围
中华人民共和国国家标准
医药工业洁净室(区)沉降菌的测试方法
Test method for settling microbe in cleanroom(area)ofthepharmaceutical industryGB/T16294--1996
本标准规定了医药工业洁净室和洁净区中沉降菌的测试条件、测试方法。本标准适用于医药工业洁净室和洁净区,无菌室或无菌区域(包括洁净工作台)的沉降菌的测定和环境的验证。
2引用标准
下列标准所包含的条文,通过在本标准中引用而构成为本标准的条文。本标准出版时,所示版本均为有效。所有标准都会被修订,使用本标准的各方应探讨使用下列标准最新版本的可能性。YY/T0188.6—1995药品检验操作规程第6部分:药品生物测定法3定义
本标准采用下列定义。
3.1洁净室(区)cleanroom(area)对尘粒及微生物污染规定需进行环境控制的房间或区域。其建筑结构、装备及其使用均具有减少对该区域内污染源的介入、产生和滞留的功能。3.2洁净工作台cleaningworkstation一种工作台或者与之类似的一个封闭围挡工作区。其特点是自身能够供给经过过滤的空气或气体,如垂直层流罩、水平层流罩、垂直层流洁净工作台、水平层流洁净工作台、自净器等。3.3洁净度cleanliness
洁净环境内单位体积空气中含大于或等于某一粒径的悬浮粒子的允许统计数。3.4茵落colonyformingunits
细菌培养后,由一个或几个细菌繁殖而形成的一细菌集落,简称CFU。通常用个数表示。3.5沉降菌settlingmicrobe
用本标准提及的方法收集到的活微生物粒子,通过专用的培养基,在适宜的生长条件下繁殖到可见的菌落数。
3.6悬浮粒子airbornepartical
可悬浮在空气中的尺寸-般在0.001μm~1000um之间的固体,液体或两者的混合物质,包括生物性粒子和非生物性粒子。
3.7单向流unidirectionalairflow(曾称为层流laminarflow)沿着平行流线,以单一通路以一定流速向单一方向流动的气流。国家技术监督局1996-04-10批准1996-10-01实施
GB/T16294-—1996
3.8非单向流nonunidirectional airflow(曾称为乱流turbulentflow)具有多个通路循环特性或气流方向不平行的,不满足单向流定义的气流。3.9静态测试at-resttest
洁净室(区)净化空气调节系统已处于正常运行状态,工艺设备已安装,洁净室(区)内没有生产人员的情况下进行的测试。
3.10动态测试operationaltest
洁净室(区)已处于正常生产状态下进行的测试。4测试方法
4.1方法概述
本测试方法采用沉降法,即通过自然沉降原理收集在空气中的生物粒子于培养基平,经若干时间,在适宜的条件下让其繁殖到可见的菌落进行计数,以平板培养Ⅲ中的菌落数来判定洁净环境内的活微生物数,并以此来评定洁净室(区)的洁净度。4.2所用的仪器和设备
4.2.1高压消毒锅
使用时应严格按照仪器说明书操作。4.2.2恒温培养箱
必须定期对培养箱的温度计进行检定。4.2.3培养Ⅲ
一般采用90mm×15mm的硼硅酸玻璃培养皿。4.2.4培养基
普通肉汤琼脂培养基或其他药典认可的培养基。其配制方法见附录A(标准的附录)。4.3测试步骤
4.3.1采样方法
将已制备好的培养Ⅲ按5.4.1.2的要求放置,打开培养Ⅲ盖,使培养基表面暴露0.5h,再将培养盖盖上后倒置。
4.3.2培养
4.3.2.1全部采样结束后,将培养血倒置于恒温培养箱中培养。4.3.2.2在30℃~35℃培养箱中培养,时间不少于48h。4.3.2.3每批培养基应有对照试验,检验培养基本身是否污染。可每批选定3只培养血作对照培养。4.3.3菌落计数
4.3.3.1用内眼直接计数,标记或在菌落计数器上点计,然后用5~10倍放大镜检查,有否遗漏。4.3.3.2若培养Ⅲ上有2个或2个以上的菌落重叠,可分辨时仍以2个或2个以上菌落计数。4.4注意事项
4.4.1测试用具要作灭菌处理,以确保测试的可靠性、正确性。4.4.2采取一切措施防止人为对样本的污染。4.4.3对培养基、培养条件及其他参数作详细的记录。4.4.4由于细菌种类繁多,差别甚大,计数时一般用透射光于培养咀背面或正面仔细观察,不要漏计培养血边缘生长的菌落,并须注意细菌菌落与培养基沉淀物的区别,必要时用显微镜鉴别。4.4.5采样前应仔细检查每个培养血的质量,如发现变质、破损或污染的应剔除。5测试规则
5.1测试状态
GB/T16294-1996
5.1.1沉降菌测试前,被测试洁净室(区)的温湿度须达到规定的要求,静压差,换气次数、空气流速必须控制在规定值内。
5.1.2沉降菌测试前,被测试洁净室(区)已经过消毒。5.1.3测试状态有静态和动态两种,测试状态的选择必须符合生产的要求,并在报告中注明测试状态。5.2测试人员
5.2.1测试人员必须穿戴符合环境洁净度级别的工作服。5.2.2静态测试时,室内测试入员不得多于二人。5.3测试时间
5.3.1对单向流,如100级净化房间及层流工作台,测试应在净化空调系统正常运行不少于10min后开始。
5.3.2对非单向流,如10000级、100000级以上的净化房间,测试应在净化空调系统正常运行不少于30min后开始。
5.4沉降菌计数
5.4.1采样点数目及其布置
5.4.1.1最少采样点数目
沉降法的最少采样点数可按表1确定。表1Www.bzxZ.net
≥10~20
>20~40
240~100
≥100~200
≥200~400
≥400~<1000
≥1000~2000
最少采样点数目
注:表中的面积,对于单向流洁净,是指送风面面积。对于非单向流洁净室是指房间的面积。在满足最少测点数的同时,还宜满足最少培养血数,见表2。表2最少培养皿数
洁净度级别
100000
5.4.1.2采样点的布置
采样点的位置可以同悬浮粒子测试点。所需$90mm培养Ⅲ数(以沉降0.5h计)14
a)工作区采样点的位置离地0.8m~1.5m左右(略高于工作面)。b)可在关键设备或关键工作活动范围处增加采样点。19
GB/T16294—1996
采样点位的详细规则见附录B(标准的附录)。5.5记录
测试报告中应记录房间温度、相对湿度、压差及测试状态。测试报告的编写见附录C(标准的附录)。5.6结果计算
5.6.1用计数方法得出各个培养Ⅲ的菌落数。5.6.2平均菌落数的计算,见式(1)。平均菌落数M-M+M,+..M.
式中:M——平均菌落数;
M—-1号培养皿菌落数;
M,—2号培养Ⅲ菌落数;
M.-n号培养血菌落数
一培养血总数。
5.7结果评定
用平均菌落数判断洁净室(区)空气中的微生物。5.7.1洁净室(区)内的平均菌落数必须低于所选定的评定标准。(1)
5.7.2若某洁净室(区)内的平均菌落数超过评定标准,则必须对此区域先进行消毒,然后重新采样两次,测试结果均须合格。
A1培养基的准备
GB/T16294—1996
附录A
(标准的附录)
培养基的准备及灭菌
培养基可以外购或自行配制。自行配制方法见YY/T0188.6—1995第6章无菌检查部分中关于此类培养基的配方和操作步骤。其他符合药典灵敏度要求的培养基亦可以自行配制。A2培养基平皿的制备
A2.1将90mm的培养血置于121℃湿热灭菌20min或180℃干热灭菌2h。A2.2将培养基加热溶化,冷至45℃时,在无菌操作要求下将培养基注入培养血,每血约15mLA2.3待琼脂凝固后,将培养基平皿倒罩于30℃~35℃恒温培养箱中培养48h,若培养基平Ⅲ上确无菌落生长,即可供采样用。
注:制备好的培养基平血宜在2℃~8℃的环境中存放。附录B
(标准的附录)
采样点布置
洁净室和洁净区采样点的布置力求均匀,避免采样点在某局部区域过于集中,某局部区域过于稀疏蔬。下列采样点布置的图示可作参考。注:·为采样点。
试依据
环境温度
培养基批号
检测日期
菌落数
评定标准
检验者
洁净度级别
100000
GB/T16294—1996
附录C
(标准的附录)
沉降菌测试报告
测试单位
测试状态
相对湿度
培养温度
报告日期
复核者
附录D
(提示的附录)
国内外有关沉降菌测定的标准
美国NASA标准
NHB5340-2
个/($90mm1h)
日本制药协会
个/(μ90mm·1h))
%静压差
平均数
中国化学制药工业协会
个/(±90mm0.5h)
中华人民共和国
国家标准
医药工业洁净室(区)悬浮粒子、浮游菌和沉降菌的测试方法
GB/T16292~16294—1996
中国标准出版社出版
北京复兴门外三里河北街16号
邮政编码:100045
话:68522112
中国标准出版社秦皇岛印刷厂印刷新华书店北京发行所发行各地新华书店经售版权专有不得翻印
开本880×12301/16
印张1%字数44千字
1996年9月第一版
1996年9月第一次印刷
印数1-6000
书号:155066·1-13165
标目297-74
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。