GB/T 14070-1993
基本信息
标准号: GB/T 14070-1993
中文名称:气体分析 校准用混合气体的制备 压力法
标准类别:国家标准(GB)
标准状态:现行
发布日期:1993-01-11
实施日期:1993-01-01
出版语种:简体中文
下载格式:.rar.pdf
下载大小:1011292

标准分类号
标准ICS号:计量学和测量、物理现象>>电学、磁学、电和磁的测量>>17.220.20电和磁量值的测量
中标分类号:仪器、仪表>>物质成分分析仪器与环境监测仪器>>N50物质成分分析仪器与环境检测仪器综合
关联标准
采标情况:=ISO 6146-79
出版信息
出版社:中国标准出版社
页数:平装16开, 页数:39, 字数:73千字
标准价格:18.0 元
相关单位信息
首发日期:1993-01-11
复审日期:2004-10-14
起草单位:南京分析仪器厂
归口单位:全国工业过程测量和控制标准化技术委员会
发布部门:国家技术监督局
主管部门:中国机械工业联合会
标准简介
本标准规定了压力法制备校准用混合气体的方法。本标准制备的各组分浓度的准确度,可在很宽的范围内变化。 GB/T 14070-1993 气体分析 校准用混合气体的制备 压力法 GB/T14070-1993 标准下载解压密码:www.bzxz.net
标准图片预览




标准内容
中华人民共和国国家标准
气体分析校准用混合气体的制备压力法
Gas analysis-Preparation of calibration gasmixtures--Manometric method
GB/T 14070—93
本标准等效采用国际标准ISO61461979《气体分析——校准用混合气体的制备—压力法》。1主题内容与适用范围
本标准规定了压力法制备校准用混合气体(以下简称校准气)的方法。本标准制备的各组分浓度的准确度,可在很宽的范围内变化。对于可以看成是理想气体的校准气见附录A(补充件),其以压力比或摩尔比所表示的浓度的相对误差小于1%。
对于某些气体,例如碳氢化合物或极性化合物,其潜在误差可能很大。由于所使用的计算方法(道尔顿法、阿马格法、凯氏法)并不绝对严格,所以,经常利用压力计量法制备近似所需浓度的校准气,然后用比较法测定其浓度;如果必要的话,也可用直接分析的方法。注:当一一种气体组分接近它的饱和点时,则浓度单位之间的换算变得比较困难。2原理
本方法是一种静态方法,用它可以大量制备校准气。组分A、B、C等和稀释气依次充入假定为恒定容积的密闭容器中,此容器应预先清洗和抽空(忽略由于内部压力增加而引起的容器膨胀)。每次充气后,测量容器内压力。校准气浓度以压力比表示,它等于充入该组分的分压与校准气的总压力之比。用压力比表示的浓度换算成摩尔比表示时,可以采用不同计算方法,常用的方法有:道尔顿法、阿马格法、凯氏法,附录B(补充件)描述了这些方法。
3实例
3.1充气系统
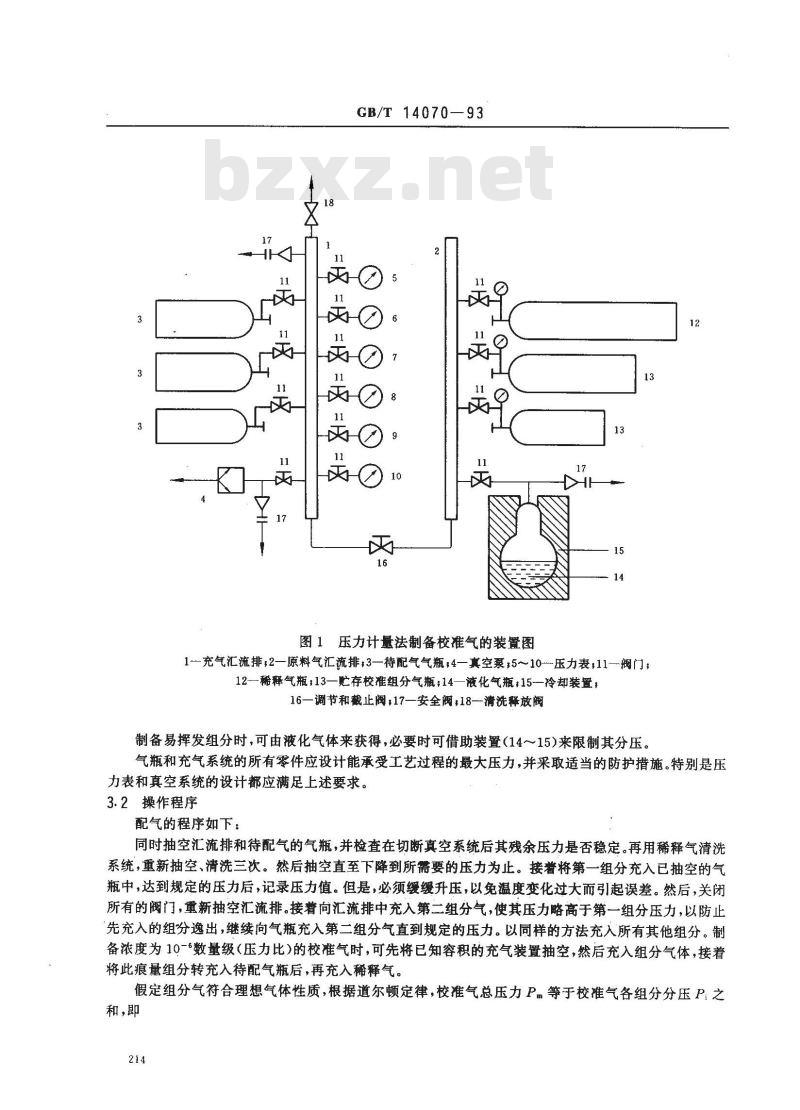
预先清洗过的待配气的气瓶(3)与汇流排(1)相连,汇流排上有一套足以包括有关压力量程的压力表(5~10),其中至少有一块是真空压力表(5),用以在充入校准组分前测量被抽空的汇流排和气瓶压力。
压力表的相对误差要满足配气准确度的要求。例如,配气浓度的相对误差为1%时,则要求压力表的相对误差小于0.5%。
装有待配组分气体的气瓶(13)与汇流排(2)相连,经阀(16)将汇流排(1)和(2)连通。国家技术监督局1993-01-11批准1993-11-01实施
GB/T 14070—93
图1压力计量法制备校准气的装置图17
1—充气汇流排,2—原料气汇流排,3—待配气气瓶:4—真空泵;5~10-压力表;11—阀门;12—稀释气瓶;13一贮存校准组分气瓶;14—液化气瓶;15冷却装置,16—调节和截止阀,17—安全阀;18—清洗释放阀制备易挥发组分时,可由液化气体来获得,必要时可借助装置14~15)来限制其分压。气瓶和充气系统的所有零件应设计能承受工艺过程的最大压力,并采取适当的防护措施。特别是压力表和真空系统的设计都应满足上述要求。3.2操作程序
配气的程序如下:
同时抽空汇流排和待配气的气瓶,并检查在切断真空系统后其残余压力是否稳定。再用稀释气清洗系统,重新抽空、清洗三次。然后抽空直至下降到所需要的压力为止。接着将第一组分充入已抽空的气瓶中,达到规定的压力后,记录压力值。但是,必须缓缓升压,以免温度变化过大而引起误差。然后,关闭所有的阀门,重新抽空汇流排。接着向汇流排中充入第二组分气,使其压力略高于第一组分压力,以防止先充入的组分逸出,继续向气瓶充入第二组分气直到规定的压力。以同样的方法充入所有其他组分。制备浓度为10-‘数量级(压力比)的校准气时,可先将已知容积的充气装置抽空,然后充入组分气体,接着将此痕量组分转充入待配气瓶后,再充入稀释气。假定组分气符合理想气体性质,根据道尔顿定律,校准气总压力P等于校准气各组分分压P之和,即
摩尔浓度X用下式计算:
GB/T 14070—93
如果考虑到不是理想气体,而是真实气体,则必须相应修正P:值,见附录A和附录B(补充件)。在充装各组分气体时,必须考虑到温度的变化,可以进行适当的修正计算,或者等到整个装置恢复到初始的环境温度,然后记录压力值,再充入另-一组分。通常,选择压缩系数Z值见附录A(补充件)偏离1最大的组分,而且该组分又不是校准气中含量最多的组分,首先充入气瓶,其原因是,如果最后充入这一组分,则它就处于最高的压缩状态,这就势必导致最大误差。
由于在充气过程中组分间的相互扩散,不能使混合气很快均匀,所以当充入另一组分时,对气瓶中原有组分有明显的活塞效应。当最终达到均匀时,校准气的压缩系数乙普遍偏低,为了保持总质量不变,通常充入压力要有所提高。试验发现,其变化量可达百分之几,这就导致了相当大的误差,但可以通过修正最终理论压力使该项误差变得最小。对于先充入的组分,压力要比原预算值偏低,并且等到压力稳定后再记录和修正最终充气压力。同时必须考虑到混合所需要的时间,混匀时间是气瓶尺寸,几何形状,充气时所引起的湍流及气体相互扩散系数的函数。校准气的自然混勾需要几周时间,用机械搅拌等方法可以加速这一过程。在室温下呈液态的物质,由于它们具有一定的蒸汽压,所以也可以用于配气,其蒸汽压大小是该物质性质和挥发度的函数。然而,即使在样品的最低使用温度下,这些液体的蒸汽压也必须高于它们在混合气中的分压。换言之,如果压力过高(或者温度过低),则部分蒸汽将冷凝下来,这样就会使校准气中组分的浓度不再是个常数。通常取P,≤0.7Ps
组分i的分压,Pa;www.bzxz.net
式中:P
Psi——组分i 在最低使用温度下的饱和蒸汽压,Pa。4准确度
:(3)
用这种方法制备的校准气,其配气浓度的准确度取决于若干因素,特别是与气体性质有关。配气最适宜的条件,也就是在等温和压缩系数Z近似等于1的压力下,其准确度接近于压力测量的准确度。如果:
AP2< 10-2
2×,10-2
式中△Pt,AP2-—分别表示压力值Pi、P,的测量误差,Pa;AX,-表示浓度 X,的误差。
·(4)
(5)
由氢、氮、氮、氧、氛、氮等永久性气体组成的校准气,只要其分压不超过1MPa时,就符合上述规律。见附录E(参考件)。
GB/T14070-93
另一方面,氢中二氧化碳校准气,在高压下,其相对误差可高达20%。使用本方法前必须考虑它的限制因素,如果一个或一个以上的组分呈液态,或者在操作条件下压缩系数乙值不能应用,则实际浓度与规定浓度之间就会出现很大偏差。如果忽略了压缩热,或者在下次充气前不能排出压缩热,则也会出现配气偏差如果组分之间发生反应,则校准气浓度也会发生显著偏差。某些混合气,如氧和氢、氯和氢、一氧化氮和二氧化氮,以及有硫存在下的不饱和烃混合物,甚至在浓度为106数量级(以压力比表示)的情况下,也能发生反应。除非添加合适的稳定剂,否则某些组分的聚合(例如0.5%的氰化氢)或分解(例如四羟基镍)也会导致配气误差。5注意事项
用压力计量法制备校准气的主要危险是增压过程中所招致的危险,此时其中的混合气可能发生反应,或者在配气期间通过爆炸区,因为在充气期间,混合气的组成不断发生变化,也许会通过爆炸区。例如,在有烃存在下压缩纯氧是很危险的。对于某些气体,例如乙炔,即使在纯态下压缩也会发生爆炸。使用的气瓶必须符合国家颁布的《气瓶安全监察规程》的规定。216
A1理想气体的定义
GB/T 14070--93
附录A
理想气体与真实气体性质简介
(补充件)
理想气体是指气体分子本身的体积和分子间的作用力都可以忽略不计的气体。并遵守下列关系:PV nRT
式中:P
气体压力,Pa;
n个摩尔气体体积,m2;
气体摩尔数;
气体常数,R=8.315J/mol·K;
气体温度,K。
真实气体非理想性的原因是:
空间位阻,分子不是质点;
(A1)
b.分子间的力(主要原因):分子,包括单原子分子,在一定温度下表现出一定的分子体积,它们相互之间具有一定的吸引力;
静电作用力:就极性分子而言;氢键;
量子效应。
状态方程式
人们已提出很多状态方程用于描述真实性气体性质,通常,愈接近它们的真实性质,状态方程则愈复杂。
可以按状态方程式中包含的常数数目将其分为:a.
2个常数:范德华、贝特洛、戴特雷西,RK状态方程式;b.4个常数:麦克劳德状态方程;5个常数:贝蒂-布里奇曼状态方程;c.
d.8个常数:BWR状态方程等。
A3对比状态原理
对各种气体相图的考察表明,它们的等温线形状极其相似,图A1和图A2分别给出了二氧化碳和乙烯的相图。对比状态原理就是基于这种相似性。例如,这两种气体的50℃等温线是不能直接比较的。为了进行这种比较,需利用对比参变量(对比压力P.,对比温度T.),其中涉及到临界点(临界压力P。;临界温度T.)参数。
GB/T 14070-93
当两种气体的对比温度和对比压力相同时,则它们处于对比状态。压力
+200℃
+100℃
+50℃
-+31℃
0.100.200.300.400.500.600.700.80摩尔体积,L
二氧化碳相图
P。= 7. 29 MPa
T. 31.1 ℃
+200℃
+100℃
+50℃
+30℃
-15℃
-30℃
0.10 0.20 0. 30 0. 40 0.50 0.60 0. 70 0.80摩尔体积,L
图A2乙烯相图
P。=5.05MPa
T。=10 ℃
例如,若1mol分子二氧化碳(气体A)所处的条件为P=9MPa,T=40℃,要求计算出处于对比状态的1 mol分子乙烯(气体B)温度和压力条件气体A
气体B
273+40
T=T,T.=1.02×(273+10)=288.66K(15.6℃)P=P ·P,=1. 23X5. 05=6. 212 MPa两种气体的对比状态是:
140℃
它们对理想气体的偏离相同。
A4压缩系数Z的定义
{6.212MPa
压缩系数Z,可用下列简单关系式定义(也称阿马格常数)。PV
理想气体的压缩系数Z=1。真实气体的压缩系数表示与理想状态的偏离程度,这就可以直接应用理想气体定律。
A5纯气压缩系数的确定
A5.1状态方程法
GB/T14070-93
人们已利用很多状态方程(见A2)来计算压缩系数Z。通常,不同作者之间给出的相对系统误差值小于10-2。附录C(补充件)中给出某些气体的压缩系数Z曲线。A5.2对比状态原理法
压缩系数是对比参数的函数:
Z = f(T, ·P.· Z.)
式中:Z.处于临界条件下的压缩系数。(A5)
兰德森、格林孔英和荷根发展了曼士纳和赛弗林安提出的关系式。附录D(补充件)兰德森表给出了Z。在0.23~0.29范围内的压缩系数Z值,该范围的Z。值可满足绝大部分配气的需要。A6理想气体定律
在等温条件下:
A6.1道尔顿定律
在给定容积下,混合气总压等于混合气中各组分的分压之和。设P。、Pb、P。为组分A、B、C的分压,则总压P等于:P P+ P+ P
A6.2阿马格定律
在给定压力下,混合气的总体积等于混合气中各组分分体积之和。设V.、Vb、V.是组分A、B、C的分体积,则混合气的总体积V是:V - v,+V+v.
附录B
以压力比衰示的浓度换算成摩尔浓度的方法(补充件)
·(A6)
·(A7)
浓度换算时,对于真实气体需要进行修正。由于包含有压缩系数乙的状态方程较简单,所以较为常用。然而,有两项预选择是必不可少的:纯气压缩系数的选择,见附录A(补充件);混合规则的选择。
对于混合规则的选择可以应用下面三种方法。注:附录所列不同混合规则也可用于微极性气体。对于极性气体,会产生很大误差,而且很难定量。B1道尔顿法
若P。、Pb、P。分别表示组分A、B、C充入后的压力读数,而当它们是理想气体时,其压力值为Pa、Ph、Pe,则:
近似可得
(Z.由P.值确定)
·(B1)
GB/T 14070—93
P’=P(Z、由 P - P.值确定)
P=Pr(Z。由 P。-P值确定)
用摩尔分数表示浓度的关系式如下:X
而混合气的压缩系数乙等于在各分压下Z值的加权平均值:z(X, + Xh + X) X.z.+ Xzh + Xz ·(B2)
对于制备低压校准气(P<0.3MPa),该法具有很高的准确度。在高压下,它仅用于那些压缩系数相差很大的组分。
B2阿马格法
采用和前面相同的符号,组分A、B、C的修正分压为:P-
摩尔分数也可用下式表示:
(Z.由P.+P,+P.值确定)
(Z由 P。+ Pb+ P。值确定)
P。 P
(Z由P.+P,+P。值确定)
对于制备低压校准气(P<0.5MPa),阿马格法修正的相对误差小于5%。实验证明在高压下,特别是在对比温度和对比压力(T,和Pt)高的情况下,比道尔顿法优越。B3假想临界常数法
这是一种直接应用对比状态原理的方法。把混合气看成纯流体,用混合规则可以得到它的假想临界常数。
最常用的混合规则是凯氏法。混合气的假想临界常数等于每个组分临界常数的加权平均值。220
GB/T14070—93
Tem =ZX,Te
P.m =ZX,P.i
Zem =ZX,Zei
(X是摩尔分数,作为近似值,它可用压力比浓度所代替)混合气对比参数:
·(B10)
..(B11)
·(B12)
.(B13)
++++++++-(B14)
利用兰德森表见附录D(补充件)可以确定混合气的压缩系数Z,可以用下式计算摩尔分数:X,
该法的局限性主要与利用凯氏规则有关。P,/z,
当0.2注:对于氨、氧和氮气体其对比参数由下式确定:T.
附录C
一般气体的压缩系数Z曲线
(补充件)
在图C1~C4中,示出了某些一般气体的压缩系数之值随压力而变化的曲线。221
GB/T 14070—93
16.85℃[290 K]
16.85℃[290
图C1氧气、氮气压缩系数Z曲线
GB/T 14070—93
图C2情性气体压缩系数Z曲线
GB/T 14070—93
甲烷压缩系数Z曲线
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
气体分析校准用混合气体的制备压力法
Gas analysis-Preparation of calibration gasmixtures--Manometric method
GB/T 14070—93
本标准等效采用国际标准ISO61461979《气体分析——校准用混合气体的制备—压力法》。1主题内容与适用范围
本标准规定了压力法制备校准用混合气体(以下简称校准气)的方法。本标准制备的各组分浓度的准确度,可在很宽的范围内变化。对于可以看成是理想气体的校准气见附录A(补充件),其以压力比或摩尔比所表示的浓度的相对误差小于1%。
对于某些气体,例如碳氢化合物或极性化合物,其潜在误差可能很大。由于所使用的计算方法(道尔顿法、阿马格法、凯氏法)并不绝对严格,所以,经常利用压力计量法制备近似所需浓度的校准气,然后用比较法测定其浓度;如果必要的话,也可用直接分析的方法。注:当一一种气体组分接近它的饱和点时,则浓度单位之间的换算变得比较困难。2原理
本方法是一种静态方法,用它可以大量制备校准气。组分A、B、C等和稀释气依次充入假定为恒定容积的密闭容器中,此容器应预先清洗和抽空(忽略由于内部压力增加而引起的容器膨胀)。每次充气后,测量容器内压力。校准气浓度以压力比表示,它等于充入该组分的分压与校准气的总压力之比。用压力比表示的浓度换算成摩尔比表示时,可以采用不同计算方法,常用的方法有:道尔顿法、阿马格法、凯氏法,附录B(补充件)描述了这些方法。
3实例
3.1充气系统
预先清洗过的待配气的气瓶(3)与汇流排(1)相连,汇流排上有一套足以包括有关压力量程的压力表(5~10),其中至少有一块是真空压力表(5),用以在充入校准组分前测量被抽空的汇流排和气瓶压力。
压力表的相对误差要满足配气准确度的要求。例如,配气浓度的相对误差为1%时,则要求压力表的相对误差小于0.5%。
装有待配组分气体的气瓶(13)与汇流排(2)相连,经阀(16)将汇流排(1)和(2)连通。国家技术监督局1993-01-11批准1993-11-01实施
GB/T 14070—93
图1压力计量法制备校准气的装置图17
1—充气汇流排,2—原料气汇流排,3—待配气气瓶:4—真空泵;5~10-压力表;11—阀门;12—稀释气瓶;13一贮存校准组分气瓶;14—液化气瓶;15冷却装置,16—调节和截止阀,17—安全阀;18—清洗释放阀制备易挥发组分时,可由液化气体来获得,必要时可借助装置14~15)来限制其分压。气瓶和充气系统的所有零件应设计能承受工艺过程的最大压力,并采取适当的防护措施。特别是压力表和真空系统的设计都应满足上述要求。3.2操作程序
配气的程序如下:
同时抽空汇流排和待配气的气瓶,并检查在切断真空系统后其残余压力是否稳定。再用稀释气清洗系统,重新抽空、清洗三次。然后抽空直至下降到所需要的压力为止。接着将第一组分充入已抽空的气瓶中,达到规定的压力后,记录压力值。但是,必须缓缓升压,以免温度变化过大而引起误差。然后,关闭所有的阀门,重新抽空汇流排。接着向汇流排中充入第二组分气,使其压力略高于第一组分压力,以防止先充入的组分逸出,继续向气瓶充入第二组分气直到规定的压力。以同样的方法充入所有其他组分。制备浓度为10-‘数量级(压力比)的校准气时,可先将已知容积的充气装置抽空,然后充入组分气体,接着将此痕量组分转充入待配气瓶后,再充入稀释气。假定组分气符合理想气体性质,根据道尔顿定律,校准气总压力P等于校准气各组分分压P之和,即
摩尔浓度X用下式计算:
GB/T 14070—93
如果考虑到不是理想气体,而是真实气体,则必须相应修正P:值,见附录A和附录B(补充件)。在充装各组分气体时,必须考虑到温度的变化,可以进行适当的修正计算,或者等到整个装置恢复到初始的环境温度,然后记录压力值,再充入另-一组分。通常,选择压缩系数Z值见附录A(补充件)偏离1最大的组分,而且该组分又不是校准气中含量最多的组分,首先充入气瓶,其原因是,如果最后充入这一组分,则它就处于最高的压缩状态,这就势必导致最大误差。
由于在充气过程中组分间的相互扩散,不能使混合气很快均匀,所以当充入另一组分时,对气瓶中原有组分有明显的活塞效应。当最终达到均匀时,校准气的压缩系数乙普遍偏低,为了保持总质量不变,通常充入压力要有所提高。试验发现,其变化量可达百分之几,这就导致了相当大的误差,但可以通过修正最终理论压力使该项误差变得最小。对于先充入的组分,压力要比原预算值偏低,并且等到压力稳定后再记录和修正最终充气压力。同时必须考虑到混合所需要的时间,混匀时间是气瓶尺寸,几何形状,充气时所引起的湍流及气体相互扩散系数的函数。校准气的自然混勾需要几周时间,用机械搅拌等方法可以加速这一过程。在室温下呈液态的物质,由于它们具有一定的蒸汽压,所以也可以用于配气,其蒸汽压大小是该物质性质和挥发度的函数。然而,即使在样品的最低使用温度下,这些液体的蒸汽压也必须高于它们在混合气中的分压。换言之,如果压力过高(或者温度过低),则部分蒸汽将冷凝下来,这样就会使校准气中组分的浓度不再是个常数。通常取P,≤0.7Ps
组分i的分压,Pa;www.bzxz.net
式中:P
Psi——组分i 在最低使用温度下的饱和蒸汽压,Pa。4准确度
:(3)
用这种方法制备的校准气,其配气浓度的准确度取决于若干因素,特别是与气体性质有关。配气最适宜的条件,也就是在等温和压缩系数Z近似等于1的压力下,其准确度接近于压力测量的准确度。如果:
AP2< 10-2
2×,10-2
式中△Pt,AP2-—分别表示压力值Pi、P,的测量误差,Pa;AX,-表示浓度 X,的误差。
·(4)
(5)
由氢、氮、氮、氧、氛、氮等永久性气体组成的校准气,只要其分压不超过1MPa时,就符合上述规律。见附录E(参考件)。
GB/T14070-93
另一方面,氢中二氧化碳校准气,在高压下,其相对误差可高达20%。使用本方法前必须考虑它的限制因素,如果一个或一个以上的组分呈液态,或者在操作条件下压缩系数乙值不能应用,则实际浓度与规定浓度之间就会出现很大偏差。如果忽略了压缩热,或者在下次充气前不能排出压缩热,则也会出现配气偏差如果组分之间发生反应,则校准气浓度也会发生显著偏差。某些混合气,如氧和氢、氯和氢、一氧化氮和二氧化氮,以及有硫存在下的不饱和烃混合物,甚至在浓度为106数量级(以压力比表示)的情况下,也能发生反应。除非添加合适的稳定剂,否则某些组分的聚合(例如0.5%的氰化氢)或分解(例如四羟基镍)也会导致配气误差。5注意事项
用压力计量法制备校准气的主要危险是增压过程中所招致的危险,此时其中的混合气可能发生反应,或者在配气期间通过爆炸区,因为在充气期间,混合气的组成不断发生变化,也许会通过爆炸区。例如,在有烃存在下压缩纯氧是很危险的。对于某些气体,例如乙炔,即使在纯态下压缩也会发生爆炸。使用的气瓶必须符合国家颁布的《气瓶安全监察规程》的规定。216
A1理想气体的定义
GB/T 14070--93
附录A
理想气体与真实气体性质简介
(补充件)
理想气体是指气体分子本身的体积和分子间的作用力都可以忽略不计的气体。并遵守下列关系:PV nRT
式中:P
气体压力,Pa;
n个摩尔气体体积,m2;
气体摩尔数;
气体常数,R=8.315J/mol·K;
气体温度,K。
真实气体非理想性的原因是:
空间位阻,分子不是质点;
(A1)
b.分子间的力(主要原因):分子,包括单原子分子,在一定温度下表现出一定的分子体积,它们相互之间具有一定的吸引力;
静电作用力:就极性分子而言;氢键;
量子效应。
状态方程式
人们已提出很多状态方程用于描述真实性气体性质,通常,愈接近它们的真实性质,状态方程则愈复杂。
可以按状态方程式中包含的常数数目将其分为:a.
2个常数:范德华、贝特洛、戴特雷西,RK状态方程式;b.4个常数:麦克劳德状态方程;5个常数:贝蒂-布里奇曼状态方程;c.
d.8个常数:BWR状态方程等。
A3对比状态原理
对各种气体相图的考察表明,它们的等温线形状极其相似,图A1和图A2分别给出了二氧化碳和乙烯的相图。对比状态原理就是基于这种相似性。例如,这两种气体的50℃等温线是不能直接比较的。为了进行这种比较,需利用对比参变量(对比压力P.,对比温度T.),其中涉及到临界点(临界压力P。;临界温度T.)参数。
GB/T 14070-93
当两种气体的对比温度和对比压力相同时,则它们处于对比状态。压力
+200℃
+100℃
+50℃
-+31℃
0.100.200.300.400.500.600.700.80摩尔体积,L
二氧化碳相图
P。= 7. 29 MPa
T. 31.1 ℃
+200℃
+100℃
+50℃
+30℃
-15℃
-30℃
0.10 0.20 0. 30 0. 40 0.50 0.60 0. 70 0.80摩尔体积,L
图A2乙烯相图
P。=5.05MPa
T。=10 ℃
例如,若1mol分子二氧化碳(气体A)所处的条件为P=9MPa,T=40℃,要求计算出处于对比状态的1 mol分子乙烯(气体B)温度和压力条件气体A
气体B
273+40
T=T,T.=1.02×(273+10)=288.66K(15.6℃)P=P ·P,=1. 23X5. 05=6. 212 MPa两种气体的对比状态是:
140℃
它们对理想气体的偏离相同。
A4压缩系数Z的定义
{6.212MPa
压缩系数Z,可用下列简单关系式定义(也称阿马格常数)。PV
理想气体的压缩系数Z=1。真实气体的压缩系数表示与理想状态的偏离程度,这就可以直接应用理想气体定律。
A5纯气压缩系数的确定
A5.1状态方程法
GB/T14070-93
人们已利用很多状态方程(见A2)来计算压缩系数Z。通常,不同作者之间给出的相对系统误差值小于10-2。附录C(补充件)中给出某些气体的压缩系数Z曲线。A5.2对比状态原理法
压缩系数是对比参数的函数:
Z = f(T, ·P.· Z.)
式中:Z.处于临界条件下的压缩系数。(A5)
兰德森、格林孔英和荷根发展了曼士纳和赛弗林安提出的关系式。附录D(补充件)兰德森表给出了Z。在0.23~0.29范围内的压缩系数Z值,该范围的Z。值可满足绝大部分配气的需要。A6理想气体定律
在等温条件下:
A6.1道尔顿定律
在给定容积下,混合气总压等于混合气中各组分的分压之和。设P。、Pb、P。为组分A、B、C的分压,则总压P等于:P P+ P+ P
A6.2阿马格定律
在给定压力下,混合气的总体积等于混合气中各组分分体积之和。设V.、Vb、V.是组分A、B、C的分体积,则混合气的总体积V是:V - v,+V+v.
附录B
以压力比衰示的浓度换算成摩尔浓度的方法(补充件)
·(A6)
·(A7)
浓度换算时,对于真实气体需要进行修正。由于包含有压缩系数乙的状态方程较简单,所以较为常用。然而,有两项预选择是必不可少的:纯气压缩系数的选择,见附录A(补充件);混合规则的选择。
对于混合规则的选择可以应用下面三种方法。注:附录所列不同混合规则也可用于微极性气体。对于极性气体,会产生很大误差,而且很难定量。B1道尔顿法
若P。、Pb、P。分别表示组分A、B、C充入后的压力读数,而当它们是理想气体时,其压力值为Pa、Ph、Pe,则:
近似可得
(Z.由P.值确定)
·(B1)
GB/T 14070—93
P’=P(Z、由 P - P.值确定)
P=Pr(Z。由 P。-P值确定)
用摩尔分数表示浓度的关系式如下:X
而混合气的压缩系数乙等于在各分压下Z值的加权平均值:z(X, + Xh + X) X.z.+ Xzh + Xz ·(B2)
对于制备低压校准气(P<0.3MPa),该法具有很高的准确度。在高压下,它仅用于那些压缩系数相差很大的组分。
B2阿马格法
采用和前面相同的符号,组分A、B、C的修正分压为:P-
摩尔分数也可用下式表示:
(Z.由P.+P,+P.值确定)
(Z由 P。+ Pb+ P。值确定)
P。 P
(Z由P.+P,+P。值确定)
对于制备低压校准气(P<0.5MPa),阿马格法修正的相对误差小于5%。实验证明在高压下,特别是在对比温度和对比压力(T,和Pt)高的情况下,比道尔顿法优越。B3假想临界常数法
这是一种直接应用对比状态原理的方法。把混合气看成纯流体,用混合规则可以得到它的假想临界常数。
最常用的混合规则是凯氏法。混合气的假想临界常数等于每个组分临界常数的加权平均值。220
GB/T14070—93
Tem =ZX,Te
P.m =ZX,P.i
Zem =ZX,Zei
(X是摩尔分数,作为近似值,它可用压力比浓度所代替)混合气对比参数:
·(B10)
..(B11)
·(B12)
.(B13)
++++++++-(B14)
利用兰德森表见附录D(补充件)可以确定混合气的压缩系数Z,可以用下式计算摩尔分数:X,
该法的局限性主要与利用凯氏规则有关。P,/z,
当0.2
附录C
一般气体的压缩系数Z曲线
(补充件)
在图C1~C4中,示出了某些一般气体的压缩系数之值随压力而变化的曲线。221
GB/T 14070—93
16.85℃[290 K]
16.85℃[290
图C1氧气、氮气压缩系数Z曲线
GB/T 14070—93
图C2情性气体压缩系数Z曲线
GB/T 14070—93
甲烷压缩系数Z曲线
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。