YY 0465-2003
基本信息
标准号: YY 0465-2003
中文名称:一次性使用空心纤维血浆分离器
标准类别:医药行业标准(YY)
英文名称: Disposable hollow fiber plasma separator
标准状态:现行
发布日期:2003-06-20
实施日期:2004-01-01
出版语种:简体中文
下载格式:.rar.pdf
下载大小:342044

标准分类号
标准ICS号:医药卫生技术>>医疗设备>>11.040.30外科器械和材料
中标分类号:医药、卫生、劳动保护>>医疗器械>>C45体外循环、人工脏器、假体装置
关联标准
采标情况:ISO 8637-1989 NEQ
出版信息
出版社:中国标准出版社
书号:155066.2-15290
页数:16
标准价格:13.0 元
出版日期:2004-04-22
相关单位信息
起草单位:全国医用体外循环设备标准化技术委员会
归口单位:全国医用体外循环设备标准化技术委员会
发布部门:国家食品药品监督局
标准简介
本标准规定了一次性使用空心纤维血浆分离器的术语和定义、要求、试验方法、检验规则、标志及包装、运输、贮存。本标准适用于一次性使用空心纤维血浆分离器,本产品配合血浆分离装置用来治疗各种免疫、代谢失调及某些中毒等危重病人进行治疗血浆置换。 YY 0465-2003 一次性使用空心纤维血浆分离器 YY0465-2003 标准下载解压密码:www.bzxz.net
标准图片预览




标准内容
YY0465—2003
本标准的尺寸、机械性能、渗透性能的试验方法参照ISO8637:1989《血液透析器、血液滤过器和血液浓缩器》的有关规定,化学性能参照GB8368-1998《次性使用输液器》的有关规定,生物学性能参照GB/T16886.1—2001《医疗器械生物学评价第1部分:评价与试验》中的有关规定。本标准的附录A、附录B、附录 C是规范性附录。本标准由国家食品药品监督管理局提出。本标准由全国医用体外循环设备标准化技术委员会归口。本标准由天津市泌尿外科研究所和天津泰达生物医学工程股份有限公司负责起草。本标主要起草人:顾汉卿、陆莱珠、宋惠飞、竺锡明、高增丽。1范围
一次性使用空心纤维而浆分离器YY0465—2003
本标准规定了一次性使用空心纤维血浆分离器的术语和定义、要求、试验方法、检验规则、标志及包装、运输、贮存。
本标准适用于一次性使用空心纤维血浆分离器(简称血浆分离器),本产品配合血浆分离装置用来治疗各种免疫、代谢失调及某些中毒等危重病人进行治疗性血浆置换。2 规范性引用文件
下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。GB/T191--2000包装储运图示标志GB/T2828一1987逐批检查计数抽样程序及抽样表(适用于连续批的检查)GB/T2829---2002周期检查计数抽样程序及抽样表(适用于生产过程稳定的检查)GB/T13074一1991血液净化术语、血液透析和血液滤过GB/T14233.1一1998医用输液、输血、注射器具检验方法第1部分:化学分析方法GB/T14233.2一1993医用输液、输血、注射器具检验方法第二部分:生物检验方法GB/T16886.1一2001医疗器械生物学评价第1部分:评价与试验GB18278—2000医疗保健产品灭菌确认和常规控制要求湿热灭菌GB18279—2000医疗器械环氧乙烷灭菌确认和常规控制GB18280—2000医疗保健产品灭菌确认和常规控制要求辐射灭菌ISO8637:1989血液透析器、血液滤过器和血液浓缩器3术语和定义
下列术语和定义适用于本标准。3.1
血浆分离 plasmaseparation
用来治疗各种免疫、代谢失调及某些中毒等危重病人进行治疗性血浆置换。3.2
筛选率filtering rate
超滤液中溶质浓度与血液中溶质浓度的比值。3.3
血浆分离装置
plasmaseparation system
由血液监护、体液平衡、血浆分离器等系统组成的装置。3.4
血浆分离器plasmaseparator
用高分子聚合物膜制成的用于分离血液中的大分子蛋白的器件。3.5
滤过率 filtration rate
YY0465--2003
在单位时间内血浆分离器能将血液中的某些物质滤出的量。3.6
transmembrane pressure
跨膜压
血浆分离器的半透膜两侧的液体静水压差。3.7
膜面积membrane area
血浆分离器内半透膜与血液接触的面积,以平方米为单位的计算。3.8
血室容量blood compartment volume在设定跨膜压时充满血浆分离器的血液容积。3.9
blood flow rate
血液流率
在单位时间内流经血浆分离器的血液量,以 mL / min 表示。3.10
模拟血液imitation blood
人工配置近似血液中所含毒素物质的液体。3.11
洗脱液 clearing fluid
以注射用水浸渍待测器件后的液体。4分类与命名
4.1型式
血浆分离器的型式为空心纤维型。4. 2血浆分离器的基本参数
4.2.1血浆分离器的有效膜面积
血浆分离器的有效膜面积不低于公称膜面积90%。4.2.2血浆分离器的血流率
血浆分离器的血流率应大于200 mL/min。4.2.3血浆分离器滤过液流率
血浆分离器滤过液流率应大于500mL/min。4.2.4血浆分离器的血室容量
血浆分离器的血室容量不大于 60 mL。4.3血浆分离器的基本尺寸
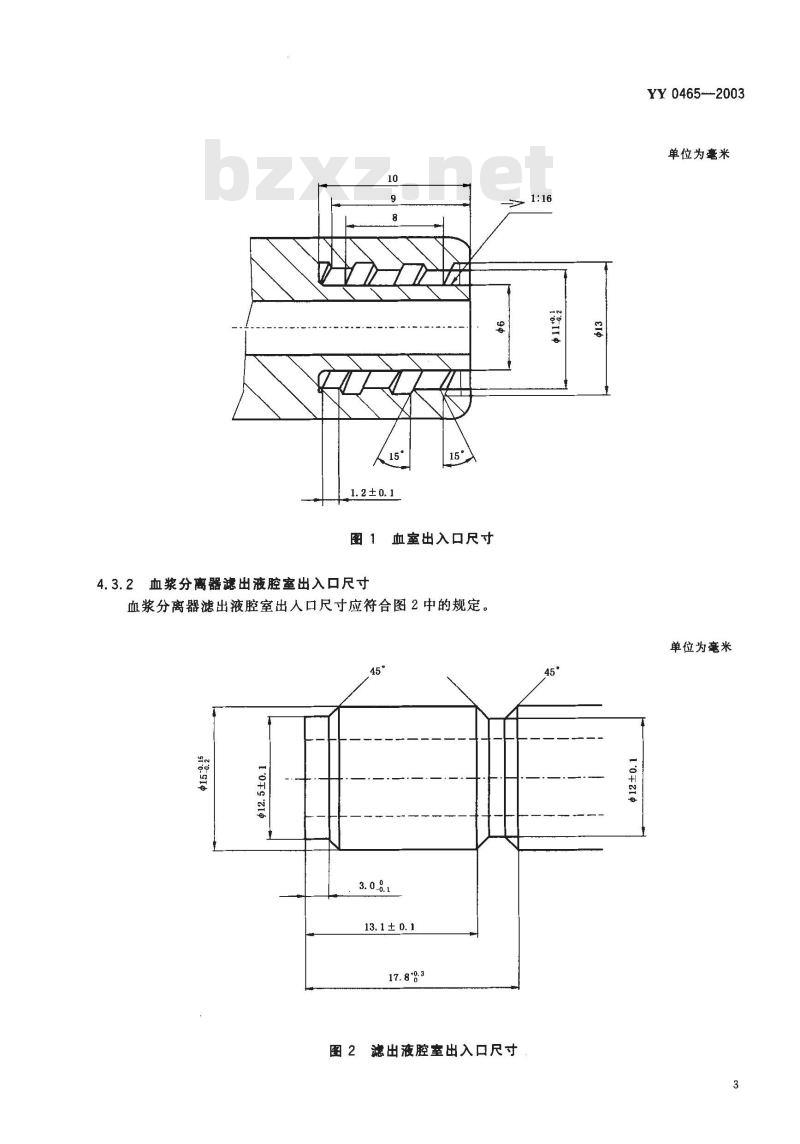
4.3.1血浆分离器血室出入口尺寸血浆分离器血室出人口尺寸应符合图1中的规定。2
1. 2 ± 0, 1
图1血室出入口尺寸
4.3.2血浆分离器滤出液腔室出入口尺寸血浆分离器滤出液腔室出人口尺寸应符合图2中的规定。45
13. 1± 0. 1
滤出液腔室出入口尺寸
YY0465-2003
单位为毫米
单位为毫米
YY 0465-—2003
4.4型号命名
5要求
5.1外观
膜公称面积,m2
系列代号
血浆分离器的外壳应透明,表面光洁,液体通道内不得有肉眼可见的杂质。5.2尺寸
血浆分离器的有效膜面积应符合4.2.1的规定。5.3血室容量
血室容量应符合4.2.4的规定。
5.4微粒
血浆分离器内腔应洁净,100mL洗脱液中15um~~25μm的微粒数不得超过200个,大于25μm的微粒数不得超过100个。
5.5血浆分离器的化学性能
5.5.1还原物质(易氧化物)
检验液和空白液消耗高锰酸钾溶液[c(KMnO.)=0.002mol/L]的体积之差应不超过2.0mL。5.5.2金属离子
5.5.2.1原子吸收分光光度计(AAS)或相当的方法进行测定时,检验液中钡、铬、铜、铅、锡的总含量应不超过1μg/ml。的含量应不超过0.1μg/mL。5.5.2.2比色分析方法:试验液呈现的颜色应不超过质量浓度p(Pb2+)1μg/mL标准对照液。5.5.3酸碱度
检验液与空白液pH值之差应不超1.5。5.5.4蒸发残渣
蒸发残渣的总量应不超过 2 mg。5.5.5紫外吸光度
检验液的吸光度应不大于0.1。
5.5.6环氧乙烷残留量
血浆分离器用环氧乙烷灭菌,环氧乙烷残留量应不大于15μg/g。5.6血浆分离器的生物性能
5.6.1生物学评价
血浆分离器应按GB/T16886.1一2001的规定要求进行生物学评价。5.6.2无菌
血浆分离器应无菌。
5.6.3无致热原
血浆分离器应无致热原。
5.7血浆分离器的密封性能
5.7. 1血浆分离器血室承受压力血浆分离器血室应能承受100 kPa的试验压力。5.7.2血浆分离器滤出腔室承受压力应承受正压100kPa,负压低于大气压93.3kPa的试验压力。4
5.8血浆分离器渗透性能
YY 0465—2003
血浆分离器当跨膜压9.3kPa,血流率150mL/min时,0.5m2膜面积的血浆分离器其渗透性能应符合以下要求:
5.8. 1血浆滤过率
血浆滤过率应大于 40 mL/min。5.8.2总蛋白筛选系数
总蛋白筛选系数≥0.8。
5. 9血浆分离器耐温性能
血浆分离器在0℃~50℃温度范围内不应有变形和破裂。6试验方法
6.1外观
目测,应符合5.1的规定。
6.2尺寸
血浆分离器的有效膜面积按式(1)计算:S= πDL · n× 10-6
式中:
S-—有效膜面积,单位为平方米(m);D-空心纤维内径,单位为毫米(mm);L一空心纤维有效长度,单位为毫米(mm),n—空心纤维根数。
6.3血室容量检验
血液侧、滤出液侧均充填经过脱气而不留气泡的充填液,置60min,先使滤出液侧处于密闭状态后,采用加压空气(约50kPa)将血液侧的水排出测量(需减去滤出液侧渗透到血液侧的量)。应符合5.3的规定。
6.4微粒
按附录A进行,应符合5.4的规定。6.5化学性能试验方法
6.5.1试液制备:取一灭菌后的产品和玻璃烧瓶连成一循环系统,用塞子封住滤出液出口,按公称纤维面积1m约用500mL生理盐水比例加人生理盐水并保持在37℃土1℃,通过动泵作用于一段尽可能短的用硅橡胶管上,使水以1L/h的流量循环2h。取50mL循环液稀释至1000mL备用。6.5.2还原物质(易氧化物)试验按GB/T14233.1一1998中5.2.2方法二规定进行,应符合5.5.1的要求。6.5.3金属离子试验
6.5.3.1原子吸收分光光度法为仲裁方法,检验液的吸光度应不大于0.1,应符合5.5.2.1的要求。6.5.3.2比色:按GB/T14233.1一1998中5.5.1方法一规定进行,应符合5.5.2.2的要求。6.5.3酸碱度
按GB/T14233.1—1998中5.4.1方法-规定进行,应符合5.5.3的要求。6.5.4蒸发残渣
按GB/T14233.1-1998规定进行,应符合5.5.4要求。6.5.5紫外吸光度
YY 0465—2003
按GB/T14233.1—1998中规定在250nm~320nm波长范围内进行,应符合5.5.5要求。6.5.6环氧乙烷残留量
按GB/T14233.1--1998第三篇的方法进行,应符合5.5.6要求。6.6生物性能试验方法
6.6.1生物学评价
企业产品注册时应按GB/T16886.1-2001的规定内容进行生物学性能的评价。若需要进行试验应进行:bZxz.net
6.6.1.1细胞毒性,按GB/T14233.2—1993中第7章的规定进行,应≤1级。6.6.1.2皮内刺激,按GB/T14233.2—1993中第8章的规定进行,应无刺激作用。6.6.1.3致敏试验,按GB/T14233.2—1993中第9章的规定进行,应无致物。6.6.1.4急性毒性试验,按GB/T14233.2--1993中第5章的规定进行,应无急性全身毒性反应。6.6.1.5血液相容性,溶血试验按GB/T14233.2一1993中第6章的规定进行,溶血率≤5%。6.6.2无菌试验
血浆分离器按GB/T18278--2000或GB/T18279—2000或GB/T18280-2000确认过的灭菌过程使其无菌。其后须对每一生产批的灭菌程序进行监控。6.6.3无热原试验
应对销售前的血浆分离器进行无热原程序确认。其后生产厂须定期进行热原试验,以保证器件无热原。
6.7密封性能试验
按ISO8637:1989中5.3机械性能试验方法进行,应符合5.7的规定。6.8渗透性能试验
6.8.1血浆滤过率试验
按附录B的方法进行,应符合5.8.1的规定。6.8.2总蛋白筛选系数试验
按附录C的方法进行,应符合5.8.2的规定。6.9耐温试验
将血浆分离器放人0℃冰箱中3min,然后放人50℃恒温箱中3h,取出后恢复至室温进行观察并做压力试验,应符合5.9的规定。
7检验规则
7.1出厂检验
7.1.1出厂检验为逐批检验。
7.1.2出厂检验以每月产量为检查批。7.1.3逐批检验应符合GB/T2828有关规定。7.1.4检查采用一次性抽样方案,其检查分类、检查项目、合格质量水平(AQI)和检查水平按表1规定。
7.2周期检验
7.2.1在下列情况下应进行周期检验:a)产品注册时;
在工艺配方或材料有重大变动可能影响产品质量时;c)
正常生产时每年的不少于一次;d)
停产半年以上恢复生产时;
国家质量监督部门提出要求时。e)[
检查分类
试验组
检查项目
检查水平
表 1 出厂检验抽样方案
全部合格
YY 0465--2003
周期检查采用一次抽样方案,其检查分类、不合格质量水平(RQL)和判别水平按表2规定。表2周期检验抽样方案
检查分类
检查项目
判别水平
检查周期
30(A,=0 R。=1)
每年一次
40(A.-0 R=1)
每半年一次
每半年次
7.2.3周期检查应在逐批检查合格后进行,周期检查不合格的处理按GB/T2829进行。7.2.4按GB/T16886.1—2001中3.7的要求进行生物学性能再评价。8
每只血浆分离器在外壳明显位置应有下列标志:8.1
制造厂名称、地址和商标;
产品名称和型号;
生产批号和日期;
灭菌方法和有效期;
有效面积;
最高使用压力;
一次性使用;
产品注册号。
8.2合格证上应有下列标志:
制造厂名称;
产品名称、型号;
检验员代码;
检验日期。
8.3外包装箱上应有下列标志:
制造厂名称、地址;
b)产品名称和型号;
数量;
YY0465—2003
毛重:
体积(长×宽×高),
生产批号和灭菌日期,
产品合格证和有效期;
产品注册号;
产品标准编号;
一次性使用字样;
k)“小心轻放”“切勿重压”“怕湿”等字样或标志,应符合GB/T191规定。包装、运输、贮存
9.1包装
9.1.1血浆分离器单包装
每只血浆分离器应用复合薄膜袋封装,密封后再装人包装盒,盒内应有使用说明书和检验合格证各份。
血浆分离器外包装
外包装采用瓦楞包装箱。
9.2运输
运输方式按订货合同规定,运输中应防止重压并避免碰撞和雨雪淋袭。9.3存
包装好的血浆分离器应贮存在相对湿度不超过80%,无腐蚀性气体,阴凉、干燥、通风良好、清洁的环境内。血浆分离器在符合贮存规定的条件下,灭菌有效期为2年。8
A.1原理
附录A
(规范性附录)
血浆分离器微粒含量测定方法
YY 0465--2003
这一方法是通过冲洗内腔液体通道表面,收集通道表面洗脱液中的粒子,并对其计数来评价污染。A.2试验仪器
仪器与装置如图A.1所示。
空气过滤器;
进气针;
氯化钠注射液;
-过滤装置;
三通开关;
聚氯乙烯软管;
被测血浆分离器;
微粒计数器;
9-取样杯。
图A.1微粒含量测定装置
YY0465—2003
A.2.1电阻式粒子计数器:有搅拌系统,一次取样量为100mL,可同时对15um~25μm和大于25μm的微粒计数。
A.2.2过滤装置:内装直径50mm,孔径0.45μm的微孔滤膜。A.2.3冲洗液:氯化钠注射液。
A.2.4聚氯乙烯软管:软管长1m,外径3.5mm~4mm。A.2.5三通转换开关。
A.3步骤
A.3.1过滤装置通过瓶塞穿刺器与装有氯化钠注射液的输液瓶子连接,过滤装置下端接三通转换开关,下接软管至微粒计数器取样杯A.3.2用100mL冲洗液冲洗过滤器、三通转换开关和软管。注:初次试验冲洗液应不少于2L。A.3.3在约1m静压头下,使冲洗液通过软管200mL,流出液流入计数器的取样杯中即得本底液,测定100mL本底液中微粒数。
注:试验应注意环境污染。
A.3.4重复A.3.3的步骤,以两次计数的平均值为100mL本底液中微粒含量。A.3.5使进气口密封,将血浆分离器的进液端与三通转换开关的另一接头连接。A.3.6在1m静压头下,使冲洗液通过血浆分离器200mL,流出液流人计数器4mL。用注射用水稀释至100mI.的取样杯中即得洗脱液,测定100mL洗脱液中的微粒数。A.4结果表示
洗脱液与本底液微粒读数之差为洗脱液中的微粒含量。10
B.1目的
附录B
(规范性附录)
血浆分离器渗透性能的测定
通过测定了解而液的血浆分离值和蛋白筛选率。B.2设备与仪器
B.2.1滚珠血泵。
B.2.2 500 mL 量筒。
B.2.3负压泵。
B.2.41000mL盛液筒。
B.2.5血液回路导管。
B.3试剂
新鲜猪血500mL加2%草酸钾制备成新鲜抗凝猪血。B.4操作步骤
YY0465-2003
B.4.1将血液回路导管进血出血口接人血浆分离器进血出血口,动静脉管插人盛有抗凝猪血容器中。B.4.2将血液回路导管、泵管接入血泵滚珠泵头。B.4.3将血浆分离器出液口上端有塞子塞住,下端接人负压泵,中间接有盛液瓶。B.4.4将血泵启动,血流量为150mL/min,负压泵启动,跨膜压9.3kPa,运转3min停止工作。B.4.5把滤出液体清理到盛液瓶,有量简计量。B.5结果表示
计量超过 120 mL血浆渗透性能为合格。11
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
本标准的尺寸、机械性能、渗透性能的试验方法参照ISO8637:1989《血液透析器、血液滤过器和血液浓缩器》的有关规定,化学性能参照GB8368-1998《次性使用输液器》的有关规定,生物学性能参照GB/T16886.1—2001《医疗器械生物学评价第1部分:评价与试验》中的有关规定。本标准的附录A、附录B、附录 C是规范性附录。本标准由国家食品药品监督管理局提出。本标准由全国医用体外循环设备标准化技术委员会归口。本标准由天津市泌尿外科研究所和天津泰达生物医学工程股份有限公司负责起草。本标主要起草人:顾汉卿、陆莱珠、宋惠飞、竺锡明、高增丽。1范围
一次性使用空心纤维而浆分离器YY0465—2003
本标准规定了一次性使用空心纤维血浆分离器的术语和定义、要求、试验方法、检验规则、标志及包装、运输、贮存。
本标准适用于一次性使用空心纤维血浆分离器(简称血浆分离器),本产品配合血浆分离装置用来治疗各种免疫、代谢失调及某些中毒等危重病人进行治疗性血浆置换。2 规范性引用文件
下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。GB/T191--2000包装储运图示标志GB/T2828一1987逐批检查计数抽样程序及抽样表(适用于连续批的检查)GB/T2829---2002周期检查计数抽样程序及抽样表(适用于生产过程稳定的检查)GB/T13074一1991血液净化术语、血液透析和血液滤过GB/T14233.1一1998医用输液、输血、注射器具检验方法第1部分:化学分析方法GB/T14233.2一1993医用输液、输血、注射器具检验方法第二部分:生物检验方法GB/T16886.1一2001医疗器械生物学评价第1部分:评价与试验GB18278—2000医疗保健产品灭菌确认和常规控制要求湿热灭菌GB18279—2000医疗器械环氧乙烷灭菌确认和常规控制GB18280—2000医疗保健产品灭菌确认和常规控制要求辐射灭菌ISO8637:1989血液透析器、血液滤过器和血液浓缩器3术语和定义
下列术语和定义适用于本标准。3.1
血浆分离 plasmaseparation
用来治疗各种免疫、代谢失调及某些中毒等危重病人进行治疗性血浆置换。3.2
筛选率filtering rate
超滤液中溶质浓度与血液中溶质浓度的比值。3.3
血浆分离装置
plasmaseparation system
由血液监护、体液平衡、血浆分离器等系统组成的装置。3.4
血浆分离器plasmaseparator
用高分子聚合物膜制成的用于分离血液中的大分子蛋白的器件。3.5
滤过率 filtration rate
YY0465--2003
在单位时间内血浆分离器能将血液中的某些物质滤出的量。3.6
transmembrane pressure
跨膜压
血浆分离器的半透膜两侧的液体静水压差。3.7
膜面积membrane area
血浆分离器内半透膜与血液接触的面积,以平方米为单位的计算。3.8
血室容量blood compartment volume在设定跨膜压时充满血浆分离器的血液容积。3.9
blood flow rate
血液流率
在单位时间内流经血浆分离器的血液量,以 mL / min 表示。3.10
模拟血液imitation blood
人工配置近似血液中所含毒素物质的液体。3.11
洗脱液 clearing fluid
以注射用水浸渍待测器件后的液体。4分类与命名
4.1型式
血浆分离器的型式为空心纤维型。4. 2血浆分离器的基本参数
4.2.1血浆分离器的有效膜面积
血浆分离器的有效膜面积不低于公称膜面积90%。4.2.2血浆分离器的血流率
血浆分离器的血流率应大于200 mL/min。4.2.3血浆分离器滤过液流率
血浆分离器滤过液流率应大于500mL/min。4.2.4血浆分离器的血室容量
血浆分离器的血室容量不大于 60 mL。4.3血浆分离器的基本尺寸
4.3.1血浆分离器血室出入口尺寸血浆分离器血室出人口尺寸应符合图1中的规定。2
1. 2 ± 0, 1
图1血室出入口尺寸
4.3.2血浆分离器滤出液腔室出入口尺寸血浆分离器滤出液腔室出人口尺寸应符合图2中的规定。45
13. 1± 0. 1
滤出液腔室出入口尺寸
YY0465-2003
单位为毫米
单位为毫米
YY 0465-—2003
4.4型号命名
5要求
5.1外观
膜公称面积,m2
系列代号
血浆分离器的外壳应透明,表面光洁,液体通道内不得有肉眼可见的杂质。5.2尺寸
血浆分离器的有效膜面积应符合4.2.1的规定。5.3血室容量
血室容量应符合4.2.4的规定。
5.4微粒
血浆分离器内腔应洁净,100mL洗脱液中15um~~25μm的微粒数不得超过200个,大于25μm的微粒数不得超过100个。
5.5血浆分离器的化学性能
5.5.1还原物质(易氧化物)
检验液和空白液消耗高锰酸钾溶液[c(KMnO.)=0.002mol/L]的体积之差应不超过2.0mL。5.5.2金属离子
5.5.2.1原子吸收分光光度计(AAS)或相当的方法进行测定时,检验液中钡、铬、铜、铅、锡的总含量应不超过1μg/ml。的含量应不超过0.1μg/mL。5.5.2.2比色分析方法:试验液呈现的颜色应不超过质量浓度p(Pb2+)1μg/mL标准对照液。5.5.3酸碱度
检验液与空白液pH值之差应不超1.5。5.5.4蒸发残渣
蒸发残渣的总量应不超过 2 mg。5.5.5紫外吸光度
检验液的吸光度应不大于0.1。
5.5.6环氧乙烷残留量
血浆分离器用环氧乙烷灭菌,环氧乙烷残留量应不大于15μg/g。5.6血浆分离器的生物性能
5.6.1生物学评价
血浆分离器应按GB/T16886.1一2001的规定要求进行生物学评价。5.6.2无菌
血浆分离器应无菌。
5.6.3无致热原
血浆分离器应无致热原。
5.7血浆分离器的密封性能
5.7. 1血浆分离器血室承受压力血浆分离器血室应能承受100 kPa的试验压力。5.7.2血浆分离器滤出腔室承受压力应承受正压100kPa,负压低于大气压93.3kPa的试验压力。4
5.8血浆分离器渗透性能
YY 0465—2003
血浆分离器当跨膜压9.3kPa,血流率150mL/min时,0.5m2膜面积的血浆分离器其渗透性能应符合以下要求:
5.8. 1血浆滤过率
血浆滤过率应大于 40 mL/min。5.8.2总蛋白筛选系数
总蛋白筛选系数≥0.8。
5. 9血浆分离器耐温性能
血浆分离器在0℃~50℃温度范围内不应有变形和破裂。6试验方法
6.1外观
目测,应符合5.1的规定。
6.2尺寸
血浆分离器的有效膜面积按式(1)计算:S= πDL · n× 10-6
式中:
S-—有效膜面积,单位为平方米(m);D-空心纤维内径,单位为毫米(mm);L一空心纤维有效长度,单位为毫米(mm),n—空心纤维根数。
6.3血室容量检验
血液侧、滤出液侧均充填经过脱气而不留气泡的充填液,置60min,先使滤出液侧处于密闭状态后,采用加压空气(约50kPa)将血液侧的水排出测量(需减去滤出液侧渗透到血液侧的量)。应符合5.3的规定。
6.4微粒
按附录A进行,应符合5.4的规定。6.5化学性能试验方法
6.5.1试液制备:取一灭菌后的产品和玻璃烧瓶连成一循环系统,用塞子封住滤出液出口,按公称纤维面积1m约用500mL生理盐水比例加人生理盐水并保持在37℃土1℃,通过动泵作用于一段尽可能短的用硅橡胶管上,使水以1L/h的流量循环2h。取50mL循环液稀释至1000mL备用。6.5.2还原物质(易氧化物)试验按GB/T14233.1一1998中5.2.2方法二规定进行,应符合5.5.1的要求。6.5.3金属离子试验
6.5.3.1原子吸收分光光度法为仲裁方法,检验液的吸光度应不大于0.1,应符合5.5.2.1的要求。6.5.3.2比色:按GB/T14233.1一1998中5.5.1方法一规定进行,应符合5.5.2.2的要求。6.5.3酸碱度
按GB/T14233.1—1998中5.4.1方法-规定进行,应符合5.5.3的要求。6.5.4蒸发残渣
按GB/T14233.1-1998规定进行,应符合5.5.4要求。6.5.5紫外吸光度
YY 0465—2003
按GB/T14233.1—1998中规定在250nm~320nm波长范围内进行,应符合5.5.5要求。6.5.6环氧乙烷残留量
按GB/T14233.1--1998第三篇的方法进行,应符合5.5.6要求。6.6生物性能试验方法
6.6.1生物学评价
企业产品注册时应按GB/T16886.1-2001的规定内容进行生物学性能的评价。若需要进行试验应进行:bZxz.net
6.6.1.1细胞毒性,按GB/T14233.2—1993中第7章的规定进行,应≤1级。6.6.1.2皮内刺激,按GB/T14233.2—1993中第8章的规定进行,应无刺激作用。6.6.1.3致敏试验,按GB/T14233.2—1993中第9章的规定进行,应无致物。6.6.1.4急性毒性试验,按GB/T14233.2--1993中第5章的规定进行,应无急性全身毒性反应。6.6.1.5血液相容性,溶血试验按GB/T14233.2一1993中第6章的规定进行,溶血率≤5%。6.6.2无菌试验
血浆分离器按GB/T18278--2000或GB/T18279—2000或GB/T18280-2000确认过的灭菌过程使其无菌。其后须对每一生产批的灭菌程序进行监控。6.6.3无热原试验
应对销售前的血浆分离器进行无热原程序确认。其后生产厂须定期进行热原试验,以保证器件无热原。
6.7密封性能试验
按ISO8637:1989中5.3机械性能试验方法进行,应符合5.7的规定。6.8渗透性能试验
6.8.1血浆滤过率试验
按附录B的方法进行,应符合5.8.1的规定。6.8.2总蛋白筛选系数试验
按附录C的方法进行,应符合5.8.2的规定。6.9耐温试验
将血浆分离器放人0℃冰箱中3min,然后放人50℃恒温箱中3h,取出后恢复至室温进行观察并做压力试验,应符合5.9的规定。
7检验规则
7.1出厂检验
7.1.1出厂检验为逐批检验。
7.1.2出厂检验以每月产量为检查批。7.1.3逐批检验应符合GB/T2828有关规定。7.1.4检查采用一次性抽样方案,其检查分类、检查项目、合格质量水平(AQI)和检查水平按表1规定。
7.2周期检验
7.2.1在下列情况下应进行周期检验:a)产品注册时;
在工艺配方或材料有重大变动可能影响产品质量时;c)
正常生产时每年的不少于一次;d)
停产半年以上恢复生产时;
国家质量监督部门提出要求时。e)[
检查分类
试验组
检查项目
检查水平
表 1 出厂检验抽样方案
全部合格
YY 0465--2003
周期检查采用一次抽样方案,其检查分类、不合格质量水平(RQL)和判别水平按表2规定。表2周期检验抽样方案
检查分类
检查项目
判别水平
检查周期
30(A,=0 R。=1)
每年一次
40(A.-0 R=1)
每半年一次
每半年次
7.2.3周期检查应在逐批检查合格后进行,周期检查不合格的处理按GB/T2829进行。7.2.4按GB/T16886.1—2001中3.7的要求进行生物学性能再评价。8
每只血浆分离器在外壳明显位置应有下列标志:8.1
制造厂名称、地址和商标;
产品名称和型号;
生产批号和日期;
灭菌方法和有效期;
有效面积;
最高使用压力;
一次性使用;
产品注册号。
8.2合格证上应有下列标志:
制造厂名称;
产品名称、型号;
检验员代码;
检验日期。
8.3外包装箱上应有下列标志:
制造厂名称、地址;
b)产品名称和型号;
数量;
YY0465—2003
毛重:
体积(长×宽×高),
生产批号和灭菌日期,
产品合格证和有效期;
产品注册号;
产品标准编号;
一次性使用字样;
k)“小心轻放”“切勿重压”“怕湿”等字样或标志,应符合GB/T191规定。包装、运输、贮存
9.1包装
9.1.1血浆分离器单包装
每只血浆分离器应用复合薄膜袋封装,密封后再装人包装盒,盒内应有使用说明书和检验合格证各份。
血浆分离器外包装
外包装采用瓦楞包装箱。
9.2运输
运输方式按订货合同规定,运输中应防止重压并避免碰撞和雨雪淋袭。9.3存
包装好的血浆分离器应贮存在相对湿度不超过80%,无腐蚀性气体,阴凉、干燥、通风良好、清洁的环境内。血浆分离器在符合贮存规定的条件下,灭菌有效期为2年。8
A.1原理
附录A
(规范性附录)
血浆分离器微粒含量测定方法
YY 0465--2003
这一方法是通过冲洗内腔液体通道表面,收集通道表面洗脱液中的粒子,并对其计数来评价污染。A.2试验仪器
仪器与装置如图A.1所示。
空气过滤器;
进气针;
氯化钠注射液;
-过滤装置;
三通开关;
聚氯乙烯软管;
被测血浆分离器;
微粒计数器;
9-取样杯。
图A.1微粒含量测定装置
YY0465—2003
A.2.1电阻式粒子计数器:有搅拌系统,一次取样量为100mL,可同时对15um~25μm和大于25μm的微粒计数。
A.2.2过滤装置:内装直径50mm,孔径0.45μm的微孔滤膜。A.2.3冲洗液:氯化钠注射液。
A.2.4聚氯乙烯软管:软管长1m,外径3.5mm~4mm。A.2.5三通转换开关。
A.3步骤
A.3.1过滤装置通过瓶塞穿刺器与装有氯化钠注射液的输液瓶子连接,过滤装置下端接三通转换开关,下接软管至微粒计数器取样杯A.3.2用100mL冲洗液冲洗过滤器、三通转换开关和软管。注:初次试验冲洗液应不少于2L。A.3.3在约1m静压头下,使冲洗液通过软管200mL,流出液流入计数器的取样杯中即得本底液,测定100mL本底液中微粒数。
注:试验应注意环境污染。
A.3.4重复A.3.3的步骤,以两次计数的平均值为100mL本底液中微粒含量。A.3.5使进气口密封,将血浆分离器的进液端与三通转换开关的另一接头连接。A.3.6在1m静压头下,使冲洗液通过血浆分离器200mL,流出液流人计数器4mL。用注射用水稀释至100mI.的取样杯中即得洗脱液,测定100mL洗脱液中的微粒数。A.4结果表示
洗脱液与本底液微粒读数之差为洗脱液中的微粒含量。10
B.1目的
附录B
(规范性附录)
血浆分离器渗透性能的测定
通过测定了解而液的血浆分离值和蛋白筛选率。B.2设备与仪器
B.2.1滚珠血泵。
B.2.2 500 mL 量筒。
B.2.3负压泵。
B.2.41000mL盛液筒。
B.2.5血液回路导管。
B.3试剂
新鲜猪血500mL加2%草酸钾制备成新鲜抗凝猪血。B.4操作步骤
YY0465-2003
B.4.1将血液回路导管进血出血口接人血浆分离器进血出血口,动静脉管插人盛有抗凝猪血容器中。B.4.2将血液回路导管、泵管接入血泵滚珠泵头。B.4.3将血浆分离器出液口上端有塞子塞住,下端接人负压泵,中间接有盛液瓶。B.4.4将血泵启动,血流量为150mL/min,负压泵启动,跨膜压9.3kPa,运转3min停止工作。B.4.5把滤出液体清理到盛液瓶,有量简计量。B.5结果表示
计量超过 120 mL血浆渗透性能为合格。11
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。