YY/T 0105-2020
基本信息
标准号: YY/T 0105-2020
中文名称:替YY 0105-1993 皮内针
标准类别:医药行业标准(YY)
标准状态:现行
出版语种:简体中文
下载格式:.zip .pdf
下载大小:11926545
相关标签: 1993

标准分类号
关联标准
出版信息
相关单位信息
标准简介
YY/T 0105-2020代替YY 0105-1993.Intradermal needles.
1范围
YY/T 0105规定了皮内针的结构.分类和规格、要求、试验方法、包装、标志、运输和贮存。
YY/T 0105适用于供中医皮内针疗法使用的皮内针。
YY/T 0105适用于针体材料符合GB/T4240--2019中规定的06Cr19Ni10或其他奥氏体不锈钢的皮内针。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 191包装储运图示标志
GB 2024- 2016针灸针
GB/T 4240- -2019 不锈 钢丝
GB/T 4340.1金属材料维氏硬度试验 第 1部分:试验方法
GB/T 14233.2- -2005医用输液 、输血.注射器具检验方法第 2部分:生物学试验方法
GB/T 16886.1- -2011医疗 器械生物学评价第1部分:风险管理过程中的评价与试验
YY/T 0149- -2006不锈钢医 用器械耐 腐蚀性能试验方法
YY/T 0466.1医疗器械 用于医疗 器械标签、标记和提供信息的符号第1部分:通用要求
3术语和定义
3.1
皮内针intradermal needles皮下埋入式小型针刺工具。
注:皮内针具有两种类型:- -种为颗粒型皮内针,另-种为揿钉型皮内针(掀针)。
3.2
颗粒型皮内针intradermal granule type needle可倾斜或水平地插人皮下组织的皮内针,通常会穿过人体的不同部位。
3.3
揿钉型皮内针intradermal thumbtack type needle类似于图钉状的皮内针。
1范围
YY/T 0105规定了皮内针的结构.分类和规格、要求、试验方法、包装、标志、运输和贮存。
YY/T 0105适用于供中医皮内针疗法使用的皮内针。
YY/T 0105适用于针体材料符合GB/T4240--2019中规定的06Cr19Ni10或其他奥氏体不锈钢的皮内针。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 191包装储运图示标志
GB 2024- 2016针灸针
GB/T 4240- -2019 不锈 钢丝
GB/T 4340.1金属材料维氏硬度试验 第 1部分:试验方法
GB/T 14233.2- -2005医用输液 、输血.注射器具检验方法第 2部分:生物学试验方法
GB/T 16886.1- -2011医疗 器械生物学评价第1部分:风险管理过程中的评价与试验
YY/T 0149- -2006不锈钢医 用器械耐 腐蚀性能试验方法
YY/T 0466.1医疗器械 用于医疗 器械标签、标记和提供信息的符号第1部分:通用要求
3术语和定义
3.1
皮内针intradermal needles皮下埋入式小型针刺工具。
注:皮内针具有两种类型:- -种为颗粒型皮内针,另-种为揿钉型皮内针(掀针)。
3.2
颗粒型皮内针intradermal granule type needle可倾斜或水平地插人皮下组织的皮内针,通常会穿过人体的不同部位。
3.3
揿钉型皮内针intradermal thumbtack type needle类似于图钉状的皮内针。
标准图片预览




标准内容
ICS11.040.60
中华人民共和国医药行业标准
YY/T0105—2020
代替YY0105-1993
皮内针
Intradermalneedles
2020-09-27发布
国家药品监督管理局
2021-09-01实施
规范性引用文件
术语和定义
结构、分类和规格·
试验方法
运输和贮存
附录A(资料性附录)
材料的指南
附录B(规范性附录)
针体与针柄的牢固度
参考文献
KaeerkAca-
YY/T0105—2020
本标准按照GB/T1.1—2009给出的规则起草。YY/T0105—2020
本标准代替YY0105一1993《撤针》,并修改名称为皮内针》,与YY0105一1993相比,除编辑性修改外主要技术变化如下:
修改了适用范围(见第1章,1993年版的第1章);修改了规范性引用文件的内容(见第2章,1993年版的第2章);增加了术语和定义的内容(见第3章,1993年版的第3章);增加了颗粒型皮内针的型式。(见3.2);修改了皮内针尺寸的要求(见5.1,1993年版的4.2);修改了针尖强度和锋利度的要求和试验方法(见5.2、6.3,1993年版的4.4、5.4.1);修改了针体硬度的要求和试验方法(见5.3、6.4.1993年版的4.5,5.4.2);增加了针体与针柄的牢固度的要求和试验方法(见5.6,6.7);增加了无菌的要求和试验方法(见5.7、6.8);增加了对生物相容性的要求和试验方法(见5.8、6.9);修改了外观的要求(见5.9,1993年版的4.4、4.6.4.8);修改了包装、标志及贮存的要求(见第7、8章,1993年版的第7章):删除了皮内针制造材料的要求(1993年版的4.3);删除了检验规则的内容(1993年版的第6章)。请注意本文件的某些内容可能涉及专利。本文件的发布机构不承担识别这些专利的责任。本标准由国家药品监督管理局提出。本标准由全国医用电器标准化技术委员会物理治疗设备分技术委员会(SAC/TC10/SC4)归口。本标准起草单位:天津市医疗器械质量监督检验中心、苏州医疗用品厂有限公司。本标准主要起草人:杨国涓、张路、高向辉、张龙飞、陈成、徐爱民。本标准所代替标准的历次版本发布情况为:YY0105—1993。
-rKaeerkca-
1范围
YY/T0105—2020
本标准规定了皮内针的结构、分类和规格、要求、试验方法、包装、标志、运输和贮存。本标准适用于供中医皮内针疗法使用的皮内针。本标准适用于针体材料符合GB/T42402019中规定的06Cr19Ni10或其他奥氏体不锈钢的皮内针。
规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。GB/T191包装储运图示标志
GB2024—2016针灸针
GB/T4240-—2019不锈钢丝
GB/T4340.1金属材料维氏硬度试验第1部分:试验方法GB/T14233.2—2005医用输液、输血、注射器具检验方法第2部分:生物学试验方法GB/T16886.1-2011医疗器械生物学评价第1部分:风险管理过程中的评价与试验YY/T01492006不锈钢医用器械耐腐蚀性能试验方法YY/T0466.1
3术语和定义
医疗器械用于医疗器械标签、标记和提供信息的符号第1部分:通用要求皮内针intradermalneedles
皮下理人式小型针刺工具。
注:皮内针具有两种类型:一种为颗粒型皮内针,另一种为撤钉型皮内针(掀针)。3.2
颗粒型皮内针intradermalgranuletypeneedle可倾斜或水平地插人皮下组织的皮内针,通常会穿过人体的不同部位。3.3
intradermalthumbtacktypeneedle撤钉型皮内针
类似于图钉状的皮内针。
bodyoftheneedle
皮内针插入身体的部分。
handle of the needle
皮内针不插人身体的部分。
-rKaeerkAca-
YY/T0105—2020
tipof theneedle
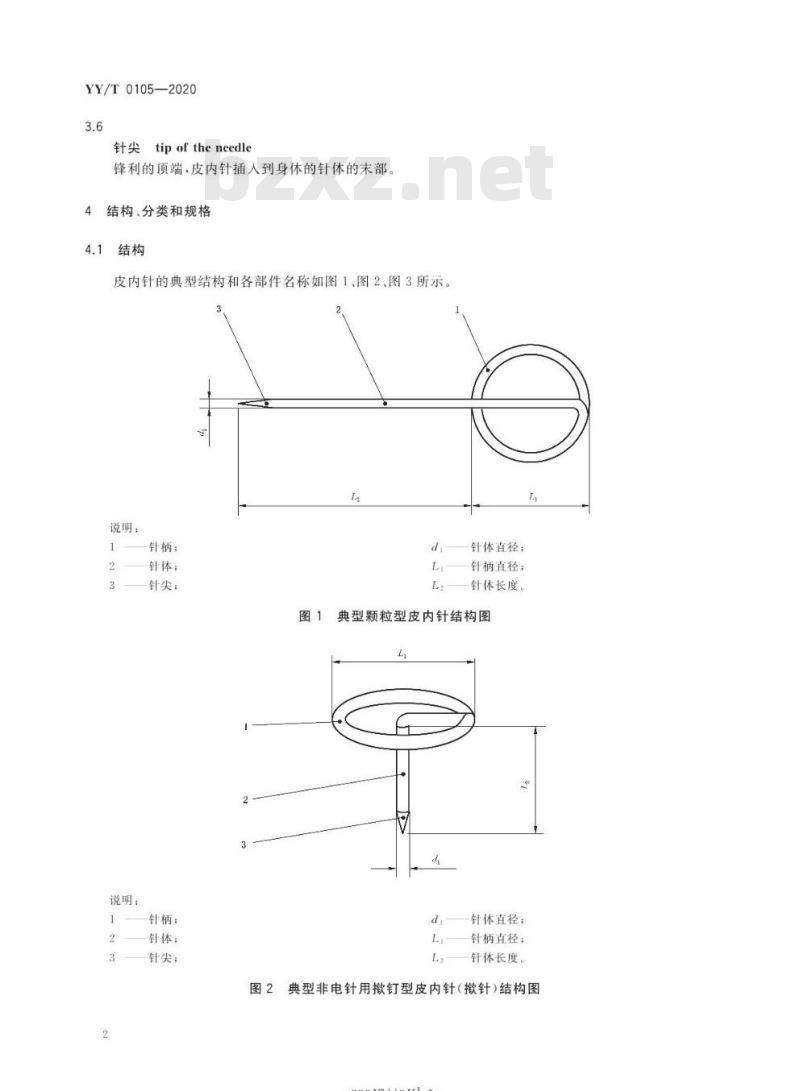
锋利的顶端,皮内针插人到身体的针体的末部。4结构、分类和规格
皮内针的典型结构和各部件名称如图1、图2、图3所示。说明:
针柄:
说明:
针体;
针尖:
针柄;
针体:
针尖:下载标准就来标准下载网
针体直径:
针柄直径:
针体长度。
典型颗粒型皮内针结构图
针体直径:
针柄直径:
针体长度。
典型非电针用钉型皮内针(针)结构图图2
-rrKaeerkca-
说明:
针柄;
针体;
针尖;
尾部;
针体直径;
针柄直径;
针体长度:
尾部长度。
图3典型电针用钉型皮内针(撤针)结构图按照是否无菌划分,皮内针可分为无菌和非无菌两种。YY/T0105—2020
按照使用方式划分,钉型皮内针(掀针)又可分为非电针用掀针和电针用掀针两种。按照针尖与针柄的结合方式划分,皮内针可分为一体成型式和非一体成型式两种。4.3
规格和材料
皮内针的规格以针体直径×针体长度表示。示例:@0.25×2mm。
用于制造皮内针的材料参见附录A。5要求
5.1尺寸
典型颗粒型皮内针的基本尺寸与允差,应符合表1的规定5.1.1
-rrKaeerkca-
YY/T0105—2020
针体直径d
针体长度L?
针柄直径L
典型颗粒型皮内针的尺寸
5≤10
如皮内针尺寸不在表1范围内·由制造商规定相关尺寸与允差,5.1.2
典型钉型皮内针(针)的基本尺寸与允差,应符合表2的规定。典型撤钉型皮内针(撤针)的尺寸表2
针体直径di
针体长度L
尾部长度
针柄直径
非电针用针
电针用撤针
电针用针
15≤30
如皮内针尺寸不在表2范围内,由制造商规定相关尺寸与允差针尖强度和锋利度
单位为毫米
单位为毫米
针尖经施加表3中规定的力与钢块接触顶压后,其穿刺力应不大于表3的规定。表3
标称针体直径d
0.10d0.12
0.120.250.35针体硬度
针体的硬度应符合表4的规定。
顶压力和穿刺力
顶压力
-KaeerKca-
穿刺力
标称针体直径d./mm
0.10≤d<0.25
0.25d<0.30
0.30≤d≤0.40
表面粗糙度
表4硬度
针体和针尖的表面粗糙度参数Ra的最大值应为0.4um。耐腐蚀性
皮内针应具有良好的耐腐蚀性能。针体与针柄的牢固度
硬度HV2
≥480.且≤680
≥460.且≤650
≥450.且≤650
YY/T 0105—2020
非一体成型式皮内针的针体与针柄的连接应牢固。当施加表5中规定的静态拉力于针体中心轴方向时,针体与针柄不脱离。
针体长度Lz/mm
2.5≤L<5
5≤L≤30
5.7无菌
牢固度测试用力
拉力/N
无菌皮内针应经一个已确认过的灭菌过程进行灭菌,使产品保证无菌。注:适宜的灭菌方法可参考文献GB18278.1、GB18279和GB18280中规定的医疗器械灭菌过程的确认和常规控制的要求。
生物相容性
预期与患者皮肤接触的部分,应按GB16886.1一2011中附录A给出的指南和原则进行评估并形成文件。
5.9外观
5.9.1针尖应锋利、圆正不偏、无毛刺、弯钩等缺陷。5.9.2针体表面不应有伤痕,曲痕和麻点。5.9.3一体成型式皮内针的针柄,螺旋圈应圆正,排列紧密,不得有明显离距。非一体成型式皮内针的针体与连接的针柄的平面应垂直。掀钉型皮内针(掀针)的针体与连接的针柄圆形的平面应垂直。颗粒型皮内针的针体与连接的针柄平面应平行,不得有明显偏斜。5
-rrKaeerkca-
YY/T0105—2020
6试验方法
6.1总则
除无菌和生物相容性试验外,其他项日取不少于3件样品进行测试6.2尺寸
使用通用量具或专用量具测量,应符合5.1的规定。6.3
针尖强度和锋利度
按GB2024一2016中5.3.2的方法进行,应符合5.2的规定。注:针体与针柄在同一截面的典型颗粒型皮内针,如针体长度<5mm可使用原材料针坏(夹持露出部分不大于标称针体长度)进行试验;针体与针柄不在同一截面的皮内针(掀针),如针体长度<7mm可用原材料针坏(夹持露出部分不大于标称针体长度)进行试验6.4针体硬度
按GB/T4340.1的方法进行试验,应符合5.3的要求。注:针体长度<25mm可使用原材料针坏进行试验。5表面粗糙度
用10倍放大镜与标准表面粗糙度样块进行比较,应符合5.4的规定6耐腐蚀性
按YY/T0149—2006中第7章柠檬酸溶液试验法的方法进行,检查试件表面的腐蚀痕迹,其腐蚀程度应为无任何锈蚀现象(a级),符合5.5的要求。6.7针体与针柄的牢固度
针体长度L2≥2.5mm时,按照附录B的方法或等效的方法进行试验,结果应符合5.6的要求。针体长度L,<2.5mm时,将皮内针全部针体的长度插入仿真皮肤模型,然后拔出,重复10次后,检查针体与针柄的连接应牢固。
推荐使用的仿真皮肤模型应满足下列要求:a)材料:加成型硅橡胶:
厚度:>2.5mm;
硬度:A10±5。
3无菌
按GB/T14233.22005中第3章无菌试验规定的无菌试验方法进行,应符合5.7的要求。注:该方法不宜用于出厂检验。6.9
生物相容性
通过检查制造商提供的资料或按GB/T16886.1—2011规定的方法进行验证来检验是否符合5.8的要求。
-rKaeerkca-
6.10外观
目视检查,应符合5.9的要求。
7包装
7.1初包装
皮内针应有初包装。
YY/T0105-2020
一次性使用无菌皮内针的初包装内不应有肉眼可见异物。包装的材料不得对内装物产生有害7.1.2
影响,此包装的材料和设计应确保:在干燥、清洁和充分通风的贮存条件下,能保证内装物在有效期内保持无菌性;a)
b)在从包装中取出时,内装物受污染的风险最小;在正常的搬动、运输和存期间,对内装物有充分的保护;c
d)一且打开,包装不能轻易地重新密封,而且应有明显的被打开的痕迹。注:GB/T19633提供了最终灭菌医疗器械包装材料和系统的要求,制造商在无菌皮内针的包装设计、评估确认时可考虑此标准的内容。
2中包装
一件或一件以上的初包装,应装人一件中包装中,中包装为最小销售单元。在正常搬运、运输和贮存期间,中包装对内装物应能充分的保护。7.3外包装
一件或一件以上的中包装,应装人一外包装中。在正常搬运、运输和贮存期间,外包装应能充分保护内装物。标志
包装标志
包装上的标签标记和提供信息的符号应符合YY/T0466.1的规定。单支包装或单元包装的初包装
初包装或单元包装上至少应有下列标志:a)
生产企业名称和或商标;
产品名称;
规格;
数量(适用于单元包装);
生产日期或生产批号;
使用期限或失效日期。
无菌皮内针初包装上还应有下列标志:灭菌方式、“无菌”等字样和/或符号;a)
b)“一次性使用”的字样和/或符号(如适用)。7
-rKaeerkca-
YY/T0105—2020
3中包装
中包装内应附有说明书、质量合格标识或产品合格证。中包装上至少应有下列标志:a)
生产企业名称、地址和或商标;b)
产品名称;
型式、规格和数量;
生产日期或生产批号;
使用期限或失效日期。
8.3.2无菌皮内针中包装上还须增加下列标志:a)
灭菌方式、“无菌”等样和/或符号:“一次性使用”的字样和/或符号:(如适用)b)
“包装破损禁止使用”及“用后销毁”等在使用前检查初包装完整性的警示字样,除非该警示说明已在初包装中给出。
外包装
如果同型式、规格的皮内针中包装装人外包装中,外包装上至少应有下列标志:8.4.1
生产企业名称和地址;
产品名称;
型式、规格和数量;
生产日期或生产批号;
使用期限或失效日期;
质量(毛、净质量);
体积(长×宽×高);
“怕雨”等字样或标志,应符合GB/T191中的规定。外包装上的字样或标志应保证不因历时较久而模糊不清。
8.4.2无菌皮内针外包装上还须增加下列标志:灭菌方式、“无菌”等字样和/或符号;a
“一次性使用”的字样和/或符号;(如适用)b)
灭菌日期或灭菌批号。
9运输和贮存
9.1运输
皮内针在运输时应小心轻放,防止重压、阳光直晒和雨雪浸淋。2贮存
包装后的皮内针应贮存在常温,无腐蚀性气体,通风良好和清洁的室内。8
-rrKaeerKAca-
附录A
(资料性附录)
材料的指南
用于制造皮内针的材料应与其灭菌过程相适应。YY/T0105—2020
用于制造皮内针的材料在常规使用的过程中,不得产生物理的或化学等有害的影响。用于制造皮内针针体的材料应符合GB/T4240—2019中的规定的06Cr19Ni10或其他奥氏体不锈钢。
若皮内针含有与人体皮肤接触用于粘贴的胶带,胶带材料的持粘性、剥离强度和生物相容性应符合YY/T0148—2006的要求
当皮内针所用材料发生变化、针体表面增加涂层(如润滑剂)或有迹象表明产品用于人体时发生生物安全性引起的不良反应时,应按照GB/T16886.1的规定增加对材料和最终产品进行生物学评价(无此情况可以豁免),基本评价试验为:a)
细胞毒性;
b)致敏;
c)刺激。
rrKaeerkAca-
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
中华人民共和国医药行业标准
YY/T0105—2020
代替YY0105-1993
皮内针
Intradermalneedles
2020-09-27发布
国家药品监督管理局
2021-09-01实施
规范性引用文件
术语和定义
结构、分类和规格·
试验方法
运输和贮存
附录A(资料性附录)
材料的指南
附录B(规范性附录)
针体与针柄的牢固度
参考文献
KaeerkAca-
YY/T0105—2020
本标准按照GB/T1.1—2009给出的规则起草。YY/T0105—2020
本标准代替YY0105一1993《撤针》,并修改名称为皮内针》,与YY0105一1993相比,除编辑性修改外主要技术变化如下:
修改了适用范围(见第1章,1993年版的第1章);修改了规范性引用文件的内容(见第2章,1993年版的第2章);增加了术语和定义的内容(见第3章,1993年版的第3章);增加了颗粒型皮内针的型式。(见3.2);修改了皮内针尺寸的要求(见5.1,1993年版的4.2);修改了针尖强度和锋利度的要求和试验方法(见5.2、6.3,1993年版的4.4、5.4.1);修改了针体硬度的要求和试验方法(见5.3、6.4.1993年版的4.5,5.4.2);增加了针体与针柄的牢固度的要求和试验方法(见5.6,6.7);增加了无菌的要求和试验方法(见5.7、6.8);增加了对生物相容性的要求和试验方法(见5.8、6.9);修改了外观的要求(见5.9,1993年版的4.4、4.6.4.8);修改了包装、标志及贮存的要求(见第7、8章,1993年版的第7章):删除了皮内针制造材料的要求(1993年版的4.3);删除了检验规则的内容(1993年版的第6章)。请注意本文件的某些内容可能涉及专利。本文件的发布机构不承担识别这些专利的责任。本标准由国家药品监督管理局提出。本标准由全国医用电器标准化技术委员会物理治疗设备分技术委员会(SAC/TC10/SC4)归口。本标准起草单位:天津市医疗器械质量监督检验中心、苏州医疗用品厂有限公司。本标准主要起草人:杨国涓、张路、高向辉、张龙飞、陈成、徐爱民。本标准所代替标准的历次版本发布情况为:YY0105—1993。
-rKaeerkca-
1范围
YY/T0105—2020
本标准规定了皮内针的结构、分类和规格、要求、试验方法、包装、标志、运输和贮存。本标准适用于供中医皮内针疗法使用的皮内针。本标准适用于针体材料符合GB/T42402019中规定的06Cr19Ni10或其他奥氏体不锈钢的皮内针。
规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。GB/T191包装储运图示标志
GB2024—2016针灸针
GB/T4240-—2019不锈钢丝
GB/T4340.1金属材料维氏硬度试验第1部分:试验方法GB/T14233.2—2005医用输液、输血、注射器具检验方法第2部分:生物学试验方法GB/T16886.1-2011医疗器械生物学评价第1部分:风险管理过程中的评价与试验YY/T01492006不锈钢医用器械耐腐蚀性能试验方法YY/T0466.1
3术语和定义
医疗器械用于医疗器械标签、标记和提供信息的符号第1部分:通用要求皮内针intradermalneedles
皮下理人式小型针刺工具。
注:皮内针具有两种类型:一种为颗粒型皮内针,另一种为撤钉型皮内针(掀针)。3.2
颗粒型皮内针intradermalgranuletypeneedle可倾斜或水平地插人皮下组织的皮内针,通常会穿过人体的不同部位。3.3
intradermalthumbtacktypeneedle撤钉型皮内针
类似于图钉状的皮内针。
bodyoftheneedle
皮内针插入身体的部分。
handle of the needle
皮内针不插人身体的部分。
-rKaeerkAca-
YY/T0105—2020
tipof theneedle
锋利的顶端,皮内针插人到身体的针体的末部。4结构、分类和规格
皮内针的典型结构和各部件名称如图1、图2、图3所示。说明:
针柄:
说明:
针体;
针尖:
针柄;
针体:
针尖:下载标准就来标准下载网
针体直径:
针柄直径:
针体长度。
典型颗粒型皮内针结构图
针体直径:
针柄直径:
针体长度。
典型非电针用钉型皮内针(针)结构图图2
-rrKaeerkca-
说明:
针柄;
针体;
针尖;
尾部;
针体直径;
针柄直径;
针体长度:
尾部长度。
图3典型电针用钉型皮内针(撤针)结构图按照是否无菌划分,皮内针可分为无菌和非无菌两种。YY/T0105—2020
按照使用方式划分,钉型皮内针(掀针)又可分为非电针用掀针和电针用掀针两种。按照针尖与针柄的结合方式划分,皮内针可分为一体成型式和非一体成型式两种。4.3
规格和材料
皮内针的规格以针体直径×针体长度表示。示例:@0.25×2mm。
用于制造皮内针的材料参见附录A。5要求
5.1尺寸
典型颗粒型皮内针的基本尺寸与允差,应符合表1的规定5.1.1
-rrKaeerkca-
YY/T0105—2020
针体直径d
针体长度L?
针柄直径L
典型颗粒型皮内针的尺寸
5≤10
如皮内针尺寸不在表1范围内·由制造商规定相关尺寸与允差,5.1.2
典型钉型皮内针(针)的基本尺寸与允差,应符合表2的规定。典型撤钉型皮内针(撤针)的尺寸表2
针体直径di
针体长度L
尾部长度
针柄直径
非电针用针
电针用撤针
电针用针
15≤30
如皮内针尺寸不在表2范围内,由制造商规定相关尺寸与允差针尖强度和锋利度
单位为毫米
单位为毫米
针尖经施加表3中规定的力与钢块接触顶压后,其穿刺力应不大于表3的规定。表3
标称针体直径d
0.10d0.12
0.12
针体的硬度应符合表4的规定。
顶压力和穿刺力
顶压力
-KaeerKca-
穿刺力
标称针体直径d./mm
0.10≤d<0.25
0.25d<0.30
0.30≤d≤0.40
表面粗糙度
表4硬度
针体和针尖的表面粗糙度参数Ra的最大值应为0.4um。耐腐蚀性
皮内针应具有良好的耐腐蚀性能。针体与针柄的牢固度
硬度HV2
≥480.且≤680
≥460.且≤650
≥450.且≤650
YY/T 0105—2020
非一体成型式皮内针的针体与针柄的连接应牢固。当施加表5中规定的静态拉力于针体中心轴方向时,针体与针柄不脱离。
针体长度Lz/mm
2.5≤L<5
5≤L≤30
5.7无菌
牢固度测试用力
拉力/N
无菌皮内针应经一个已确认过的灭菌过程进行灭菌,使产品保证无菌。注:适宜的灭菌方法可参考文献GB18278.1、GB18279和GB18280中规定的医疗器械灭菌过程的确认和常规控制的要求。
生物相容性
预期与患者皮肤接触的部分,应按GB16886.1一2011中附录A给出的指南和原则进行评估并形成文件。
5.9外观
5.9.1针尖应锋利、圆正不偏、无毛刺、弯钩等缺陷。5.9.2针体表面不应有伤痕,曲痕和麻点。5.9.3一体成型式皮内针的针柄,螺旋圈应圆正,排列紧密,不得有明显离距。非一体成型式皮内针的针体与连接的针柄的平面应垂直。掀钉型皮内针(掀针)的针体与连接的针柄圆形的平面应垂直。颗粒型皮内针的针体与连接的针柄平面应平行,不得有明显偏斜。5
-rrKaeerkca-
YY/T0105—2020
6试验方法
6.1总则
除无菌和生物相容性试验外,其他项日取不少于3件样品进行测试6.2尺寸
使用通用量具或专用量具测量,应符合5.1的规定。6.3
针尖强度和锋利度
按GB2024一2016中5.3.2的方法进行,应符合5.2的规定。注:针体与针柄在同一截面的典型颗粒型皮内针,如针体长度<5mm可使用原材料针坏(夹持露出部分不大于标称针体长度)进行试验;针体与针柄不在同一截面的皮内针(掀针),如针体长度<7mm可用原材料针坏(夹持露出部分不大于标称针体长度)进行试验6.4针体硬度
按GB/T4340.1的方法进行试验,应符合5.3的要求。注:针体长度<25mm可使用原材料针坏进行试验。5表面粗糙度
用10倍放大镜与标准表面粗糙度样块进行比较,应符合5.4的规定6耐腐蚀性
按YY/T0149—2006中第7章柠檬酸溶液试验法的方法进行,检查试件表面的腐蚀痕迹,其腐蚀程度应为无任何锈蚀现象(a级),符合5.5的要求。6.7针体与针柄的牢固度
针体长度L2≥2.5mm时,按照附录B的方法或等效的方法进行试验,结果应符合5.6的要求。针体长度L,<2.5mm时,将皮内针全部针体的长度插入仿真皮肤模型,然后拔出,重复10次后,检查针体与针柄的连接应牢固。
推荐使用的仿真皮肤模型应满足下列要求:a)材料:加成型硅橡胶:
厚度:>2.5mm;
硬度:A10±5。
3无菌
按GB/T14233.22005中第3章无菌试验规定的无菌试验方法进行,应符合5.7的要求。注:该方法不宜用于出厂检验。6.9
生物相容性
通过检查制造商提供的资料或按GB/T16886.1—2011规定的方法进行验证来检验是否符合5.8的要求。
-rKaeerkca-
6.10外观
目视检查,应符合5.9的要求。
7包装
7.1初包装
皮内针应有初包装。
YY/T0105-2020
一次性使用无菌皮内针的初包装内不应有肉眼可见异物。包装的材料不得对内装物产生有害7.1.2
影响,此包装的材料和设计应确保:在干燥、清洁和充分通风的贮存条件下,能保证内装物在有效期内保持无菌性;a)
b)在从包装中取出时,内装物受污染的风险最小;在正常的搬动、运输和存期间,对内装物有充分的保护;c
d)一且打开,包装不能轻易地重新密封,而且应有明显的被打开的痕迹。注:GB/T19633提供了最终灭菌医疗器械包装材料和系统的要求,制造商在无菌皮内针的包装设计、评估确认时可考虑此标准的内容。
2中包装
一件或一件以上的初包装,应装人一件中包装中,中包装为最小销售单元。在正常搬运、运输和贮存期间,中包装对内装物应能充分的保护。7.3外包装
一件或一件以上的中包装,应装人一外包装中。在正常搬运、运输和贮存期间,外包装应能充分保护内装物。标志
包装标志
包装上的标签标记和提供信息的符号应符合YY/T0466.1的规定。单支包装或单元包装的初包装
初包装或单元包装上至少应有下列标志:a)
生产企业名称和或商标;
产品名称;
规格;
数量(适用于单元包装);
生产日期或生产批号;
使用期限或失效日期。
无菌皮内针初包装上还应有下列标志:灭菌方式、“无菌”等字样和/或符号;a)
b)“一次性使用”的字样和/或符号(如适用)。7
-rKaeerkca-
YY/T0105—2020
3中包装
中包装内应附有说明书、质量合格标识或产品合格证。中包装上至少应有下列标志:a)
生产企业名称、地址和或商标;b)
产品名称;
型式、规格和数量;
生产日期或生产批号;
使用期限或失效日期。
8.3.2无菌皮内针中包装上还须增加下列标志:a)
灭菌方式、“无菌”等样和/或符号:“一次性使用”的字样和/或符号:(如适用)b)
“包装破损禁止使用”及“用后销毁”等在使用前检查初包装完整性的警示字样,除非该警示说明已在初包装中给出。
外包装
如果同型式、规格的皮内针中包装装人外包装中,外包装上至少应有下列标志:8.4.1
生产企业名称和地址;
产品名称;
型式、规格和数量;
生产日期或生产批号;
使用期限或失效日期;
质量(毛、净质量);
体积(长×宽×高);
“怕雨”等字样或标志,应符合GB/T191中的规定。外包装上的字样或标志应保证不因历时较久而模糊不清。
8.4.2无菌皮内针外包装上还须增加下列标志:灭菌方式、“无菌”等字样和/或符号;a
“一次性使用”的字样和/或符号;(如适用)b)
灭菌日期或灭菌批号。
9运输和贮存
9.1运输
皮内针在运输时应小心轻放,防止重压、阳光直晒和雨雪浸淋。2贮存
包装后的皮内针应贮存在常温,无腐蚀性气体,通风良好和清洁的室内。8
-rrKaeerKAca-
附录A
(资料性附录)
材料的指南
用于制造皮内针的材料应与其灭菌过程相适应。YY/T0105—2020
用于制造皮内针的材料在常规使用的过程中,不得产生物理的或化学等有害的影响。用于制造皮内针针体的材料应符合GB/T4240—2019中的规定的06Cr19Ni10或其他奥氏体不锈钢。
若皮内针含有与人体皮肤接触用于粘贴的胶带,胶带材料的持粘性、剥离强度和生物相容性应符合YY/T0148—2006的要求
当皮内针所用材料发生变化、针体表面增加涂层(如润滑剂)或有迹象表明产品用于人体时发生生物安全性引起的不良反应时,应按照GB/T16886.1的规定增加对材料和最终产品进行生物学评价(无此情况可以豁免),基本评价试验为:a)
细胞毒性;
b)致敏;
c)刺激。
rrKaeerkAca-
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。