YY/T 1768.2-2021
基本信息
标准号: YY/T 1768.2-2021
中文名称:医用针式注射系统要求和试验方法 第2部分:针头
标准类别:医药行业标准(YY)
标准状态:现行
出版语种:简体中文
下载格式:.zip .pdf
下载大小:11518148

标准分类号
关联标准
出版信息
相关单位信息
标准简介
YY/T 1768.2-2021.Needle based injection systems for medical use- Requirements and test methods-Part 2 : Needles.
1范圈
YY/T 1768本部分规定了一次性使用双头式无菌针头的要求和试验方法。
YY/T 1768.2适用于与YY/T 1768.1的针式注射系统(NIS)配套使用的针头。
YY/T 1768.2不适用于牙科用针头.预充注射针头.制造商预组装的针头和无需组装或连接到NIS的针头。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注期的引用文件 ,其最新版本(包括所有的修改单)适用于本文件.
GB/T 2423.4- 2008 电工电子产品环境试验第2 部分:试验方法试验 Db交变湿热(12 h+12 h循环)(IEC 60068-2-30; 2005 ,IDT)
GB/T 6682分析实验室用水 规格和试验方法(GB/T 6682- -2008,IS0 3696; 1987 ,MOD)
GB/T 14233.1- 2008医用输 液输血.注射器具检验方法第1部分:化学分析方法
GB/T 14233.2- 2005医用输液 输血.注射器具检验方法第2部分:生物学试验方法
GB/T 16886.1医疗器械生物学评价 第1部分:风险管理过程中的评价与试验(GB/T 1686.1-2011,ISO 10993-1:2009 ,IDT)
GB/T 18457- 2015 制造 医疗器械用不锈钢针管(ISO 9626.1991 ,MOD)
YY/T 0466.1医疗器械 用于 医疗器械标签。标记和提供信息的符号第1部分:通用要求(YY/T 0466.1- 2016,ISO 15223-1 :2012 ,IDT)
YY/T 0615.1标示“无菌”医疗 器械的要求第1部分:最终灭菌医疗器械的要求(YY/T 0615.1-2007 ,EN 556-1;2001 ,IDT)
3术语和定义
下列术语和定义适用于本文件。
3.1
针式注射系统needl-based injection systems;NIS通过使用针头和多剂量或单剂量容器注射臂肠外药物的注射系统。
3.2
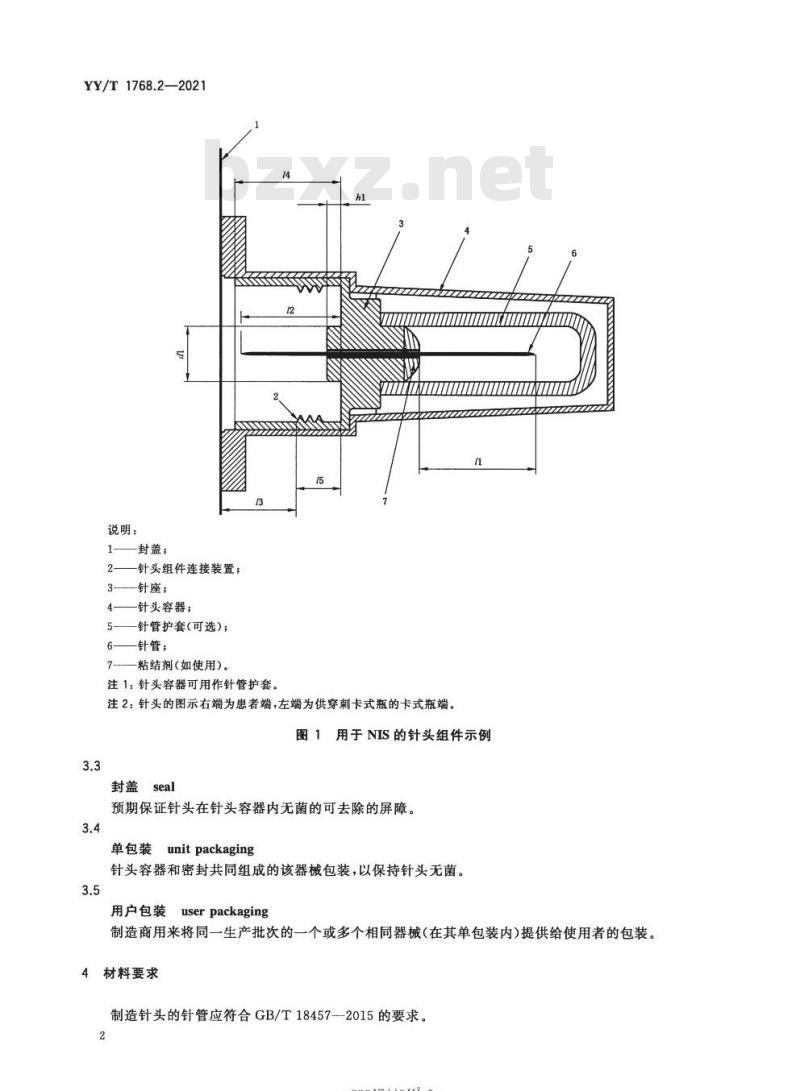
针头needle预期与针式注射系统(NIS)和多剂量或单剂量容器配合使用的双头式无菌针头,见图1.
1范圈
YY/T 1768本部分规定了一次性使用双头式无菌针头的要求和试验方法。
YY/T 1768.2适用于与YY/T 1768.1的针式注射系统(NIS)配套使用的针头。
YY/T 1768.2不适用于牙科用针头.预充注射针头.制造商预组装的针头和无需组装或连接到NIS的针头。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注期的引用文件 ,其最新版本(包括所有的修改单)适用于本文件.
GB/T 2423.4- 2008 电工电子产品环境试验第2 部分:试验方法试验 Db交变湿热(12 h+12 h循环)(IEC 60068-2-30; 2005 ,IDT)
GB/T 6682分析实验室用水 规格和试验方法(GB/T 6682- -2008,IS0 3696; 1987 ,MOD)
GB/T 14233.1- 2008医用输 液输血.注射器具检验方法第1部分:化学分析方法
GB/T 14233.2- 2005医用输液 输血.注射器具检验方法第2部分:生物学试验方法
GB/T 16886.1医疗器械生物学评价 第1部分:风险管理过程中的评价与试验(GB/T 1686.1-2011,ISO 10993-1:2009 ,IDT)
GB/T 18457- 2015 制造 医疗器械用不锈钢针管(ISO 9626.1991 ,MOD)
YY/T 0466.1医疗器械 用于 医疗器械标签。标记和提供信息的符号第1部分:通用要求(YY/T 0466.1- 2016,ISO 15223-1 :2012 ,IDT)
YY/T 0615.1标示“无菌”医疗 器械的要求第1部分:最终灭菌医疗器械的要求(YY/T 0615.1-2007 ,EN 556-1;2001 ,IDT)
3术语和定义
下列术语和定义适用于本文件。
3.1
针式注射系统needl-based injection systems;NIS通过使用针头和多剂量或单剂量容器注射臂肠外药物的注射系统。
3.2
针头needle预期与针式注射系统(NIS)和多剂量或单剂量容器配合使用的双头式无菌针头,见图1.
标准图片预览




标准内容
ICS 11.040.20
中华人民共和国医药行业标
YY/T 1768.2—2021
医用针式注射系统
要求和试验方法
第2部分:针头
Needle-based injection systems for medical useRequirements and test methods-Part 2:Needles
(ISO11608-2.2012,NEQ)
2021-03-09发布
国家药品监督管理局
2022-04-01实施
规范性引用文件
术语和定义
材料要求
物理要求
针头流量
针座和针管间的连接
患者端测量
与针式注射系统的功能适配性
易于组装和拆卸
6化学要求
检验液制备
酸碱度
重金属含量(金属离子)
生物学要求
细菌内毒素
生物相容性
制造商提供的信息
使用说明
附录A(规范性附录)
标准大气和试验仪器
附录B(规范性附录)
附录C(规范性附录)
附录D(规范性附录)
附录E(规范性附录)
附录F(规范性附录)
参考文献
针头的预处理
患者端测量点的径向跳动测定方法测定通过针头的流量·
针座和针管之间连接的测定方法确认针头和注射系统适配性的试验方法-rKaeerKa-
YY/T1768.2—2021
YY/T1768《医用针式注射系统
要求和试验方法》由以下部分组成:第1部分:针式注射系统;
一第2部分:针头;
第3部分:容器;
第4部分:电子和机电笔式注射器;第5部分:自动功能;
第7部分:为视力受损人士提供无障碍服务。本部分为YY/T1768的第2部分。
本部分按照GB/T1.1—2009给出的规则起草。YY/T1768.2—2021
本部分使用重新起草法参考ISO11608-2:2012《医用针式注射系统要求和试验方法第2部分:
针头》,与ISO11608-2:2012的一致性程度为非等效。请注意本文件的某些内容可能涉及专利。本文件的发布机构不承担识别这些专利的责任。本部分由国家药品监督管理局提出。本部分由全国医用注射器(针)标准化技术委员会(SAC/TC95)归口。本部分起草单位:山东威高集团医用高分子制品股份有限公司、上海市医疗器械检测所、浙江康德莱医疗器械股份有限公司、中国食品药品检定研究院、贝朗医疗(上海)国际贸易有限公司、北京伏尔特技术有限公司、上海埃斯埃医疗技术有限公司、碧迪医疗器械(上海)有限公司。本部分主要起草人:李未扬、李赞、张谦、付步芳、朱会芳、杨建鑫、孙洪荣、徐源梅。m
rKaeerkAca-
1范围
医用针式注射系统要求和试验方法第2部分:针头
YY/T1768本部分规定了一次性使用双头式无菌针头的要求和试验方法。本部分适用于与YY/T1768.1的针式注射系统(NIS)配套使用的针头。YY/T1768.2—2021
本部分不适用于牙科用针头、预充注射针头、制造商预组装的针头和无需组装或连接到NIS的针头。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。交变湿热(12h+
GB/T2423.4-2008电工电子产品环境试验第2部分:试验方法试验Db12h循环)(IEC60068-2-30:2005,IDT)GB/T6682分析实验室用水规格和试验方法(GB/T6682—2008ISO3696:1987,MOD)GB/T14233.1-2008医用输液、输血、注射器具检验方法第1部分:化学分析方法GB/T14233.2一2005医用输液、输血、注射器具检验方法第2部分:生物学试验方法GB/T16886.1医疗器械生物学评价第1部分:风险管理过程中的评价与试验(GB/T16886.1-2011,ISO10993-1.2009,IDT)
GB/T18457—2015制造医疗器械用不锈钢针管(ISO9626:1991,MOD)YY/T0466.1医疗器械用于医疗器械标签、标记和提供信息的符号第1部分:通用要求(YY/T0466.1—2016,ISO15223-1:2012,IDT)YY/T0615.1标示“无菌”医疗器械的要求第1部分:最终灭菌医疗器械的要求(YY/T0615.1一2007,EN556-1:2001,IDT
3术语和定义
下列术语和定义适用于本文件。3.1
needle-based injection systems;NIS针式注射系统
通过使用针头和多剂量或单剂量容器注射胃肠外药物的注射系统。3.2
针头needle
预期与针式注射系统(NIS)和多剂量或单剂量容器配合使用的双头式无菌针头,见图1。1下载标准就来标准下载网
rKaeerkAca-
YY/T1768.2—2021
说明:
封盖:
针头组件连接装置:
一针座;
一针头容器;
针管护套(可选);
针管;
7——粘结剂(如使用)。
注1:针头容器可用作针管护套。2
注2:针头的图示右端为患者端,左端为供穿刺卡式瓶的卡式瓶端。图1用于NIS的针头组件示例
封盖seal
预期保证针头在针头容器内无菌的可去除的屏障。3.4
单包装unitpackaging
针头容器和密封共同组成的该器械包装,以保持针头无菌。3.5
用户包装userpackaging
制造商用来将同一生产批次的一个或多个相同器械(在其单包装内)提供给使用者的包装。4材料要求
制造针头的针管应符合GB/T18457—2015的要求。2
rrKaeerKAca-
物理要求
5.1尺寸
YY/T1768.2—2021
针头组件连接部分的尺寸应使针头能与符合YY/T1768.1规定的NIS配合使用。5.1.2
2针头的尺寸
用符合附录A中A.1的试验仪器,在A.2规定的标准大气下对无需经附录B预处理的针头试验时,应与附录C中规定的测试规相适配。尺寸应符合表1的要求。表1针头组件的尺寸要求
尺寸(见图1)
要求/mm
标识长度士1.25
注:针头可设计成不与附录C中描述的测试规适配,以及不符合表1中给出的尺寸要求。在这种情况下,宜针对具体设计加工一款专用测试规以进行附录D中的试验。除5.1.2之外,其他要求适用。如果针头不满足5.1.2的尺寸要求,标签需说明该针头是专门为某NIS设计并与之一起使用的。5.2
针头流量
用符合A.1的试验仪器,在A.2规定的标准大气下对无需经附录B预处理的针头按附录D进行流量试验时,以毫升每分(mL/min)为单位。除符合第9章的标志要求外,流量应能按要求提供。注;流量参数不是第9章的强制性要求,但NIS制造商或其他各方可能对此予以关注。流量是NIS系统整体性能(如注射力和注射时间)的一个重要影响因子。5.3针座和针管间的连接
用符合A.1的试验仪器,按附录E进行试验时,针座和针管的连接处不应受到损坏。5.4针尖
在A.2规定的标准大气下,在×2.5的放大倍数下对针头进行检查时,针尖应尖锐且无毛边、毛刺和弯钩。
注:卡式瓶端的针尖宜设计成当穿刺卡式瓶垫片时使穿刺落屑为最少。5.5正直
在A.2规定的标准大气下,目力检查针头,针座与针管连接应正直,针管不应有明显的歪斜。3
-riKacerKAca-
YY/T1768.2—2021
5.6润滑
针管应在患者端和卡式瓶端进行润滑。在A.2规定的标准大气下,用正常或矫正视力观察,针管外表面不应有可见的润滑剂积聚。5.7患者端测量
用符合A.1的试验仪器,在A.2规定的标准大气下,按附录C试验时,患者端针管测量点的径向跳动应符合表2的要求。
2患者端最大允许径向跳动
患者端针管长度11
5.8与针式注射系统的功能适配性最大允许径向跳动dmx
0.07×11+0.3
应只有在A.2规定的标准大气下,按附录F对拟适配的NIS试验后,满足接受准则的要求后才能声称针头与该NIS功能适配。
注:YY/T1768的其他部分和NIS的使用说明也将定义功能适配性要求。5.9易于组装和拆卸
在A2规定的标准大气下,应无需从打开后的单包装中取出针头,便可以将针头与注射系统连接。按附录F检验其符合性。
6化学要求
6.1检验液制备
将25支拔去护套的针头浸入250mL新制成的符合GB/T6682中规定的二级水中,在(37士1)℃下恒温1h,取出针头获取检验液;同时按上述同样方法不放针头制备空白对照液。6.2酸碱度
按GB/T14233.12008规定的方法试验时,6.1制备的检验液与空白对照液的pH之差应不大于1。
6.3重金属含量(金属离子)
用原子吸收分光光度计法(AAS)或相当的方法进行测定时,检验液中锁、铬、铜、铅和锡的总含量应不超过5μg/mL。镉的含量应不超过0.1μg/mL。按GB/T14233.1一2008中5.6.1规定的方法试验时,检验液呈现的颜色应不超过浓度为5μg/mL的标准对照液的颜色。
-rrKaeerkAca-
7生物学要求
7.1无菌
单包装里的针头应符合YY/T0615.1的要求。7.2
细菌内毒素
YY/T1768.2—2021
按GB/T14233.2一2005中规定方法试验时,细菌内毒素含量应小于20EU/支。生物相容性
应按GB/T16886.1中规定的评价程序在材料表征基础上对材料和/或最终产品进行生物学评价。注:出于保护动物的考虑,生物评价推荐采用GB/T16886.1中给出的评价程序。采用这样的评价程序,如能证实被评价针管的材料与GB/T18457一2015规定的材料具有等同性,并且产品生产过程与上市同类产品的生产过程具有等同性的支持性文件;或者证实生产过程引入的有毒有害物质在临床使用中人体摄入量低于人体对该物质的容许限量(TI),即能证实产品具有良好的生物相容性,而无需进行相应的生物学试验。8包装
每个针头应密封在单包装中。一个或多个单包装应放置在用户包装中。单包装中使用的材料不应对内装物产生不利影响。该包装的材料和设计宜确保:a)在正常搬运和储存期间保持内装物的无菌性;b)从包装中取出过程中内装物受污染的风险最小;c)拆除密封时,不会影响随后的针头和NIS的组装;d)在正常搬运、运输和储存期间对内装物进行适宜的保护;e)一旦打开,包装便留有包装已被打开的迹象,包装不能重新密封。9制造商提供的信息
9.1总则
针头应附有足以安全使用的信息,同时考虑到潜在用户的培训和知识。该信息应包括制造商的识别。
使用说明应包含在用户包装中,除非针头在没有说明的情况下可安全使用。按5.2测定的流量宜在标签上提供。9.2标志
9.2.1总则
单包装上对安全使用NIS至关重要的任何标记应清晰易读9.2.2单包装标志
单包装上的标志至少包括以下信息/内容:制造商名称或商品名称。
注:商标或徽标可能足以识别制造商。5
rKaeerkca-
YY/T1768.2—2021
b)用户识别针头所需的信息,包括标记的公称尺寸,按式(1)表示:o.d.xl
式中:
针管的公称外径,单位为毫米(mm);o.d.
针管的公称长度,单位为毫米(mm)。示例:
0.33mmX12.7mm。
c)“无菌”字样或YY/T0466.1中要求的符号。STERILE
d)批号代码或批号,以相应符号或文字打头。e)失效日期,如果需要(年、月和日,表示为YYYY-MM-DD)。示例:
2009-12-30。
如果无法在单包装上标明失效日期,则应在用户包装上标明。9.2.3用户包装标志
用户包装上的标记应至少包括以下信息/内容:a)制造商的名称和地址。
b)用户识别针头所需的信息,包括按9.2.2标记的公称尺寸。-(1)
针头预期用于装配的NIS的信息,这些信息是已经按5.8确定过两者在功能上是适配的。(要c
声称与任何NIS具有适配性,其适配性应是已按附录F试验过的)。d)“一次性使用”字样或YY/T0466.1中要求的符号。厂
e)“无菌”字样或相应的符号[见9.2.2c)]。f)批号代码或批号。
g)失效日期,如果需要(年、月和日,表示为YYYY-MM-DD)。示例:
2009-12-30。
h)任何特殊的储存和/或搬运条件。6
-rKaeerKa-
使用说明
在给出的使用说明中,至少应包含以下信息/内容:a)9.2.3中要求的信息,但有关批号、批代码和失效日期的信息除外。YY/T1768.2—2021
针头预期适用的所有NIS的信息,这些信息是已经按5.8确定过两者在功能上是适配的(要声b
称与任何NIS具有适配性,其适配性应是按附录F试验过的)。如果连接步骤与NIS的使用说明不同,则应提供有关针头与NIS连接的信息。7
-rrKaeerKAca-
YY/T1768.2—2021
A.1总则
附录A
(规范性附录)
标准大气和试验仪器
当可以获得所需的准确度(校准)和精密度(GaugeR&R),可使用任何适合的试验系统。试验仪器的重复性和再现性(GaugeR&R)应不大于任何给定的测量允许公差范围的20%。对于破坏性试验测量,GaugeR&R应不大于允许公差范围的30%。其GaugeR&R至少宜包含土2个标准差(从而覆盖约95%的变异)。
示例:
测量技术规范限值为土0.01mL(范围为0.02mL)的测量系统,出自GaugeR&R/公差范围比为20%的GaugeR&R,这意味着其GaugeR&R(4倍标准不确定度)等于0.02mL/5=0.004mL。该测量的不确定度为士2标准差(GUM),等于0.002mL。
本部分中的某些要求仅具有单侧限值,在这种情况下,GaugeR&R宜只用于找到R&R标准差。按GaugeR&R标准偏差的两倍计算测量不确定度。对于本部分中的此类测量,最大测量的不确定度的要求为:尺寸为0.01mm;
扭矩为0.001N·m;
压力为0.1kPa(0.001bar);
—时间为0.25s;
一质量为0.001g。
所有给人剂量,V,以重量法记录,m(以克表示)。用环境条件下的液体密度p[以克每毫升(g/mL)表示]将这些记录转化成体积,将这些记录m转化成体积V:m
A.2试验标准大气条件
除非另有规定,测量应在以下大气环境中进行:温度:18℃~28℃;
相对湿度:25%~75%。
在这一大气环境下至少存放4h。8
rKaeerkAca-
干热大气中进行预处理
附录B
(规范性附录)
针头的预处理
将单包装中的针头放人下列条件的试验箱中至少96h:温度:(70士2)℃;
相对湿度:(50±10)%。
2、冷冻环境中进行预处理
将单包装中的针头放人以下条件的试验箱中至少96h:温度:(一40±3)℃。
在周期性大气环境中进行预处理YY/T1768.2—2021
将单包装中的针头放人试验箱中。按GB/T2423.4一2008和如下要求进行处理:变化1[见GB/T2423.4—2008中的图2a)温度下限:(25士3)℃(无湿度要求);温度上限:(55土2)℃;
-6个周期。
注:GB/T2423.4一2008中相应的章是第4章(试验箱)、第7章(条件试验)和第9章(恢复)。9
-rrKaeerkca-
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
中华人民共和国医药行业标
YY/T 1768.2—2021
医用针式注射系统
要求和试验方法
第2部分:针头
Needle-based injection systems for medical useRequirements and test methods-Part 2:Needles
(ISO11608-2.2012,NEQ)
2021-03-09发布
国家药品监督管理局
2022-04-01实施
规范性引用文件
术语和定义
材料要求
物理要求
针头流量
针座和针管间的连接
患者端测量
与针式注射系统的功能适配性
易于组装和拆卸
6化学要求
检验液制备
酸碱度
重金属含量(金属离子)
生物学要求
细菌内毒素
生物相容性
制造商提供的信息
使用说明
附录A(规范性附录)
标准大气和试验仪器
附录B(规范性附录)
附录C(规范性附录)
附录D(规范性附录)
附录E(规范性附录)
附录F(规范性附录)
参考文献
针头的预处理
患者端测量点的径向跳动测定方法测定通过针头的流量·
针座和针管之间连接的测定方法确认针头和注射系统适配性的试验方法-rKaeerKa-
YY/T1768.2—2021
YY/T1768《医用针式注射系统
要求和试验方法》由以下部分组成:第1部分:针式注射系统;
一第2部分:针头;
第3部分:容器;
第4部分:电子和机电笔式注射器;第5部分:自动功能;
第7部分:为视力受损人士提供无障碍服务。本部分为YY/T1768的第2部分。
本部分按照GB/T1.1—2009给出的规则起草。YY/T1768.2—2021
本部分使用重新起草法参考ISO11608-2:2012《医用针式注射系统要求和试验方法第2部分:
针头》,与ISO11608-2:2012的一致性程度为非等效。请注意本文件的某些内容可能涉及专利。本文件的发布机构不承担识别这些专利的责任。本部分由国家药品监督管理局提出。本部分由全国医用注射器(针)标准化技术委员会(SAC/TC95)归口。本部分起草单位:山东威高集团医用高分子制品股份有限公司、上海市医疗器械检测所、浙江康德莱医疗器械股份有限公司、中国食品药品检定研究院、贝朗医疗(上海)国际贸易有限公司、北京伏尔特技术有限公司、上海埃斯埃医疗技术有限公司、碧迪医疗器械(上海)有限公司。本部分主要起草人:李未扬、李赞、张谦、付步芳、朱会芳、杨建鑫、孙洪荣、徐源梅。m
rKaeerkAca-
1范围
医用针式注射系统要求和试验方法第2部分:针头
YY/T1768本部分规定了一次性使用双头式无菌针头的要求和试验方法。本部分适用于与YY/T1768.1的针式注射系统(NIS)配套使用的针头。YY/T1768.2—2021
本部分不适用于牙科用针头、预充注射针头、制造商预组装的针头和无需组装或连接到NIS的针头。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。交变湿热(12h+
GB/T2423.4-2008电工电子产品环境试验第2部分:试验方法试验Db12h循环)(IEC60068-2-30:2005,IDT)GB/T6682分析实验室用水规格和试验方法(GB/T6682—2008ISO3696:1987,MOD)GB/T14233.1-2008医用输液、输血、注射器具检验方法第1部分:化学分析方法GB/T14233.2一2005医用输液、输血、注射器具检验方法第2部分:生物学试验方法GB/T16886.1医疗器械生物学评价第1部分:风险管理过程中的评价与试验(GB/T16886.1-2011,ISO10993-1.2009,IDT)
GB/T18457—2015制造医疗器械用不锈钢针管(ISO9626:1991,MOD)YY/T0466.1医疗器械用于医疗器械标签、标记和提供信息的符号第1部分:通用要求(YY/T0466.1—2016,ISO15223-1:2012,IDT)YY/T0615.1标示“无菌”医疗器械的要求第1部分:最终灭菌医疗器械的要求(YY/T0615.1一2007,EN556-1:2001,IDT
3术语和定义
下列术语和定义适用于本文件。3.1
needle-based injection systems;NIS针式注射系统
通过使用针头和多剂量或单剂量容器注射胃肠外药物的注射系统。3.2
针头needle
预期与针式注射系统(NIS)和多剂量或单剂量容器配合使用的双头式无菌针头,见图1。1下载标准就来标准下载网
rKaeerkAca-
YY/T1768.2—2021
说明:
封盖:
针头组件连接装置:
一针座;
一针头容器;
针管护套(可选);
针管;
7——粘结剂(如使用)。
注1:针头容器可用作针管护套。2
注2:针头的图示右端为患者端,左端为供穿刺卡式瓶的卡式瓶端。图1用于NIS的针头组件示例
封盖seal
预期保证针头在针头容器内无菌的可去除的屏障。3.4
单包装unitpackaging
针头容器和密封共同组成的该器械包装,以保持针头无菌。3.5
用户包装userpackaging
制造商用来将同一生产批次的一个或多个相同器械(在其单包装内)提供给使用者的包装。4材料要求
制造针头的针管应符合GB/T18457—2015的要求。2
rrKaeerKAca-
物理要求
5.1尺寸
YY/T1768.2—2021
针头组件连接部分的尺寸应使针头能与符合YY/T1768.1规定的NIS配合使用。5.1.2
2针头的尺寸
用符合附录A中A.1的试验仪器,在A.2规定的标准大气下对无需经附录B预处理的针头试验时,应与附录C中规定的测试规相适配。尺寸应符合表1的要求。表1针头组件的尺寸要求
尺寸(见图1)
要求/mm
标识长度士1.25
注:针头可设计成不与附录C中描述的测试规适配,以及不符合表1中给出的尺寸要求。在这种情况下,宜针对具体设计加工一款专用测试规以进行附录D中的试验。除5.1.2之外,其他要求适用。如果针头不满足5.1.2的尺寸要求,标签需说明该针头是专门为某NIS设计并与之一起使用的。5.2
针头流量
用符合A.1的试验仪器,在A.2规定的标准大气下对无需经附录B预处理的针头按附录D进行流量试验时,以毫升每分(mL/min)为单位。除符合第9章的标志要求外,流量应能按要求提供。注;流量参数不是第9章的强制性要求,但NIS制造商或其他各方可能对此予以关注。流量是NIS系统整体性能(如注射力和注射时间)的一个重要影响因子。5.3针座和针管间的连接
用符合A.1的试验仪器,按附录E进行试验时,针座和针管的连接处不应受到损坏。5.4针尖
在A.2规定的标准大气下,在×2.5的放大倍数下对针头进行检查时,针尖应尖锐且无毛边、毛刺和弯钩。
注:卡式瓶端的针尖宜设计成当穿刺卡式瓶垫片时使穿刺落屑为最少。5.5正直
在A.2规定的标准大气下,目力检查针头,针座与针管连接应正直,针管不应有明显的歪斜。3
-riKacerKAca-
YY/T1768.2—2021
5.6润滑
针管应在患者端和卡式瓶端进行润滑。在A.2规定的标准大气下,用正常或矫正视力观察,针管外表面不应有可见的润滑剂积聚。5.7患者端测量
用符合A.1的试验仪器,在A.2规定的标准大气下,按附录C试验时,患者端针管测量点的径向跳动应符合表2的要求。
2患者端最大允许径向跳动
患者端针管长度11
5.8与针式注射系统的功能适配性最大允许径向跳动dmx
0.07×11+0.3
应只有在A.2规定的标准大气下,按附录F对拟适配的NIS试验后,满足接受准则的要求后才能声称针头与该NIS功能适配。
注:YY/T1768的其他部分和NIS的使用说明也将定义功能适配性要求。5.9易于组装和拆卸
在A2规定的标准大气下,应无需从打开后的单包装中取出针头,便可以将针头与注射系统连接。按附录F检验其符合性。
6化学要求
6.1检验液制备
将25支拔去护套的针头浸入250mL新制成的符合GB/T6682中规定的二级水中,在(37士1)℃下恒温1h,取出针头获取检验液;同时按上述同样方法不放针头制备空白对照液。6.2酸碱度
按GB/T14233.12008规定的方法试验时,6.1制备的检验液与空白对照液的pH之差应不大于1。
6.3重金属含量(金属离子)
用原子吸收分光光度计法(AAS)或相当的方法进行测定时,检验液中锁、铬、铜、铅和锡的总含量应不超过5μg/mL。镉的含量应不超过0.1μg/mL。按GB/T14233.1一2008中5.6.1规定的方法试验时,检验液呈现的颜色应不超过浓度为5μg/mL的标准对照液的颜色。
-rrKaeerkAca-
7生物学要求
7.1无菌
单包装里的针头应符合YY/T0615.1的要求。7.2
细菌内毒素
YY/T1768.2—2021
按GB/T14233.2一2005中规定方法试验时,细菌内毒素含量应小于20EU/支。生物相容性
应按GB/T16886.1中规定的评价程序在材料表征基础上对材料和/或最终产品进行生物学评价。注:出于保护动物的考虑,生物评价推荐采用GB/T16886.1中给出的评价程序。采用这样的评价程序,如能证实被评价针管的材料与GB/T18457一2015规定的材料具有等同性,并且产品生产过程与上市同类产品的生产过程具有等同性的支持性文件;或者证实生产过程引入的有毒有害物质在临床使用中人体摄入量低于人体对该物质的容许限量(TI),即能证实产品具有良好的生物相容性,而无需进行相应的生物学试验。8包装
每个针头应密封在单包装中。一个或多个单包装应放置在用户包装中。单包装中使用的材料不应对内装物产生不利影响。该包装的材料和设计宜确保:a)在正常搬运和储存期间保持内装物的无菌性;b)从包装中取出过程中内装物受污染的风险最小;c)拆除密封时,不会影响随后的针头和NIS的组装;d)在正常搬运、运输和储存期间对内装物进行适宜的保护;e)一旦打开,包装便留有包装已被打开的迹象,包装不能重新密封。9制造商提供的信息
9.1总则
针头应附有足以安全使用的信息,同时考虑到潜在用户的培训和知识。该信息应包括制造商的识别。
使用说明应包含在用户包装中,除非针头在没有说明的情况下可安全使用。按5.2测定的流量宜在标签上提供。9.2标志
9.2.1总则
单包装上对安全使用NIS至关重要的任何标记应清晰易读9.2.2单包装标志
单包装上的标志至少包括以下信息/内容:制造商名称或商品名称。
注:商标或徽标可能足以识别制造商。5
rKaeerkca-
YY/T1768.2—2021
b)用户识别针头所需的信息,包括标记的公称尺寸,按式(1)表示:o.d.xl
式中:
针管的公称外径,单位为毫米(mm);o.d.
针管的公称长度,单位为毫米(mm)。示例:
0.33mmX12.7mm。
c)“无菌”字样或YY/T0466.1中要求的符号。STERILE
d)批号代码或批号,以相应符号或文字打头。e)失效日期,如果需要(年、月和日,表示为YYYY-MM-DD)。示例:
2009-12-30。
如果无法在单包装上标明失效日期,则应在用户包装上标明。9.2.3用户包装标志
用户包装上的标记应至少包括以下信息/内容:a)制造商的名称和地址。
b)用户识别针头所需的信息,包括按9.2.2标记的公称尺寸。-(1)
针头预期用于装配的NIS的信息,这些信息是已经按5.8确定过两者在功能上是适配的。(要c
声称与任何NIS具有适配性,其适配性应是已按附录F试验过的)。d)“一次性使用”字样或YY/T0466.1中要求的符号。厂
e)“无菌”字样或相应的符号[见9.2.2c)]。f)批号代码或批号。
g)失效日期,如果需要(年、月和日,表示为YYYY-MM-DD)。示例:
2009-12-30。
h)任何特殊的储存和/或搬运条件。6
-rKaeerKa-
使用说明
在给出的使用说明中,至少应包含以下信息/内容:a)9.2.3中要求的信息,但有关批号、批代码和失效日期的信息除外。YY/T1768.2—2021
针头预期适用的所有NIS的信息,这些信息是已经按5.8确定过两者在功能上是适配的(要声b
称与任何NIS具有适配性,其适配性应是按附录F试验过的)。如果连接步骤与NIS的使用说明不同,则应提供有关针头与NIS连接的信息。7
-rrKaeerKAca-
YY/T1768.2—2021
A.1总则
附录A
(规范性附录)
标准大气和试验仪器
当可以获得所需的准确度(校准)和精密度(GaugeR&R),可使用任何适合的试验系统。试验仪器的重复性和再现性(GaugeR&R)应不大于任何给定的测量允许公差范围的20%。对于破坏性试验测量,GaugeR&R应不大于允许公差范围的30%。其GaugeR&R至少宜包含土2个标准差(从而覆盖约95%的变异)。
示例:
测量技术规范限值为土0.01mL(范围为0.02mL)的测量系统,出自GaugeR&R/公差范围比为20%的GaugeR&R,这意味着其GaugeR&R(4倍标准不确定度)等于0.02mL/5=0.004mL。该测量的不确定度为士2标准差(GUM),等于0.002mL。
本部分中的某些要求仅具有单侧限值,在这种情况下,GaugeR&R宜只用于找到R&R标准差。按GaugeR&R标准偏差的两倍计算测量不确定度。对于本部分中的此类测量,最大测量的不确定度的要求为:尺寸为0.01mm;
扭矩为0.001N·m;
压力为0.1kPa(0.001bar);
—时间为0.25s;
一质量为0.001g。
所有给人剂量,V,以重量法记录,m(以克表示)。用环境条件下的液体密度p[以克每毫升(g/mL)表示]将这些记录转化成体积,将这些记录m转化成体积V:m
A.2试验标准大气条件
除非另有规定,测量应在以下大气环境中进行:温度:18℃~28℃;
相对湿度:25%~75%。
在这一大气环境下至少存放4h。8
rKaeerkAca-
干热大气中进行预处理
附录B
(规范性附录)
针头的预处理
将单包装中的针头放人下列条件的试验箱中至少96h:温度:(70士2)℃;
相对湿度:(50±10)%。
2、冷冻环境中进行预处理
将单包装中的针头放人以下条件的试验箱中至少96h:温度:(一40±3)℃。
在周期性大气环境中进行预处理YY/T1768.2—2021
将单包装中的针头放人试验箱中。按GB/T2423.4一2008和如下要求进行处理:变化1[见GB/T2423.4—2008中的图2a)温度下限:(25士3)℃(无湿度要求);温度上限:(55土2)℃;
-6个周期。
注:GB/T2423.4一2008中相应的章是第4章(试验箱)、第7章(条件试验)和第9章(恢复)。9
-rrKaeerkca-
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。