YY/T 1699-2020
基本信息
标准号: YY/T 1699-2020
中文名称:组织工程医疗器械产品壳聚糖
标准类别:医药行业标准(YY)
标准状态:现行
出版语种:简体中文
下载格式:.zip .pdf
下载大小:14155747

标准分类号
关联标准
出版信息
相关单位信息
标准简介
YY/T 1699-2020.Tissue engineering medical device products- Chitosan.
1范围
YY/T 1699规定了用于制备组织工程医疗器械产品的壳聚糖及其盐的要求、试验方法等。
YY/T 1699适用于制备组织工程医疗器械产品的壳聚糖及其盐。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注8期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 191包装 储运图示标志
GB/T 16886.1医疗器 械生物学评价
第1部分:风险管理过程中的评价与试验
GB/T 16886.7医疗器械生物学评价 第1部分:环氧乙烷灭菌残留量
GB/T 16886.12医疗 器械生物学评价第12部分样品制备与参照样晶
GB18278.1医疗保健产品灭菌湿热第1部分医疗器械灭菌过程的开发.确认和常规控制要求.
GB 18279.1医疗保健产品灭菌 环氧乙烷 第1 部分。医疗器械灭菌过程的开发、确认和常规控制的要求
GB18280.1医疗保健产品灭菌辐射第1部分:医疗器械灭菌过程的开发.确认和常规控制要求
YY/T 0313医用高分子制品包装 、标志.运输和贮存
YY/T 0771.1动物源医疗器械 第1部分风险管理应用
YY/T 0771.2动物源医疗器械 第2部分;来源、收集与处置的控制
YY/T 0771.3动物源医疗器械 第3部分:病毒和传播性海锦状脑病(TSE)因子去除与灭活的确认《中华人民共和国药典)(2015年版)四部
3术语和定义
下列术语和定义适用于本文件.
3.1
壳聚糖chitosan由2-氨基-2-脱氧D吡喃葡萄糖(GIcN)和2-乙酰氨基2脱氧-D吡喃葡萄糖(GIleNAc)通过$(l→4)连接而成的线性多糖.其结构式为:
1范围
YY/T 1699规定了用于制备组织工程医疗器械产品的壳聚糖及其盐的要求、试验方法等。
YY/T 1699适用于制备组织工程医疗器械产品的壳聚糖及其盐。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注8期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 191包装 储运图示标志
GB/T 16886.1医疗器 械生物学评价
第1部分:风险管理过程中的评价与试验
GB/T 16886.7医疗器械生物学评价 第1部分:环氧乙烷灭菌残留量
GB/T 16886.12医疗 器械生物学评价第12部分样品制备与参照样晶
GB18278.1医疗保健产品灭菌湿热第1部分医疗器械灭菌过程的开发.确认和常规控制要求.
GB 18279.1医疗保健产品灭菌 环氧乙烷 第1 部分。医疗器械灭菌过程的开发、确认和常规控制的要求
GB18280.1医疗保健产品灭菌辐射第1部分:医疗器械灭菌过程的开发.确认和常规控制要求
YY/T 0313医用高分子制品包装 、标志.运输和贮存
YY/T 0771.1动物源医疗器械 第1部分风险管理应用
YY/T 0771.2动物源医疗器械 第2部分;来源、收集与处置的控制
YY/T 0771.3动物源医疗器械 第3部分:病毒和传播性海锦状脑病(TSE)因子去除与灭活的确认《中华人民共和国药典)(2015年版)四部
3术语和定义
下列术语和定义适用于本文件.
3.1
壳聚糖chitosan由2-氨基-2-脱氧D吡喃葡萄糖(GIcN)和2-乙酰氨基2脱氧-D吡喃葡萄糖(GIleNAc)通过$(l→4)连接而成的线性多糖.其结构式为:
标准图片预览




标准内容
ICS_11.040.40
中华人民共和国医药行业标准
YY/T1699—2020
代替YY/T0606.7-2008
组织工程医疗器械产品
壳聚糖
Tissue engineering medical device products-Chitosan2020-02-21发布
国家药品监督管理局
2021-01-01实施
本标准按照GB/T1.1—2009给出的规则起草。YY/T1699—2020
本标准代替YY/T0606.7—2008《组织工程医疗产品第7部分:壳聚糖》,与YY/T0606.7—2008相比,除编辑性修改外主要技术变化如下:标准名称修改为“组织工程医疗器械产品壳聚糖”;删除了YY/T16886系列规范性引用文件(仅GB/T16886.1、GB/T16886.7和GB/T16886.12保留)(见第2章,2008年版的第2章);-增加了规范性引用文件YY/T0771.1~0771.3《动物源医疗器械》(见第2章);修改了规范性引用文件以及《中华人民共和国药典》的版本年号(见第2章,2008年版的第2章);
修改了分类(见第4章,2008年版的第4章);修改了动物源性材料要求(见第5章,2008年版的第5章);修改了性状的要求(见6.1,2008年版的6.1);增加了傅里叶变换红外光谱的部分主要特征峰(见6.2,2008年版的6.2);增加了含量的要求及试验方法(见6.3、7.3及附录A);修改了脱乙酰度试验方法(见7.4,2008年版的7.3);修改了pH的要求及试验方法(见6.5、7.5,2008年版的6.4、7.4);增加了分子量及分布系数的要求及试验方法(见6.7、7.7及附录B);修改了重金属含量的试验方法(见7.8,2008年版的7.6及附录A);修改了蛋白质试验方法(见附录C,2008年版的附录B;修改了乙醇(有机溶剂)残余量的要求及试验方法(见6.10及附录D,2008年版的6.8及附录C);删除了灰分的要求及试验方法(2008年版6.10、7.10);增加了炽灼残渣的要求及试验方法(见6.12、7.12);增加了砷盐的要求及试验方法(见6.14、7.14);修改了细菌内毒素限量要求(见6.15,2008年版的6.12);修改了无菌试验要求及试验方法(见6.16,7.16,2008年版的6.13及7.13);增加了微生物限量的要求及试验方法(见6.17、7.17);删除了生物学评价的具体要求及试验方法,仅保留总则(见6.18、7.18,2008年版的6.14及7.14、7.15);
删除了第7章检验规则(见2008年版的第8章);删除了附录D背景资料(见2008年版的附录D);增加了参考文献“动物源性医疗器械产品注册申报资料指导原则”和欧洲药典(见参考文献),修改了参考文献ASTMF2103-01版本号(见参考文献,2008年版的参考文献)。请注意本文件的某些内容可能涉及专利。本文件的发布机构不承担识别这些专利的责任。本标准由国家药品监督管理局提出。本标准由全国外科植入物和矫形器械标准化技术委员会组织工程医疗器械产品分技术委员会(SAC/TC110/SC3)归口。
本标准起草单位:上海其胜生物制剂有限公司、中国食品药品检定研究院、青岛博益特生物材料股I
YY/T1699—2020
份有限公司。
本标准主要起草人:蒋丽霞、魏长征、郭盼盼、徐丽明、邵安良、韩宝芹、宋福来中国石化
1范围
组织工程医疗器械产品壳聚糖
YY/T1699—2020
本标准规定了用于制备组织工程医疗器械产品的壳聚糖及其盐的要求、试验方法等。本标准适用于制备组织工程医疗器械产品的壳聚糖及其盐。2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。GB/T191包装储运图示标志
GB/T16886.1:医疗器械生物学评价第1部分:风险管理过程中的评价与试验GB/T16886.7医疗器械生物学评价第1部分:环氧乙烷灭菌残留量GB/T16886.12医疗器械生物学评价第12部分:样品制备与参照样品GB18278.1
GB18279.1
制的要求
GB18280.1
YY/T0313
医疗保健产品灭菌湿热第1部分:医疗器械灭菌过程的开发、确认和常规控制医疗保健产品灭菌
环氧乙烷第1部分:医疗器械灭菌过程的开发、确认和常规控医疗保健产品灭菌
第1部分:医疗器械灭菌过程的开发、确认和常规控制辐射
医用高分子制品包装、标志、运输和贮存YY/T0771.1
动物源医疗器械第1部分风险管理应用YY/T0771.2
动物源医疗器械第2部分:来源、收集与处置的控制YY/T0771.3
动物源医疗器械第3部分:病毒和传播性海绵状脑病(TSE)因子去除与灭活的确认
《中华人民共和国药典》(2015年版)四部3术语和定义
下列术语和定义适用于本文件。3.1
壳聚糖chitosan
由2-氨基-2-脱氧-D-吡喃葡萄糖(GlcN)和2-乙酰氨基-2-脱氧-D-吡喃葡萄糖(GlcNAc)通过B(1-→4)连接而成的线性多糖。其结构式为:HC
GIcNAc
YY/T1699—2020
脱乙酰度degreeofdeacetylation一个壳聚糖分子中葡萄糖胺单元(脱乙酰基的单元)的摩尔分数。4分类
按照是否与酸结合,可分为壳聚糖、壳聚糖盐酸盐、壳聚糖乙酸盐、壳聚糖谷氨酸盐和壳聚糖乳酸盐。
5动物源性材料要求
动物组织中提取制备的壳聚糖及其盐应按照YY/T0771.1、YY/T0771.2、YY/T0771.3的要求进行管理和控制。
6要求
6.1性状
中国石
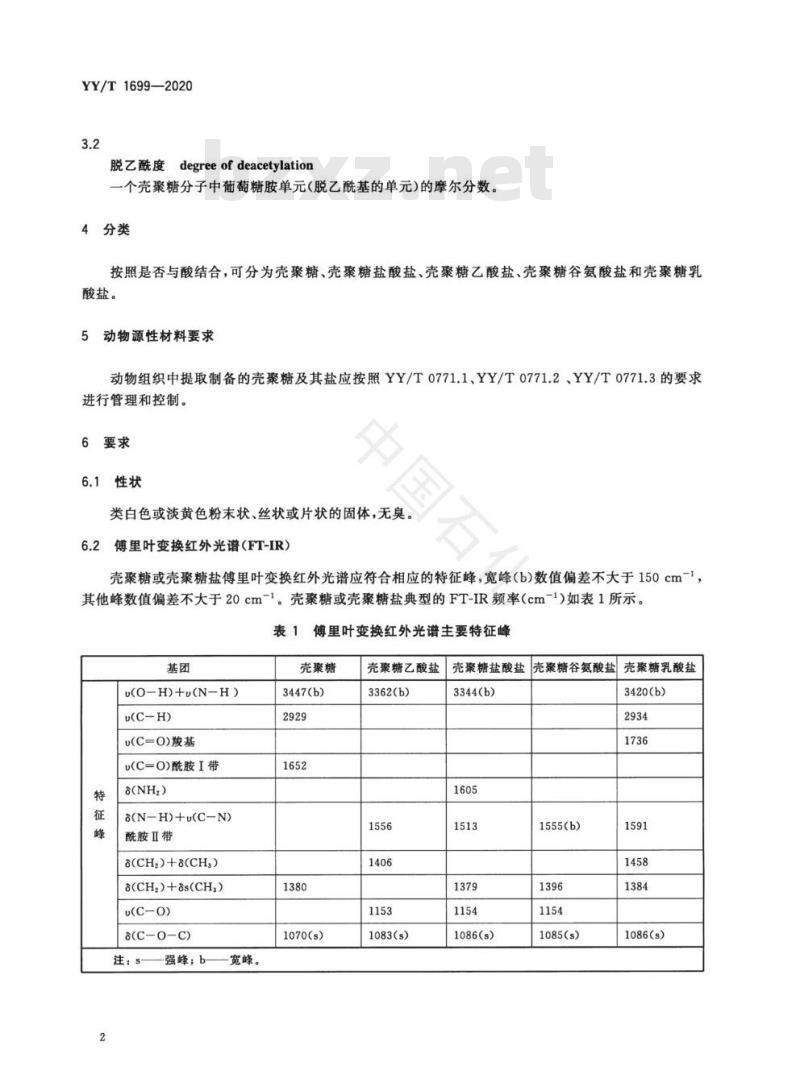
类白色或淡黄色粉末状、丝状或片状的固体,无臭。傅里叶变换红外光谱(FT-IR)
壳聚糖或壳聚糖盐傅里叶变换红外光谱应符合相应的特征峰,宽峰(b)数值偏差不大于150cm-1,其他峰数值偏差不大于20cm-1。壳聚糖或壳聚糖盐典型的FT-IR频率(cm-1)如表1所示。表1傅里叶变换红外光谱主要特征峰基团
u(O-H)+(N-H)
D(C-H)
u(C=O)羧基
u(C=O)酰胺I带
a(N-H)+u(C-N)
酰胺Ⅱ带
8(CH2)+8(CH,)
8(CH2)+8s(CH)
u(C-0)
8(C-0-C)
注:s-
强蜂;b-
宽峰。
壳聚糖
3447(b)
1070(s)
壳聚糖乙酸盐
3362(b)
1083(s)
壳聚糖盐酸盐壳聚糖谷氨酸盐
壳聚糖乳酸盐
3344(b)
1086(s)
1555(b))
1085(s)
3420(b)
1086(s)
6.3含量
以干燥品计算,壳聚糖或其盐的含量应不小于85%。6.4
脱乙酰度
应为标示值的90%~110%。
壳聚糖检测液的pH应为5.0~8.0;壳聚糖盐检测液的pH应为4.06.0。6.6
动力黏度
在20℃时壳聚糖的动力黏度不得超过标示量的80%~120%。注:以mPa·s或Pa·s为单位标明黏度。6.7重均分子量及相对分子质量分布壳聚糖或其盐重均分子量和相对分子质量分布(M./M,)由制造商确定。6.8
重金属含量
重金属含量(以Pb计)应不大于10μg/g(质量分数)。6.9
蛋白质含量
壳聚糖蛋白质残留量应不大于0.2%(质量分数)。6.10乙醇等有机溶剂残余量
乙醇残余量应不大于0.5%(质量分数)。注:如在加工过程中使用了除乙醇之外的其他有机溶剂,应建立相应的检验指标和检验方法。6.11干燥失重
应不大于10%(质量分数)。
6.12炽灼残渣
应不大于1.0%(质量分数)。
6.13不溶物
应不大于0.5%(质量分数)。
6.14砷盐
不得过百万分之一。
6.15细菌内毒素含量
每1.0mg壳聚糖或其盐细菌内毒素含量应小于0.05EU。YY/T1699—2020
注:如果以非无菌的方式提供,则最终用户需进行去除细菌内毒素的处理以达到细菌内毒素限量要求,3
YY/T1699—2020
6.16无菌试验
应无菌。如果壳聚糖或其盐以无菌方式提供,应进行该项目的检测,并按照GB18278.1、GB18279.1、GB18280.1进行无菌工艺确认。如果采用环氧乙烷灭菌,还应按照GB/T16886.7对其残留量进行控制和检测。wwW.bzxz.Net
6.17微生物限度
每克(g)供试品中需氧菌总数小于100CFU,霉菌和酵母菌菌落数小于20CFU,不得检出金黄色葡萄球菌、铜绿假单胞菌和大肠埃希菌。注:如果壳聚糖或其盐以非无菌的方式提供,则进行该项目的检测。6.18生物学性能
应按照GB/T16886.1的要求对壳聚糖及其盐进行生物学评价。中国石
7试验方法
7.1性状
肉眼直接观测,应符合6.1规定。7.2傅里叶变换红外光谱(FT-IR)按照《中华人民共和国药典》(2015年版)四部,通则0402,红外分光光度法规定的方法测定,应符合6.2规定
注:用溴化钾压片作为仲裁方法。7.3含量
按照附录A的方法测定,应符合6.3规定。7.4脱乙酰度
7.4.1脱乙酰度可采用以下方法测定,但不限于以下方法,应符合6.4规定。7.4.2壳聚糖盐样品的制备
称取约2g壳聚糖盐,置烧杯中,加乙醇100mL,边搅拌边滴加10%氢氧化钠溶液,至pH大于8。过滤,用水洗涤沉淀物至洗出液呈中性,50℃干燥4h,再于105℃干燥至恒重,作为供试品。7.4.3脱乙酰度测定-酸碱滴定法准确称取在105℃下干燥至恒重的样品0.2g~0.3g,置于250mL锥形瓶中,加人0.1mol/L的盐酸滴定液30mL,在20℃~25℃下搅拌至完全溶解(可加人适量水稀释)。加甲基橙-苯胺蓝(将0.1%的甲基橙水溶液和0.1%苯胺蓝水溶液以1:2体积比混合)指示剂5滴~6滴,用氢氧化钠滴定液(0.1mol/L)滴至红色褪去。按式(1)和式(2)计算。P=
式中:
样品中氨基含量,%;
ciV,-cV,)×10-×16
6×100%
203×p
16+42×力
×100%
(1)
(2)
盐酸滴定液的浓度,单位为摩尔每升(mol/L);盐酸滴定液的体积,单位为毫升(mL);氢氧化钠滴定液的浓度,单位为摩尔每升(mol/L);氢氧化钠滴定液的体积,单位为毫升(mL);氨基的相对分子质量;
样品质量,单位为克(g);
样品的脱乙酰度,%,
-N-乙酰氨基-D-葡萄糖结构单元相对分子质量;乙酰基的相对分子质量。
7.4.4脱乙酰度测定—双突跃电位滴定法YY/T1699—2020
准确称取在105℃下干燥至恒重的样品0.2g~0.3g,加人过量的0.1mol/L盐酸滴定液,搅拌至完全溶解。然后在电位滴定装置上用氢氧化钠滴定液滴定,氢氧化钠滴定液首先中和过量的HCI,PH出现急剧上升,即第一个突变,然后氢氧化钠滴定液再中和与壳聚糖的氨基结合的盐酸,达到滴定等当点时,pH出现第二个突变,两个突跃点消耗的氢氧化钠摩尔数相当于样品中的氨基摩尔数。按式(3)计算。
式中:
0.0994—
D.D(%)=4V× cNoH × 10- ×16m×0.0994
样品的脱乙酰度,%;
两突跃点之间消耗的氢氧化钠滴定液体积之差,单位为毫升(mL);氢氧化钠滴定液的浓度,单位为摩尔每升(mol/L);样品质量,单位为克(g);
氨基的相对分子质量;
理论氨基含量。
以方法7.4.4为仲裁方法。
(3)
取壳聚糖盐,用纯化水制成10mg/mL的溶液,搅拌溶解,制备检测液;取壳聚糖,以10mg/mL的比例加人纯化水,在37℃土1℃于密闭容器中浸提24h,制备检测液,按照《中华人民共和国药典》(2015年版)四部通则0631pH测定法测定,应符合6.5规定。7.6动力黏度
壳聚糖/壳聚糖盐用1%乙酸溶液/纯化水溶解至浓度为10mg/mL的溶液,搅拌溶解后,按照《中华人民共和国药典》(2015年版)四部通则0633黏度测定法第三法测定,采用旋转式黏度计或流变仪,在规定的转速和转子号或剪切速率,20℃士0.5℃条件下,应符合6.6规定。7.7重均相对分子质量及相对分子质量分布按照附录B规定的方法测定,应符合6.7规定。7.8重金属含量
按照《中华人民共和国药典》(2015年版)四部,通则0821,重金属检查法(第二法)测定。若按该法操作溶液有颜色,可按2015年版四部,通则0821,重金属检查法(第一法)第一段中“若供试液带颜色”进行。应符合6.8规定。
YY/T1699—2020
7.9蛋白质含量
按照附录C规定的方法测定,应符合6.9规定。7.10乙醇残余量
按照附录D规定的方法测定,应符合6.10规定。7.11干燥失重
按照《中华人民共和国药典》(2015年版)四部,通则0831,干燥失重测定法,取本品1.0g,在105℃土2℃下干燥至恒重,按照干燥后重量与取样量进行计算,应符合6.11规定。7.12炽灼残渣
按照《中华人民共和国药典》(2015年版)四部,通则0841,炽灼残渣检查法,取本品1.0g进行测定,应满足6.12要求。
7.13不溶物
准确称取供试品2.0g,壳聚糖用1%乙酸溶液或壳聚糖盐用纯化水400mL溶解,待完全溶解后。将溶液转移至2L容器中,加纯化水200mL。加热至沸腾并保持微沸2h,加热过程中盖住烧杯口。用砂芯漏斗(3#)过滤,用水洗涤残留物,100℃~105℃干燥至恒重,按照残留物重量与取样量进行计算,应符合6.13规定。
7.14砷盐
取本品2.0g,加氢氧化钙1.0g,混合,加水2mL,搅拌均匀,置水浴上蒸干,以小火烧灼至炭化,后以500℃~600℃炽灼使完全炭化,放冷,加盐酸5mL,加水23mL,按照《中华人民共和国药典》(2015年版)四部,通则0822,砷盐检查法(第一法)测定,应符合6.14规定。7.15细菌内毒素含量
壳聚糖用细菌内毒素检查用水浸提或壳聚糖盐用细菌内毒素检查用水溶解,按照《中华人民共和国药典》(2015年版)四部,通则1143,细菌内毒素检查法测定,应符合6.15规定。7.16无菌试验
按照《中华人民共和国药典》(2015年版)四部,通则1101,无菌检查法测定,应符合6.16规定。7.17微生物限度
按照《中华人民共和国药典》(2015年版)四部,通则1105,非无菌产品微生物限度检查:微生物计数法测定,通则1106,非无菌产品微生物限度检查:控制菌检查法测定,应符合6.17规定。7.18生物学性能
按照GB/T16886.12规定的方法制备实验样品,按照GB/T16886.1确定相关生物学评价试验。8标志
8.1大包装应有下列标志:
生产厂名和地址;
产品名称;
执行标准编号;
规格和数量;
生产批号或日期;
失效日期;
贮存条件。
小包装应有下列标志:
产品名称;
生产厂名和地址;
规格和数量;
生产批号或日期;
原料来源;
失效日期;
贮存条件;
灭菌方法;
i)适用范围。
贮运标志
应符合GB/T191中的规定。
中国石化
注:可参考YY0466.1中所给出的图形符号满足上述要求。9
包装、运输和贮存
应采用适宜的包装,确保壳聚糖及其盐产品的安全性和有效性。产品的包装、贮存、运输应符合YY/T0313的规定。9.2
YY/T1699——2020
YY/T1699—2020
A.1测定方法
附录A
(规范性附录)
含量测定
按《中华人民共和国药典》(2015年版)四部,通则0704,氮测定法第二法(半微量法)规定的方法进行。
A.2结果计算
壳聚糖含量按照式(A.1)和式(A.2)(壳聚糖及其一元羧酸盐))、式(A.3)(壳聚糖二元羧酸盐)计算:(V-V.)×c×2×14
mx(1-F)
14×1000
2×NXm
14×(2+DD%)×1000
式中:
待检样品中的总氮含量,单位为毫克每克(mg/g);待检样品质量,单位为克(g);待检样品中水分含量,%;
样品管消耗标准硫酸溶液体积,单位为毫升(mL);空白管消耗标准硫酸溶液体积,单位为毫升(mL);标准硫酸溶液的浓度,单位为摩尔每升,(mol/L);壳聚糖含量,%;
氮原子质量;
理论条件下,壳聚糖或其盐单元平均相对分子质量。壳聚糖或壳聚糖盐单元平均相对分子质量计算式:壳聚糖及其一元羧酸盐:203-42×DD%+M×DD%壳聚糖二元羧酸盐:203-42×DD%+1/2×M×DD%.式中:
.(A.1)
.(A.5)
壳聚糖盐的羧酸根摩尔质量[壳聚糖:0:盐酸盐:36.5;乙酸盐:60:乳酸盐:90:谷氨酸盐(C,H,NO.):147J;
壳聚糖或其盐的脱乙酰度,%。
注:M应根据壳聚糖或其盐的脱乙酰度的不同给定,8
B.1原理
附录B
(规范性附录)
重均相对分子质量及相对分子质量分布系数测定YY/T1699—2020
光散射法是测定高聚物绝对分子质量的方法。高分子溶液可视为不均匀介质,当光通过它时,人射光就会发生散射。其散射光强度远高于纯溶剂,并且与高聚物的相对分子质量链形态、溶液浓度、散射光角度和折光指数增量(dn/dc)密切相关。因此由光散射法测得不同浓度(c)的高聚物溶液在不同散射角()下的散射光强(I.)数据后,即可求得其重均相对分子质量(M)等。若要得到相对分子质量分布系数,可采用激光散射-凝胶渗透色谱联用法(LLS-GPC)。B.2设备
分析天平、激光散射仪、示差检测器、HPLC泵、柱温箱、保护柱、线性柱(TSKG6000PWXL-CP)或相关色谱柱、1.0mL进样环。
B.3溶液制备
B.3.1流动相(推荐)
0.25mol/L乙酸-乙酸钠缓冲液(pH4.5,0.2%叠氮化钠):准确称取乙酸钠205g、叠氮化钠2.0g,用冰乙酸调pH至4.5,加蒸馏水溶解并稀释至10000mL,并用0.45μm的滤膜过滤。B.3.2样品制备
准确称取供试品适量,用上述流动相溶解并稀释至适宜浓度,用0.22μm过滤器过滤。B.3.3样品制备(dn/dc测定)
准确称取供试品适量,用上述流动相溶解并稀释至适宜浓度,再用流动相按照1:5、2:4、3:3、4:2、5:1的浓度比进行梯度稀释,配制成6个不同浓度的系列样品,用0.22μm过滤器过滤。B.4步骤
B.4.1折光指数增量(dn/dc):用流动相清洗后的进样器,依次从低浓度到高浓度抽取适量样品,注人示差检测器,在基线出现平行时采集数据1min,通过仪器系统测定出dn/dc。B.4.2将色谱柱与激光散射仪和示差检测器连接,流动相冲洗至基线平稳后,取适量样品溶液进样,在规定流速、色谱柱温度条件下检测样品的相对分子质量及相对分子质量分布。B.5结果计算
检测完毕后,通过仪器配套的色谱分析软件确定样品的峰面积,输人dn/dc值,根据软件要求设置9
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
中华人民共和国医药行业标准
YY/T1699—2020
代替YY/T0606.7-2008
组织工程医疗器械产品
壳聚糖
Tissue engineering medical device products-Chitosan2020-02-21发布
国家药品监督管理局
2021-01-01实施
本标准按照GB/T1.1—2009给出的规则起草。YY/T1699—2020
本标准代替YY/T0606.7—2008《组织工程医疗产品第7部分:壳聚糖》,与YY/T0606.7—2008相比,除编辑性修改外主要技术变化如下:标准名称修改为“组织工程医疗器械产品壳聚糖”;删除了YY/T16886系列规范性引用文件(仅GB/T16886.1、GB/T16886.7和GB/T16886.12保留)(见第2章,2008年版的第2章);-增加了规范性引用文件YY/T0771.1~0771.3《动物源医疗器械》(见第2章);修改了规范性引用文件以及《中华人民共和国药典》的版本年号(见第2章,2008年版的第2章);
修改了分类(见第4章,2008年版的第4章);修改了动物源性材料要求(见第5章,2008年版的第5章);修改了性状的要求(见6.1,2008年版的6.1);增加了傅里叶变换红外光谱的部分主要特征峰(见6.2,2008年版的6.2);增加了含量的要求及试验方法(见6.3、7.3及附录A);修改了脱乙酰度试验方法(见7.4,2008年版的7.3);修改了pH的要求及试验方法(见6.5、7.5,2008年版的6.4、7.4);增加了分子量及分布系数的要求及试验方法(见6.7、7.7及附录B);修改了重金属含量的试验方法(见7.8,2008年版的7.6及附录A);修改了蛋白质试验方法(见附录C,2008年版的附录B;修改了乙醇(有机溶剂)残余量的要求及试验方法(见6.10及附录D,2008年版的6.8及附录C);删除了灰分的要求及试验方法(2008年版6.10、7.10);增加了炽灼残渣的要求及试验方法(见6.12、7.12);增加了砷盐的要求及试验方法(见6.14、7.14);修改了细菌内毒素限量要求(见6.15,2008年版的6.12);修改了无菌试验要求及试验方法(见6.16,7.16,2008年版的6.13及7.13);增加了微生物限量的要求及试验方法(见6.17、7.17);删除了生物学评价的具体要求及试验方法,仅保留总则(见6.18、7.18,2008年版的6.14及7.14、7.15);
删除了第7章检验规则(见2008年版的第8章);删除了附录D背景资料(见2008年版的附录D);增加了参考文献“动物源性医疗器械产品注册申报资料指导原则”和欧洲药典(见参考文献),修改了参考文献ASTMF2103-01版本号(见参考文献,2008年版的参考文献)。请注意本文件的某些内容可能涉及专利。本文件的发布机构不承担识别这些专利的责任。本标准由国家药品监督管理局提出。本标准由全国外科植入物和矫形器械标准化技术委员会组织工程医疗器械产品分技术委员会(SAC/TC110/SC3)归口。
本标准起草单位:上海其胜生物制剂有限公司、中国食品药品检定研究院、青岛博益特生物材料股I
YY/T1699—2020
份有限公司。
本标准主要起草人:蒋丽霞、魏长征、郭盼盼、徐丽明、邵安良、韩宝芹、宋福来中国石化
1范围
组织工程医疗器械产品壳聚糖
YY/T1699—2020
本标准规定了用于制备组织工程医疗器械产品的壳聚糖及其盐的要求、试验方法等。本标准适用于制备组织工程医疗器械产品的壳聚糖及其盐。2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。GB/T191包装储运图示标志
GB/T16886.1:医疗器械生物学评价第1部分:风险管理过程中的评价与试验GB/T16886.7医疗器械生物学评价第1部分:环氧乙烷灭菌残留量GB/T16886.12医疗器械生物学评价第12部分:样品制备与参照样品GB18278.1
GB18279.1
制的要求
GB18280.1
YY/T0313
医疗保健产品灭菌湿热第1部分:医疗器械灭菌过程的开发、确认和常规控制医疗保健产品灭菌
环氧乙烷第1部分:医疗器械灭菌过程的开发、确认和常规控医疗保健产品灭菌
第1部分:医疗器械灭菌过程的开发、确认和常规控制辐射
医用高分子制品包装、标志、运输和贮存YY/T0771.1
动物源医疗器械第1部分风险管理应用YY/T0771.2
动物源医疗器械第2部分:来源、收集与处置的控制YY/T0771.3
动物源医疗器械第3部分:病毒和传播性海绵状脑病(TSE)因子去除与灭活的确认
《中华人民共和国药典》(2015年版)四部3术语和定义
下列术语和定义适用于本文件。3.1
壳聚糖chitosan
由2-氨基-2-脱氧-D-吡喃葡萄糖(GlcN)和2-乙酰氨基-2-脱氧-D-吡喃葡萄糖(GlcNAc)通过B(1-→4)连接而成的线性多糖。其结构式为:HC
GIcNAc
YY/T1699—2020
脱乙酰度degreeofdeacetylation一个壳聚糖分子中葡萄糖胺单元(脱乙酰基的单元)的摩尔分数。4分类
按照是否与酸结合,可分为壳聚糖、壳聚糖盐酸盐、壳聚糖乙酸盐、壳聚糖谷氨酸盐和壳聚糖乳酸盐。
5动物源性材料要求
动物组织中提取制备的壳聚糖及其盐应按照YY/T0771.1、YY/T0771.2、YY/T0771.3的要求进行管理和控制。
6要求
6.1性状
中国石
类白色或淡黄色粉末状、丝状或片状的固体,无臭。傅里叶变换红外光谱(FT-IR)
壳聚糖或壳聚糖盐傅里叶变换红外光谱应符合相应的特征峰,宽峰(b)数值偏差不大于150cm-1,其他峰数值偏差不大于20cm-1。壳聚糖或壳聚糖盐典型的FT-IR频率(cm-1)如表1所示。表1傅里叶变换红外光谱主要特征峰基团
u(O-H)+(N-H)
D(C-H)
u(C=O)羧基
u(C=O)酰胺I带
a(N-H)+u(C-N)
酰胺Ⅱ带
8(CH2)+8(CH,)
8(CH2)+8s(CH)
u(C-0)
8(C-0-C)
注:s-
强蜂;b-
宽峰。
壳聚糖
3447(b)
1070(s)
壳聚糖乙酸盐
3362(b)
1083(s)
壳聚糖盐酸盐壳聚糖谷氨酸盐
壳聚糖乳酸盐
3344(b)
1086(s)
1555(b))
1085(s)
3420(b)
1086(s)
6.3含量
以干燥品计算,壳聚糖或其盐的含量应不小于85%。6.4
脱乙酰度
应为标示值的90%~110%。
壳聚糖检测液的pH应为5.0~8.0;壳聚糖盐检测液的pH应为4.06.0。6.6
动力黏度
在20℃时壳聚糖的动力黏度不得超过标示量的80%~120%。注:以mPa·s或Pa·s为单位标明黏度。6.7重均分子量及相对分子质量分布壳聚糖或其盐重均分子量和相对分子质量分布(M./M,)由制造商确定。6.8
重金属含量
重金属含量(以Pb计)应不大于10μg/g(质量分数)。6.9
蛋白质含量
壳聚糖蛋白质残留量应不大于0.2%(质量分数)。6.10乙醇等有机溶剂残余量
乙醇残余量应不大于0.5%(质量分数)。注:如在加工过程中使用了除乙醇之外的其他有机溶剂,应建立相应的检验指标和检验方法。6.11干燥失重
应不大于10%(质量分数)。
6.12炽灼残渣
应不大于1.0%(质量分数)。
6.13不溶物
应不大于0.5%(质量分数)。
6.14砷盐
不得过百万分之一。
6.15细菌内毒素含量
每1.0mg壳聚糖或其盐细菌内毒素含量应小于0.05EU。YY/T1699—2020
注:如果以非无菌的方式提供,则最终用户需进行去除细菌内毒素的处理以达到细菌内毒素限量要求,3
YY/T1699—2020
6.16无菌试验
应无菌。如果壳聚糖或其盐以无菌方式提供,应进行该项目的检测,并按照GB18278.1、GB18279.1、GB18280.1进行无菌工艺确认。如果采用环氧乙烷灭菌,还应按照GB/T16886.7对其残留量进行控制和检测。wwW.bzxz.Net
6.17微生物限度
每克(g)供试品中需氧菌总数小于100CFU,霉菌和酵母菌菌落数小于20CFU,不得检出金黄色葡萄球菌、铜绿假单胞菌和大肠埃希菌。注:如果壳聚糖或其盐以非无菌的方式提供,则进行该项目的检测。6.18生物学性能
应按照GB/T16886.1的要求对壳聚糖及其盐进行生物学评价。中国石
7试验方法
7.1性状
肉眼直接观测,应符合6.1规定。7.2傅里叶变换红外光谱(FT-IR)按照《中华人民共和国药典》(2015年版)四部,通则0402,红外分光光度法规定的方法测定,应符合6.2规定
注:用溴化钾压片作为仲裁方法。7.3含量
按照附录A的方法测定,应符合6.3规定。7.4脱乙酰度
7.4.1脱乙酰度可采用以下方法测定,但不限于以下方法,应符合6.4规定。7.4.2壳聚糖盐样品的制备
称取约2g壳聚糖盐,置烧杯中,加乙醇100mL,边搅拌边滴加10%氢氧化钠溶液,至pH大于8。过滤,用水洗涤沉淀物至洗出液呈中性,50℃干燥4h,再于105℃干燥至恒重,作为供试品。7.4.3脱乙酰度测定-酸碱滴定法准确称取在105℃下干燥至恒重的样品0.2g~0.3g,置于250mL锥形瓶中,加人0.1mol/L的盐酸滴定液30mL,在20℃~25℃下搅拌至完全溶解(可加人适量水稀释)。加甲基橙-苯胺蓝(将0.1%的甲基橙水溶液和0.1%苯胺蓝水溶液以1:2体积比混合)指示剂5滴~6滴,用氢氧化钠滴定液(0.1mol/L)滴至红色褪去。按式(1)和式(2)计算。P=
式中:
样品中氨基含量,%;
ciV,-cV,)×10-×16
6×100%
203×p
16+42×力
×100%
(1)
(2)
盐酸滴定液的浓度,单位为摩尔每升(mol/L);盐酸滴定液的体积,单位为毫升(mL);氢氧化钠滴定液的浓度,单位为摩尔每升(mol/L);氢氧化钠滴定液的体积,单位为毫升(mL);氨基的相对分子质量;
样品质量,单位为克(g);
样品的脱乙酰度,%,
-N-乙酰氨基-D-葡萄糖结构单元相对分子质量;乙酰基的相对分子质量。
7.4.4脱乙酰度测定—双突跃电位滴定法YY/T1699—2020
准确称取在105℃下干燥至恒重的样品0.2g~0.3g,加人过量的0.1mol/L盐酸滴定液,搅拌至完全溶解。然后在电位滴定装置上用氢氧化钠滴定液滴定,氢氧化钠滴定液首先中和过量的HCI,PH出现急剧上升,即第一个突变,然后氢氧化钠滴定液再中和与壳聚糖的氨基结合的盐酸,达到滴定等当点时,pH出现第二个突变,两个突跃点消耗的氢氧化钠摩尔数相当于样品中的氨基摩尔数。按式(3)计算。
式中:
0.0994—
D.D(%)=4V× cNoH × 10- ×16m×0.0994
样品的脱乙酰度,%;
两突跃点之间消耗的氢氧化钠滴定液体积之差,单位为毫升(mL);氢氧化钠滴定液的浓度,单位为摩尔每升(mol/L);样品质量,单位为克(g);
氨基的相对分子质量;
理论氨基含量。
以方法7.4.4为仲裁方法。
(3)
取壳聚糖盐,用纯化水制成10mg/mL的溶液,搅拌溶解,制备检测液;取壳聚糖,以10mg/mL的比例加人纯化水,在37℃土1℃于密闭容器中浸提24h,制备检测液,按照《中华人民共和国药典》(2015年版)四部通则0631pH测定法测定,应符合6.5规定。7.6动力黏度
壳聚糖/壳聚糖盐用1%乙酸溶液/纯化水溶解至浓度为10mg/mL的溶液,搅拌溶解后,按照《中华人民共和国药典》(2015年版)四部通则0633黏度测定法第三法测定,采用旋转式黏度计或流变仪,在规定的转速和转子号或剪切速率,20℃士0.5℃条件下,应符合6.6规定。7.7重均相对分子质量及相对分子质量分布按照附录B规定的方法测定,应符合6.7规定。7.8重金属含量
按照《中华人民共和国药典》(2015年版)四部,通则0821,重金属检查法(第二法)测定。若按该法操作溶液有颜色,可按2015年版四部,通则0821,重金属检查法(第一法)第一段中“若供试液带颜色”进行。应符合6.8规定。
YY/T1699—2020
7.9蛋白质含量
按照附录C规定的方法测定,应符合6.9规定。7.10乙醇残余量
按照附录D规定的方法测定,应符合6.10规定。7.11干燥失重
按照《中华人民共和国药典》(2015年版)四部,通则0831,干燥失重测定法,取本品1.0g,在105℃土2℃下干燥至恒重,按照干燥后重量与取样量进行计算,应符合6.11规定。7.12炽灼残渣
按照《中华人民共和国药典》(2015年版)四部,通则0841,炽灼残渣检查法,取本品1.0g进行测定,应满足6.12要求。
7.13不溶物
准确称取供试品2.0g,壳聚糖用1%乙酸溶液或壳聚糖盐用纯化水400mL溶解,待完全溶解后。将溶液转移至2L容器中,加纯化水200mL。加热至沸腾并保持微沸2h,加热过程中盖住烧杯口。用砂芯漏斗(3#)过滤,用水洗涤残留物,100℃~105℃干燥至恒重,按照残留物重量与取样量进行计算,应符合6.13规定。
7.14砷盐
取本品2.0g,加氢氧化钙1.0g,混合,加水2mL,搅拌均匀,置水浴上蒸干,以小火烧灼至炭化,后以500℃~600℃炽灼使完全炭化,放冷,加盐酸5mL,加水23mL,按照《中华人民共和国药典》(2015年版)四部,通则0822,砷盐检查法(第一法)测定,应符合6.14规定。7.15细菌内毒素含量
壳聚糖用细菌内毒素检查用水浸提或壳聚糖盐用细菌内毒素检查用水溶解,按照《中华人民共和国药典》(2015年版)四部,通则1143,细菌内毒素检查法测定,应符合6.15规定。7.16无菌试验
按照《中华人民共和国药典》(2015年版)四部,通则1101,无菌检查法测定,应符合6.16规定。7.17微生物限度
按照《中华人民共和国药典》(2015年版)四部,通则1105,非无菌产品微生物限度检查:微生物计数法测定,通则1106,非无菌产品微生物限度检查:控制菌检查法测定,应符合6.17规定。7.18生物学性能
按照GB/T16886.12规定的方法制备实验样品,按照GB/T16886.1确定相关生物学评价试验。8标志
8.1大包装应有下列标志:
生产厂名和地址;
产品名称;
执行标准编号;
规格和数量;
生产批号或日期;
失效日期;
贮存条件。
小包装应有下列标志:
产品名称;
生产厂名和地址;
规格和数量;
生产批号或日期;
原料来源;
失效日期;
贮存条件;
灭菌方法;
i)适用范围。
贮运标志
应符合GB/T191中的规定。
中国石化
注:可参考YY0466.1中所给出的图形符号满足上述要求。9
包装、运输和贮存
应采用适宜的包装,确保壳聚糖及其盐产品的安全性和有效性。产品的包装、贮存、运输应符合YY/T0313的规定。9.2
YY/T1699——2020
YY/T1699—2020
A.1测定方法
附录A
(规范性附录)
含量测定
按《中华人民共和国药典》(2015年版)四部,通则0704,氮测定法第二法(半微量法)规定的方法进行。
A.2结果计算
壳聚糖含量按照式(A.1)和式(A.2)(壳聚糖及其一元羧酸盐))、式(A.3)(壳聚糖二元羧酸盐)计算:(V-V.)×c×2×14
mx(1-F)
14×1000
2×NXm
14×(2+DD%)×1000
式中:
待检样品中的总氮含量,单位为毫克每克(mg/g);待检样品质量,单位为克(g);待检样品中水分含量,%;
样品管消耗标准硫酸溶液体积,单位为毫升(mL);空白管消耗标准硫酸溶液体积,单位为毫升(mL);标准硫酸溶液的浓度,单位为摩尔每升,(mol/L);壳聚糖含量,%;
氮原子质量;
理论条件下,壳聚糖或其盐单元平均相对分子质量。壳聚糖或壳聚糖盐单元平均相对分子质量计算式:壳聚糖及其一元羧酸盐:203-42×DD%+M×DD%壳聚糖二元羧酸盐:203-42×DD%+1/2×M×DD%.式中:
.(A.1)
.(A.5)
壳聚糖盐的羧酸根摩尔质量[壳聚糖:0:盐酸盐:36.5;乙酸盐:60:乳酸盐:90:谷氨酸盐(C,H,NO.):147J;
壳聚糖或其盐的脱乙酰度,%。
注:M应根据壳聚糖或其盐的脱乙酰度的不同给定,8
B.1原理
附录B
(规范性附录)
重均相对分子质量及相对分子质量分布系数测定YY/T1699—2020
光散射法是测定高聚物绝对分子质量的方法。高分子溶液可视为不均匀介质,当光通过它时,人射光就会发生散射。其散射光强度远高于纯溶剂,并且与高聚物的相对分子质量链形态、溶液浓度、散射光角度和折光指数增量(dn/dc)密切相关。因此由光散射法测得不同浓度(c)的高聚物溶液在不同散射角()下的散射光强(I.)数据后,即可求得其重均相对分子质量(M)等。若要得到相对分子质量分布系数,可采用激光散射-凝胶渗透色谱联用法(LLS-GPC)。B.2设备
分析天平、激光散射仪、示差检测器、HPLC泵、柱温箱、保护柱、线性柱(TSKG6000PWXL-CP)或相关色谱柱、1.0mL进样环。
B.3溶液制备
B.3.1流动相(推荐)
0.25mol/L乙酸-乙酸钠缓冲液(pH4.5,0.2%叠氮化钠):准确称取乙酸钠205g、叠氮化钠2.0g,用冰乙酸调pH至4.5,加蒸馏水溶解并稀释至10000mL,并用0.45μm的滤膜过滤。B.3.2样品制备
准确称取供试品适量,用上述流动相溶解并稀释至适宜浓度,用0.22μm过滤器过滤。B.3.3样品制备(dn/dc测定)
准确称取供试品适量,用上述流动相溶解并稀释至适宜浓度,再用流动相按照1:5、2:4、3:3、4:2、5:1的浓度比进行梯度稀释,配制成6个不同浓度的系列样品,用0.22μm过滤器过滤。B.4步骤
B.4.1折光指数增量(dn/dc):用流动相清洗后的进样器,依次从低浓度到高浓度抽取适量样品,注人示差检测器,在基线出现平行时采集数据1min,通过仪器系统测定出dn/dc。B.4.2将色谱柱与激光散射仪和示差检测器连接,流动相冲洗至基线平稳后,取适量样品溶液进样,在规定流速、色谱柱温度条件下检测样品的相对分子质量及相对分子质量分布。B.5结果计算
检测完毕后,通过仪器配套的色谱分析软件确定样品的峰面积,输人dn/dc值,根据软件要求设置9
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。