YY/T 1730-2020
基本信息
标准号: YY/T 1730-2020
中文名称:一次性使用血液透析导管
标准类别:医药行业标准(YY)
标准状态:现行
出版语种:简体中文
下载格式:.zip .pdf
下载大小:7419031

标准分类号
关联标准
出版信息
相关单位信息
标准简介
YY/T 1730-2020.Hemodialysis catheter for single use.
1范圈
YY/T 1730规定了与血液净化及相关治疗配合使用的一次性使用血液透析导管(以下简称透析导管)的术语和定义、分类、要求及试验方法。
YY/T 1730适用于与血液净化及相关治疗配合使用的透析导管,包括无隧道无涤纶套导管和带隧道带諜纶套导管。本标准不包含对与透析导管配合使用的其他附件的要求。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注8期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 1962.2注射器 .注射针及其他医疗器械6%(鲁尔)圆锥接头第2 部分:锁定接头
GB/T 6682分析实验室用水 规格和试验方法
GB 8368一次性使用输液器 重力输液式
GB/T 13074血 液净化术语
GB/T 14233.1医用输液 .输血.注射器具检验方法第1 部分:化学分析方法
GB/T 16886.1医疗器械生物学评价 第1部分;风险管理过程中的评价与试验
YY 0030- 2004 腹膜透析管
YY 0267血液透析及相关治疗 血 液净化装置的体外循环血路
YY 0285.1- -2017 血管内导臂- .次性使用无菌导管第1部分:通用要求
YY/T 0586医用高分 子制品X 射线不透性试验方法《中华人民共和国药典)(2015年版)四部
3术语和定义
GB/T 13074中界定的及以下术语和定义适用于本文件。
3.1
套环cuff固定在透析导管上的一段利于组织攀生的环状物(常由绦纶材料制造),有助于透析导管植人人体后固定,皮下隧道内组织攀生封合套环,降低体外微生物通过导管外壁进人患者体内的风险。
3.2
有效长度ffective length造析导管(水合性导管包括水合前和水合后)能插人患者体内的最大长度。
4分类
根据导管的结构不同进行分类,透析导管可分为无隧道无绦纶套导管和带隧道带涤纶套导管。
1范圈
YY/T 1730规定了与血液净化及相关治疗配合使用的一次性使用血液透析导管(以下简称透析导管)的术语和定义、分类、要求及试验方法。
YY/T 1730适用于与血液净化及相关治疗配合使用的透析导管,包括无隧道无涤纶套导管和带隧道带諜纶套导管。本标准不包含对与透析导管配合使用的其他附件的要求。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注8期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 1962.2注射器 .注射针及其他医疗器械6%(鲁尔)圆锥接头第2 部分:锁定接头
GB/T 6682分析实验室用水 规格和试验方法
GB 8368一次性使用输液器 重力输液式
GB/T 13074血 液净化术语
GB/T 14233.1医用输液 .输血.注射器具检验方法第1 部分:化学分析方法
GB/T 16886.1医疗器械生物学评价 第1部分;风险管理过程中的评价与试验
YY 0030- 2004 腹膜透析管
YY 0267血液透析及相关治疗 血 液净化装置的体外循环血路
YY 0285.1- -2017 血管内导臂- .次性使用无菌导管第1部分:通用要求
YY/T 0586医用高分 子制品X 射线不透性试验方法《中华人民共和国药典)(2015年版)四部
3术语和定义
GB/T 13074中界定的及以下术语和定义适用于本文件。
3.1
套环cuff固定在透析导管上的一段利于组织攀生的环状物(常由绦纶材料制造),有助于透析导管植人人体后固定,皮下隧道内组织攀生封合套环,降低体外微生物通过导管外壁进人患者体内的风险。
3.2
有效长度ffective length造析导管(水合性导管包括水合前和水合后)能插人患者体内的最大长度。
4分类
根据导管的结构不同进行分类,透析导管可分为无隧道无绦纶套导管和带隧道带涤纶套导管。
标准图片预览




标准内容
ICS_11.040
中华人民共和国医药行业标准
YY/T 1730—2020
一次性使用血液透析导管
Hemodialysiscatheterforsingleuse2020-06-30发布
国家药品监督管理局
2021-06-01实施
本标准按照GB/T1.1一2009给出的规则起草。YY/T1730—2020
请注意本文件的某些内容可能涉及专利。本文件的发布机构不承担识别这些专利的责任。本标准由国家药品监督管理局提出。本标准由全国医用体外循环设备标准化技术委员会(SAC/TC158)归口。本标准起草单位:广东省医疗器械质量监督检验所、广州健恩医疗设备有限公司、广东百合医疗科技股份有限公司。
本标准主要起草人:何晓帆、胡相华、梁翠芳、李诗、潘木球、徐苏华。rrKaeerkAca-
1范围
一次性使用血液透析导管
YY/T1730—2020
本标准规定了与血液净化及相关治疗配合使用的一次性使用血液透析导管(以下简称透析导管)的术语和定义、分类、要求及试验方法。本标准适用于与血液净化及相关治疗配合使用的透析导管,包括无隧道无涤纶套导管和带隧道带涤纶套导管。本标准不包含对与透析导管配合使用的其他附件的要求。2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。GB/T1962.2注射器、注射针及其他医疗器械6%(鲁尔)圆锥接头第2部分:锁定接头GB/T6682分析实验室用水规格和试验方法GB8368一次性使用输液器重力输液式GB/T13074血液净化术语
GB/T14233.1医用输液、输血、注射器具检验方法第1部分:化学分析方法GB/T16886.1医疗器械生物学评价第1部分:风险管理过程中的评价与试验YY0030—2004腹膜透析管
YY0267血液透析及相关治疗血液净化装置的体外循环血路YY0285.1一2017血管内导管一次性使用无菌导管第1部分:通用要求YY/T0586医用高分子制品X射线不透性试验方法《中华人民共和国药典》(2015年版)四部3术语和定义
GB/T13074中界定的及以下术语和定义适用于本文件。3.1
套环cuff
固定在透析导管上的一段利于组织攀生的环状物(常由涤纶材料制造),有助于透析导管植入人体后固定,皮下隧道内组织攀生封合套环,降低体外微生物通过导管外壁进入患者体内的风险。3.2
有效长度
effectivelength
透析导管(水合性导管包括水合前和水合后)能插人患者体内的最大长度。4分类
根据导管的结构不同进行分类,透析导管可分为无隧道无涤纶套导管和带隧道带涤纶套导管。1
-iiKaeerkAca-
YY/T1730—2020
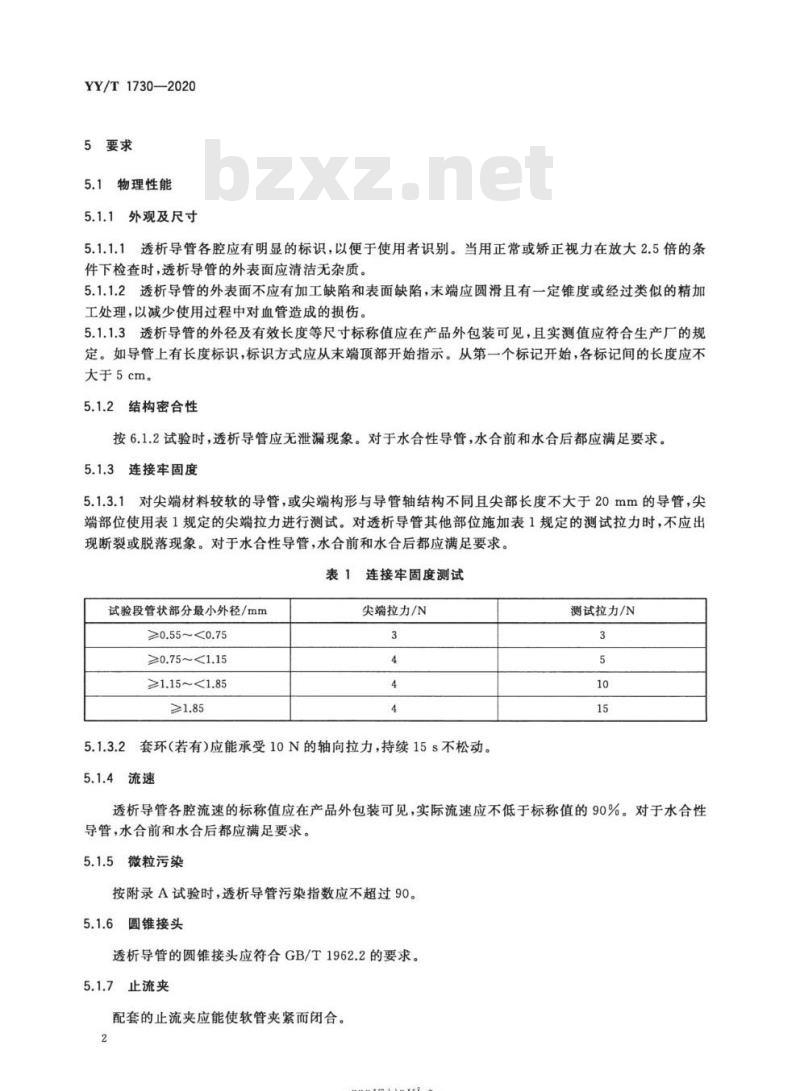
5要求
5.1物理性能
外观及尺寸
5.1.1.1透析导管各腔应有明显的标识,以便于使用者识别。当用正常或矫正视力在放大2.5倍的条件下检查时,透析导管的外表面应清洁无杂质。5.1.1.2透析导管的外表面不应有加工缺陷和表面缺陷,末端应圆滑且有一定锥度或经过类似的精加工处理,以减少使用过程中对血管造成的损伤。5.1.1.3透析导管的外径及有效长度等尺寸标称值应在产品外包装可见,且实测值应符合生产厂的规定。如导管上有长度标识,标识方式应从末端顶部开始指示。从第一个标记开始,各标记间的长度应不大于5cm。
5.1.2结构密合性
按6.1.2试验时,透析导管应无泄漏现象。对于水合性导管,水合前和水合后都应满足要求。5.1.3连接牢固度
5.1.3.1对尖端材料较软的导管,或尖端构形与导管轴结构不同且尖部长度不大于20mm的导管,尖端部位使用表1规定的尖端拉力进行测试。对透析导管其他部位施加表1规定的测试拉力时,不应出现断裂或脱落现象。对于水合性导管,水合前和水合后都应满足要求。表1连接牢固度测试
试验段管状部分最小外径/mm
≥0.55~<0.75
≥0.75~<1.15
≥1.15~<1.85
尖端拉力/N
5.1.3.2套环(若有)应能承受10N的轴向拉力,持续15s不松动。5.1.4流速
测试拉力/N
透析导管各腔流速的标称值应在产品外包装可见,实际流速应不低于标称值的90%。对于水合性导管,水合前和水合后都应满足要求。5.1.5微粒污染
按附录A试验时,透析导管污染指数应不超过90。5.1.6圆锥接头
透析导管的圆锥接头应符合GB/T1962.2的要求。5.1.7止流夹
配套的止流夹应能使软管夹紧而闭合。2
rKaeerkAca-
射线可探测性
透析导管应能被X射线探测。
5.2化学性能
5.2.1还原物质
YY/T1730—2020
检验液与同批空白对照液所消耗的高锰酸钾溶液[c(KMnO,)=0.002mol/L的体积之差应不超过2.0mL。
2重金属
当用原子吸收分光光度计法(AAS)或相当的方法进行测定时,检验液中钡、铬、铜、铅、锡的总含量应不超过1μg/mL,镉的含量应不超过0.1μg/mL。当用比色法进行测定时,检验液呈现的颜色应不超过质量浓度p(Pb2+)=1μg/mL的标准对照液。5.2.3
酸碱度
检验液与同批空白对照液对比,pH之差应不超过1.5。5.2.4
蒸发残渣
50mL检验液的蒸发残渣的总量应不超过2mg。5.2.5
紫外吸光度
检验液的吸光度应不大于0.1。
6色泽
检验液应无色透明。
环氧乙烷残留量
如透析导管采用环氧乙烷气体灭菌,其环氧乙烷残留量应不大于10μg/g。5.3
有效期
应给出有效期,有效期内产品应符合规定要求。生物性能
5.4.1无菌
透析导管应无菌。
2热原
透析导管应无热原反应。
3细菌内毒素
细菌内毒素结果应不超过20EU/支。3
-rrKaeerkAca-
YY/T1730—2020
5.4.4生物学评价
透析导管中与血液直接或间接接触的部件应进行生物学危害的评价。注:应根据透析导管的临床接触时间按GB/T16886.1选择生物学评价项目。6试验方法
6.1物理性能下载标准就来标准下载网
外观及尺寸
以目力观察或通用量具进行测量,应符合5.1.1的规定。6.1.2结构密合性
6.1.2.1正压试验
用37℃士1℃C的水注满器件,封闭所有端口。施加300kPa压力并至少保持10min,目视检察器件,应符合5.1.2的规定。
负压试验
用37℃士1℃的除气泡水注满器件,封闭所有端口。施加93.3kPa负压,若在高海拔地区则施加可获得的最高负压值,并至少保持10min,目视检察器件,应符合5.1.2的规定。6.1.3连接牢固度
6.1.3.1选定导管试验段,使各管状部分、导管座或连接器与管路之间的各个连接点及各管状部分之间的连接点都被测试到。对各试验段施加标准所规定的的拉伸力,保持15s,应符合5.1.3.1的规定。6.1.3.2按YY0030—2004中附录A试验方法进行,应符合5.1.3.2的规定。6.1.4流速
按YY0285.1一2017中附录E试验方法进行,应符合5.1.4的规定。6.1.5微粒污染
按附录A方法进行,应符合5.1.5的规定。6.1.6圆锥接头
按GB/T1962.2中试验方法进行,应符合5.1.6的规定。6.1.7止流夹
反复夹闭打开止流夹(无涤纶套导管重复30次,带涤纶套导管重复60次),将透析导管充满水,关闭止流夹,然后按6.1.2.1进行测试,应符合5.1.7的规定。6.1.8射线可探测性
按YY/T0586中试验方法进行,应符合5.1.8的规定。注:当采用光密度法时,推荐以0.10的光密度差作为最低可接受标准;当采用数字图像分析方法评价时,推荐以2.0mm厚度的铝板作为用户规定的标准品。4
-rrKaeerKAca-
6.2化学性能
6.2.1制备检验液
YY/T1730—2020
将完整的透析导管切成1cm长的段,按样品重量0.2g加1mL水的比例加入符合GB/T6682的一级水或二级水,37℃土1℃下浸提72h,将样品与液体分离,冷却至室温作为检验液。取同体积水,不装样品同法制备空白对照液。6.2.2还原物质
按GB/T14233.1中还原物质间接滴定法进行,应符合5.2.1的规定。6.2.3重金属
原子吸收法:按GB/T14233.1中原子吸收分光光度计法或相当的方法规定进行检验,应符合5.2.2的规定。
比色法:按GB/T14233.1中重金属总含量方法一进行检验,应符合5.2.2的规定。6.2.4酸碱度
按GB/T14233.1中酸度计法进行,应符合5.2.3的规定。6.2.5蒸发残渣
按GB/T14233.1中蒸发残渣试验方法进行,应符合5.2.4的规定。6.2.6紫外吸光度
按GB/T14233.1中紫外吸光度试验方法在250nm~320nm波长范围内进行,应符合5.2.5的规定。
6.2.7色泽
目力观察,应符合5.2.6的规定。6.2.8环氧乙烷残留量
按GB/T14233.1中气相色谱法进行,应符合5.2.7的规定。6.3有效期
取过期不超过一个月的产品(仲裁法,宜优先采用),或按YY0267的规定进行加速老化,检测5.1.2、5.4.1、5.4.2,结果应符合5.3的规定。注:带涂层的透析导管建议使用仲裁法进行有效期试验,涂层的评价指南参见附录B。6.4生物性能
6.4.1无菌
按《中华人民共和国药典》(2015年版)四部的相关规定进行,应符合5.4.1的规定。6.4.2热原
按《中华人民共和国药典》(2015年版)四部的相关规定进行,应符合5.4.2的规定。5
-riKacerKAca-
YY/T1730—2020
6.4.3细菌内毒素
按《中华人民共和国药典》(2015年版)四部的相关规定进行,应符合5.4.3的规定6.4.4生物学评价
按GB/T16886.1的规定进行生物学评价,应符合5.4.4的规定。rrKaeerkAca
A.1方法
附录A
(规范性附录)
微粒污染试验方法
YY/T1730—2020
按GB8368规定的方法进行,但洗脱液制备及污染指数计算按A.2和A.3的规定进行。A.2洗脱液制备
取10支供用状态的导管,各用30mL冲洗液均匀冲洗导管内腔(操作过程中应注意避免污染管身外壁),剪下并弃去导管座,将导管的管身部分浸人上述液体中,振荡20s,得300mL汇集洗脱液,按表A.1测试并计算导管中的平均微粒数。收集10等份30mL共300mL冲洗液,不加样品同法进行测试,按表A.1计算空白对照液的平均微粒数。空白中的微粒数(N,)应不超过9,否则应拆开试验装置重新清洗,并重新进行背景试验。试验报告中应注明空白微粒数测定值。表A.1
微粒污染评价
微粒大小/μm
10支导管中平均微粒数
空白对照液中平均微粒数
评价系数
3污染指数计算
尺寸分类
51~100
对各尺寸分类的10支导管中的平均微粒数分别乘以评价系数,各结果相加即得导管的微粒数N。。再对各尺寸分类的空白对照样品中的微粒数分别乘以评价系数,各结果相加即得空白样品中的微粒数N.。
导管微粒数:
N.=n.X0.1+n,X0.2十nX5
空白微粒数:
N,=nb,Xo.1+nbXo.2+nb,X5
污染指数:
N=N.-N,90
-rrKaeerKAca-
YY/T1730—2020
B.1概述
附录B
(资料性附录)
透析导管涂层评价指南
带有涂层的透析导管,建议补充涂层的覆盖度、稳定性及效果评价。2涂层覆盖度评价
涂层覆盖度可根据生产厂规定的验证方法进行验证示例:肝素涂层的覆盖度可通过使用阳离子染料(如甲苯胺蓝)染色进行验证。染料被带负电荷的表面吸附时颜色会发生改变(蓝色变为紫色),通过观察颜色分布情况评价涂层覆盖度。B.3涂层稳定性评价
涂层稳定性可根据生产厂规定的验证方法进行验证。测试时应规定适当的提取介质,模拟最大额定条件下进行。额定条件包括温度、流量、压力、持续时间等。B.4
涂层效果评价
生产广可根据预期的临床效果规定合适的评价试验方法。8
-rrKaeerKAca-
GB19335
参考文献
一次性使用血路产品通用技术条件YY0285.1
YY/T1492
YY/T1556
一次性使用无菌导管第1部分:通用要求血管内导管
表面涂层产品通用要求
心肺转流系统
医用输液、输血、注射器具微粒污染检验方法YY/T1730—2020
中国医院协会血液净化中心管理分会血液净化通路学组。中国血液透析用血管通路专家共[5]
识(第1版)[J].中国血液净化.2014,13(8):549~558.9
-riKaeerkca-
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
中华人民共和国医药行业标准
YY/T 1730—2020
一次性使用血液透析导管
Hemodialysiscatheterforsingleuse2020-06-30发布
国家药品监督管理局
2021-06-01实施
本标准按照GB/T1.1一2009给出的规则起草。YY/T1730—2020
请注意本文件的某些内容可能涉及专利。本文件的发布机构不承担识别这些专利的责任。本标准由国家药品监督管理局提出。本标准由全国医用体外循环设备标准化技术委员会(SAC/TC158)归口。本标准起草单位:广东省医疗器械质量监督检验所、广州健恩医疗设备有限公司、广东百合医疗科技股份有限公司。
本标准主要起草人:何晓帆、胡相华、梁翠芳、李诗、潘木球、徐苏华。rrKaeerkAca-
1范围
一次性使用血液透析导管
YY/T1730—2020
本标准规定了与血液净化及相关治疗配合使用的一次性使用血液透析导管(以下简称透析导管)的术语和定义、分类、要求及试验方法。本标准适用于与血液净化及相关治疗配合使用的透析导管,包括无隧道无涤纶套导管和带隧道带涤纶套导管。本标准不包含对与透析导管配合使用的其他附件的要求。2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。GB/T1962.2注射器、注射针及其他医疗器械6%(鲁尔)圆锥接头第2部分:锁定接头GB/T6682分析实验室用水规格和试验方法GB8368一次性使用输液器重力输液式GB/T13074血液净化术语
GB/T14233.1医用输液、输血、注射器具检验方法第1部分:化学分析方法GB/T16886.1医疗器械生物学评价第1部分:风险管理过程中的评价与试验YY0030—2004腹膜透析管
YY0267血液透析及相关治疗血液净化装置的体外循环血路YY0285.1一2017血管内导管一次性使用无菌导管第1部分:通用要求YY/T0586医用高分子制品X射线不透性试验方法《中华人民共和国药典》(2015年版)四部3术语和定义
GB/T13074中界定的及以下术语和定义适用于本文件。3.1
套环cuff
固定在透析导管上的一段利于组织攀生的环状物(常由涤纶材料制造),有助于透析导管植入人体后固定,皮下隧道内组织攀生封合套环,降低体外微生物通过导管外壁进入患者体内的风险。3.2
有效长度
effectivelength
透析导管(水合性导管包括水合前和水合后)能插人患者体内的最大长度。4分类
根据导管的结构不同进行分类,透析导管可分为无隧道无涤纶套导管和带隧道带涤纶套导管。1
-iiKaeerkAca-
YY/T1730—2020
5要求
5.1物理性能
外观及尺寸
5.1.1.1透析导管各腔应有明显的标识,以便于使用者识别。当用正常或矫正视力在放大2.5倍的条件下检查时,透析导管的外表面应清洁无杂质。5.1.1.2透析导管的外表面不应有加工缺陷和表面缺陷,末端应圆滑且有一定锥度或经过类似的精加工处理,以减少使用过程中对血管造成的损伤。5.1.1.3透析导管的外径及有效长度等尺寸标称值应在产品外包装可见,且实测值应符合生产厂的规定。如导管上有长度标识,标识方式应从末端顶部开始指示。从第一个标记开始,各标记间的长度应不大于5cm。
5.1.2结构密合性
按6.1.2试验时,透析导管应无泄漏现象。对于水合性导管,水合前和水合后都应满足要求。5.1.3连接牢固度
5.1.3.1对尖端材料较软的导管,或尖端构形与导管轴结构不同且尖部长度不大于20mm的导管,尖端部位使用表1规定的尖端拉力进行测试。对透析导管其他部位施加表1规定的测试拉力时,不应出现断裂或脱落现象。对于水合性导管,水合前和水合后都应满足要求。表1连接牢固度测试
试验段管状部分最小外径/mm
≥0.55~<0.75
≥0.75~<1.15
≥1.15~<1.85
尖端拉力/N
5.1.3.2套环(若有)应能承受10N的轴向拉力,持续15s不松动。5.1.4流速
测试拉力/N
透析导管各腔流速的标称值应在产品外包装可见,实际流速应不低于标称值的90%。对于水合性导管,水合前和水合后都应满足要求。5.1.5微粒污染
按附录A试验时,透析导管污染指数应不超过90。5.1.6圆锥接头
透析导管的圆锥接头应符合GB/T1962.2的要求。5.1.7止流夹
配套的止流夹应能使软管夹紧而闭合。2
rKaeerkAca-
射线可探测性
透析导管应能被X射线探测。
5.2化学性能
5.2.1还原物质
YY/T1730—2020
检验液与同批空白对照液所消耗的高锰酸钾溶液[c(KMnO,)=0.002mol/L的体积之差应不超过2.0mL。
2重金属
当用原子吸收分光光度计法(AAS)或相当的方法进行测定时,检验液中钡、铬、铜、铅、锡的总含量应不超过1μg/mL,镉的含量应不超过0.1μg/mL。当用比色法进行测定时,检验液呈现的颜色应不超过质量浓度p(Pb2+)=1μg/mL的标准对照液。5.2.3
酸碱度
检验液与同批空白对照液对比,pH之差应不超过1.5。5.2.4
蒸发残渣
50mL检验液的蒸发残渣的总量应不超过2mg。5.2.5
紫外吸光度
检验液的吸光度应不大于0.1。
6色泽
检验液应无色透明。
环氧乙烷残留量
如透析导管采用环氧乙烷气体灭菌,其环氧乙烷残留量应不大于10μg/g。5.3
有效期
应给出有效期,有效期内产品应符合规定要求。生物性能
5.4.1无菌
透析导管应无菌。
2热原
透析导管应无热原反应。
3细菌内毒素
细菌内毒素结果应不超过20EU/支。3
-rrKaeerkAca-
YY/T1730—2020
5.4.4生物学评价
透析导管中与血液直接或间接接触的部件应进行生物学危害的评价。注:应根据透析导管的临床接触时间按GB/T16886.1选择生物学评价项目。6试验方法
6.1物理性能下载标准就来标准下载网
外观及尺寸
以目力观察或通用量具进行测量,应符合5.1.1的规定。6.1.2结构密合性
6.1.2.1正压试验
用37℃士1℃C的水注满器件,封闭所有端口。施加300kPa压力并至少保持10min,目视检察器件,应符合5.1.2的规定。
负压试验
用37℃士1℃的除气泡水注满器件,封闭所有端口。施加93.3kPa负压,若在高海拔地区则施加可获得的最高负压值,并至少保持10min,目视检察器件,应符合5.1.2的规定。6.1.3连接牢固度
6.1.3.1选定导管试验段,使各管状部分、导管座或连接器与管路之间的各个连接点及各管状部分之间的连接点都被测试到。对各试验段施加标准所规定的的拉伸力,保持15s,应符合5.1.3.1的规定。6.1.3.2按YY0030—2004中附录A试验方法进行,应符合5.1.3.2的规定。6.1.4流速
按YY0285.1一2017中附录E试验方法进行,应符合5.1.4的规定。6.1.5微粒污染
按附录A方法进行,应符合5.1.5的规定。6.1.6圆锥接头
按GB/T1962.2中试验方法进行,应符合5.1.6的规定。6.1.7止流夹
反复夹闭打开止流夹(无涤纶套导管重复30次,带涤纶套导管重复60次),将透析导管充满水,关闭止流夹,然后按6.1.2.1进行测试,应符合5.1.7的规定。6.1.8射线可探测性
按YY/T0586中试验方法进行,应符合5.1.8的规定。注:当采用光密度法时,推荐以0.10的光密度差作为最低可接受标准;当采用数字图像分析方法评价时,推荐以2.0mm厚度的铝板作为用户规定的标准品。4
-rrKaeerKAca-
6.2化学性能
6.2.1制备检验液
YY/T1730—2020
将完整的透析导管切成1cm长的段,按样品重量0.2g加1mL水的比例加入符合GB/T6682的一级水或二级水,37℃土1℃下浸提72h,将样品与液体分离,冷却至室温作为检验液。取同体积水,不装样品同法制备空白对照液。6.2.2还原物质
按GB/T14233.1中还原物质间接滴定法进行,应符合5.2.1的规定。6.2.3重金属
原子吸收法:按GB/T14233.1中原子吸收分光光度计法或相当的方法规定进行检验,应符合5.2.2的规定。
比色法:按GB/T14233.1中重金属总含量方法一进行检验,应符合5.2.2的规定。6.2.4酸碱度
按GB/T14233.1中酸度计法进行,应符合5.2.3的规定。6.2.5蒸发残渣
按GB/T14233.1中蒸发残渣试验方法进行,应符合5.2.4的规定。6.2.6紫外吸光度
按GB/T14233.1中紫外吸光度试验方法在250nm~320nm波长范围内进行,应符合5.2.5的规定。
6.2.7色泽
目力观察,应符合5.2.6的规定。6.2.8环氧乙烷残留量
按GB/T14233.1中气相色谱法进行,应符合5.2.7的规定。6.3有效期
取过期不超过一个月的产品(仲裁法,宜优先采用),或按YY0267的规定进行加速老化,检测5.1.2、5.4.1、5.4.2,结果应符合5.3的规定。注:带涂层的透析导管建议使用仲裁法进行有效期试验,涂层的评价指南参见附录B。6.4生物性能
6.4.1无菌
按《中华人民共和国药典》(2015年版)四部的相关规定进行,应符合5.4.1的规定。6.4.2热原
按《中华人民共和国药典》(2015年版)四部的相关规定进行,应符合5.4.2的规定。5
-riKacerKAca-
YY/T1730—2020
6.4.3细菌内毒素
按《中华人民共和国药典》(2015年版)四部的相关规定进行,应符合5.4.3的规定6.4.4生物学评价
按GB/T16886.1的规定进行生物学评价,应符合5.4.4的规定。rrKaeerkAca
A.1方法
附录A
(规范性附录)
微粒污染试验方法
YY/T1730—2020
按GB8368规定的方法进行,但洗脱液制备及污染指数计算按A.2和A.3的规定进行。A.2洗脱液制备
取10支供用状态的导管,各用30mL冲洗液均匀冲洗导管内腔(操作过程中应注意避免污染管身外壁),剪下并弃去导管座,将导管的管身部分浸人上述液体中,振荡20s,得300mL汇集洗脱液,按表A.1测试并计算导管中的平均微粒数。收集10等份30mL共300mL冲洗液,不加样品同法进行测试,按表A.1计算空白对照液的平均微粒数。空白中的微粒数(N,)应不超过9,否则应拆开试验装置重新清洗,并重新进行背景试验。试验报告中应注明空白微粒数测定值。表A.1
微粒污染评价
微粒大小/μm
10支导管中平均微粒数
空白对照液中平均微粒数
评价系数
3污染指数计算
尺寸分类
51~100
对各尺寸分类的10支导管中的平均微粒数分别乘以评价系数,各结果相加即得导管的微粒数N。。再对各尺寸分类的空白对照样品中的微粒数分别乘以评价系数,各结果相加即得空白样品中的微粒数N.。
导管微粒数:
N.=n.X0.1+n,X0.2十nX5
空白微粒数:
N,=nb,Xo.1+nbXo.2+nb,X5
污染指数:
N=N.-N,90
-rrKaeerKAca-
YY/T1730—2020
B.1概述
附录B
(资料性附录)
透析导管涂层评价指南
带有涂层的透析导管,建议补充涂层的覆盖度、稳定性及效果评价。2涂层覆盖度评价
涂层覆盖度可根据生产厂规定的验证方法进行验证示例:肝素涂层的覆盖度可通过使用阳离子染料(如甲苯胺蓝)染色进行验证。染料被带负电荷的表面吸附时颜色会发生改变(蓝色变为紫色),通过观察颜色分布情况评价涂层覆盖度。B.3涂层稳定性评价
涂层稳定性可根据生产厂规定的验证方法进行验证。测试时应规定适当的提取介质,模拟最大额定条件下进行。额定条件包括温度、流量、压力、持续时间等。B.4
涂层效果评价
生产广可根据预期的临床效果规定合适的评价试验方法。8
-rrKaeerKAca-
GB19335
参考文献
一次性使用血路产品通用技术条件YY0285.1
YY/T1492
YY/T1556
一次性使用无菌导管第1部分:通用要求血管内导管
表面涂层产品通用要求
心肺转流系统
医用输液、输血、注射器具微粒污染检验方法YY/T1730—2020
中国医院协会血液净化中心管理分会血液净化通路学组。中国血液透析用血管通路专家共[5]
识(第1版)[J].中国血液净化.2014,13(8):549~558.9
-riKaeerkca-
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。