YY/T 0523-2009
基本信息
标准号: YY/T 0523-2009
中文名称:ISO/TR 1175: 1993 牙科学牙种植体开发指南
标准类别:医药行业标准(YY)
标准状态:现行
出版语种:简体中文
下载格式:.zip .pdf
下载大小:1574966

标准分类号
关联标准
出版信息
相关单位信息
标准简介
YY/T 0523-2009/ISO/TR 1175: 1993.Dentistry Guidelines for developing dental implants.
1范围
YY/T 0523为生产始定类型的牙种植体产品提供了通用性指南。原则和概念。本标准的日的不是定义理想牙种植体。
YY/T 0523包括技术方面和生物方面(分别见5 1和5. 2)的内容。
2规范性引用文件
下列文件中的条款通过本标准的引用面成为本标准的条款。凡是生日期的引用文件.其随后所有的修改单(不包括勘误的内容)或修订成均不适用于本标准.然而.鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不谁日期的引用文件.其最新版本适用于本标准。
GB/T 9937.1- 2008 口腔词汇 第1部分:基本和临床术语(ISO 1942-1.1989.IDT)
GB/T 16886.1-201医疗器械生物学评价 第1部分:评价与试验(IS0 1091.1997,11)1
YY/T028- 2008牙科学口腔医疗器械生物学评价 第1单元:评价与试验(ISO/FDIS 7405,2008,NEQ)
YY/T0287- -00医疗器械质量管理体系用于法规的要求(ISO 1485.200.1010
YY/T 0524- -2009牙科学牙种植体系统技术文件内容(IS0 10451.2002,.DT)
3术请及定义
GB/T 9937. 1以及下列术语和定义适用于本标准。
3.1
牙种植体deatal implant通过外科1手术方法植人到上领或下领骨内或骨上的装置,用以抵扰牙科修复装置的移位。它可以是穿经牙齦的(一部分植人体位于牙服上,做为直接桥基)。或完全位于牙龈下(目的为支持活动修复装置)。[GB/T 987. 1- 2008中的1. 080]
3. 2
经概管种植体或经根尖种植体trunseododou tle implant or transradiclar implant专门设计和/成制备的经根管或通过牙根到达骨肉的棒状植入体。[GB/T 9937.1- 2008中的1. 081]
3.3
骨内种植体endusscous implant部分或整体植人骨里的牙种植体。完全堰植的牙种植体fully eabedded dental implant完全敏牙雄或北腐覆董的牙种植体。
3.
穿颛种植体(穿贴膜种植体) traghgtral [ransmosa] implant穿口腔黏膜,其延伸至口腔的部分用以抵抗牙科修复装置的移位的牙种植体。
1范围
YY/T 0523为生产始定类型的牙种植体产品提供了通用性指南。原则和概念。本标准的日的不是定义理想牙种植体。
YY/T 0523包括技术方面和生物方面(分别见5 1和5. 2)的内容。
2规范性引用文件
下列文件中的条款通过本标准的引用面成为本标准的条款。凡是生日期的引用文件.其随后所有的修改单(不包括勘误的内容)或修订成均不适用于本标准.然而.鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不谁日期的引用文件.其最新版本适用于本标准。
GB/T 9937.1- 2008 口腔词汇 第1部分:基本和临床术语(ISO 1942-1.1989.IDT)
GB/T 16886.1-201医疗器械生物学评价 第1部分:评价与试验(IS0 1091.1997,11)1
YY/T028- 2008牙科学口腔医疗器械生物学评价 第1单元:评价与试验(ISO/FDIS 7405,2008,NEQ)
YY/T0287- -00医疗器械质量管理体系用于法规的要求(ISO 1485.200.1010
YY/T 0524- -2009牙科学牙种植体系统技术文件内容(IS0 10451.2002,.DT)
3术请及定义
GB/T 9937. 1以及下列术语和定义适用于本标准。
3.1
牙种植体deatal implant通过外科1手术方法植人到上领或下领骨内或骨上的装置,用以抵扰牙科修复装置的移位。它可以是穿经牙齦的(一部分植人体位于牙服上,做为直接桥基)。或完全位于牙龈下(目的为支持活动修复装置)。[GB/T 987. 1- 2008中的1. 080]
3. 2
经概管种植体或经根尖种植体trunseododou tle implant or transradiclar implant专门设计和/成制备的经根管或通过牙根到达骨肉的棒状植入体。[GB/T 9937.1- 2008中的1. 081]
3.3
骨内种植体endusscous implant部分或整体植人骨里的牙种植体。完全堰植的牙种植体fully eabedded dental implant完全敏牙雄或北腐覆董的牙种植体。
3.
穿颛种植体(穿贴膜种植体) traghgtral [ransmosa] implant穿口腔黏膜,其延伸至口腔的部分用以抵抗牙科修复装置的移位的牙种植体。
标准图片预览




标准内容
ICS11.060.10
中华人民共和国医药行业标准
YY/T0523--2009/ISO/TR11175:1993牙科学
牙种植体开发指南
Dentistry
Guidelines for developing dental implants(ISO/TR11175:1993IDT)
2009-12-30发布
国家食品药品监督管理局
2011-06-01实施Www.bzxZ.net
本标准的全部技术内容为推荐性的。前
YY/T0523—2009/ISO/TR11175:1993本标准等同来用ISO/TR11175:1993(Dentalimplants-Guidelinesfordevelopingdentalim-plants)。
本标准依据ISO/TR11175:1993重新起草。规范性引用文件中以最新版本标准代替了已废除的旧标准。本标准与ISO/TR11175:1993的差异已编人正文中,并在它们所涉及的条款的页边空白处用垂直单线标识。
本标准与ISO/TR11175:1993的主要差异和原因如下:删除了2规范性引用文件中作废标推ISO6018:1987.并相应在条款7删除相关内容;-规范性引用文件中的ISO/TR9966:1989改为GB/T16886.1医疗器械生物学评价第1部分:评价与试验,并相应在5.2.2替换相关内容;规范性引用文件中的ISO90011987改为YY/T0287一2003于法规的要求(ISO13485:2003),并相应在5.1.2替换相关内容。本标准由国家食品药品监督管理局提出。本标准由国家食品药品监督管理局批准。质量管理体系
医疗器械
本标准由全国口腔材料和器械设备标推化技术委员会(SAC/TC99)归口。本标准起草单位:北京大学口腔医学院口腔医疗器械检测中心。本标准主要起草人:郑刚、白伟、徐永祥。YY/T0523—2009/IS0/TR11175:1993言
本标准的目的在于建立牙种植体开发通用指南。1范围
YY/T0523-2009/ISO/TR11175:1993牙科学
牙种植体开发指南
本标推为生产给定类型的牙种植体产品提供了通用性指南、原则和概念。本标准的目的不是定义理想牙种植体。
本标准包括技术方面和生物方面(分别见5.1和5.2)的内容。2规范性引用文件
下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。GB/T9937.12008口腔词汇第1部分:基本和临床术语(ISO1942-1:1989IDT)GB/T16886.1一2001医疗器械生物学评价第1部分:评价与试验(ISO10993-1:1997,IDT)YY/T0268一2008牙科学口腔医疗器械生物学评价第1单元:评价与试验(ISO/FDIS7405:2008.NEQ)
YY/T0287—2003医疗器械质量管理体系用于法规的要求(ISO13485:2003,IDT)YY/T0524—2009牙科学牙种植体系统技术文件内容(ISO10451:2002,IDT)3术语及定义
GB/T9937.1以及下列术语和定义适用于本标准。3.1
牙种植体dentalimplant
通过外科手术方法植人到上颌或下颌骨内或骨上的装置,用以抵抗牙科修复装置的移位。它可以是穿经牙龈的(一部分植人体位于牙龈上,做为直接桥基),或完全位于牙龈下(目的为支持活动修复装置。【GB/T9937.1—2008中的1.080】3.2
transendodontic implant or transradicular implant经根管种植体或经根尖种植体
专门设计和/或制备的经根管或通过牙根到达骨内的棒状植人体。【GB/T9937.1一2008中的1.0811
骨内种植体endosseous implant部分或整体植人骨里的牙种植体。3.4
完全埋植的牙种植体fullyembeddeddentalimplant完全被牙龈或黏膜覆盖的牙种植体。3.5
穿龈种植体(穿黏膜种植体)transgingival【transmucosal]implant穿口腔黏膜,其延伸至口腔的部分用以抵抗牙科修复装置的移位的牙种植体。YY/T0523—2009/ISO/TR11175:19933.6
骨膜下种植体subperiostealimplant位于骨膜和骨表面之间的牙种植体。3.7
黏膜内种植体intramucosalimplant位于口腔软组织层内的牙种植体。3.8
transosseous implant
穿颌骨种植体
位于穿颌骨上边界和下边界放置的牙种植体,通常由口腔外切口植人。4牙种植体的受力
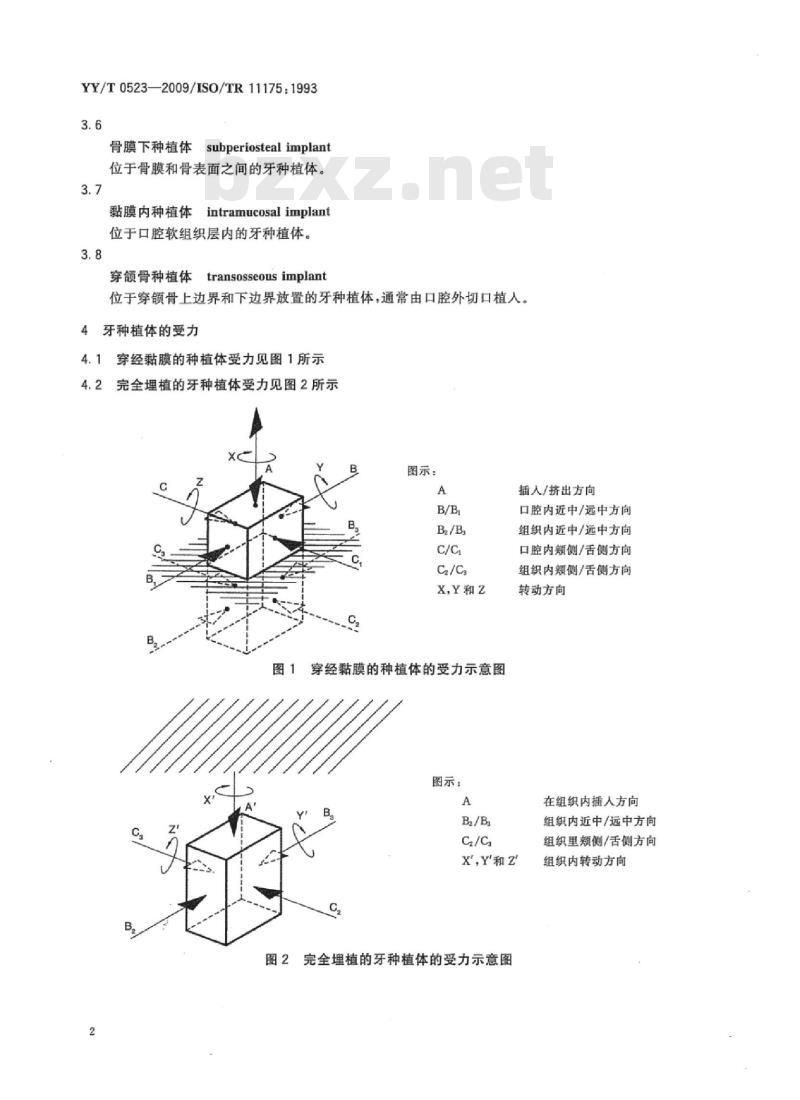
4.1穿经黏膜的种植体受力见图1所示4.2完全埋植的牙种植体受力见图2所示图示:
X,Y和z
图1穿经黏膜的种植体的受力示意图图示:
插入/挤出方向
口腔内近中/远中方向
组织内近中/远中方向
口腔内颊侧/舌侧方向
组织内颊侧/舌侧方向
转动方向
在组织内插人方向
组织内近中/远中方向
组织里颊侧/舌侧方向
X\,Y'和z
完全埋植的牙种植体的受力示意图组织内转动方向
5建议
5.1技术性方面建议
YY/T0523—2009/IS0/TR11175:19935.1.1种植体的设计者应综合来自于研究、临床、和技术经验的所有可用性信息,包括:a)生物材料科学和生物学特性;b)
周围组织的生物力学和生物学反应;c)
包括牙科技工工艺学在内的义齿修复学;口腔外科学;
牙周病学;
放射影像学。
5.1.2这些指南应当与YY/T0287质量体系结合,其中至少包括:设计控制,包括材料的技术规范、理论计算、鉴定试验、临床试验、制造厂资料[见b和设计a)
记录:
b)制造信息数据,包括原料、中间产品和最终产品的检验、制图和工作指导书的程序,包装、标签、灭菌和质量记录程序。
5.1.3应根据YY/T0524的格式描述所选取材料的固有内在特性。5.1.4应给出包括切削、机加工、最终表面处理、灭菌和消毒等与种植体有关的制造程序。5.2生物学方面建议
生物学建议有三个方面
a)考虑不同类型牙种植体的安全性和有效性的特殊需要;b)规定评价安全性和有效性的方法;一在所选原料级别水平上的考虑;牙种植体在体内和体外试验水平上的考虑;c)与临床试验操作规范(GCP)一致。5.2.2这些建议的制定应考虑YY/T0268和GB/T16886.1标准。6测试
注1:临床评价要区分由ISO/TC194/WG4起草的临床调查方案中的“水平标准”和ISO/TC106/SC8/WG1和WG2为起草的测试牙种植体的“垂直标准”。6.1测试方法应模拟植入时和与其上部结构结合在一起行使功能时所承受的力。目的是包括疲劳试验和电化学现象的评价。
6.2这些测试中所用固定器具应能使种植体以模拟植人部位参数的方式固定,并施以适宜的具有一定方向性的载荷并予以记录。
6.3测试应模拟种植体在体内的实际状态,包括疲劳试验。7标识、标签和包装
生产厂应为使用者提供包括种植体的操作和植入的使用说明书。3
中华人民共和国医药
行业标准
牙科学
牙种植体开发指南
YY/T0523—2009/ISO/TR11175:1993中国医药科技出版社出版发行
北京市海淀区文慧园北路甲22号邮政编码:100082
网址cmstp.com
电话:发行:010-62227427邮购:010—62236938三河市腾飞印务有限公司印刷
各地新华书店经销
开本880X1230
印张0.5
字数12千字
2011年5月第一次印刷
2011年5月第一版
书号:145067·44
定价15.00元
如有印装差错由本社发行部调换版权专有侵权必究
举报电话:(010)62214756
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
中华人民共和国医药行业标准
YY/T0523--2009/ISO/TR11175:1993牙科学
牙种植体开发指南
Dentistry
Guidelines for developing dental implants(ISO/TR11175:1993IDT)
2009-12-30发布
国家食品药品监督管理局
2011-06-01实施Www.bzxZ.net
本标准的全部技术内容为推荐性的。前
YY/T0523—2009/ISO/TR11175:1993本标准等同来用ISO/TR11175:1993(Dentalimplants-Guidelinesfordevelopingdentalim-plants)。
本标准依据ISO/TR11175:1993重新起草。规范性引用文件中以最新版本标准代替了已废除的旧标准。本标准与ISO/TR11175:1993的差异已编人正文中,并在它们所涉及的条款的页边空白处用垂直单线标识。
本标准与ISO/TR11175:1993的主要差异和原因如下:删除了2规范性引用文件中作废标推ISO6018:1987.并相应在条款7删除相关内容;-规范性引用文件中的ISO/TR9966:1989改为GB/T16886.1医疗器械生物学评价第1部分:评价与试验,并相应在5.2.2替换相关内容;规范性引用文件中的ISO90011987改为YY/T0287一2003于法规的要求(ISO13485:2003),并相应在5.1.2替换相关内容。本标准由国家食品药品监督管理局提出。本标准由国家食品药品监督管理局批准。质量管理体系
医疗器械
本标准由全国口腔材料和器械设备标推化技术委员会(SAC/TC99)归口。本标准起草单位:北京大学口腔医学院口腔医疗器械检测中心。本标准主要起草人:郑刚、白伟、徐永祥。YY/T0523—2009/IS0/TR11175:1993言
本标准的目的在于建立牙种植体开发通用指南。1范围
YY/T0523-2009/ISO/TR11175:1993牙科学
牙种植体开发指南
本标推为生产给定类型的牙种植体产品提供了通用性指南、原则和概念。本标准的目的不是定义理想牙种植体。
本标准包括技术方面和生物方面(分别见5.1和5.2)的内容。2规范性引用文件
下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。GB/T9937.12008口腔词汇第1部分:基本和临床术语(ISO1942-1:1989IDT)GB/T16886.1一2001医疗器械生物学评价第1部分:评价与试验(ISO10993-1:1997,IDT)YY/T0268一2008牙科学口腔医疗器械生物学评价第1单元:评价与试验(ISO/FDIS7405:2008.NEQ)
YY/T0287—2003医疗器械质量管理体系用于法规的要求(ISO13485:2003,IDT)YY/T0524—2009牙科学牙种植体系统技术文件内容(ISO10451:2002,IDT)3术语及定义
GB/T9937.1以及下列术语和定义适用于本标准。3.1
牙种植体dentalimplant
通过外科手术方法植人到上颌或下颌骨内或骨上的装置,用以抵抗牙科修复装置的移位。它可以是穿经牙龈的(一部分植人体位于牙龈上,做为直接桥基),或完全位于牙龈下(目的为支持活动修复装置。【GB/T9937.1—2008中的1.080】3.2
transendodontic implant or transradicular implant经根管种植体或经根尖种植体
专门设计和/或制备的经根管或通过牙根到达骨内的棒状植人体。【GB/T9937.1一2008中的1.0811
骨内种植体endosseous implant部分或整体植人骨里的牙种植体。3.4
完全埋植的牙种植体fullyembeddeddentalimplant完全被牙龈或黏膜覆盖的牙种植体。3.5
穿龈种植体(穿黏膜种植体)transgingival【transmucosal]implant穿口腔黏膜,其延伸至口腔的部分用以抵抗牙科修复装置的移位的牙种植体。YY/T0523—2009/ISO/TR11175:19933.6
骨膜下种植体subperiostealimplant位于骨膜和骨表面之间的牙种植体。3.7
黏膜内种植体intramucosalimplant位于口腔软组织层内的牙种植体。3.8
transosseous implant
穿颌骨种植体
位于穿颌骨上边界和下边界放置的牙种植体,通常由口腔外切口植人。4牙种植体的受力
4.1穿经黏膜的种植体受力见图1所示4.2完全埋植的牙种植体受力见图2所示图示:
X,Y和z
图1穿经黏膜的种植体的受力示意图图示:
插入/挤出方向
口腔内近中/远中方向
组织内近中/远中方向
口腔内颊侧/舌侧方向
组织内颊侧/舌侧方向
转动方向
在组织内插人方向
组织内近中/远中方向
组织里颊侧/舌侧方向
X\,Y'和z
完全埋植的牙种植体的受力示意图组织内转动方向
5建议
5.1技术性方面建议
YY/T0523—2009/IS0/TR11175:19935.1.1种植体的设计者应综合来自于研究、临床、和技术经验的所有可用性信息,包括:a)生物材料科学和生物学特性;b)
周围组织的生物力学和生物学反应;c)
包括牙科技工工艺学在内的义齿修复学;口腔外科学;
牙周病学;
放射影像学。
5.1.2这些指南应当与YY/T0287质量体系结合,其中至少包括:设计控制,包括材料的技术规范、理论计算、鉴定试验、临床试验、制造厂资料[见b和设计a)
记录:
b)制造信息数据,包括原料、中间产品和最终产品的检验、制图和工作指导书的程序,包装、标签、灭菌和质量记录程序。
5.1.3应根据YY/T0524的格式描述所选取材料的固有内在特性。5.1.4应给出包括切削、机加工、最终表面处理、灭菌和消毒等与种植体有关的制造程序。5.2生物学方面建议
生物学建议有三个方面
a)考虑不同类型牙种植体的安全性和有效性的特殊需要;b)规定评价安全性和有效性的方法;一在所选原料级别水平上的考虑;牙种植体在体内和体外试验水平上的考虑;c)与临床试验操作规范(GCP)一致。5.2.2这些建议的制定应考虑YY/T0268和GB/T16886.1标准。6测试
注1:临床评价要区分由ISO/TC194/WG4起草的临床调查方案中的“水平标准”和ISO/TC106/SC8/WG1和WG2为起草的测试牙种植体的“垂直标准”。6.1测试方法应模拟植入时和与其上部结构结合在一起行使功能时所承受的力。目的是包括疲劳试验和电化学现象的评价。
6.2这些测试中所用固定器具应能使种植体以模拟植人部位参数的方式固定,并施以适宜的具有一定方向性的载荷并予以记录。
6.3测试应模拟种植体在体内的实际状态,包括疲劳试验。7标识、标签和包装
生产厂应为使用者提供包括种植体的操作和植入的使用说明书。3
中华人民共和国医药
行业标准
牙科学
牙种植体开发指南
YY/T0523—2009/ISO/TR11175:1993中国医药科技出版社出版发行
北京市海淀区文慧园北路甲22号邮政编码:100082
网址cmstp.com
电话:发行:010-62227427邮购:010—62236938三河市腾飞印务有限公司印刷
各地新华书店经销
开本880X1230
印张0.5
字数12千字
2011年5月第一次印刷
2011年5月第一版
书号:145067·44
定价15.00元
如有印装差错由本社发行部调换版权专有侵权必究
举报电话:(010)62214756
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。