YY/T 1095-2007
标准分类号
关联标准
出版信息
相关单位信息
标准简介
YY/T 1095-2007.Myoelectric biofeedback equipment.
1范围
YY/T 1095规定了肌电生物反馈仪的术语、要求.试验方法、检验规则和标志、包装、运输、贮存。
YY/T 1095适用于肌电生物反馈仪(以下简称“肌反仪”)。
2规范性引用文件
下列文件中的条款通过本标准的引用成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。
GB/T 191- -2000包装 储运图示标志
GB9706.1-1995医用电气设备 第一部分:通 用安全要求(idt IEC 601-1:1988)
GB9706. 15- 1999 医用电气设备 第- -部分:通用安全要求1. 并列标准:医用电气系统安全要求(IEC 60601-1-1:1995,IDT)
GB/T 14710- -1993医用电 气设备环境要求及试验方法
GB/T 16886. 1- -2001医疗器械生物学评价第 1部分:评价与试验(ISO 10993-1:1997 ,IDT)
GB/T 16886.5- -2003 医疗器械生物学评价 第 5部分:体外细胞毒性试验(ISO 10993-5:1999,IDT)
GB/T 16886. 10-2005
医疗器械生物学评价
第10部分:刺激与迟发型超敏反应试验(ISO 10993-10:2002 ,IDT)
YY0505- -2005 医用电气设备 第 1-2部分:安全通用要求并列标准:电磁兼容 要求和试验(IEC 60601-1-2:2001 ,IDT)
3术语和定义
下列术语和定义适用于本标准。
3.1
肌电生物反馈仪myoelectric biofeedback equipment以肌电作为生理信息,以相应的视觉或听觉等形式反馈给受训者的治疗心身疾病和康复治疗的仪器。
4要求
1范围
YY/T 1095规定了肌电生物反馈仪的术语、要求.试验方法、检验规则和标志、包装、运输、贮存。
YY/T 1095适用于肌电生物反馈仪(以下简称“肌反仪”)。
2规范性引用文件
下列文件中的条款通过本标准的引用成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。
GB/T 191- -2000包装 储运图示标志
GB9706.1-1995医用电气设备 第一部分:通 用安全要求(idt IEC 601-1:1988)
GB9706. 15- 1999 医用电气设备 第- -部分:通用安全要求1. 并列标准:医用电气系统安全要求(IEC 60601-1-1:1995,IDT)
GB/T 14710- -1993医用电 气设备环境要求及试验方法
GB/T 16886. 1- -2001医疗器械生物学评价第 1部分:评价与试验(ISO 10993-1:1997 ,IDT)
GB/T 16886.5- -2003 医疗器械生物学评价 第 5部分:体外细胞毒性试验(ISO 10993-5:1999,IDT)
GB/T 16886. 10-2005
医疗器械生物学评价
第10部分:刺激与迟发型超敏反应试验(ISO 10993-10:2002 ,IDT)
YY0505- -2005 医用电气设备 第 1-2部分:安全通用要求并列标准:电磁兼容 要求和试验(IEC 60601-1-2:2001 ,IDT)
3术语和定义
下列术语和定义适用于本标准。
3.1
肌电生物反馈仪myoelectric biofeedback equipment以肌电作为生理信息,以相应的视觉或听觉等形式反馈给受训者的治疗心身疾病和康复治疗的仪器。
4要求
标准图片预览




标准内容
ICS11.040.60
中华人民共和国医药行业标准
YY/T1095—2007
代替YY91095-1999
肌电生物反馈仪
Myoelectricbiofeedbackequipment2007-01-31发布
国家食品药品监督管理局
2008-01-01实施
YY/T1095—2007
本标准的安全要求全面贯彻GB9706.1一1995《医用电气设备第一部分:安全通用要求》和YY0505一2005《医用电气设备第1-2部分:安全通用要求并列标准:电磁兼容要求和试验》的规定。
本标准的电磁兼容性要求与YY0505一2005《医用电气设备第1-2部分:安全通用要求
并列标
准:电磁兼容要求和试验》同期执行,本标准代替YY91095—1999《肌电生物反馈仪》。本标准与YY910951999相比主要变化如下:a)增加了反馈灵敏度的要求;
b)增加了说明书中必须对反馈信号进行描述的规定;增加了带计算机控制的温度生物反馈仪的隔离要求;d)增加了与人体接触的非金属应用部分的生物相容性要求。本标准由国家食品药品监督管理局提出。本标准由全国医用电器标准化技术委员会物理治疗设备分技术委员会归口。本标准起草单位:国家食品药品监督管理局天津医疗器械质量监督检验中心。本标准主要起草人:段传英、杨国消、杨健、韩漠、杨建刚。1范围
肌电生物反馈仪
YY/T1095—2007
本标准规定了肌电生物反馈仪的术语、要求、试验方法、检验规则和标志、包装、运输、贮存。本标准适用于肌电生物反馈仪(以下简称“肌反仪”)。2规范性引用文件
下列文件中的条款通过本标准的引用成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。GB/T191-2000包装储运图示标志GB9706.1-1995医用电气设备第一部分:通用安全要求(idtIEC601-1:1988)GB9706.15一1999医用电气设备第一部分:通用安全要求1.并列标准:医用电气系统安全要求(IEC60601-1-1:1995,IDT)GB/T14710—1993医用电气设备环境要求及试验方法GB/T16886.1—2001
GB/T16886.5—2003
GB/T16886.10-2005bzxZ.net
(ISO10993-10:2002IDT)
医疗器械生物学评价第1部分:评价与试验(ISO10993-1:1997,IDT)医疗器械生物学评价第5部分:体外细胞毒性试验(ISO10993-5:1999,第10部分:刺激与迟发型超敏反应试验医疗器械生物学评价
YY0505—2005医用电气设备第1-2部分:安全通用要求并列标准:电磁兼容
(IEC60601-1-22001,IDT)
3术语和定义
下列术语和定义适用于本标准。3.1
myoelectric biofeedbackequipment肌电生物反馈仪
要求和试验
以肌电作为生理信息,以相应的视觉或听觉等形式反馈给受训者的治疗心身疾病和康复治疗的仪器。
4要求
4.1工作条件
4.1.1环境温度:5℃~40℃,
4.1.2相对湿度:不大于80%。
4.1.3电源应符合下列规定:
a)交流供电:220V±22V,频率50Hz士1Hz。b)直流供电:电压应不大于60V。4.2性能
4.2.1测量范围:1μV~999μV。4.2.2最高分辨率:小于0.2μV。1
YY/T1095—2007
4.2.3输人噪声:小于1μV。
4.2.4通频带:120Hz~1000Hz(-3dB)。4.2.5差模输入阻抗:大于5Mo。4.2.6共模抑制比:大于100dB。4.2.7在说明书中应对反馈信号的方式进行描述。4.2.8当测得肌电信号变化达到0.2μV时,反馈信号即有变化,4.2.9带计算机的肌反仪,肌电测量部分与计算机应有效的隔离,计算机应符合相应的安全标准。4.3外观
治疗仪外观应整洁,色泽均匀,无划痕、裂纹等缺陷。控制和调节机构应安装牢固,灵活可靠,紧固件部位应无松动。
4.4安全
应符合GB9706.1-1995的要求。
4.5电磁兼容性
应符合YY0505—2005的要求。
4.6非金属应用部分的生物相容性应按GB/T16886.1--2001对材料进行生物学评价,基本评价试验为:a)细胞毒性:
b)致敏:
刺激或皮内反应。
4.7环境试验要求
肌反仪的环境试验应符合GB/T14710—1993中气候环境I组、机械环境Ⅱ组的要求。5试验方法
5.1预处理
试验前治疗仪应在试验场所不通电停放至少24h,在正式进行试验之前,应先按使用说明书的要求运转治疗仪。
5.2校验肌反仪的显示(指示)系统首先用低频信号发生器和交流毫伏表校验肌反仪的显示(指示)系统,其精度应符合要求。再用肌反仪本身的显示(指示),测量其他技术指标。5.2.1测试仪器应符合下列规定:a)
低频信号发生器:频率误差≤2%,非线性失真≤0.1%;交流毫伏表:误差不大于±2.5%,输入电阻大于1MQ,频率范围10Hz~1MHz;b)
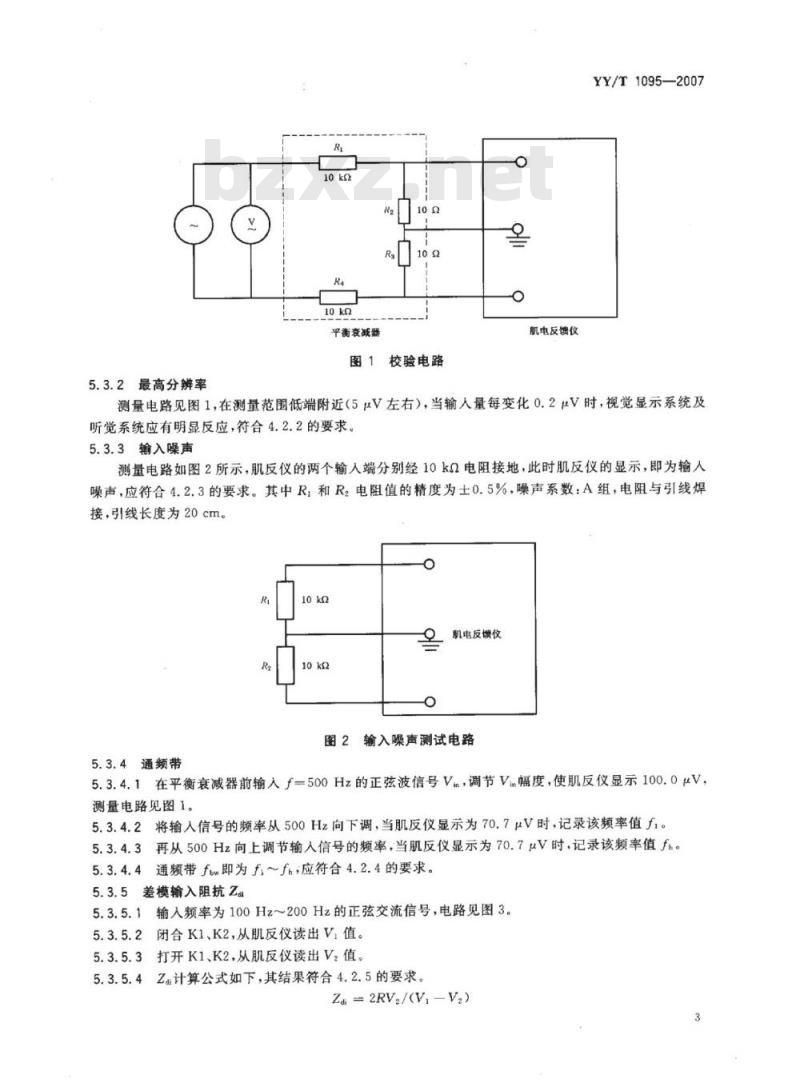
c)平衡衰减器:1:1000;无感电阻精度土0.5%;低噪声。5.2.2校验电路见图1。
5.2.3将正弦交流信号经平衡衰减器加至肌反仪的输人端,信号频率为中心频率500Hz。5.2.4调信号源输出电压幅度,使显示系统表示的读数分别为各档的10%和90%所对应的值,从交流毫伏表依次读取各相应值的读数,其精度应在10%之内。5.3性能试验
5.3.1测量范围
测量电路见图1,信号频率为500Hz的正弦波,调节输入电压幅度,使显示系统的读数为999V,读取相应输人信号数值,误差应小于10%;低端为噪声信号折算到输人端的有效值,测量结果应符合4.2.1的要求。
5.3.2最高分辨率
平衡衰减器
图1校验电路
肌电反馈仪
YY/T1095—2007
测量电路见图1,在测量范围低端附近(5μV左右),当输入量每变化0.2μV时,视觉显示系统及听觉系统应有明显反应,符合4.2.2的要求。5.3.3输入噪声
测量电路如图2所示,肌反仪的两个输人端分别经10k2电阻接地,此时肌反仪的显示,即为输人噪声,应符合4.2.3的要求。其中R,和R2电阻值的精度为士0.5%,噪声系数:A组,电阻与引线焊接,引线长度为20cm。
10 ks2
肌电反馈仪
图2输入噪声测试电路
5.3.4通频带
5.3.4.1在平衡衰减器前输人f=500Hz的正弦波信号Vi,调节V幅度,使肌反仪显示100.0μV,测量电路见图1。
5.3.4.2将输入信号的频率从500Hz向下调,当肌反仪显示为70.7μV时,记录该频率值f1。5.3.4.3再从500Hz向上调节输入信号的频率,当肌反仪显示为70.7μV时,记录该频率值f。5.3.4.4通频带fw即为f~fh,应符合4.2.4的要求。5.3.5差模输入阻抗Za
5.3.5.1输入频率为100Hz~200Hz的正弦交流信号,电路见图3。5.3.5.2闭合K1、K2,从肌反仪读出V,值。5.3.5.3打开K1、K2,从肌反仪读出V2值。5.3.5.4:Za计算公式如下,其结果符合4.2.5的要求。Zd=2RVe/(V,-V2)
YY/T1095-—2007
式中:
(200kQ~1M0),误差±1%。
平衡衰减器
图3差模输入阻抗测试图
5.3.6共模抑制比CMRR
肌电反馈仪
两输人端短接,对“地输人V.为1V~5V,频率为120Hz的正弦交流信号,电路如图4所示。记录肌反仪显示的数值V。,按下式计算,其结果符合4.2.6的要求。CMRR=20lg(K..V./V.)
式中:
K—差模放大倍数,(Kg=0.7)。
肌电反馈仪
5.3.7反馈信号描述的检查
图4共模抑制比测试图
通过检查说明书予以验证,应符合4.2.7的要求。5.3.8反馈信号响应试验
将肌电信号变化0.2μV,反馈信号应符合4.2.8的要求。5.3.9测温部分隔离试验
按GB9706.15—1995中17g)规定的方法进行试验,应符合4.2.9的要求。5.4外观检验
以目力观测及操作予以验证,应符合4.3的要求。5.5安全试验
按GB9706.1-1995中规定的方法进行,应符合4.4的要求。5.6电磁兼容性
按YY0505—2005中规定的方法进行,应符合4.5的要求。4
5.7非金属应用部分的生物相容性试验按GB/T16886.1一2001进行生物评价。如有必要按下列试验进行:细胞毒性试验:按GB/T16886.5—2003的规定进行;a)
b)致敏试验:按GB/T16886.10—2005的规定进行;c)刺激或皮内反应试验:按GB/T16886.10—2005的规定进行。5.8环境试验
按GB/T14710—1993中规定的方法进行试验,应符合4.7的规定。6检验规则
出厂检验
肌反仪应由生产商质量检验部门逐台检验合格后方可出厂。6.2型式检验
在下列情况之一时应进行型式检验:6.2.1
新产品投产前;
正常生产中每年不少于一次;
设计、工艺、材料有重大变化时;停产一年以上再生产时;
国家质量监督部门提出要求时。型式检验包括:
注册检验;
周期检验;
安全认证检验。
YY/T1095--2007
6.3检验项目
6.3.1出厂检验项目:本标准中的4.2和4.3,安全性能至少检验GB9706.1一1995中第18章、第19意和第20章,
6.3.2型式检验项目:本标准中的全部检验项目。6.4抽样
6.4.1出厂检验逐台进行,交收试验抽样按表1规定。表1抽
交验数量/台
抽样比例
6.4.2型式检验为送样检验,送样数量为1台。6.5判定规则
6.5.1出厂检验
不少于1台
出厂检验结果应所有检查项目都符合标准要求时,方判定为合格,否则判定为不合格。6.5.2型式检验
在检验的项目中,如有不符合本标准要求的项目时,允许对不合格项进行修复,修复后根据验收方或“第三方”与生产方共同商定的复验项目进行检验,如仍有一项不符合本标准要求时,判为不合格。5
YY/T1095—2007
7标志、包装、运输、贮存
治疗仪在适当的明显位置,应固定铭牌一块,铭牌上应有下列标志:7.1.1
产品出厂编号:
产品注册号和产品标准号:
出厂日期。
检验合格证上应有下列标志:
产品名称及型号;
出厂编号;
检验日期;
检验员代号。
包装箱上应有下列标志:
制造厂名称及地址:
产品名称及型号:
净重、毛重;
外型尺寸(长×宽×高);
出厂日期;
“小心轻放”“向上”“怕湿”等字样或标志,标志应符合GB/T191一2000的有关规定;产品注册号。
治疗仪应装在具有防潮、防震措施的包装箱内。包装箱内应有下列文件:
说明书;
b)装箱单:
检验合格证。
7.3运输
按订货合同规定。
7.4贮存
包装后的治疗仪应贮存在温度一40℃~55℃、相对湿度不超过90%、无腐蚀性气体和通风良好的室内。
YY/T1095-2007
中华人民共和国医药
行业标准
肌电生物反馈仪
YY/T1095—2007
中国标准出版社出版发行
北京复兴门外三里河北街16号
邮政编码:100045
网址spc.net.cn
电话:6852394668517548
中国标准出版社秦皇岛印刷厂印刷各地新华书店经销
开本880×12301/16
印张0.75字数13千字
2007年7月第一版2007年7月第一次印刷书号:155066·2-17738定价14.00元如有印装差错由本社发行中心调换版权专有侵权必究
举报电话:(010)68533533
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
中华人民共和国医药行业标准
YY/T1095—2007
代替YY91095-1999
肌电生物反馈仪
Myoelectricbiofeedbackequipment2007-01-31发布
国家食品药品监督管理局
2008-01-01实施
YY/T1095—2007
本标准的安全要求全面贯彻GB9706.1一1995《医用电气设备第一部分:安全通用要求》和YY0505一2005《医用电气设备第1-2部分:安全通用要求并列标准:电磁兼容要求和试验》的规定。
本标准的电磁兼容性要求与YY0505一2005《医用电气设备第1-2部分:安全通用要求
并列标
准:电磁兼容要求和试验》同期执行,本标准代替YY91095—1999《肌电生物反馈仪》。本标准与YY910951999相比主要变化如下:a)增加了反馈灵敏度的要求;
b)增加了说明书中必须对反馈信号进行描述的规定;增加了带计算机控制的温度生物反馈仪的隔离要求;d)增加了与人体接触的非金属应用部分的生物相容性要求。本标准由国家食品药品监督管理局提出。本标准由全国医用电器标准化技术委员会物理治疗设备分技术委员会归口。本标准起草单位:国家食品药品监督管理局天津医疗器械质量监督检验中心。本标准主要起草人:段传英、杨国消、杨健、韩漠、杨建刚。1范围
肌电生物反馈仪
YY/T1095—2007
本标准规定了肌电生物反馈仪的术语、要求、试验方法、检验规则和标志、包装、运输、贮存。本标准适用于肌电生物反馈仪(以下简称“肌反仪”)。2规范性引用文件
下列文件中的条款通过本标准的引用成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。GB/T191-2000包装储运图示标志GB9706.1-1995医用电气设备第一部分:通用安全要求(idtIEC601-1:1988)GB9706.15一1999医用电气设备第一部分:通用安全要求1.并列标准:医用电气系统安全要求(IEC60601-1-1:1995,IDT)GB/T14710—1993医用电气设备环境要求及试验方法GB/T16886.1—2001
GB/T16886.5—2003
GB/T16886.10-2005bzxZ.net
(ISO10993-10:2002IDT)
医疗器械生物学评价第1部分:评价与试验(ISO10993-1:1997,IDT)医疗器械生物学评价第5部分:体外细胞毒性试验(ISO10993-5:1999,第10部分:刺激与迟发型超敏反应试验医疗器械生物学评价
YY0505—2005医用电气设备第1-2部分:安全通用要求并列标准:电磁兼容
(IEC60601-1-22001,IDT)
3术语和定义
下列术语和定义适用于本标准。3.1
myoelectric biofeedbackequipment肌电生物反馈仪
要求和试验
以肌电作为生理信息,以相应的视觉或听觉等形式反馈给受训者的治疗心身疾病和康复治疗的仪器。
4要求
4.1工作条件
4.1.1环境温度:5℃~40℃,
4.1.2相对湿度:不大于80%。
4.1.3电源应符合下列规定:
a)交流供电:220V±22V,频率50Hz士1Hz。b)直流供电:电压应不大于60V。4.2性能
4.2.1测量范围:1μV~999μV。4.2.2最高分辨率:小于0.2μV。1
YY/T1095—2007
4.2.3输人噪声:小于1μV。
4.2.4通频带:120Hz~1000Hz(-3dB)。4.2.5差模输入阻抗:大于5Mo。4.2.6共模抑制比:大于100dB。4.2.7在说明书中应对反馈信号的方式进行描述。4.2.8当测得肌电信号变化达到0.2μV时,反馈信号即有变化,4.2.9带计算机的肌反仪,肌电测量部分与计算机应有效的隔离,计算机应符合相应的安全标准。4.3外观
治疗仪外观应整洁,色泽均匀,无划痕、裂纹等缺陷。控制和调节机构应安装牢固,灵活可靠,紧固件部位应无松动。
4.4安全
应符合GB9706.1-1995的要求。
4.5电磁兼容性
应符合YY0505—2005的要求。
4.6非金属应用部分的生物相容性应按GB/T16886.1--2001对材料进行生物学评价,基本评价试验为:a)细胞毒性:
b)致敏:
刺激或皮内反应。
4.7环境试验要求
肌反仪的环境试验应符合GB/T14710—1993中气候环境I组、机械环境Ⅱ组的要求。5试验方法
5.1预处理
试验前治疗仪应在试验场所不通电停放至少24h,在正式进行试验之前,应先按使用说明书的要求运转治疗仪。
5.2校验肌反仪的显示(指示)系统首先用低频信号发生器和交流毫伏表校验肌反仪的显示(指示)系统,其精度应符合要求。再用肌反仪本身的显示(指示),测量其他技术指标。5.2.1测试仪器应符合下列规定:a)
低频信号发生器:频率误差≤2%,非线性失真≤0.1%;交流毫伏表:误差不大于±2.5%,输入电阻大于1MQ,频率范围10Hz~1MHz;b)
c)平衡衰减器:1:1000;无感电阻精度土0.5%;低噪声。5.2.2校验电路见图1。
5.2.3将正弦交流信号经平衡衰减器加至肌反仪的输人端,信号频率为中心频率500Hz。5.2.4调信号源输出电压幅度,使显示系统表示的读数分别为各档的10%和90%所对应的值,从交流毫伏表依次读取各相应值的读数,其精度应在10%之内。5.3性能试验
5.3.1测量范围
测量电路见图1,信号频率为500Hz的正弦波,调节输入电压幅度,使显示系统的读数为999V,读取相应输人信号数值,误差应小于10%;低端为噪声信号折算到输人端的有效值,测量结果应符合4.2.1的要求。
5.3.2最高分辨率
平衡衰减器
图1校验电路
肌电反馈仪
YY/T1095—2007
测量电路见图1,在测量范围低端附近(5μV左右),当输入量每变化0.2μV时,视觉显示系统及听觉系统应有明显反应,符合4.2.2的要求。5.3.3输入噪声
测量电路如图2所示,肌反仪的两个输人端分别经10k2电阻接地,此时肌反仪的显示,即为输人噪声,应符合4.2.3的要求。其中R,和R2电阻值的精度为士0.5%,噪声系数:A组,电阻与引线焊接,引线长度为20cm。
10 ks2
肌电反馈仪
图2输入噪声测试电路
5.3.4通频带
5.3.4.1在平衡衰减器前输人f=500Hz的正弦波信号Vi,调节V幅度,使肌反仪显示100.0μV,测量电路见图1。
5.3.4.2将输入信号的频率从500Hz向下调,当肌反仪显示为70.7μV时,记录该频率值f1。5.3.4.3再从500Hz向上调节输入信号的频率,当肌反仪显示为70.7μV时,记录该频率值f。5.3.4.4通频带fw即为f~fh,应符合4.2.4的要求。5.3.5差模输入阻抗Za
5.3.5.1输入频率为100Hz~200Hz的正弦交流信号,电路见图3。5.3.5.2闭合K1、K2,从肌反仪读出V,值。5.3.5.3打开K1、K2,从肌反仪读出V2值。5.3.5.4:Za计算公式如下,其结果符合4.2.5的要求。Zd=2RVe/(V,-V2)
YY/T1095-—2007
式中:
(200kQ~1M0),误差±1%。
平衡衰减器
图3差模输入阻抗测试图
5.3.6共模抑制比CMRR
肌电反馈仪
两输人端短接,对“地输人V.为1V~5V,频率为120Hz的正弦交流信号,电路如图4所示。记录肌反仪显示的数值V。,按下式计算,其结果符合4.2.6的要求。CMRR=20lg(K..V./V.)
式中:
K—差模放大倍数,(Kg=0.7)。
肌电反馈仪
5.3.7反馈信号描述的检查
图4共模抑制比测试图
通过检查说明书予以验证,应符合4.2.7的要求。5.3.8反馈信号响应试验
将肌电信号变化0.2μV,反馈信号应符合4.2.8的要求。5.3.9测温部分隔离试验
按GB9706.15—1995中17g)规定的方法进行试验,应符合4.2.9的要求。5.4外观检验
以目力观测及操作予以验证,应符合4.3的要求。5.5安全试验
按GB9706.1-1995中规定的方法进行,应符合4.4的要求。5.6电磁兼容性
按YY0505—2005中规定的方法进行,应符合4.5的要求。4
5.7非金属应用部分的生物相容性试验按GB/T16886.1一2001进行生物评价。如有必要按下列试验进行:细胞毒性试验:按GB/T16886.5—2003的规定进行;a)
b)致敏试验:按GB/T16886.10—2005的规定进行;c)刺激或皮内反应试验:按GB/T16886.10—2005的规定进行。5.8环境试验
按GB/T14710—1993中规定的方法进行试验,应符合4.7的规定。6检验规则
出厂检验
肌反仪应由生产商质量检验部门逐台检验合格后方可出厂。6.2型式检验
在下列情况之一时应进行型式检验:6.2.1
新产品投产前;
正常生产中每年不少于一次;
设计、工艺、材料有重大变化时;停产一年以上再生产时;
国家质量监督部门提出要求时。型式检验包括:
注册检验;
周期检验;
安全认证检验。
YY/T1095--2007
6.3检验项目
6.3.1出厂检验项目:本标准中的4.2和4.3,安全性能至少检验GB9706.1一1995中第18章、第19意和第20章,
6.3.2型式检验项目:本标准中的全部检验项目。6.4抽样
6.4.1出厂检验逐台进行,交收试验抽样按表1规定。表1抽
交验数量/台
抽样比例
6.4.2型式检验为送样检验,送样数量为1台。6.5判定规则
6.5.1出厂检验
不少于1台
出厂检验结果应所有检查项目都符合标准要求时,方判定为合格,否则判定为不合格。6.5.2型式检验
在检验的项目中,如有不符合本标准要求的项目时,允许对不合格项进行修复,修复后根据验收方或“第三方”与生产方共同商定的复验项目进行检验,如仍有一项不符合本标准要求时,判为不合格。5
YY/T1095—2007
7标志、包装、运输、贮存
治疗仪在适当的明显位置,应固定铭牌一块,铭牌上应有下列标志:7.1.1
产品出厂编号:
产品注册号和产品标准号:
出厂日期。
检验合格证上应有下列标志:
产品名称及型号;
出厂编号;
检验日期;
检验员代号。
包装箱上应有下列标志:
制造厂名称及地址:
产品名称及型号:
净重、毛重;
外型尺寸(长×宽×高);
出厂日期;
“小心轻放”“向上”“怕湿”等字样或标志,标志应符合GB/T191一2000的有关规定;产品注册号。
治疗仪应装在具有防潮、防震措施的包装箱内。包装箱内应有下列文件:
说明书;
b)装箱单:
检验合格证。
7.3运输
按订货合同规定。
7.4贮存
包装后的治疗仪应贮存在温度一40℃~55℃、相对湿度不超过90%、无腐蚀性气体和通风良好的室内。
YY/T1095-2007
中华人民共和国医药
行业标准
肌电生物反馈仪
YY/T1095—2007
中国标准出版社出版发行
北京复兴门外三里河北街16号
邮政编码:100045
网址spc.net.cn
电话:6852394668517548
中国标准出版社秦皇岛印刷厂印刷各地新华书店经销
开本880×12301/16
印张0.75字数13千字
2007年7月第一版2007年7月第一次印刷书号:155066·2-17738定价14.00元如有印装差错由本社发行中心调换版权专有侵权必究
举报电话:(010)68533533
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
