YY/T 1216-2013
基本信息
标准号: YY/T 1216-2013
中文名称:甲胎蛋白定量标记免疫分析试剂盒
标准类别:医药行业标准(YY)
标准状态:现行
出版语种:简体中文
下载格式:.zip .pdf
下载大小:1910100
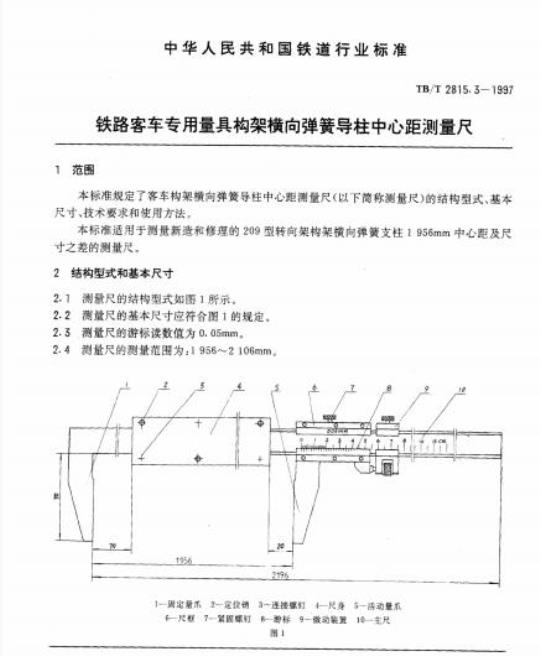
标准分类号
关联标准
出版信息
相关单位信息
标准简介
YY/T 1216-2013.Alpha-fetoprotein quantitative labelling immunoassay kit.
1范围
YY/T 1216规定了甲胎蛋白定量标记免疫分析试剂盒的分类、要求.试验方法,使用说明书、标识、标签以及包装.运输贮存。
YY/T 1216适用于进行甲胎蛋白定量测定的标记免疫分析试剂盒(以下简称AFP试剂盒)。包括以酶标记、化学发光标记、时间分辨荧光标记等标记方法为捕获抗体,以微孔板、管、磁颗粒、微珠和塑料珠等为载体包被抗体,定量测定AFP的免疫分析测定试剂盒。
YY/T 1216不适用于:
a) 胶体金标记AFP试纸条;
b) 用5I等放射性同位素标记的各类放射免疫或免疫放射试剂盒。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注8期的引用文件,仅注日8期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
YY 0466.1医疗器械用于医疗 器械标签、标记和提供信息的符号第1部分:通用要求
3分类
AFP试剂盒按照标记方法不同可以分为酶联免疫法、化学发光法、时间分辨免疫荧光法等AFP试剂盒,根据固相载体不同可以分为微孔板式、管式、磁颗粒、微珠和塑料珠等为载体的AFP试剂盒;根据操作过程的不同可分为手工操作法和仪器自动操作法的AFP试剂盒。
4要求
4.1外观
试剂盒应组分齐全,内外包装均应完整,标签清晰,液体试剂无渗漏,冻千组分呈疏松体,加入去离子水等复溶剂后应在20min内完全溶解.
注:制造商可根据自己产品的包装待点规定适当的外观要求。
4.2最低检测限
最低检测限应不高于5. 0 ng/mL.
4.3剂量-反应曲线的线性
1范围
YY/T 1216规定了甲胎蛋白定量标记免疫分析试剂盒的分类、要求.试验方法,使用说明书、标识、标签以及包装.运输贮存。
YY/T 1216适用于进行甲胎蛋白定量测定的标记免疫分析试剂盒(以下简称AFP试剂盒)。包括以酶标记、化学发光标记、时间分辨荧光标记等标记方法为捕获抗体,以微孔板、管、磁颗粒、微珠和塑料珠等为载体包被抗体,定量测定AFP的免疫分析测定试剂盒。
YY/T 1216不适用于:
a) 胶体金标记AFP试纸条;
b) 用5I等放射性同位素标记的各类放射免疫或免疫放射试剂盒。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注8期的引用文件,仅注日8期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
YY 0466.1医疗器械用于医疗 器械标签、标记和提供信息的符号第1部分:通用要求
3分类
AFP试剂盒按照标记方法不同可以分为酶联免疫法、化学发光法、时间分辨免疫荧光法等AFP试剂盒,根据固相载体不同可以分为微孔板式、管式、磁颗粒、微珠和塑料珠等为载体的AFP试剂盒;根据操作过程的不同可分为手工操作法和仪器自动操作法的AFP试剂盒。
4要求
4.1外观
试剂盒应组分齐全,内外包装均应完整,标签清晰,液体试剂无渗漏,冻千组分呈疏松体,加入去离子水等复溶剂后应在20min内完全溶解.
注:制造商可根据自己产品的包装待点规定适当的外观要求。
4.2最低检测限
最低检测限应不高于5. 0 ng/mL.
4.3剂量-反应曲线的线性
标准图片预览





标准内容
ICS11.100
中华人民共和国医药行业标准
YY/T1216-2013
甲胎蛋自定量标记免疫分析试剂盒Alpha-fetoprotein quantitative labelling immunoassay kit2013-10-21发布
国家食品药品监督管理总局
2014-10-01实施
本标准按照GB/T1.1—2009给出的规则起草言
YY/T1216—2013
请注意本标准的某些内容可能涉及专利。本标准的发布机构不承担识别这些专利的责任。本标推由国家食品药品监督管理总局提出。本标准由全国医用临床检验实验室和体外诊断系统标准化技术委员会(SAC/TC136)归口。本标推起草单位:中国食品药品检定研究院。本标推主要起草人:刘艳、黄题、高尚先。1范围
甲胎蛋白定量标记免疫分析试剂盒YY/T1216—2013
本标准规定了甲胎蛋白定量标记免疫分析试剂盒的分类、要求、试验方法、使用说明书、标识、标签以及包装、运输、贮存。
本标准适用于进行甲胎蛋白定量测定的标记免疫分析试剂盒(以下简称AFP试剂盒)。包括以酶标记,化学发光标记,时间分辨荧光标记等标记方法为捕获抗体,以微孔板,管,磁颗粒,微珠和塑料珠等为载体包被抗体,定量测定AFP的免疫分析测定试剂盒。本标准不适用于:
a)胶体金标记AFP试纸条!
b)用125I等放射性同位素标记的各类放射免疫或免疫放射试剂盒。2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。YY0466.1医疗器械用于医疗器械标签、标记和提供信息的符号第1部分:通用要求3分类
AFP试剂盒按照标记方法不同可以分为酶联免疫法、化学发光法、时间分辨免疫荧光法等AFP试剂盒,根据固相载体不同可以分为微孔板式、管式、磁颗粒、微珠和塑料珠等为载体的AFP试剂盒;根据操作过程的不同可分为手工操作法和仪器自动操作法的AFP试剂盒。4要求
4.1外观
试剂盒应组分齐全,内外包装均应完整,标签清晰,液体试剂无渗漏,冻干组分呈疏松体,加人去离子水等复溶剂后应在20min内完全溶解。注:制造商可根据自己产品的包装特点规定适当的外观要求。4.2最低检测限
最低检测限应不高于5.0ng/mL。4.3剂量-反应曲线的线性
在制造商给定的线性区间内,剂量-反应曲线相关系数(r)应不小于0.9900。4.4准确度
在试剂盒的线性区间内,制备2~3个不同浓度的国家标准品作为样品进行检测,测定值与靶值的1
YY/T1216-—2013
相对偏差不应超过士15.0%。
4.5精密度
4.5.1分析内精密度
在试剂盒的线性范围内,设置2~3个不同浓度的质控品,检测结果的变异系数应不高于15.0%,全自动试剂盒应不高于8.0%。
4.5.2分析间精密度
在试剂盒的线性范围内,设置23个不同浓度的质控品,检测结果的变异系数应不高于20.0%。注:仅限于手工操作的试剂盒。4.5.3批间精密度
在试剂盒的线性范围内,设置2~3个不同浓度的质控品,批间精密度应不高于20.0%。4.6特异性
至少检测10份正常血清,检测结果均应不高于20.0ng/mL。4.7质控品的测定值
在试剂盒的线性范围内,设置2~3个不同浓度的质控品,测定结果应在质控品测定值充许的区间内。
4.8稳定性
可以选用以下方法进行:
效期末稳定性
试剂盒在规定的保存条件下保存至有效期末进行检验,检验结果应符合4.1、4.2、4.3、4.4、4.5.1、4.5.2、4.6、4.7的规定。
4.8.2热稳定性
根据试剂盒的有效期,通常将试剂盒置于37℃一定时间(通常是3d~7d)后,进行检验检验结果应符合4.1,4.2、4.3、4.4、4.5.1、4.5.2、4.6、4.7规定。注1:热稳定性不能用于推导产品有效期,除非是采用基于大量的稳定性研究数据建立的推导公式。注2:根据产品特性可选择以上方法之一进行验证,但所选用方法宜能验证产品的稳定性,以保证在效期内产品性能符合标准要求。
5试验方法
5.1外观
采用目测法,在自然光线明亮处目视,应符合4.1的规定。5.2最低检测限
至少10次平行测定零值校准品或样本稀释液的信号值,计算平均数()与标准差(SD),并计算2
十2SD的值,此值对应的样本浓度为本试剂盒的最低检测限,应符合4.2的要求。5.3剂量-反应曲线的线性
复孔测定试剂盒的校准品,按制造商说明的方式进行拟和,应符合4.3的要求。5.4准确度
YY/T1216—2013
检测不同浓度的国家标准品,每浓度样本检测3次,计算测定结果的均值,并按照公式(1)计算相对偏差,应符合4.4的要求。
式中:
B—相对偏差,%;
测定浓度的均值
一测定样本的靶值。
5.5精密度
5.5.1分析内精密度
用同一批号试剂盒,对不同浓度的质控品分别重复测定10次,计算10次测定结果的平均值()和标准差(SD),根据公式(2)得出变异系数(CV,结果应符合4.5.1规定。SD×100%
式中:
一变异系数,%;
SD——10次测定结果的标推差;元——10次测量结果的平均值。5.5.2分析间精密度
.(2)
用同一批号试剂盒,测定不同浓度的质控品,应不少于3次独立分析,根据公式(2)计算质控品测定值的变异系数,应符合4.5.2规定。5.5.3批间精密度
用3个不同批号试剂盒,检测不同浓度质控品,各10次,根据公式(2)计算30次测定结果的变异系数,应符合4.5.3的要求。
5.6特异性
检测至少10份正常人血清样本,应符合4.6的要求。5.7质控品的测定值
复孔平行测定不同浓度的质控品,计算测定结果的均值,应符合4.7的要求。5.8稳定性
试剂盒按照4.8.1或4.8.2规定的条件贮存后,检测5.1、5.2、5.3、5.4、5.5.1、5.5.2、5.6、5.7,检验结果应符合4.8的要求。
YY/T12162013
6标识、标签和使用说明书
6.1试剂盒标签、包装标识
一般应包括以下内容:
产品名称、型号、规格;
生产企业名称、注册地址、生产地址、联系方式;医疗器械注册证书编号;
产品标准编号;
产品生产日期或批号:
失效日期;
贮存条件。
g)!
产品使用说明书
一般应包括以下内容:
a)产品名称、型号、规格;
生产企业名称、注册地址、生产地址、联系方式及售后服务单位:b)
《医疗器械生产企业许可证》编号(第一类医疗器械除外)、医疗器械注册证书编号:d)产品标准编号:
产品的性能、主要组成、预期用途;e)
检验原理、检验方法、样本要求;参考值(参考区间);
检验结果的解释;
检验方法的局限性;
储存条件及有效期;
注意事项;
参考文献;
说明书批准及修改日期;
产品标准中规定的应当在说明书中标明的其他内容。包装、运输和贮存
7.1包装
包装储运图示标志应符合YY/T0466.1的规定。包装容器应保证密封性良好,完整,无泄露,无破损。
7.2运输
试剂盒应按制造商的要求运输。在运输过程中,应防潮,应防止重物堆压,避免阳光直射和雨雪浸淋,防止与酸碱物质接触,防止内外包装破损。7.3贮存
试剂盒应在制造商规定条件下保存。4
GB3100国际单位制及其应用
参考文献
YY/T1216—2013
参考测量程序的说明
GB/T19702—2005体外诊断医疗器械生物源性样品中量的测量GB/T197032005
体外诊断医疗器械生物源性样品中量的测量叶应妩.全国临床检验操作规范.3版.南京:东南大学出版社,2006WS/T124—1999临床化学体外诊断试剂(盒)质量检验总则参考物质的说明
GB/T29791.1—2013体外诊断医疗器械[6]
制造商提供的信息(标示)
第1部分:术语、定
义和通用要求
YY/T1216-2013
打印日期:2013年12月26日F009中华人民共和国医药
行业标准
甲胎蛋白定量标记免疫分析试剂盒YY/T1216—2013bzxZ.net
中国标准出版社出版发行
北京市朝阳区和平里西街甲2号(100013)北京市西城区三里河北街16号(100045)网址spc.net.cn
总编室:(010))64275323发行中心:(010)51780235读者服务部:(010)68523946
中国标准出版社秦皇岛印刷厂印刷各地新华书店经销
开本880×12301/16印张0.75字数12千字2013年12月第一版
2013年12月第一次印刷
书号:155066·2-26305定价18.00元如有印装差错由本社发行中心调换版权专有侵权必究
举报电话:(010)68510107
-9IGILIAA
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
中华人民共和国医药行业标准
YY/T1216-2013
甲胎蛋自定量标记免疫分析试剂盒Alpha-fetoprotein quantitative labelling immunoassay kit2013-10-21发布
国家食品药品监督管理总局
2014-10-01实施
本标准按照GB/T1.1—2009给出的规则起草言
YY/T1216—2013
请注意本标准的某些内容可能涉及专利。本标准的发布机构不承担识别这些专利的责任。本标推由国家食品药品监督管理总局提出。本标准由全国医用临床检验实验室和体外诊断系统标准化技术委员会(SAC/TC136)归口。本标推起草单位:中国食品药品检定研究院。本标推主要起草人:刘艳、黄题、高尚先。1范围
甲胎蛋白定量标记免疫分析试剂盒YY/T1216—2013
本标准规定了甲胎蛋白定量标记免疫分析试剂盒的分类、要求、试验方法、使用说明书、标识、标签以及包装、运输、贮存。
本标准适用于进行甲胎蛋白定量测定的标记免疫分析试剂盒(以下简称AFP试剂盒)。包括以酶标记,化学发光标记,时间分辨荧光标记等标记方法为捕获抗体,以微孔板,管,磁颗粒,微珠和塑料珠等为载体包被抗体,定量测定AFP的免疫分析测定试剂盒。本标准不适用于:
a)胶体金标记AFP试纸条!
b)用125I等放射性同位素标记的各类放射免疫或免疫放射试剂盒。2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。YY0466.1医疗器械用于医疗器械标签、标记和提供信息的符号第1部分:通用要求3分类
AFP试剂盒按照标记方法不同可以分为酶联免疫法、化学发光法、时间分辨免疫荧光法等AFP试剂盒,根据固相载体不同可以分为微孔板式、管式、磁颗粒、微珠和塑料珠等为载体的AFP试剂盒;根据操作过程的不同可分为手工操作法和仪器自动操作法的AFP试剂盒。4要求
4.1外观
试剂盒应组分齐全,内外包装均应完整,标签清晰,液体试剂无渗漏,冻干组分呈疏松体,加人去离子水等复溶剂后应在20min内完全溶解。注:制造商可根据自己产品的包装特点规定适当的外观要求。4.2最低检测限
最低检测限应不高于5.0ng/mL。4.3剂量-反应曲线的线性
在制造商给定的线性区间内,剂量-反应曲线相关系数(r)应不小于0.9900。4.4准确度
在试剂盒的线性区间内,制备2~3个不同浓度的国家标准品作为样品进行检测,测定值与靶值的1
YY/T1216-—2013
相对偏差不应超过士15.0%。
4.5精密度
4.5.1分析内精密度
在试剂盒的线性范围内,设置2~3个不同浓度的质控品,检测结果的变异系数应不高于15.0%,全自动试剂盒应不高于8.0%。
4.5.2分析间精密度
在试剂盒的线性范围内,设置23个不同浓度的质控品,检测结果的变异系数应不高于20.0%。注:仅限于手工操作的试剂盒。4.5.3批间精密度
在试剂盒的线性范围内,设置2~3个不同浓度的质控品,批间精密度应不高于20.0%。4.6特异性
至少检测10份正常血清,检测结果均应不高于20.0ng/mL。4.7质控品的测定值
在试剂盒的线性范围内,设置2~3个不同浓度的质控品,测定结果应在质控品测定值充许的区间内。
4.8稳定性
可以选用以下方法进行:
效期末稳定性
试剂盒在规定的保存条件下保存至有效期末进行检验,检验结果应符合4.1、4.2、4.3、4.4、4.5.1、4.5.2、4.6、4.7的规定。
4.8.2热稳定性
根据试剂盒的有效期,通常将试剂盒置于37℃一定时间(通常是3d~7d)后,进行检验检验结果应符合4.1,4.2、4.3、4.4、4.5.1、4.5.2、4.6、4.7规定。注1:热稳定性不能用于推导产品有效期,除非是采用基于大量的稳定性研究数据建立的推导公式。注2:根据产品特性可选择以上方法之一进行验证,但所选用方法宜能验证产品的稳定性,以保证在效期内产品性能符合标准要求。
5试验方法
5.1外观
采用目测法,在自然光线明亮处目视,应符合4.1的规定。5.2最低检测限
至少10次平行测定零值校准品或样本稀释液的信号值,计算平均数()与标准差(SD),并计算2
十2SD的值,此值对应的样本浓度为本试剂盒的最低检测限,应符合4.2的要求。5.3剂量-反应曲线的线性
复孔测定试剂盒的校准品,按制造商说明的方式进行拟和,应符合4.3的要求。5.4准确度
YY/T1216—2013
检测不同浓度的国家标准品,每浓度样本检测3次,计算测定结果的均值,并按照公式(1)计算相对偏差,应符合4.4的要求。
式中:
B—相对偏差,%;
测定浓度的均值
一测定样本的靶值。
5.5精密度
5.5.1分析内精密度
用同一批号试剂盒,对不同浓度的质控品分别重复测定10次,计算10次测定结果的平均值()和标准差(SD),根据公式(2)得出变异系数(CV,结果应符合4.5.1规定。SD×100%
式中:
一变异系数,%;
SD——10次测定结果的标推差;元——10次测量结果的平均值。5.5.2分析间精密度
.(2)
用同一批号试剂盒,测定不同浓度的质控品,应不少于3次独立分析,根据公式(2)计算质控品测定值的变异系数,应符合4.5.2规定。5.5.3批间精密度
用3个不同批号试剂盒,检测不同浓度质控品,各10次,根据公式(2)计算30次测定结果的变异系数,应符合4.5.3的要求。
5.6特异性
检测至少10份正常人血清样本,应符合4.6的要求。5.7质控品的测定值
复孔平行测定不同浓度的质控品,计算测定结果的均值,应符合4.7的要求。5.8稳定性
试剂盒按照4.8.1或4.8.2规定的条件贮存后,检测5.1、5.2、5.3、5.4、5.5.1、5.5.2、5.6、5.7,检验结果应符合4.8的要求。
YY/T12162013
6标识、标签和使用说明书
6.1试剂盒标签、包装标识
一般应包括以下内容:
产品名称、型号、规格;
生产企业名称、注册地址、生产地址、联系方式;医疗器械注册证书编号;
产品标准编号;
产品生产日期或批号:
失效日期;
贮存条件。
g)!
产品使用说明书
一般应包括以下内容:
a)产品名称、型号、规格;
生产企业名称、注册地址、生产地址、联系方式及售后服务单位:b)
《医疗器械生产企业许可证》编号(第一类医疗器械除外)、医疗器械注册证书编号:d)产品标准编号:
产品的性能、主要组成、预期用途;e)
检验原理、检验方法、样本要求;参考值(参考区间);
检验结果的解释;
检验方法的局限性;
储存条件及有效期;
注意事项;
参考文献;
说明书批准及修改日期;
产品标准中规定的应当在说明书中标明的其他内容。包装、运输和贮存
7.1包装
包装储运图示标志应符合YY/T0466.1的规定。包装容器应保证密封性良好,完整,无泄露,无破损。
7.2运输
试剂盒应按制造商的要求运输。在运输过程中,应防潮,应防止重物堆压,避免阳光直射和雨雪浸淋,防止与酸碱物质接触,防止内外包装破损。7.3贮存
试剂盒应在制造商规定条件下保存。4
GB3100国际单位制及其应用
参考文献
YY/T1216—2013
参考测量程序的说明
GB/T19702—2005体外诊断医疗器械生物源性样品中量的测量GB/T197032005
体外诊断医疗器械生物源性样品中量的测量叶应妩.全国临床检验操作规范.3版.南京:东南大学出版社,2006WS/T124—1999临床化学体外诊断试剂(盒)质量检验总则参考物质的说明
GB/T29791.1—2013体外诊断医疗器械[6]
制造商提供的信息(标示)
第1部分:术语、定
义和通用要求
YY/T1216-2013
打印日期:2013年12月26日F009中华人民共和国医药
行业标准
甲胎蛋白定量标记免疫分析试剂盒YY/T1216—2013bzxZ.net
中国标准出版社出版发行
北京市朝阳区和平里西街甲2号(100013)北京市西城区三里河北街16号(100045)网址spc.net.cn
总编室:(010))64275323发行中心:(010)51780235读者服务部:(010)68523946
中国标准出版社秦皇岛印刷厂印刷各地新华书店经销
开本880×12301/16印张0.75字数12千字2013年12月第一版
2013年12月第一次印刷
书号:155066·2-26305定价18.00元如有印装差错由本社发行中心调换版权专有侵权必究
举报电话:(010)68510107
-9IGILIAA
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。