YY 91095~91096-1999
基本信息
标准号: YY 91095~91096-1999
中文名称:肌电生物反馈仪温度生物反馈仪
标准类别:医药行业标准(YY)
标准状态:现行
出版语种:简体中文
下载格式:.zip .pdf
下载大小:4775051

标准分类号
关联标准
出版信息
相关单位信息
标准简介
YY 91095~91096-1999.
YY 91095规定了肌电生物反馈仪(简称“肌电反馈仪”)的技术要求、试验方法、检验规则、标志、包装、运输和贮存等内容。
YY 91095适用于肌电反馈仪。
2 引用标准
GB 191包装储运图示标志
GB 9706.1医用电气设备 第一 部分:通用安全要求
WS2-1金属制件的镀层分类、 技术条件
WS2- -283医用电器设备环境要求及 试验方法
3术语
3.1.肌电反馈仪:凡以肌电作为生理信息,以相应的视觉或听觉等形式反馈给受训者的治疗心身疾病和康复治疗的仪器统称肌电反馈仪。
4技术要求
4.1肌电反馈仪应符合本标准要求,并按规定程序所批准的图样及文件制造。
4.2工作条件
4.2.1环境温度: 5 ~ 40C。
4.2.2相对湿度:不大于80%。
4.2.3电源电压
4.2.3.1交流供电: 电压220 V t 10%、频率50Hz士2 %。
4.2.3.2直流供电: 电压应不大于60V :%。
4.3 性能
4.3.1测量范围: 1 ~ 999μV (rms)。
4.3.2最高分辨率:小于0.2μV(rms)。
4.3.3 输人噪声:小于1μV (rms)。
4.3.4 通频带: 120~1000Hz(- 3dB)。
4.3.5 差模输人阻抗:大于5 M2。
4.3.6共模抑制比: 大于100dB.
4.4安全性能
4.4.1绝缘电阻
采用交流220 V供电的肌电反馈仪,电源部分和设备壳体之间的绝缘电阻应不小于10MQ.
4.4.2电介质强度
YY 91095规定了肌电生物反馈仪(简称“肌电反馈仪”)的技术要求、试验方法、检验规则、标志、包装、运输和贮存等内容。
YY 91095适用于肌电反馈仪。
2 引用标准
GB 191包装储运图示标志
GB 9706.1医用电气设备 第一 部分:通用安全要求
WS2-1金属制件的镀层分类、 技术条件
WS2- -283医用电器设备环境要求及 试验方法
3术语
3.1.肌电反馈仪:凡以肌电作为生理信息,以相应的视觉或听觉等形式反馈给受训者的治疗心身疾病和康复治疗的仪器统称肌电反馈仪。
4技术要求
4.1肌电反馈仪应符合本标准要求,并按规定程序所批准的图样及文件制造。
4.2工作条件
4.2.1环境温度: 5 ~ 40C。
4.2.2相对湿度:不大于80%。
4.2.3电源电压
4.2.3.1交流供电: 电压220 V t 10%、频率50Hz士2 %。
4.2.3.2直流供电: 电压应不大于60V :%。
4.3 性能
4.3.1测量范围: 1 ~ 999μV (rms)。
4.3.2最高分辨率:小于0.2μV(rms)。
4.3.3 输人噪声:小于1μV (rms)。
4.3.4 通频带: 120~1000Hz(- 3dB)。
4.3.5 差模输人阻抗:大于5 M2。
4.3.6共模抑制比: 大于100dB.
4.4安全性能
4.4.1绝缘电阻
采用交流220 V供电的肌电反馈仪,电源部分和设备壳体之间的绝缘电阻应不小于10MQ.
4.4.2电介质强度
标准图片预览




标准内容
中华人民共和国专业标准
YY 91095~91096-99
肌电生物反馈仪
温度生物反馈仪
1990-01-03发布
国家医药管理局
1990-06-01实施
ZBC42004-89
肌电生物反馈仪
ZBC42005—89
温度生物反馈仪
(1)
(7)
中华人民共和国专业标准
肌电生物反馈仪
1主题内容与适用范围
Y91095-93
本标准规定了肌电生物反馈仪(简称“肌电反馈仪”)的技术要求、试验方法、检验规则、标志、包装、运输和贮存等内容。
本标准适用于肌电反馈仪。
2引用标准
GB191包装储运图示标志
GB9706.1医用电气设备第一部分:通用安全要求WS2一1金属制件的镀层分类、技术条件WS2—283医用电器设备环境要求及试验方法3术语
3.1.肌电反馈仪:凡以肌电作为生理信息,以相应的视觉或听觉等形式反馈给受训者的治疗心身疾病和康复治疗的仪器统称肌电反馈仪。4技术要求
4.1肌电反馈仪应符合本标准要求,并按规定程序所批准的图样及文件制造。4.2工作条件
4.2.1环境温度:5~40℃。
4.2.2相对湿度:不大于80%。
4.2.3电源电压
4.2.3.1交流供电:电压220V±10%、频率50Hz±2%。4.2.3.2直流供电:电压应不大于60V=5%。4.3性能
4.3.1测量范围:1~999μV(rms)。4.3.2最高分辨率:小于0.2μV(rms)。输人噪声:小于1μV(rms)。
通频带:120~1000Hz(-3dB)。
差模输人阻抗:大于5MQ。
4.3.6共模抑制比:大于100dB。4.4安全性能
4.4.1绝缘电阻
采用交流220V供电的肌电反馈仪,电源部分和设备壳体之间的绝缘电阻应不小于10M2。4.4.2电介质强度
肌电反馈仪根据不同的防电击保护类型按GB9706.1的20.1及20.3条,以表5、表6、表7的实验电压,历时1min无闪烁和击穿现象。国家医药管理局1990-01-03批准1990-06-01实施
4.4.3连续漏电流
ZBC42004-89
肌电反馈仪属于B型设备,连续漏电流指标应不大于GB9706.1的19.3条中表4的数值。4.5外观
4.5.1肌电反馈仪表面应平整、光洁,无划伤、锋棱、毛刺。4.5.2电镀零件应符合WS2-1中规定的IV类要求。4.6肌电反馈仪按WS-2一283中的规定进行环境试验,气候环境为I组,机械环境为Ⅱ组,其各·项性能应符合本标准的规定。
5试验方法
5.1测试仪器
a.低频信号发生器:频率误差2%,非线性失真<0.1%,b.交流毫伏表:误差土2.5%,输人电阻大于1Mα,频率范围10Hz~1MHz。5.2校验肌电反馈仪的显示(指示)系统:首先用低频信号发生器和交流毫伏表校验肌电反馈仪的显示(指示)系统,其精度应符合要求。再用肌电反馈仪本身的显示(指示),测量其他技术指标。5.2.1校验电路:
平街衰减器
肌电反馈仪
5.2.2将正弦交流信号经平衡衰减器加至肌电反馈仪的输入端,信号频率为中心频率500Hz。5.2.3调信号源输出电压幅度,使显示系统表示的读数分别为各档的10%和90%所对应的值,从交流毫伏表依次读取各相应值的读数(除以衰减器的衰减倍数),其精度应在10%之内。5.2.4平衡衰减器:1:1000,电阻精度±0.5%,低噪声。5.3性能检验
5.8.1测量范围
测量电路见图1,信号频率为500Hz,调节输人电压幅度,使显示系统的读数为999μV,读取相应输人信号的数值,误差应小于10%,低端为噪声信号折算到输人端的有效值,测量结果应符合4.3.1的要求。
5.3.2最高分辨率
测量电路见图1,在测量范围低端附近(5μV左右),当输人量每变化0.2μV时,视觉显示系统及听觉系统应有明显反应,符合4.3.2的要求。灯标显示,至少有一个灯的变化;指针式仪表:至少有一个小格的变化,数字显示:至少有一个字的变化。5.3.3输人噪声
ZBC42004--89
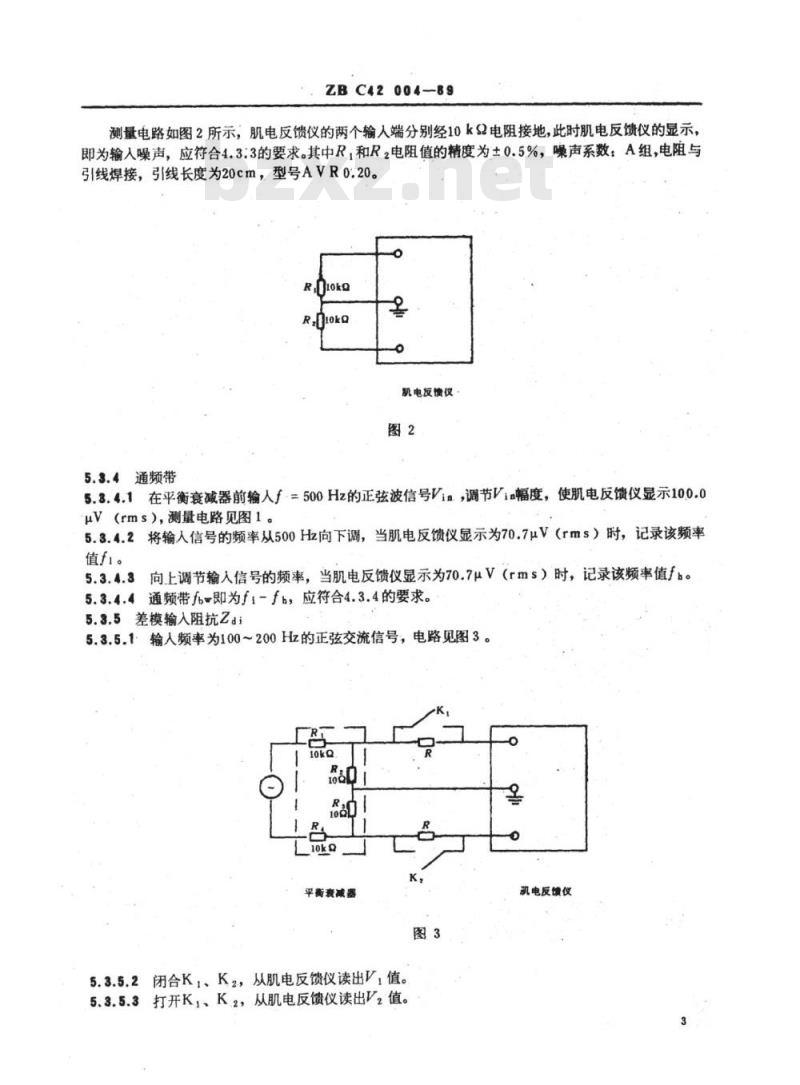
测量电路如图2所示,肌电反馈仪的两个输人端分别经10k电阻接地,此时肌电反馈仪的显示,即为输入噪声,应符合4.3:3的要求。其中R,和R,电阻值的精度为±0.5%,噪声系数:A组,电阻与引线焊接,引线长度为20cm,型号AVRo.20。Rn1oko
电反馈仪
5.3.4通频带
5.3.4.1在平衡衰减器前输人=500Hz的正弦波信号Vin.,调节Vin幅度,使肌电反馈仪显示100.0μV(rms),测量电路见图1。
5.3.4.2将输人信号的频率从500Hz向下调,当肌电反馈仪显示为70.7μV(rms)时,记录该频率值ft。
5.3.4.3向上调节输入信号的频率,当肌电反馈仪显示为70.7μV(rms)时,记录该频率值fb。5.3.4.4通频带fb-即为f1-fh,应符合4.3.4的要求。5.3.5差模输入阻抗ZdiWww.bzxZ.net
5.3.5.1:输人频率为100~200Hz的正弦交流信号,电路见图3。10kQ
平衡衰减器
5.3.5.2闭合K,、K2,从肌电反馈仪读出V,值。5.3.5.3打开K,、K.2,从肌电反馈仪读出V2值。R
凯电反馈仪
ZBC42004-89
5.3.5.4Zd!计算公式如下,其结果符合4.3.5的要求。2V2
Zai\v.-V2
电阻的要求:R=200kQ~1Me、误差±1%。5.3.6共模抑制比CMRR
两输入端短接,对“地”输人Vin为1~5V(rms)、频率为120Hz的正弦交流信号,电路如图4所示。记录肌电反馈仪显示的数值V。,按如下公式计算,其结果符合4.3.6的要求。(Vin.Ka)(Ka=0.7)
CMRR=201g
式中:Kd差模放大倍数。
肌电反馈仪
检验规则
6.1肌电反馈仪由制造厂技术检验部门逐台进行检验,合格后方可提交验收。6.2肌电反馈仪必须成批提交验收,批量大小按订货合同规定,检验数量按表1的规定。表1
交验数量,台
>100~200
检验数量占每批交验量百分比,%10
6.3检验时按表2的规定逐项进行验收。备
不少于1台
检验项目
ZBC42004-89
检验范围
4.3、4.4条
6.4在验收过程中,如性能发现在一台中有一项技术要求不符合本标准要求时,该产品全部退回重新分类整理。
6.5经分类整理后,可再提交检验。复验时按6.2条规定,抽取双倍数量进行检验,若不符合本标准时,该批产品不予验收。
6.6在验收过程中,双方对产品质量是否合格产生争议时,由技术归口单位进行仲裁。6.7在下列情况下之一时,应进行例行试验:a。新产品投产前;
间隔一年以上再生产时;
当产品改变设计时,改变主要工艺、主要元器件和材料代用时;国家质量监督机构提出进行型式检验要求时。d.
6.8每次例行试验应不少于一台,例行试验应包括本标准中所规定的全部项目。标志、包装、运输、贮存
肌电反馈仪应有下列标志:
制造厂名称及地址;
产品名称及型号:
商标;
出厂编号(或日期);
电源电压及最大功率;
本标准号。
7.2肌电反馈仪附有检验合格证,使用说明书及装箱单各一份。检验合格证上应有下列标志:
制造厂名称和地址;
产品名称及型号;
出厂编号(或日期);
检验日期;
检验员代号。
7.3肌电反馈仪应装入包装箱内,箱内应衬有减震材料,肌电反馈仪在箱内应被可靠地支撑、固定。7.4包装箱上应有下列标志:
制造厂名称和地址;
产品名称、型号;
出厂日期;
净重、毛重;
“小心轻放”、“向上”、“防湿”“防晒”“禁止翻滚”等标志,其图形应符合GB191的规定。包装后的肌电反馈仪应贮存在相对湿度小于80%,无腐蚀性气体及通风良好的室内。7.5
附加说明:
ZBC42004-89
本标准由天津市医疗器械研究所归口。本标准由天津市医疗器械研究所负责起草。本株准起草人挚食川、刘起卫。
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
YY 91095~91096-99
肌电生物反馈仪
温度生物反馈仪
1990-01-03发布
国家医药管理局
1990-06-01实施
ZBC42004-89
肌电生物反馈仪
ZBC42005—89
温度生物反馈仪
(1)
(7)
中华人民共和国专业标准
肌电生物反馈仪
1主题内容与适用范围
Y91095-93
本标准规定了肌电生物反馈仪(简称“肌电反馈仪”)的技术要求、试验方法、检验规则、标志、包装、运输和贮存等内容。
本标准适用于肌电反馈仪。
2引用标准
GB191包装储运图示标志
GB9706.1医用电气设备第一部分:通用安全要求WS2一1金属制件的镀层分类、技术条件WS2—283医用电器设备环境要求及试验方法3术语
3.1.肌电反馈仪:凡以肌电作为生理信息,以相应的视觉或听觉等形式反馈给受训者的治疗心身疾病和康复治疗的仪器统称肌电反馈仪。4技术要求
4.1肌电反馈仪应符合本标准要求,并按规定程序所批准的图样及文件制造。4.2工作条件
4.2.1环境温度:5~40℃。
4.2.2相对湿度:不大于80%。
4.2.3电源电压
4.2.3.1交流供电:电压220V±10%、频率50Hz±2%。4.2.3.2直流供电:电压应不大于60V=5%。4.3性能
4.3.1测量范围:1~999μV(rms)。4.3.2最高分辨率:小于0.2μV(rms)。输人噪声:小于1μV(rms)。
通频带:120~1000Hz(-3dB)。
差模输人阻抗:大于5MQ。
4.3.6共模抑制比:大于100dB。4.4安全性能
4.4.1绝缘电阻
采用交流220V供电的肌电反馈仪,电源部分和设备壳体之间的绝缘电阻应不小于10M2。4.4.2电介质强度
肌电反馈仪根据不同的防电击保护类型按GB9706.1的20.1及20.3条,以表5、表6、表7的实验电压,历时1min无闪烁和击穿现象。国家医药管理局1990-01-03批准1990-06-01实施
4.4.3连续漏电流
ZBC42004-89
肌电反馈仪属于B型设备,连续漏电流指标应不大于GB9706.1的19.3条中表4的数值。4.5外观
4.5.1肌电反馈仪表面应平整、光洁,无划伤、锋棱、毛刺。4.5.2电镀零件应符合WS2-1中规定的IV类要求。4.6肌电反馈仪按WS-2一283中的规定进行环境试验,气候环境为I组,机械环境为Ⅱ组,其各·项性能应符合本标准的规定。
5试验方法
5.1测试仪器
a.低频信号发生器:频率误差2%,非线性失真<0.1%,b.交流毫伏表:误差土2.5%,输人电阻大于1Mα,频率范围10Hz~1MHz。5.2校验肌电反馈仪的显示(指示)系统:首先用低频信号发生器和交流毫伏表校验肌电反馈仪的显示(指示)系统,其精度应符合要求。再用肌电反馈仪本身的显示(指示),测量其他技术指标。5.2.1校验电路:
平街衰减器
肌电反馈仪
5.2.2将正弦交流信号经平衡衰减器加至肌电反馈仪的输入端,信号频率为中心频率500Hz。5.2.3调信号源输出电压幅度,使显示系统表示的读数分别为各档的10%和90%所对应的值,从交流毫伏表依次读取各相应值的读数(除以衰减器的衰减倍数),其精度应在10%之内。5.2.4平衡衰减器:1:1000,电阻精度±0.5%,低噪声。5.3性能检验
5.8.1测量范围
测量电路见图1,信号频率为500Hz,调节输人电压幅度,使显示系统的读数为999μV,读取相应输人信号的数值,误差应小于10%,低端为噪声信号折算到输人端的有效值,测量结果应符合4.3.1的要求。
5.3.2最高分辨率
测量电路见图1,在测量范围低端附近(5μV左右),当输人量每变化0.2μV时,视觉显示系统及听觉系统应有明显反应,符合4.3.2的要求。灯标显示,至少有一个灯的变化;指针式仪表:至少有一个小格的变化,数字显示:至少有一个字的变化。5.3.3输人噪声
ZBC42004--89
测量电路如图2所示,肌电反馈仪的两个输人端分别经10k电阻接地,此时肌电反馈仪的显示,即为输入噪声,应符合4.3:3的要求。其中R,和R,电阻值的精度为±0.5%,噪声系数:A组,电阻与引线焊接,引线长度为20cm,型号AVRo.20。Rn1oko
电反馈仪
5.3.4通频带
5.3.4.1在平衡衰减器前输人=500Hz的正弦波信号Vin.,调节Vin幅度,使肌电反馈仪显示100.0μV(rms),测量电路见图1。
5.3.4.2将输人信号的频率从500Hz向下调,当肌电反馈仪显示为70.7μV(rms)时,记录该频率值ft。
5.3.4.3向上调节输入信号的频率,当肌电反馈仪显示为70.7μV(rms)时,记录该频率值fb。5.3.4.4通频带fb-即为f1-fh,应符合4.3.4的要求。5.3.5差模输入阻抗ZdiWww.bzxZ.net
5.3.5.1:输人频率为100~200Hz的正弦交流信号,电路见图3。10kQ
平衡衰减器
5.3.5.2闭合K,、K2,从肌电反馈仪读出V,值。5.3.5.3打开K,、K.2,从肌电反馈仪读出V2值。R
凯电反馈仪
ZBC42004-89
5.3.5.4Zd!计算公式如下,其结果符合4.3.5的要求。2V2
Zai\v.-V2
电阻的要求:R=200kQ~1Me、误差±1%。5.3.6共模抑制比CMRR
两输入端短接,对“地”输人Vin为1~5V(rms)、频率为120Hz的正弦交流信号,电路如图4所示。记录肌电反馈仪显示的数值V。,按如下公式计算,其结果符合4.3.6的要求。(Vin.Ka)(Ka=0.7)
CMRR=201g
式中:Kd差模放大倍数。
肌电反馈仪
检验规则
6.1肌电反馈仪由制造厂技术检验部门逐台进行检验,合格后方可提交验收。6.2肌电反馈仪必须成批提交验收,批量大小按订货合同规定,检验数量按表1的规定。表1
交验数量,台
>100~200
检验数量占每批交验量百分比,%10
6.3检验时按表2的规定逐项进行验收。备
不少于1台
检验项目
ZBC42004-89
检验范围
4.3、4.4条
6.4在验收过程中,如性能发现在一台中有一项技术要求不符合本标准要求时,该产品全部退回重新分类整理。
6.5经分类整理后,可再提交检验。复验时按6.2条规定,抽取双倍数量进行检验,若不符合本标准时,该批产品不予验收。
6.6在验收过程中,双方对产品质量是否合格产生争议时,由技术归口单位进行仲裁。6.7在下列情况下之一时,应进行例行试验:a。新产品投产前;
间隔一年以上再生产时;
当产品改变设计时,改变主要工艺、主要元器件和材料代用时;国家质量监督机构提出进行型式检验要求时。d.
6.8每次例行试验应不少于一台,例行试验应包括本标准中所规定的全部项目。标志、包装、运输、贮存
肌电反馈仪应有下列标志:
制造厂名称及地址;
产品名称及型号:
商标;
出厂编号(或日期);
电源电压及最大功率;
本标准号。
7.2肌电反馈仪附有检验合格证,使用说明书及装箱单各一份。检验合格证上应有下列标志:
制造厂名称和地址;
产品名称及型号;
出厂编号(或日期);
检验日期;
检验员代号。
7.3肌电反馈仪应装入包装箱内,箱内应衬有减震材料,肌电反馈仪在箱内应被可靠地支撑、固定。7.4包装箱上应有下列标志:
制造厂名称和地址;
产品名称、型号;
出厂日期;
净重、毛重;
“小心轻放”、“向上”、“防湿”“防晒”“禁止翻滚”等标志,其图形应符合GB191的规定。包装后的肌电反馈仪应贮存在相对湿度小于80%,无腐蚀性气体及通风良好的室内。7.5
附加说明:
ZBC42004-89
本标准由天津市医疗器械研究所归口。本标准由天津市医疗器械研究所负责起草。本株准起草人挚食川、刘起卫。
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。