YY/T 0963-2014
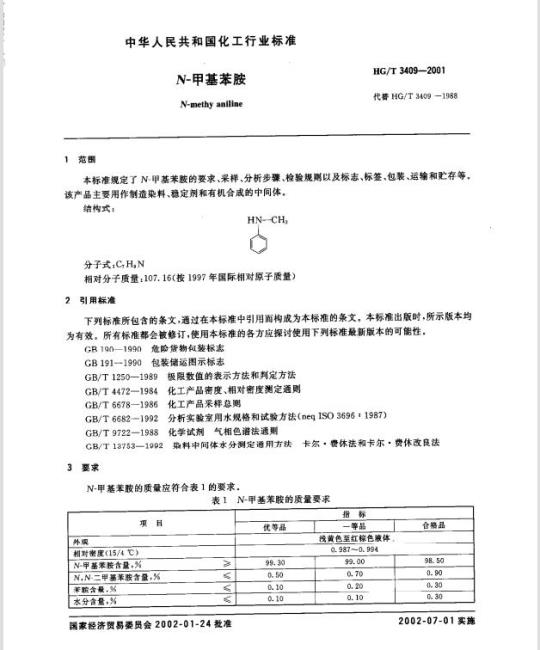
基本信息
标准号: YY/T 0963-2014
中文名称:关节置换植入物肩关节假体
标准类别:医药行业标准(YY)
标准状态:现行
出版语种:简体中文
下载格式:.zip .pdf
下载大小:2708218
标准分类号
关联标准
出版信息
相关单位信息
标准简介
YY/T 0963-2014.Joint replacement implants-Shoulder prostheses.
YY/T 0963规定了关节置换植入物一肩关节假体的术语和定义 、分类、材料、设计评价、制造、灭菌、包装.制造商应提供的信息。
YY/T 0963适用于由关节盂部件和肱骨部件组成并提供功能性关节作用的部分或全肩关节假体。
YY/T 0963不适用于定制型假体。组合式假体适用于本标准。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 14233.1医用输液 、输血、注射器具检验方法第1 部分:化学分析方法
GB/T 14233.2医用输液 、输血.注射器具检验方法第2部分:生物学试验方法
GB/T 16886.1医疗 器械生物学评价第1部分:试验选择指南(GB/T 16886.1-2011,ISO 10993-1:2009 ,IDT)
GB/T 16886.7医疗器 械生物学评价第 7部分:环氧乙烷灭菌残留量(GB/T 16886.7-2001,idtISO 10993-7:1995)
GB 18278医疗保健产 品灭菌确认和常 规控制要求工业湿热灭菌(GB 18278- 2000,idt ISO11134:1994)
GB 18279医疗器械环氧乙烷灭 菌确认和常规控制(GB 18279- 2000 ,idt ISO 11135:1994)
GB 18280医疗保健产品灭菌确认和常规控制要求辐射灭菌(GB 18280- -2000, idt ISO11137 :1995)
GB/T 19701.2超高分子量聚乙烯第 2部分:模塑料(GB/T 9701.2- 2005 , ISO 5834-2: 1998,IDT)
YY 0117.1外科植入物骨关节假体锻.铸件Ti6A14V 钛合金锻件
YY 0117.2外科植人物骨关节假体锻、铸件ZTi6A14V 钛合金铸件
YY 0117.3外科植入物 骨关节假体锻 .铸件钴铬钼合金铸件
YY/T 0605.5外科植人物金属材料 第5 部分:锻造钴-铬钨-镍合金(YY/T 0605.5- -2007,ISO 5832-5 :2005 , IDT)
YY/T 0605.6外科植入物金属材料 第6 部分:锻造钴镍铬钼合金(YY/T 0605.5- 207,ISO 5832- 6:1997 ,IDT)
YY/T 0605.8外科植入物 金属材料 第8 部分:锻造钴-镍铬钼-钨铁合金(YY/T 0605.8-2007 , ISO 5832-8;1997 ,IDT)
YY 0605.12外科植人物金属材料第12 部分:锻造钴铬钼合金(YY/T 0605.12-2007 , ISO5832- 12:1996,IDT)
YY/T 0963规定了关节置换植入物一肩关节假体的术语和定义 、分类、材料、设计评价、制造、灭菌、包装.制造商应提供的信息。
YY/T 0963适用于由关节盂部件和肱骨部件组成并提供功能性关节作用的部分或全肩关节假体。
YY/T 0963不适用于定制型假体。组合式假体适用于本标准。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 14233.1医用输液 、输血、注射器具检验方法第1 部分:化学分析方法
GB/T 14233.2医用输液 、输血.注射器具检验方法第2部分:生物学试验方法
GB/T 16886.1医疗 器械生物学评价第1部分:试验选择指南(GB/T 16886.1-2011,ISO 10993-1:2009 ,IDT)
GB/T 16886.7医疗器 械生物学评价第 7部分:环氧乙烷灭菌残留量(GB/T 16886.7-2001,idtISO 10993-7:1995)
GB 18278医疗保健产 品灭菌确认和常 规控制要求工业湿热灭菌(GB 18278- 2000,idt ISO11134:1994)
GB 18279医疗器械环氧乙烷灭 菌确认和常规控制(GB 18279- 2000 ,idt ISO 11135:1994)
GB 18280医疗保健产品灭菌确认和常规控制要求辐射灭菌(GB 18280- -2000, idt ISO11137 :1995)
GB/T 19701.2超高分子量聚乙烯第 2部分:模塑料(GB/T 9701.2- 2005 , ISO 5834-2: 1998,IDT)
YY 0117.1外科植入物骨关节假体锻.铸件Ti6A14V 钛合金锻件
YY 0117.2外科植人物骨关节假体锻、铸件ZTi6A14V 钛合金铸件
YY 0117.3外科植入物 骨关节假体锻 .铸件钴铬钼合金铸件
YY/T 0605.5外科植人物金属材料 第5 部分:锻造钴-铬钨-镍合金(YY/T 0605.5- -2007,ISO 5832-5 :2005 , IDT)
YY/T 0605.6外科植入物金属材料 第6 部分:锻造钴镍铬钼合金(YY/T 0605.5- 207,ISO 5832- 6:1997 ,IDT)
YY/T 0605.8外科植入物 金属材料 第8 部分:锻造钴-镍铬钼-钨铁合金(YY/T 0605.8-2007 , ISO 5832-8;1997 ,IDT)
YY 0605.12外科植人物金属材料第12 部分:锻造钴铬钼合金(YY/T 0605.12-2007 , ISO5832- 12:1996,IDT)
标准图片预览





标准内容
ICS11.040.40
中华人民共和国医药行业标准
YY/T0963—2014
关节置换植入物
肩关节假体
Joint replacement implants-Shoulder prostheses2014-06-17发布
国家食品药品监督管理总局
2015-07-01实施
本标准按照GB/T1.1-2009给出的规则起草。YY/T0963—2014
本标准使用重新起草法参考ISO21534:2007《无源外科植人物关节置换植人物
ASTMF1378—2005《肩关节假体标准要求》。本标准与ASTMF1378—2005的技术性差异如下:删除了原第10章“关键词”;
将附录X1改为附录A,内容不变:根据ISO21534:2007增加了第7章“制造”第8章“灭菌”、第9章“包装”;采用ISO标准、国家标准以及行业标准代替了相应的美国标准。特殊要求》和
请注意本文件的某些内容可能涉及专利。本文件的发布机构不承担识别这些专利的责任本标准由国家食品药品监督管理总局提出。本标准由全国外科植物和矫形器械标化技术委员会材料及骨科植入物分技术委员会(SAC/TC110/SC1)归口。
本标准起草单位:天津市医疗器械质量监督检验中心、北京百幕航材高科技股份有限公司。本标准主要起草人:董双鹏、陶凯、张路、张述、梁芳惠、白剑锋。I
1范围wwW.bzxz.Net
关节置换植入物肩关节假体
YY/T0963—2014
本标准规定了关节置换植人物一肩关节假体的术语和定义、分类、材料、设计评价、制造、灭菌、包装、制造商应提供的信息。
本标准适用于由关节盂部件和肱骨部件组成并提供功能性关节作用的部分或全肩关节假体。本标准不适用于定制型假体。组合式假体适用于本标准。2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。GB/T14233.1医用输液、输血、注射器具检验方法第1部分:化学分析方法GB/T14233.2医用输液、输血、注射器具检验方法第2部分:生物学试验方法GB/T16886.1医疗器械生物学评价第1部分:试验选择指南(GB/T16886.1-2011,ISO10993-1.2009,IDT)
GB/T16886.7医疗器械生物学评价第7部分:环氧乙烷灭菌残留量(GB/T16886.7-2001,idtISO10993-7:1995)
GB18278医疗保健产品灭菌确认和常规控制要求工业湿热灭菌(GB18278一2000,idtISO11134:1994)
GB18279医疗器械环氧乙烷灭菌确认和常规控制(GB18279—2000,idtISO11135:1994)GB18280医疗保健产品灭菌确认和常规控制要求辐射灭菌(GB18280—2000,idtISO11137.1995)
GB/T19701.2超高分子量聚乙烯第2部分:模塑料(GB/T9701.2—2005,ISO5834-2:1998,IDT)
骨关节假体锻、铸件Ti6A14V钛合金锻件YYo117.12
外科植人物
YY0117.2外科植人物
骨关节假体锻、铸件ZTi6A14V钛合金铸件YY0117.3外科植人物骨关节假体锻、铸件钻铬钼合金铸件YY/T0605.5外科植人物金属材料第5部分:锻造钻-铬-钨-镍合金(YY/T0605.5一2007,ISO5832-5:2005,IDT)
YY/T0605.6外科植人物
ISO5832-6:1997,IDT)
金属材料第6部分:锻造钻-镍-铬-钼合金(YY/T0605.5一2007,YY/T0605.8外科植人物
金属材料第8部分:锻造钻-镍-铬-钼-钨-铁合金(YY/T0605.82007,ISO5832-8:1997,IDT)
YY0605.12外科植人物
5832-12:1996.IDT)
金属材料第12部分:锻造钻-铬-钼合金(YY/T0605.12—2007,ISOISO4287产品几何技术规范(GPS)表面结构:轮廊法术语、定义及表面结构参数[Geometrical product specification(GPS)--Surface texture: Profile method-Terms, definitions andsurface texture parameters
YY/T0963—2014
ISO5832-1外科植人物金属材料第1部分:锻造不锈钢(Implantsforsurgery一MetallicmaterialsPart l: Wrought stainless steel)ISO6474-1外科植人物陶瓷材料第1部分:高纯氧化铝基陶瓷材料(ImplantsforsurgeryCeramic materialsPart l: Ceramic materials based on high purity alumina)ISO21534:2007无源外科植入物关节置换植人物特殊要求(Non-activesurgicalimplantsJoint replacement implants-Particular requirements)ASTMF746外科植入物金属材料的点蚀和缝隙腐蚀试验方法(Testmethodfotpittingorcrevice corrosion of metallic surgical implant materials)ASTMF1044磷酸钙涂层和金属涂层的剪切试验方法(Standardtestmethodforsheartestingof calcium phosphate coatings and metal coatings)ASTMF1147磷酸钙涂层和金属涂层的拉伸试验方法(Standardtestmethodfortensiontestingof calcium phosphate and metallic coatings)ASTMF1829关节盂剪切方向的锁定机制的静态评价试验方法(Testmethodforstaticevaluation of glenoid locking mechanism in shear)ASTMF2028关节盂松动或脱位的动态评价试验方法(Testmethodsforthedynamicevaluation of glenoid loosening or dissociation)3术语和定义
下列术语和定义适用于本文件。3.1
领collar
颈部和柄部连接处的凸缘。
关节孟部件glenoidcomponent
假体的一部分,用以部分或全部代替肩脚骨关节孟窝,并与生理肱骨头或置换假体形成关节。3.3
脑骨头head
与关节孟形成关节的承载部件。3.4
humeral component
肱骨部件
假体的一部分,用以部分或全部代替脑骨近端或肱骨头,并与自然关节孟或置换假体形成关节。3.5
龙骨(或钉)keel(orpegs)
与关节盂窝中的型腔配合以防止关节孟部件移动和/或转动的一个或多个突起物。3.6
颈neck
连接肱骨头和柄部的部分。
倒置型肩关节植入物
reverse design shoulder implants具有一个球型关节孟部件和一个凹状脑骨部件设计的植人物。2
柄stem
预期插人脑骨髓腔的部分。
4分类
4.1约束型
YY/T0963—2014
约束型关节假体用于关节置换,且防止假体在一个以上的解剖平面内脱位,包含一个单独的、可变的、跨关节的部件或者多个连接或配合的部件。4.2部分约束型
部分约束型关节假体用于部分或全肩关节置换,通过关节面的几何形状限制假体在一个或多个平面内的移动和转动。它不包含跨关节连接。4.3非约束型
非约束型关节假体用于部分或全肩关节置换,对假体在一个或多个平面内的运动约束最小。它不包含跨关节的连接。
5材料
5.1总则
制造假体材料的选择是确保假体功能的必要非充分条件。所有符合本标准的假体,其制造材料应具有足够的力学强度、耐久性、耐腐蚀性和生物相容性。5.2力学强度
肩关节假体的各种部件已成功采用以下材料制造。但是,对那些承受高应力的关键部件,并非所有的材料都具有足够的强度。这些材料标准包括GB/T19701.2、YY0117.1YY0117.3,YY/T0605.5YY/T0605.6、YY/T0605.8(仅用于非承载时)、ISO5832-1YY0605.12、ISO6474-1。5.3耐腐蚀性
对于临床应用中尚未证明适合的材料,当依据标准ASTMF746中的试验方法进行试验时,其耐腐蚀性应与5.2中所列的一种材料相当或更优。5.4生物相容性
对于临床应用中尚未证明适合的材料,当依据GB/T16886.1进行试验时,应具有与5.2中所列的一种材料相当或更优的可接受的生物学反应。6设计评价
6.1材料的磨损
了解关节面的磨损性能是非常重要的。在生理条件下进行试验时,任何新的或不同的材料的磨损率均不应超过下列材料组合的磨损率。当前标准的磨损组合为CoCrMo合金(YY0117.3)对超高分子8
YY/T0963—2014
量聚乙烯(GB/T19701.2),且两者均具有符合6.6要求的高质量表面。注:当销盘试验不适合时,可以考虑其他试验方法6.2肩关节假体植入前的运动范围屈曲应≥90°外展应≥90内旋应≥90°,外旋应≥45°,伸展应≥45°。6.3多孔金属涂层力学性能
多孔金属涂层应根据试验方法ASTMF1044(剪切强度)和ASTMF1147(拉伸强度)的规定进行试验。
6.4体外试验评价指南
6.4.1植人物试验应反映针对该植人物当前临床中的和潜在的失效模式。试验可直接针对半脱位、关节孟松动、衬垫自金属背衬中脱离和肱骨头脱位等。为便于进行以上试验,已汇集了一些关于肩关节载荷的相关文献1.2.3]。基于Anglin等1]和Poppen等[]的研究工作,正常肩关节作用力约为人体体重的12倍,加载方向如Anglin等的文献中的图3所示。在肩关节假体设计中,这些信息(如载荷大小和方向)有助于确定肩关节力的最恶劣状况。然而,这些关节作用力是基于正常情况。为了对特定肩关节假体制定合格/不合格标准(即力、角度和试验循环次数),应考虑预期的患者人群、最恶劣的生理载荷及角度,合理的安全系数和无支撑表面的可能性。6.4.2所有组合式植入物应根据ASTMF1829的试验方法进行试验。6.4.3所有关节盂假体部件应能承受持续的最高为人体体重的静态和动态生理载荷,且不影响其在预期使用和环境下的功能。植人物应根据临床相关循环次数进行松动试验。Anglin等L3建议合理的循环次数是100000次。在最恶劣状况下,可能需要增加循环次数。一种测试骨水泥关节盂部件的试验方法见ASTMF2028。
6.5尺寸
肩关节假体部件的尺寸应参照图1~图3的要求进行标注,制造商应规定相应产品的尺寸及其公差范围,各部位尺寸和公差的检验,用通用量具,专用检具或测量仪器检测6.6关节面粗糙度
6.6.1金属关节面
主要关节面的表面粗糙度Ra值应不大于0.10μm,根据ISO4287方法测量,取样长度为0.25mm。
6.6.2塑料关节面(若使用)
主要关节面的表面粗糙度Ra值应不大于2μm,根据ISO4287方法测量,取样长度为0.8mm。4
关节面半径
脑骨头宽度、
肚骨头厚度
(或柄的直径,当柄宽=柄厚时)注:此器械中可能包含一个组合式连接。图1脑骨无领设计
关节面半径:
肱骨头宽度
肱骨头厚度
(或柄的直径,当柄宽=柄厚时)注:此器械中可能包含一个组合式连接。图2肱骨有领设计
YY/T0963—2014
YY/T0963—2014
盂部件高度
关节面半轻
孟部件有效厚度
龙骨高度
注1:若关节盂部件关于横截面非对称,应规定部件的最小和最大宽度。注2:此器械中可能包含一个组合式连接。图3关节孟部件
7制造
IS021534:2007第8章的要求适用于本标准。8灭菌
8.1总则
ISO21534:2007第9章的要求和下述内容适用于本标准。8.2以无菌状态供货的产品
对于以无菌状态供货的产品,灭菌过程应有效并依照惯例进行控制。龙骨宽度
注:GB/T14233.2规定了无菌试验方法,但该方法不能证明灭菌过程的有效性。灭菌过程可参见GB18278~GB18280。
8.3包含常规超高分子量聚乙烯的植入物若采用电离辐射灭菌,则植人物接受的累计辐射剂量不应超过40kGy。8.4
以非无菌状态供货的产品
以非无菌状态供货的产品,制造商应至少规定一种合适的灭菌方法,若不允许多次灭菌,制造商在所提供的产品信息中应对此予以说明。8.5环氧乙烷灭菌残留量
以环氧乙烷灭菌状态供货的产品,制造商应确定环氧乙烷灭菌残留量的可接受极限,并且不应超过GB/T16886.7的规定,应按GB/T14233.1给出的方法测量。9包装
ISO21534:2007第10章的要求适用于本标准。6
制造商应提供的信息
10.1总则
ISO21534:2007第11章的要求和下述内容适用于本标准。2产品标记
本标准中的部件应视空间允许情况下依次标记如下内容:制造商;
材料;
批号:
产品编号:
—规格;
附加信息可包括在、右和前等标记:关节盂部件的标记可以标明方向(适用时,上、左、右),可选;YY/T0963—2014
如果其中一个部件在X光下不可见,强烈推荐其上应包含显影丝或其他射线探测方法这由制造商判断。
3标签
植人物使用的材料应在包装标签和内附说明中标明。7
YY/T0963—2014
附录A
(资料性附录)
基本原理
A.1本标准的目的是为全肩关节置换部件的制造和使用提供指导。全肩关节置换部件预期用于成年患者,承受动态载荷,处于腐蚀性环境,并在承载面上保持持续的运动。对于完整的关节评价,目前尚未有效建立能够准确模拟所受荷载、侵蚀性电解质和复杂体液组分的实验室试验。几十年来满意性能的长期效果可用作推荐,但利用现有的筛选程序不能进行准确地预测。本标准指出了那些对保证假体寿命中令人满意的重要因素。这里,需要认识到尽管假体部件完好无损,关节置换术的失败仍可能发生。这种情况是事实,它归结于关节置换术本身的综合因素,其中包括植人物、骨水泥(如有)及生理环境等。A.2根据现有信息,本标准涉及的材料代表了当前的最新技术水平。若有新材料经证明是可接受的,在以后的修订中可考虑增加。
A,2.1参考性能应针对患者的解剖结构考虑部件的性能。目前已明确认识到,超出正常范围的事件或活动,如意外事故或是极其剧烈的运动,其引起的物理应力会超过任何部件设计所允许的应力水平。同时还认识到其他一些主要与患者自身因素相关的关节置换失效形式,如骨质疏松、佩吉特氏病、活动不当和活动不足等。
A.2.1.1本标准未规定假体的特定的磨损试验。当前认为磨损在已有的及未来的假体设计中不是主要问题;目前没有可用的技术来进行假体部件的特定的磨损试验;这种考虑已部分涵盖于6.1中。A.2.1.2规定的假体运动范围参数是最小值,这样植人物自身就不会限制患者肩关节运动,因此允许植人物潜在的脱位或松动。起初,运动参数最小范围较大,但已降低到6.2中给出的数值。A.2.2尺寸应使用通用方法测量尺寸,并尽可能使用国际基准。A.2.3表面处理与标记制造商的商标应在每个部件上清晰标出。在空间允许时,应包含完整的信息,包括大小,方向(如存在),带日期的编号等。8
参考文献
YY/T0963—2014
[i]Anglin,C.,Wyss,U.P.,Pichora,D.R.,\Glenohumeral Contact Forces,\Proceedings of theInstitution of Mechanical Engineers.Part H-Journal of Engineering in Medicine,214(6),2000,Pp.637-644.
[2]Poppen,N.K.,Walker,P.S.,\Forces at Glenohumeral Joint in Abduction,\Clinical Ortho-paedics&Related Research,135,Sept.1978,pp.165-170.[3]Anglin,C.,Wyss,U.P.,Pichora,D.R.,\Mechanical Testing of Shoulder Prostheses and RecommendationsforGlenoidDesign,\Journal of Shoulder andElbowSurgery,9,2000,pp.323-3319
YY/T0963-2014
打印日期:2015年4月8日F009A
中华人民共和国医药
行业标准
关节置换植入物肩关节假体
YY/T0963—2014
中国标准出版社出版发行
北京市朝阳区和平里西街甲2号(100029)北京市西城区三里河北街16号(100045)网址spc.net.cn
发行中心:(010)51780235
总编室:(010)64275323)
读者服务部:(010)68523946
中国标准出版社秦皇岛印刷厂印刷各地新华书店经销
开本880×12301/16印张1字数20千字2015年3月第一版
2015年3月第一次印刷
书号:155066·2-28393定价24.00元如有印装差错由本社发行中心调换版权专有侵权必究
举报电话:(010)68510107
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
中华人民共和国医药行业标准
YY/T0963—2014
关节置换植入物
肩关节假体
Joint replacement implants-Shoulder prostheses2014-06-17发布
国家食品药品监督管理总局
2015-07-01实施
本标准按照GB/T1.1-2009给出的规则起草。YY/T0963—2014
本标准使用重新起草法参考ISO21534:2007《无源外科植人物关节置换植人物
ASTMF1378—2005《肩关节假体标准要求》。本标准与ASTMF1378—2005的技术性差异如下:删除了原第10章“关键词”;
将附录X1改为附录A,内容不变:根据ISO21534:2007增加了第7章“制造”第8章“灭菌”、第9章“包装”;采用ISO标准、国家标准以及行业标准代替了相应的美国标准。特殊要求》和
请注意本文件的某些内容可能涉及专利。本文件的发布机构不承担识别这些专利的责任本标准由国家食品药品监督管理总局提出。本标准由全国外科植物和矫形器械标化技术委员会材料及骨科植入物分技术委员会(SAC/TC110/SC1)归口。
本标准起草单位:天津市医疗器械质量监督检验中心、北京百幕航材高科技股份有限公司。本标准主要起草人:董双鹏、陶凯、张路、张述、梁芳惠、白剑锋。I
1范围wwW.bzxz.Net
关节置换植入物肩关节假体
YY/T0963—2014
本标准规定了关节置换植人物一肩关节假体的术语和定义、分类、材料、设计评价、制造、灭菌、包装、制造商应提供的信息。
本标准适用于由关节盂部件和肱骨部件组成并提供功能性关节作用的部分或全肩关节假体。本标准不适用于定制型假体。组合式假体适用于本标准。2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。GB/T14233.1医用输液、输血、注射器具检验方法第1部分:化学分析方法GB/T14233.2医用输液、输血、注射器具检验方法第2部分:生物学试验方法GB/T16886.1医疗器械生物学评价第1部分:试验选择指南(GB/T16886.1-2011,ISO10993-1.2009,IDT)
GB/T16886.7医疗器械生物学评价第7部分:环氧乙烷灭菌残留量(GB/T16886.7-2001,idtISO10993-7:1995)
GB18278医疗保健产品灭菌确认和常规控制要求工业湿热灭菌(GB18278一2000,idtISO11134:1994)
GB18279医疗器械环氧乙烷灭菌确认和常规控制(GB18279—2000,idtISO11135:1994)GB18280医疗保健产品灭菌确认和常规控制要求辐射灭菌(GB18280—2000,idtISO11137.1995)
GB/T19701.2超高分子量聚乙烯第2部分:模塑料(GB/T9701.2—2005,ISO5834-2:1998,IDT)
骨关节假体锻、铸件Ti6A14V钛合金锻件YYo117.12
外科植人物
YY0117.2外科植人物
骨关节假体锻、铸件ZTi6A14V钛合金铸件YY0117.3外科植人物骨关节假体锻、铸件钻铬钼合金铸件YY/T0605.5外科植人物金属材料第5部分:锻造钻-铬-钨-镍合金(YY/T0605.5一2007,ISO5832-5:2005,IDT)
YY/T0605.6外科植人物
ISO5832-6:1997,IDT)
金属材料第6部分:锻造钻-镍-铬-钼合金(YY/T0605.5一2007,YY/T0605.8外科植人物
金属材料第8部分:锻造钻-镍-铬-钼-钨-铁合金(YY/T0605.82007,ISO5832-8:1997,IDT)
YY0605.12外科植人物
5832-12:1996.IDT)
金属材料第12部分:锻造钻-铬-钼合金(YY/T0605.12—2007,ISOISO4287产品几何技术规范(GPS)表面结构:轮廊法术语、定义及表面结构参数[Geometrical product specification(GPS)--Surface texture: Profile method-Terms, definitions andsurface texture parameters
YY/T0963—2014
ISO5832-1外科植人物金属材料第1部分:锻造不锈钢(Implantsforsurgery一MetallicmaterialsPart l: Wrought stainless steel)ISO6474-1外科植人物陶瓷材料第1部分:高纯氧化铝基陶瓷材料(ImplantsforsurgeryCeramic materialsPart l: Ceramic materials based on high purity alumina)ISO21534:2007无源外科植入物关节置换植人物特殊要求(Non-activesurgicalimplantsJoint replacement implants-Particular requirements)ASTMF746外科植入物金属材料的点蚀和缝隙腐蚀试验方法(Testmethodfotpittingorcrevice corrosion of metallic surgical implant materials)ASTMF1044磷酸钙涂层和金属涂层的剪切试验方法(Standardtestmethodforsheartestingof calcium phosphate coatings and metal coatings)ASTMF1147磷酸钙涂层和金属涂层的拉伸试验方法(Standardtestmethodfortensiontestingof calcium phosphate and metallic coatings)ASTMF1829关节盂剪切方向的锁定机制的静态评价试验方法(Testmethodforstaticevaluation of glenoid locking mechanism in shear)ASTMF2028关节盂松动或脱位的动态评价试验方法(Testmethodsforthedynamicevaluation of glenoid loosening or dissociation)3术语和定义
下列术语和定义适用于本文件。3.1
领collar
颈部和柄部连接处的凸缘。
关节孟部件glenoidcomponent
假体的一部分,用以部分或全部代替肩脚骨关节孟窝,并与生理肱骨头或置换假体形成关节。3.3
脑骨头head
与关节孟形成关节的承载部件。3.4
humeral component
肱骨部件
假体的一部分,用以部分或全部代替脑骨近端或肱骨头,并与自然关节孟或置换假体形成关节。3.5
龙骨(或钉)keel(orpegs)
与关节盂窝中的型腔配合以防止关节孟部件移动和/或转动的一个或多个突起物。3.6
颈neck
连接肱骨头和柄部的部分。
倒置型肩关节植入物
reverse design shoulder implants具有一个球型关节孟部件和一个凹状脑骨部件设计的植人物。2
柄stem
预期插人脑骨髓腔的部分。
4分类
4.1约束型
YY/T0963—2014
约束型关节假体用于关节置换,且防止假体在一个以上的解剖平面内脱位,包含一个单独的、可变的、跨关节的部件或者多个连接或配合的部件。4.2部分约束型
部分约束型关节假体用于部分或全肩关节置换,通过关节面的几何形状限制假体在一个或多个平面内的移动和转动。它不包含跨关节连接。4.3非约束型
非约束型关节假体用于部分或全肩关节置换,对假体在一个或多个平面内的运动约束最小。它不包含跨关节的连接。
5材料
5.1总则
制造假体材料的选择是确保假体功能的必要非充分条件。所有符合本标准的假体,其制造材料应具有足够的力学强度、耐久性、耐腐蚀性和生物相容性。5.2力学强度
肩关节假体的各种部件已成功采用以下材料制造。但是,对那些承受高应力的关键部件,并非所有的材料都具有足够的强度。这些材料标准包括GB/T19701.2、YY0117.1YY0117.3,YY/T0605.5YY/T0605.6、YY/T0605.8(仅用于非承载时)、ISO5832-1YY0605.12、ISO6474-1。5.3耐腐蚀性
对于临床应用中尚未证明适合的材料,当依据标准ASTMF746中的试验方法进行试验时,其耐腐蚀性应与5.2中所列的一种材料相当或更优。5.4生物相容性
对于临床应用中尚未证明适合的材料,当依据GB/T16886.1进行试验时,应具有与5.2中所列的一种材料相当或更优的可接受的生物学反应。6设计评价
6.1材料的磨损
了解关节面的磨损性能是非常重要的。在生理条件下进行试验时,任何新的或不同的材料的磨损率均不应超过下列材料组合的磨损率。当前标准的磨损组合为CoCrMo合金(YY0117.3)对超高分子8
YY/T0963—2014
量聚乙烯(GB/T19701.2),且两者均具有符合6.6要求的高质量表面。注:当销盘试验不适合时,可以考虑其他试验方法6.2肩关节假体植入前的运动范围屈曲应≥90°外展应≥90内旋应≥90°,外旋应≥45°,伸展应≥45°。6.3多孔金属涂层力学性能
多孔金属涂层应根据试验方法ASTMF1044(剪切强度)和ASTMF1147(拉伸强度)的规定进行试验。
6.4体外试验评价指南
6.4.1植人物试验应反映针对该植人物当前临床中的和潜在的失效模式。试验可直接针对半脱位、关节孟松动、衬垫自金属背衬中脱离和肱骨头脱位等。为便于进行以上试验,已汇集了一些关于肩关节载荷的相关文献1.2.3]。基于Anglin等1]和Poppen等[]的研究工作,正常肩关节作用力约为人体体重的12倍,加载方向如Anglin等的文献中的图3所示。在肩关节假体设计中,这些信息(如载荷大小和方向)有助于确定肩关节力的最恶劣状况。然而,这些关节作用力是基于正常情况。为了对特定肩关节假体制定合格/不合格标准(即力、角度和试验循环次数),应考虑预期的患者人群、最恶劣的生理载荷及角度,合理的安全系数和无支撑表面的可能性。6.4.2所有组合式植入物应根据ASTMF1829的试验方法进行试验。6.4.3所有关节盂假体部件应能承受持续的最高为人体体重的静态和动态生理载荷,且不影响其在预期使用和环境下的功能。植人物应根据临床相关循环次数进行松动试验。Anglin等L3建议合理的循环次数是100000次。在最恶劣状况下,可能需要增加循环次数。一种测试骨水泥关节盂部件的试验方法见ASTMF2028。
6.5尺寸
肩关节假体部件的尺寸应参照图1~图3的要求进行标注,制造商应规定相应产品的尺寸及其公差范围,各部位尺寸和公差的检验,用通用量具,专用检具或测量仪器检测6.6关节面粗糙度
6.6.1金属关节面
主要关节面的表面粗糙度Ra值应不大于0.10μm,根据ISO4287方法测量,取样长度为0.25mm。
6.6.2塑料关节面(若使用)
主要关节面的表面粗糙度Ra值应不大于2μm,根据ISO4287方法测量,取样长度为0.8mm。4
关节面半径
脑骨头宽度、
肚骨头厚度
(或柄的直径,当柄宽=柄厚时)注:此器械中可能包含一个组合式连接。图1脑骨无领设计
关节面半径:
肱骨头宽度
肱骨头厚度
(或柄的直径,当柄宽=柄厚时)注:此器械中可能包含一个组合式连接。图2肱骨有领设计
YY/T0963—2014
YY/T0963—2014
盂部件高度
关节面半轻
孟部件有效厚度
龙骨高度
注1:若关节盂部件关于横截面非对称,应规定部件的最小和最大宽度。注2:此器械中可能包含一个组合式连接。图3关节孟部件
7制造
IS021534:2007第8章的要求适用于本标准。8灭菌
8.1总则
ISO21534:2007第9章的要求和下述内容适用于本标准。8.2以无菌状态供货的产品
对于以无菌状态供货的产品,灭菌过程应有效并依照惯例进行控制。龙骨宽度
注:GB/T14233.2规定了无菌试验方法,但该方法不能证明灭菌过程的有效性。灭菌过程可参见GB18278~GB18280。
8.3包含常规超高分子量聚乙烯的植入物若采用电离辐射灭菌,则植人物接受的累计辐射剂量不应超过40kGy。8.4
以非无菌状态供货的产品
以非无菌状态供货的产品,制造商应至少规定一种合适的灭菌方法,若不允许多次灭菌,制造商在所提供的产品信息中应对此予以说明。8.5环氧乙烷灭菌残留量
以环氧乙烷灭菌状态供货的产品,制造商应确定环氧乙烷灭菌残留量的可接受极限,并且不应超过GB/T16886.7的规定,应按GB/T14233.1给出的方法测量。9包装
ISO21534:2007第10章的要求适用于本标准。6
制造商应提供的信息
10.1总则
ISO21534:2007第11章的要求和下述内容适用于本标准。2产品标记
本标准中的部件应视空间允许情况下依次标记如下内容:制造商;
材料;
批号:
产品编号:
—规格;
附加信息可包括在、右和前等标记:关节盂部件的标记可以标明方向(适用时,上、左、右),可选;YY/T0963—2014
如果其中一个部件在X光下不可见,强烈推荐其上应包含显影丝或其他射线探测方法这由制造商判断。
3标签
植人物使用的材料应在包装标签和内附说明中标明。7
YY/T0963—2014
附录A
(资料性附录)
基本原理
A.1本标准的目的是为全肩关节置换部件的制造和使用提供指导。全肩关节置换部件预期用于成年患者,承受动态载荷,处于腐蚀性环境,并在承载面上保持持续的运动。对于完整的关节评价,目前尚未有效建立能够准确模拟所受荷载、侵蚀性电解质和复杂体液组分的实验室试验。几十年来满意性能的长期效果可用作推荐,但利用现有的筛选程序不能进行准确地预测。本标准指出了那些对保证假体寿命中令人满意的重要因素。这里,需要认识到尽管假体部件完好无损,关节置换术的失败仍可能发生。这种情况是事实,它归结于关节置换术本身的综合因素,其中包括植人物、骨水泥(如有)及生理环境等。A.2根据现有信息,本标准涉及的材料代表了当前的最新技术水平。若有新材料经证明是可接受的,在以后的修订中可考虑增加。
A,2.1参考性能应针对患者的解剖结构考虑部件的性能。目前已明确认识到,超出正常范围的事件或活动,如意外事故或是极其剧烈的运动,其引起的物理应力会超过任何部件设计所允许的应力水平。同时还认识到其他一些主要与患者自身因素相关的关节置换失效形式,如骨质疏松、佩吉特氏病、活动不当和活动不足等。
A.2.1.1本标准未规定假体的特定的磨损试验。当前认为磨损在已有的及未来的假体设计中不是主要问题;目前没有可用的技术来进行假体部件的特定的磨损试验;这种考虑已部分涵盖于6.1中。A.2.1.2规定的假体运动范围参数是最小值,这样植人物自身就不会限制患者肩关节运动,因此允许植人物潜在的脱位或松动。起初,运动参数最小范围较大,但已降低到6.2中给出的数值。A.2.2尺寸应使用通用方法测量尺寸,并尽可能使用国际基准。A.2.3表面处理与标记制造商的商标应在每个部件上清晰标出。在空间允许时,应包含完整的信息,包括大小,方向(如存在),带日期的编号等。8
参考文献
YY/T0963—2014
[i]Anglin,C.,Wyss,U.P.,Pichora,D.R.,\Glenohumeral Contact Forces,\Proceedings of theInstitution of Mechanical Engineers.Part H-Journal of Engineering in Medicine,214(6),2000,Pp.637-644.
[2]Poppen,N.K.,Walker,P.S.,\Forces at Glenohumeral Joint in Abduction,\Clinical Ortho-paedics&Related Research,135,Sept.1978,pp.165-170.[3]Anglin,C.,Wyss,U.P.,Pichora,D.R.,\Mechanical Testing of Shoulder Prostheses and RecommendationsforGlenoidDesign,\Journal of Shoulder andElbowSurgery,9,2000,pp.323-3319
YY/T0963-2014
打印日期:2015年4月8日F009A
中华人民共和国医药
行业标准
关节置换植入物肩关节假体
YY/T0963—2014
中国标准出版社出版发行
北京市朝阳区和平里西街甲2号(100029)北京市西城区三里河北街16号(100045)网址spc.net.cn
发行中心:(010)51780235
总编室:(010)64275323)
读者服务部:(010)68523946
中国标准出版社秦皇岛印刷厂印刷各地新华书店经销
开本880×12301/16印张1字数20千字2015年3月第一版
2015年3月第一次印刷
书号:155066·2-28393定价24.00元如有印装差错由本社发行中心调换版权专有侵权必究
举报电话:(010)68510107
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。