YY 0875-2013
标准分类号
关联标准
出版信息
相关单位信息
标准简介
YY 0875-2013.Linear stapler and cartridge.
1范围
YY 0875规定了直线型吻合器的结构型式和材料.要求,试验方法、标志、使用说明书及包装、运输和贮存。
YY 0875适用于直线型吻合器(以下简称吻合器),吻合器适用于消化道重建、脏器切除手术中缝合组织器官的残端和切口。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 228金属材料窒温拉伸 试验方法
GB/T 230.1金属材料 洛氏硬度试验第1 部分:试验方法(A.B.C.D.E.F.G.H.K.N.T标尺)
GB/T 1220不锈钢棒
GB/T 3280不锈 钢冷轧钢板和钢带
GB/T 10610产晶几何技术规范(GPS)表面结构轮廓法评 定表面结构的规则和方法
GB/T 12672丙烯腈-丁二烯苯乙烯(ABS)树 脂
GB/T 13810外科植人物用钛及 钛合金加工材
GB/T 16886.1医疗器 械生物学评价第1部分:风险管理过程中的评价与试验
GB/T 16886.5医疗器 械生物学评价第5部分:体外细胞毒性试验
GB/T 16886.7医疗器 械生物学评价第7部分:环氧乙烧灭菌残留量
GB/T 16886.10医疗器械生物学评价 第10部分:刺激与迟发型超敏反应试验
GB/T 19633最终 灭菌医疗器械的包装
YY/T 0149- 2006 不锈钢医用器械 耐腐 蚀性能试验方法
YY/T 0171- -2008外科器械包装.标志和使用说明书
YY/T 0294.1外科器械金属材料第1 部分:不锈钢
HG/T 2503聚碳酸酯树脂
中华人民共和国药典(2010年版)二部
ISO 13782:1996外科植入物 金属材料 外科植人物用纯钽材料
3使用状态
3.1组件
内置吻合钉,仅使用一次。
3.2重复性使用吻合器
器身经重复灭菌消毒用于多台手术,与无菌包装的组件配合使用.
1范围
YY 0875规定了直线型吻合器的结构型式和材料.要求,试验方法、标志、使用说明书及包装、运输和贮存。
YY 0875适用于直线型吻合器(以下简称吻合器),吻合器适用于消化道重建、脏器切除手术中缝合组织器官的残端和切口。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 228金属材料窒温拉伸 试验方法
GB/T 230.1金属材料 洛氏硬度试验第1 部分:试验方法(A.B.C.D.E.F.G.H.K.N.T标尺)
GB/T 1220不锈钢棒
GB/T 3280不锈 钢冷轧钢板和钢带
GB/T 10610产晶几何技术规范(GPS)表面结构轮廓法评 定表面结构的规则和方法
GB/T 12672丙烯腈-丁二烯苯乙烯(ABS)树 脂
GB/T 13810外科植人物用钛及 钛合金加工材
GB/T 16886.1医疗器 械生物学评价第1部分:风险管理过程中的评价与试验
GB/T 16886.5医疗器 械生物学评价第5部分:体外细胞毒性试验
GB/T 16886.7医疗器 械生物学评价第7部分:环氧乙烧灭菌残留量
GB/T 16886.10医疗器械生物学评价 第10部分:刺激与迟发型超敏反应试验
GB/T 19633最终 灭菌医疗器械的包装
YY/T 0149- 2006 不锈钢医用器械 耐腐 蚀性能试验方法
YY/T 0171- -2008外科器械包装.标志和使用说明书
YY/T 0294.1外科器械金属材料第1 部分:不锈钢
HG/T 2503聚碳酸酯树脂
中华人民共和国药典(2010年版)二部
ISO 13782:1996外科植入物 金属材料 外科植人物用纯钽材料
3使用状态
3.1组件
内置吻合钉,仅使用一次。
3.2重复性使用吻合器
器身经重复灭菌消毒用于多台手术,与无菌包装的组件配合使用.
标准图片预览



标准内容
ICS11.040.30
中华人民共和国医药行业标准
YY0875—2013
直线型吻合器及组件
Linear stapler and cartridge2013-10-21发布
国家食品药品监督管理总局
2014-10-01实施
本标准按照GB/T1.1—2009给出的规则起草。YY0875—2013
请注意本标准的某些内容可能涉及专利,本标的发布机构不承担识别这些专利的责任。本标准由全国外科器械标准化技术委员会(SAC/TC94)提出并归口。本标准起草单位:常州市康迪医用吻合器有限公司、上海市医疗器械检测所、上海医疗器械(集团)有限公司手术器械厂。
本标准参与单位:江苏省医疗器械检验所、常州市三联星海医疗器械制造有限公司、强生(中国)医疗器材有限公司。
本标准的主要起草人:袁栋坤、翁秉豪、刘伟群。I
1范围
直线型吻合器及组件
YY0875—2013
本标准规定了直线型吻合器的结构型式和材料、要求,试验方法、标志、使用说明书及包装、运输和贮存。
本标准适用于直线型吻合器(以下简称吻合器),吻合器适用于消化道重建、脏器切除手术中缝合组织器官的残端和切口。
规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。GB/T228金属材料室温拉伸试验方法GB/T230.1金属材料氏硬度试验第1部分:试验方法(A、B.C.D.E,F.G、H.K.N.T标尺)GB/T1220
不锈钢棒
GB/T3280不锈钢冷轧钢板和钢带)产品几何技术规范(GPS)表面结构轮廊法评定表面结构的规则和方法GB/T10610
GB/T12672
GB/T13810
内烯腈-丁二烯-苯乙烯(ABS)树脂外科植人物用钛及钛合金加工材GB/T16886.1
医疗器械生物学评价第1部分:风险管理过程中的评价与试验GB/T16886.5
GB/T16886.7
医疗器械生物学评价第5部分:体外细胞毒性试验医疗器械生物学评价第7部分:环氧乙烷灭菌残留量GB/T16886.10医疗器械生物学评价第10部分:刺激与迟发型超敏反应试验GB/T19633最终灭菌医疗器械的包装YY/T01492006不锈钢医用器械耐磨蚀性能试验方法YY/T0171一2008外科器械包装,标志和使用说明书YY/T0294.1外科器械金属材料第1部分:不锈钢HG/T2503
3聚碳酸酯树脂
中华人民共和国药典(2010年版)二部ISO13782:1996外科植人物金属材料外科植人物用纯钼材料3使用状态
3.1组件
内置吻合钉,仅使用一次。
靠童复性使用吻合器
器身经重复灭菌消毒用于多台手术,与无菌包装的组件配合使用。1
YY0875—2013
一次性使用吻合器
器身无菌包装,用于单台手术(单个患者),与无菌包装的组件配合使用。4
结构型式和材料
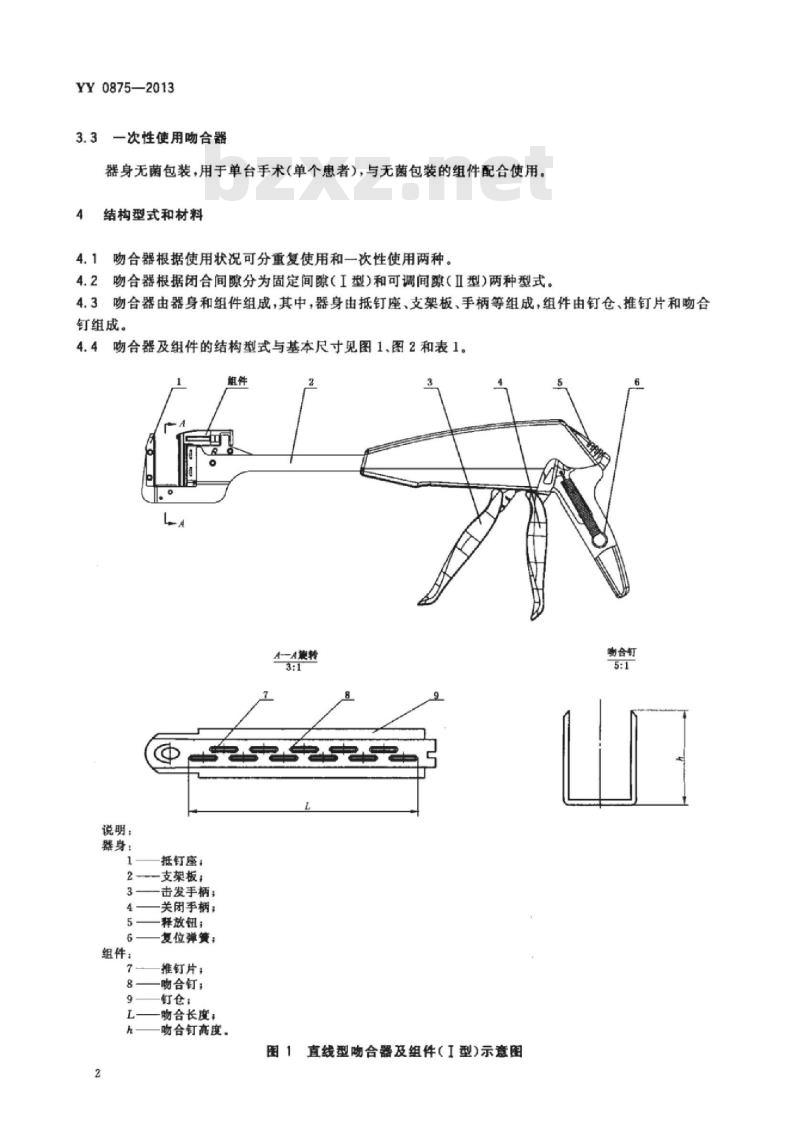
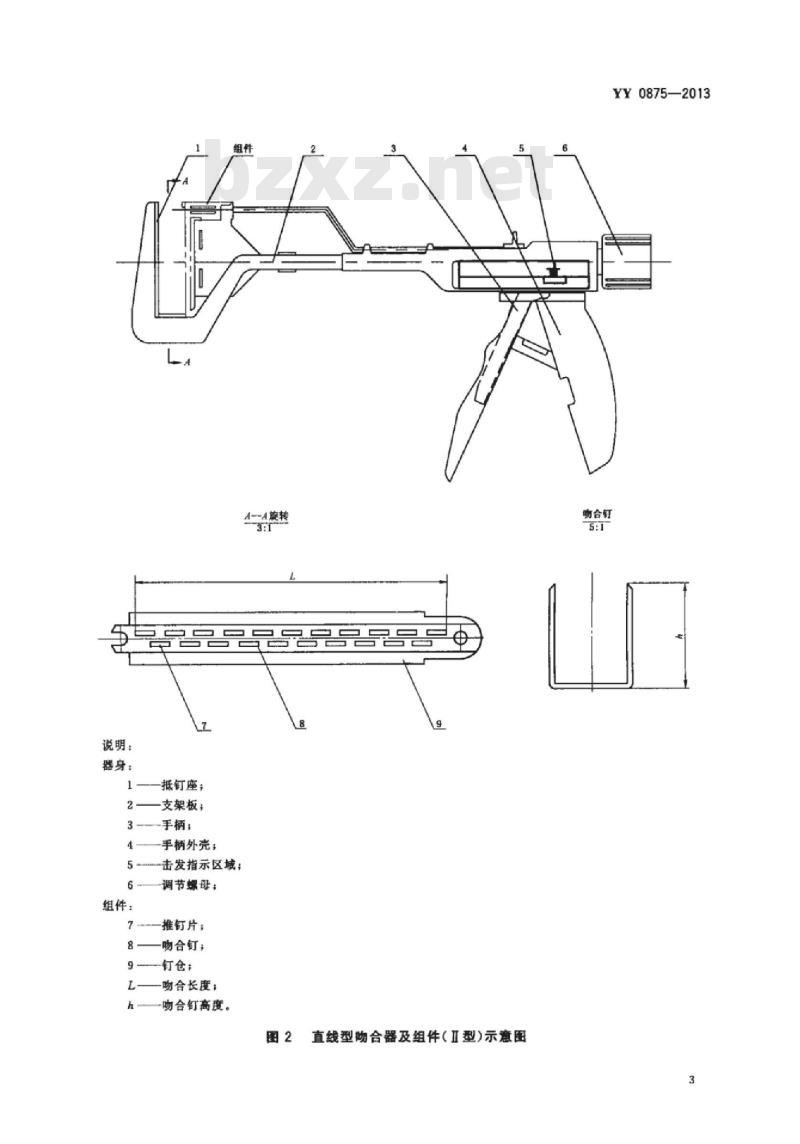
4.1吻合器根据使用状况可分重复使用和一次性使用两种。4.2吻合器根据闭合间隙分为固定间隙(I型)和可调间隙(Ⅱ型)两种型式。4.3吻合器由器身和组件组成,其中,器身由抵钉座、支架板、手柄等组成,组件由钉仓、推钉片和吻合钉组成。
4.4吻合器及组件的结构型式与基本尺寸见图1.图2和表1。组件
说明:
器身:
抵钉座:
一支架板;
组件:
击发手柄:
关闭手柄:
释放钮:
复位弹簧:
推钉片,
吻合钉;
钉仓:
吻合长度:
吻合钉高度。
A--A能转
喇合钉
图1直线型吻合器及组件(I型)示意图说明:
器身:
组件:
一抵钉座;
支架板:
一手柄:
手柄外壳:
击发指示区域:
调节螺母:
推钉片
吻合钉:
9—钉仓:
吻合长度;
吻合钉高度。
A--A旋转
直线型吻合器及组件(Ⅱ型)示意图YY0875—2013
吻合钉
YY0875—2013
吻合长度L
标示值土2.0
表1基本尺寸
4.5吻合器及组件主要零件材料应符合表2的规定。主要零件材料要求
季件名称
重复使用的抵钉座
一次性使用抵钉座
吻合钉
材料牌号
05Cr17Ni4Cu4Nb.20Cr13.30Cr13B.C
12Cr18Ni9.06Cr19Ni10
TAI.TA2.TA3.TC4
:也可采用经验证被评价为安全的、符合本标准要求的其他材料。吻合器及组件的规格应标记如下:4.6
吻合钉高度
吻合长度
标记示例:
吻合钉高度A
标示值土0.2
标准号
GB/T1220
YY/T0249.1
GB/T3280
YY/T0249.1
GB/T13810
ISO13782
GB/T12672
HG/T2503
吻合长度为60mm,吻合钉高度为4.8mm的直线型吻合器,其规格标记为:60×4.8。5要求
5.1吻合钉材料
吻合钉应选择表2中规定的材料制成。单位为毫米
制成吻合钉的纯钛,钛合金材料的化学成分应符合GB/T13810的规定。制成吻合钉的纯钼材料的化学成分应符合ISO13782的规定。制成吻合钉材料的拉伸强度应不小于240MPa。5.2
灵活性
5.2.1吻合器开闭应灵活,不应有卡阻现象,5.2.2I型吻合器的复位弹簧的弹性应确保按下释放钮时能完全复位。5.2.3Ⅱ型吻合器应有一个有效击发指示区域,当调节到合适的吻合间隙时,其指针标线应在有效击发指示区域内。
5.3装配性
5.3.1吻合器组件更换应方便、定位可靠。5.3.2组件经甩动后吻合钉不应露出钉仓表面。5.4吻合性能
吻合器应具有良好的吻合性能,经不少于5次吻合,其吻合后缝钉应成类“B”字形。5.5耐压性能
吻合后的吻合口应能承受不小于3.6×10*Pa压强,在15s内漏水不超过10滴。5.6硬度
重复使用的抵钉座的硬度应不小于35HRC。5.7表面粗糙度
吻合器金属外表面粗糙度Ra应不大于0.8μm。5.8耐腐蚀性能
YY0875—2013
重复使用的抵钉座应有良好的耐腐蚀性能,试验后其表面状态应不低于YY/T0149一2006中5.4b级的规定。
5.9包装密封
5.9.1一次性使用吻合器及组件的包装应完好,粘合密封区域应无通道或穿孔。5.9.2一次性使用吻合器及组件的包装封口剥离强度不小于0.10N/mm。剥离时两接触表面应光滑且连续均勾,无分层或撕裂现象。5.10外观
5.10.1吻合器外形光滑,轮廊清晰、无毛刺、划伤、锈迹等缺陷。5.10.2吻合器外表面上的字迹、标志清晰,不得有错位,歪斜等缺陷。5.10.3吻合钉表面不得有毛刺、飞边等缺陷。5.11尺寸
吻合器及组件尺寸应符合表1的规定。5.12灭菌
5.12.1一次性使用吻合器及组件经已确认过的灭菌过程进行灭菌,产品应无菌。5.12.2如采用环氧乙烷灭菌,一次性使用吻合器及组件的环氧乙烷残留量应不大于10μg/g。5.13生物学评价
5.13.1吻合钉,选用表面作改性处理的纯钛.钛合金材料和纯钼材料或表2未规定的其他材料,应按GB/T16886.1的规定进行生物学评价,评价结果应无生物相容性危害。5.13.2抵钉座,钉仓的细胞毒性计分应不大于1。5.13.3抵钉座、钉仓迟发型超数反应等级应不大于1。5
YY0875—2013
5.13.4抵钉座、钉仓皮内反应记分应不大于1。6试验方法免费标准下载网bzxz
6.1材料检验
制成吻合钉的纯钛和钛合金材料的化学成分检验按GB/T13810中规定的方法进行;制成吻合钉的钮丝材料的化学成分检验按ISO13782中规定的方法进行;吻合钉材料的拉伸强度按GB/T228中规定的方法进行:检验结果应符合5.1的规定。
6.2灵活性检验
6.2.1调节抵钉座和组件之间的间隙及开闭手柄,应符合5.2.1的规定。6.2.2调节抵钉座和组件之间的间隙,夹住两层总厚度为钉高的1/2~2/3的EVA低发泡板试样(见附录A),目视检查:
a)I型吻合器按下释放钮,观察吻合器是否完全复位,应符合5.2.2的规定;b)Ⅱ型吻合器在调节到规定的吻合间隙时,应符合5.2.3的规定。6.3装配性检验
6.3.1更换组件,应符合5.3.1的规定。6.3.2甩动组件至少5次后,用手触摸钉仓表面,应符合5.3.2的规定。6.4吻合性能试验
吻合两层总厚度为钉高的1/2~2/3的EVA低发泡板试样。沿成型吻合钉边缘去除多余EVA低发泡板,露出成型后的吻合钉,用目视检查,应符合5.4的规定。6.5耐压性能试验
按附录B规定的方法进行试验,应符合5.5的规定。6.6硬度
按GB/T230.1中规定的方法进行,在抵钉座表面测3点,取其3点的算术平均值,应符合5.6的规定。
6.7表面粗糙度检验
表面粗糙度用样块比较法或GB/T10610规定的轮廊法进行,应符合5.7的规定。仲裁时采用轮廊法。
6.8耐腐蚀性能试验
按YY/T0149—2006中沸水试验法进行,应符合5.8的规定。6.9包装密封检验
6.9.1密封性能试验
按附录C的方法进行试验,应符合5.9.1的规定。6
6.9.2剥离强度试验
按附录D规定的方法进行,应符合5.9.2的规定。6.10外观检验
目测及用手拭摸,应符合5.10的规定。6.11尺寸检验
用通用量具测量或专用量具,应符合5.11的规定。6.12无菌和环氧乙烷残留量检验YY0875—2013
6.12.1无菌检验按《中华人民共和国药典(2010年版)二部》中规定的方法进行,应符合5.12.1的规定。
6.12.2环氧乙烷残留量的测定按GB/T16886.7中规定的方法进行,应符合5.12.2的规定。6.13生物学评价
6.13.1表面作改性处理的纯钛、钛合金材料和纯钼材料或表2未规定的其他材料制成的吻合钉应按GB/T16886.1的规定项目作生物学评价,应符合5.13.1的规定。6.13.2按GB/T16886.5—2003中8.2(浸提液试验)规定的方法进行,应符合5.13.2的规定。6.13.3按GB/T16886.10—2005中7.4(最大剂量试验)规定的方法进行,应符合5.13.3的规定。6.13.4按GB/T16886.10—2005中(附录B.2皮内反应试验)规定的方法进行,应符合5.13.4的规定。
7标志,使用说明书
7.1标志
7.1.1每把吻合器的器身上应有制造厂代号或商标。7.1.2重复性使用的吻合器的包装盒的标志应符合YY/T0171一2008中的4.1.1的规定。7.1.3一次性使用的吻合器和组件的包装标志:a)单包装标志应符合YY/T0171—2008中的4.1.3的规定;b)外包装标志应符合YY/T01712008中的4.2.3的规定。7.1.4合格证上的标志应符合YY/T0171一2008中的4.3的规定。7.2使用说明书
使用说明书的编写应符合YY/T0171--2008中第5章的规定。8包装、运输、贮存、有效期
8.1包装
8.1.1重复性使用的吻合器器身包装:a)重复性使用的吻合器的器身应单独包装:b)每把吻合器的器身应装人能将产品固定的包装盒内,防止在运输过程中松动受损:7
YY0875—2013
包装盒内应有检验合格证、使用说明书。8.1.2一次性使用的吻合器包装:a)吻合器应单件包装,在储存期内应保持无菌;b)单包装打开后应留有打开过的痕迹单包装装人包装盒内,应附有使用说明书和合格证。8.1.3
组件包装:
组件应单件包装,在储存期内应保持无菌;a)
单包装打开后应留有打开过的痕迹;若干个单包装装人包装盒内,应附有使用说明书和合格证。运输、贮存
吻合器及组件的外包装应能保证在正常运输、贮存条件下不损坏。8.2.2
外包装上的字样或标志应保证不应历时较久而模糊不清。8.2.3
包装后的吻合器应贮存在相对湿度不超过80%,无腐蚀气体和通风良好的室内。8.3有效期
8.3.1重复使用吻合器经包装后,在遵守贮存规则的条件下,应保证在两年内不生锈。8.3.2
两年。
一次性使用的吻合器和组件经灭菌后,在遵守贮存规则的条件下,从灭菌之日起有效期不少于A1
材料名称
EVA低发泡板。
材料参数
厚度:0.7mm~2.5mm
密度:80kg/m2~110kg/m
(资料性附录)
吻合性能试验材料
拉伸强度:1150kPa~1350kPa。
25%压缩强度:120kPa~150kPa。YY0875—2013
YY0875—2013
B.1定义
附录B
(规范性附最)
耐压性能试验
B.1.1吻合口耐压:是指用吻合器将组织或器官吻合完毕后,吻合口所能承受的压力。B.1.2吻合:组织或器官的切口对接且完全吻合、畅通。B.1.3缝合:残端切口的关闭。
B.2仪器要求
仪器应按规定程序所批准的图样及文件制造。B.2.1
B.2.2仪器所需要电源电压:220V士22V;电源频率:50Hz士0.5Hz。B.2.3仪器的计量单位:“kPa(于帕》”。B.2.4仪器的示值范围:0kPa~6kPa,示值误差:士0.12kPa。B.2.5仪器有进水、排水和停止动作。仪器的压力表每隔一年检查一次。B.2.6
仪器的进水、排水管道应通畅,控制装置应可靠。B.2.7
B.3试验材料
试验材料为新鲜的猪肠,离体时间小于24h,5℃15℃范围内保存,无冰晶形成。B.3.1
试验前应将肠腔洗净,去除待吻(缝)合处的肠脂垂及肠系膜。B.3.2
试验方法
选择与被测吻合器规格相适应的肠管作残端吻合。B.4.1
B.4.2将肠管平整置人吻合器钳口,关闭吻合器,并击发:用手术刀将残端切除,在离吻合口100mm左右将肠管剪断。
B.4.3肠管开口与吻(缝)合口压力测试器的注水口连接,并结扎牢固,不得渗漏。B.4.4将压力逐渐增至标准中规定的数值,停止加压,持续155。B.4.5
存细观察吻合口。
5试验报告
B.5.1标识试验样品的来源,记录样品批号。B.5.2
2报告吻合口的漏水状况
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
中华人民共和国医药行业标准
YY0875—2013
直线型吻合器及组件
Linear stapler and cartridge2013-10-21发布
国家食品药品监督管理总局
2014-10-01实施
本标准按照GB/T1.1—2009给出的规则起草。YY0875—2013
请注意本标准的某些内容可能涉及专利,本标的发布机构不承担识别这些专利的责任。本标准由全国外科器械标准化技术委员会(SAC/TC94)提出并归口。本标准起草单位:常州市康迪医用吻合器有限公司、上海市医疗器械检测所、上海医疗器械(集团)有限公司手术器械厂。
本标准参与单位:江苏省医疗器械检验所、常州市三联星海医疗器械制造有限公司、强生(中国)医疗器材有限公司。
本标准的主要起草人:袁栋坤、翁秉豪、刘伟群。I
1范围
直线型吻合器及组件
YY0875—2013
本标准规定了直线型吻合器的结构型式和材料、要求,试验方法、标志、使用说明书及包装、运输和贮存。
本标准适用于直线型吻合器(以下简称吻合器),吻合器适用于消化道重建、脏器切除手术中缝合组织器官的残端和切口。
规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。GB/T228金属材料室温拉伸试验方法GB/T230.1金属材料氏硬度试验第1部分:试验方法(A、B.C.D.E,F.G、H.K.N.T标尺)GB/T1220
不锈钢棒
GB/T3280不锈钢冷轧钢板和钢带)产品几何技术规范(GPS)表面结构轮廊法评定表面结构的规则和方法GB/T10610
GB/T12672
GB/T13810
内烯腈-丁二烯-苯乙烯(ABS)树脂外科植人物用钛及钛合金加工材GB/T16886.1
医疗器械生物学评价第1部分:风险管理过程中的评价与试验GB/T16886.5
GB/T16886.7
医疗器械生物学评价第5部分:体外细胞毒性试验医疗器械生物学评价第7部分:环氧乙烷灭菌残留量GB/T16886.10医疗器械生物学评价第10部分:刺激与迟发型超敏反应试验GB/T19633最终灭菌医疗器械的包装YY/T01492006不锈钢医用器械耐磨蚀性能试验方法YY/T0171一2008外科器械包装,标志和使用说明书YY/T0294.1外科器械金属材料第1部分:不锈钢HG/T2503
3聚碳酸酯树脂
中华人民共和国药典(2010年版)二部ISO13782:1996外科植人物金属材料外科植人物用纯钼材料3使用状态
3.1组件
内置吻合钉,仅使用一次。
靠童复性使用吻合器
器身经重复灭菌消毒用于多台手术,与无菌包装的组件配合使用。1
YY0875—2013
一次性使用吻合器
器身无菌包装,用于单台手术(单个患者),与无菌包装的组件配合使用。4
结构型式和材料
4.1吻合器根据使用状况可分重复使用和一次性使用两种。4.2吻合器根据闭合间隙分为固定间隙(I型)和可调间隙(Ⅱ型)两种型式。4.3吻合器由器身和组件组成,其中,器身由抵钉座、支架板、手柄等组成,组件由钉仓、推钉片和吻合钉组成。
4.4吻合器及组件的结构型式与基本尺寸见图1.图2和表1。组件
说明:
器身:
抵钉座:
一支架板;
组件:
击发手柄:
关闭手柄:
释放钮:
复位弹簧:
推钉片,
吻合钉;
钉仓:
吻合长度:
吻合钉高度。
A--A能转
喇合钉
图1直线型吻合器及组件(I型)示意图说明:
器身:
组件:
一抵钉座;
支架板:
一手柄:
手柄外壳:
击发指示区域:
调节螺母:
推钉片
吻合钉:
9—钉仓:
吻合长度;
吻合钉高度。
A--A旋转
直线型吻合器及组件(Ⅱ型)示意图YY0875—2013
吻合钉
YY0875—2013
吻合长度L
标示值土2.0
表1基本尺寸
4.5吻合器及组件主要零件材料应符合表2的规定。主要零件材料要求
季件名称
重复使用的抵钉座
一次性使用抵钉座
吻合钉
材料牌号
05Cr17Ni4Cu4Nb.20Cr13.30Cr13B.C
12Cr18Ni9.06Cr19Ni10
TAI.TA2.TA3.TC4
:也可采用经验证被评价为安全的、符合本标准要求的其他材料。吻合器及组件的规格应标记如下:4.6
吻合钉高度
吻合长度
标记示例:
吻合钉高度A
标示值土0.2
标准号
GB/T1220
YY/T0249.1
GB/T3280
YY/T0249.1
GB/T13810
ISO13782
GB/T12672
HG/T2503
吻合长度为60mm,吻合钉高度为4.8mm的直线型吻合器,其规格标记为:60×4.8。5要求
5.1吻合钉材料
吻合钉应选择表2中规定的材料制成。单位为毫米
制成吻合钉的纯钛,钛合金材料的化学成分应符合GB/T13810的规定。制成吻合钉的纯钼材料的化学成分应符合ISO13782的规定。制成吻合钉材料的拉伸强度应不小于240MPa。5.2
灵活性
5.2.1吻合器开闭应灵活,不应有卡阻现象,5.2.2I型吻合器的复位弹簧的弹性应确保按下释放钮时能完全复位。5.2.3Ⅱ型吻合器应有一个有效击发指示区域,当调节到合适的吻合间隙时,其指针标线应在有效击发指示区域内。
5.3装配性
5.3.1吻合器组件更换应方便、定位可靠。5.3.2组件经甩动后吻合钉不应露出钉仓表面。5.4吻合性能
吻合器应具有良好的吻合性能,经不少于5次吻合,其吻合后缝钉应成类“B”字形。5.5耐压性能
吻合后的吻合口应能承受不小于3.6×10*Pa压强,在15s内漏水不超过10滴。5.6硬度
重复使用的抵钉座的硬度应不小于35HRC。5.7表面粗糙度
吻合器金属外表面粗糙度Ra应不大于0.8μm。5.8耐腐蚀性能
YY0875—2013
重复使用的抵钉座应有良好的耐腐蚀性能,试验后其表面状态应不低于YY/T0149一2006中5.4b级的规定。
5.9包装密封
5.9.1一次性使用吻合器及组件的包装应完好,粘合密封区域应无通道或穿孔。5.9.2一次性使用吻合器及组件的包装封口剥离强度不小于0.10N/mm。剥离时两接触表面应光滑且连续均勾,无分层或撕裂现象。5.10外观
5.10.1吻合器外形光滑,轮廊清晰、无毛刺、划伤、锈迹等缺陷。5.10.2吻合器外表面上的字迹、标志清晰,不得有错位,歪斜等缺陷。5.10.3吻合钉表面不得有毛刺、飞边等缺陷。5.11尺寸
吻合器及组件尺寸应符合表1的规定。5.12灭菌
5.12.1一次性使用吻合器及组件经已确认过的灭菌过程进行灭菌,产品应无菌。5.12.2如采用环氧乙烷灭菌,一次性使用吻合器及组件的环氧乙烷残留量应不大于10μg/g。5.13生物学评价
5.13.1吻合钉,选用表面作改性处理的纯钛.钛合金材料和纯钼材料或表2未规定的其他材料,应按GB/T16886.1的规定进行生物学评价,评价结果应无生物相容性危害。5.13.2抵钉座,钉仓的细胞毒性计分应不大于1。5.13.3抵钉座、钉仓迟发型超数反应等级应不大于1。5
YY0875—2013
5.13.4抵钉座、钉仓皮内反应记分应不大于1。6试验方法免费标准下载网bzxz
6.1材料检验
制成吻合钉的纯钛和钛合金材料的化学成分检验按GB/T13810中规定的方法进行;制成吻合钉的钮丝材料的化学成分检验按ISO13782中规定的方法进行;吻合钉材料的拉伸强度按GB/T228中规定的方法进行:检验结果应符合5.1的规定。
6.2灵活性检验
6.2.1调节抵钉座和组件之间的间隙及开闭手柄,应符合5.2.1的规定。6.2.2调节抵钉座和组件之间的间隙,夹住两层总厚度为钉高的1/2~2/3的EVA低发泡板试样(见附录A),目视检查:
a)I型吻合器按下释放钮,观察吻合器是否完全复位,应符合5.2.2的规定;b)Ⅱ型吻合器在调节到规定的吻合间隙时,应符合5.2.3的规定。6.3装配性检验
6.3.1更换组件,应符合5.3.1的规定。6.3.2甩动组件至少5次后,用手触摸钉仓表面,应符合5.3.2的规定。6.4吻合性能试验
吻合两层总厚度为钉高的1/2~2/3的EVA低发泡板试样。沿成型吻合钉边缘去除多余EVA低发泡板,露出成型后的吻合钉,用目视检查,应符合5.4的规定。6.5耐压性能试验
按附录B规定的方法进行试验,应符合5.5的规定。6.6硬度
按GB/T230.1中规定的方法进行,在抵钉座表面测3点,取其3点的算术平均值,应符合5.6的规定。
6.7表面粗糙度检验
表面粗糙度用样块比较法或GB/T10610规定的轮廊法进行,应符合5.7的规定。仲裁时采用轮廊法。
6.8耐腐蚀性能试验
按YY/T0149—2006中沸水试验法进行,应符合5.8的规定。6.9包装密封检验
6.9.1密封性能试验
按附录C的方法进行试验,应符合5.9.1的规定。6
6.9.2剥离强度试验
按附录D规定的方法进行,应符合5.9.2的规定。6.10外观检验
目测及用手拭摸,应符合5.10的规定。6.11尺寸检验
用通用量具测量或专用量具,应符合5.11的规定。6.12无菌和环氧乙烷残留量检验YY0875—2013
6.12.1无菌检验按《中华人民共和国药典(2010年版)二部》中规定的方法进行,应符合5.12.1的规定。
6.12.2环氧乙烷残留量的测定按GB/T16886.7中规定的方法进行,应符合5.12.2的规定。6.13生物学评价
6.13.1表面作改性处理的纯钛、钛合金材料和纯钼材料或表2未规定的其他材料制成的吻合钉应按GB/T16886.1的规定项目作生物学评价,应符合5.13.1的规定。6.13.2按GB/T16886.5—2003中8.2(浸提液试验)规定的方法进行,应符合5.13.2的规定。6.13.3按GB/T16886.10—2005中7.4(最大剂量试验)规定的方法进行,应符合5.13.3的规定。6.13.4按GB/T16886.10—2005中(附录B.2皮内反应试验)规定的方法进行,应符合5.13.4的规定。
7标志,使用说明书
7.1标志
7.1.1每把吻合器的器身上应有制造厂代号或商标。7.1.2重复性使用的吻合器的包装盒的标志应符合YY/T0171一2008中的4.1.1的规定。7.1.3一次性使用的吻合器和组件的包装标志:a)单包装标志应符合YY/T0171—2008中的4.1.3的规定;b)外包装标志应符合YY/T01712008中的4.2.3的规定。7.1.4合格证上的标志应符合YY/T0171一2008中的4.3的规定。7.2使用说明书
使用说明书的编写应符合YY/T0171--2008中第5章的规定。8包装、运输、贮存、有效期
8.1包装
8.1.1重复性使用的吻合器器身包装:a)重复性使用的吻合器的器身应单独包装:b)每把吻合器的器身应装人能将产品固定的包装盒内,防止在运输过程中松动受损:7
YY0875—2013
包装盒内应有检验合格证、使用说明书。8.1.2一次性使用的吻合器包装:a)吻合器应单件包装,在储存期内应保持无菌;b)单包装打开后应留有打开过的痕迹单包装装人包装盒内,应附有使用说明书和合格证。8.1.3
组件包装:
组件应单件包装,在储存期内应保持无菌;a)
单包装打开后应留有打开过的痕迹;若干个单包装装人包装盒内,应附有使用说明书和合格证。运输、贮存
吻合器及组件的外包装应能保证在正常运输、贮存条件下不损坏。8.2.2
外包装上的字样或标志应保证不应历时较久而模糊不清。8.2.3
包装后的吻合器应贮存在相对湿度不超过80%,无腐蚀气体和通风良好的室内。8.3有效期
8.3.1重复使用吻合器经包装后,在遵守贮存规则的条件下,应保证在两年内不生锈。8.3.2
两年。
一次性使用的吻合器和组件经灭菌后,在遵守贮存规则的条件下,从灭菌之日起有效期不少于A1
材料名称
EVA低发泡板。
材料参数
厚度:0.7mm~2.5mm
密度:80kg/m2~110kg/m
(资料性附录)
吻合性能试验材料
拉伸强度:1150kPa~1350kPa。
25%压缩强度:120kPa~150kPa。YY0875—2013
YY0875—2013
B.1定义
附录B
(规范性附最)
耐压性能试验
B.1.1吻合口耐压:是指用吻合器将组织或器官吻合完毕后,吻合口所能承受的压力。B.1.2吻合:组织或器官的切口对接且完全吻合、畅通。B.1.3缝合:残端切口的关闭。
B.2仪器要求
仪器应按规定程序所批准的图样及文件制造。B.2.1
B.2.2仪器所需要电源电压:220V士22V;电源频率:50Hz士0.5Hz。B.2.3仪器的计量单位:“kPa(于帕》”。B.2.4仪器的示值范围:0kPa~6kPa,示值误差:士0.12kPa。B.2.5仪器有进水、排水和停止动作。仪器的压力表每隔一年检查一次。B.2.6
仪器的进水、排水管道应通畅,控制装置应可靠。B.2.7
B.3试验材料
试验材料为新鲜的猪肠,离体时间小于24h,5℃15℃范围内保存,无冰晶形成。B.3.1
试验前应将肠腔洗净,去除待吻(缝)合处的肠脂垂及肠系膜。B.3.2
试验方法
选择与被测吻合器规格相适应的肠管作残端吻合。B.4.1
B.4.2将肠管平整置人吻合器钳口,关闭吻合器,并击发:用手术刀将残端切除,在离吻合口100mm左右将肠管剪断。
B.4.3肠管开口与吻(缝)合口压力测试器的注水口连接,并结扎牢固,不得渗漏。B.4.4将压力逐渐增至标准中规定的数值,停止加压,持续155。B.4.5
存细观察吻合口。
5试验报告
B.5.1标识试验样品的来源,记录样品批号。B.5.2
2报告吻合口的漏水状况
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
