YY/T 0870.1-2013
基本信息
标准号: YY/T 0870.1-2013
中文名称:医疗器械遗传毒性试验 第1部分:细菌回复突变试验
标准类别:医药行业标准(YY)
标准状态:现行
出版语种:简体中文
下载格式:.zip .pdf
下载大小:3701454

标准分类号
关联标准
出版信息
相关单位信息
标准简介
YY/T 0870.1-2013.Test for genotoxicity of medical devices-Part 1 :Bacterial reverse mutation test.
6.3.2.2接种:取有组氨酸和无组氨酸培养基平皿各一个,按菌株号顺序各取-白金耳菌液划线(直线)接种在培养基表面,37 C培养48 h。
6.3.2.3结果判定:受试菌株在有组氨酸培养基平皿表面各长出一条菌膜,无组氨酸培养基平皿上除自发回复突变菌落外无菌膜,说明受试菌株确为组氨酸缺陷型。
6.3.3脂 多糖屏障缺陷的鉴定
6.3.3.1接种:取菌液0.1mL移人平皿,迅速将加热融化的营养肉汤琼脂培养基(冷却至50C左右)适量倒人平皿,混匀,平放凝固。将--片无菌滤纸片放人已凝固的培养基平皿中央,用移液器在滤纸片上滴加0. 1%结晶紫溶液10 μL,37 C培养24 h,每个菌株做一个平皿。
6.3.3.2结果判定:阳性者在纸周围出现一个透明的抑制带。说明存在rfa(深粗型)突变。TA97、TA98.TA100、TA1535.TA1637、TA102和WP2(pKM101)均有抑制带,野生型鼠伤寒沙门氏菌和野生型WP2(pKM101)没有抑制带。
6.3.4 R因子的鉴定.
6.3.4.1加热融化营养肉汤琼脂培养基,冷却至50C左右,适量倒人平皿电,平放凝固,用移液器吸0. 8%氨苄青霉素10以在凝固的培养基表面依中线涂成条带,待氨节青霉素溶液干后,用接种环与氨苄青霉素带相交叉划线接种要鉴定的菌株,并且接种个不具有R因子的菌株作氨茉青霉索抗性的对照(- -个平皿可同时鉴定几个菌株) ,37心培养241由。
6.3.4.2结果判定 :茵株经过24 h培养,在氨¥青理紫带的周围依然生长不受抑制,即有抗氨苄青霉素效应,证明带有R因子
6.3.5 uveB 修复缺陷型的鉴定
6.3.5.1在营养肉汤琼脂培养基平皿表面用接种环划线接种需要的菌株。接种后的平m-半用黑纸覆盖,在距15 W紫外线灭菌灯33 cm处照射8s37 C培养24 h.
6.3.5.2结果判定:对紫外线敏 感的菌株仅在没有照射过的部分生长。
6.3.6四环素 抗性的鉴定
6.3.6.1用移 液器各吸取后μL~10 μL 0.8%的四环素溶液和0. 8%的氨苄青霉素溶液,在营养肉汤琼脂培养基平皿表面依中线各涂成一条带,待四环素和氨苄青霉秦液干后,用接种环于四环素和氨苄青霉素带相交叉划线接种TA102和一种有R因子的菌株(作为四环素抗性的对照) ,37 C培养24 h.
6.3.6.2结果判定 :TA 102菌株生长不受抑制,对照菌株有一段生 长抑制区,表明TA102菌株有抗四环素效应。
6.3.2.2接种:取有组氨酸和无组氨酸培养基平皿各一个,按菌株号顺序各取-白金耳菌液划线(直线)接种在培养基表面,37 C培养48 h。
6.3.2.3结果判定:受试菌株在有组氨酸培养基平皿表面各长出一条菌膜,无组氨酸培养基平皿上除自发回复突变菌落外无菌膜,说明受试菌株确为组氨酸缺陷型。
6.3.3脂 多糖屏障缺陷的鉴定
6.3.3.1接种:取菌液0.1mL移人平皿,迅速将加热融化的营养肉汤琼脂培养基(冷却至50C左右)适量倒人平皿,混匀,平放凝固。将--片无菌滤纸片放人已凝固的培养基平皿中央,用移液器在滤纸片上滴加0. 1%结晶紫溶液10 μL,37 C培养24 h,每个菌株做一个平皿。
6.3.3.2结果判定:阳性者在纸周围出现一个透明的抑制带。说明存在rfa(深粗型)突变。TA97、TA98.TA100、TA1535.TA1637、TA102和WP2(pKM101)均有抑制带,野生型鼠伤寒沙门氏菌和野生型WP2(pKM101)没有抑制带。
6.3.4 R因子的鉴定.
6.3.4.1加热融化营养肉汤琼脂培养基,冷却至50C左右,适量倒人平皿电,平放凝固,用移液器吸0. 8%氨苄青霉素10以在凝固的培养基表面依中线涂成条带,待氨节青霉素溶液干后,用接种环与氨苄青霉素带相交叉划线接种要鉴定的菌株,并且接种个不具有R因子的菌株作氨茉青霉索抗性的对照(- -个平皿可同时鉴定几个菌株) ,37心培养241由。
6.3.4.2结果判定 :茵株经过24 h培养,在氨¥青理紫带的周围依然生长不受抑制,即有抗氨苄青霉素效应,证明带有R因子
6.3.5 uveB 修复缺陷型的鉴定
6.3.5.1在营养肉汤琼脂培养基平皿表面用接种环划线接种需要的菌株。接种后的平m-半用黑纸覆盖,在距15 W紫外线灭菌灯33 cm处照射8s37 C培养24 h.
6.3.5.2结果判定:对紫外线敏 感的菌株仅在没有照射过的部分生长。
6.3.6四环素 抗性的鉴定
6.3.6.1用移 液器各吸取后μL~10 μL 0.8%的四环素溶液和0. 8%的氨苄青霉素溶液,在营养肉汤琼脂培养基平皿表面依中线各涂成一条带,待四环素和氨苄青霉秦液干后,用接种环于四环素和氨苄青霉素带相交叉划线接种TA102和一种有R因子的菌株(作为四环素抗性的对照) ,37 C培养24 h.
6.3.6.2结果判定 :TA 102菌株生长不受抑制,对照菌株有一段生 长抑制区,表明TA102菌株有抗四环素效应。
标准图片预览




标准内容
ICS 11.040.01
中华人民共和国医药行业标准
YY/T0870.1—2013
医疗器械遗传毒性试验
第1部分:细菌回复突变试验
Test for gcnotoxicity of medical devices-Part 1:Bacterial reverse mutation test2013-10-21发布
国家食品药品监督管理总局
2014-10-01实施
YY/T0870的总标题是《医疗器遗传声性试验》,包括以下部分:第1部分:细菌回复突变试验;
第2部分:体外哺乳动物细胞染色体畸变试验;第3部分:用小鼠淋巴瘤细胞进行的体外哺乳动物细胞基因突变试验;第4部分:哺乳动物骨髓红细胞微核试验;-第5部分:哺乳动物骨髓染色体畸变试验,有关其他方面的遗传毒性试验将有其他部分的标准。本部分为YY/T0870的第1部分。
本部分按照GB/T1.1—2009给出的规则起草。YY/T0870.1--2013
YY/T0870的本部分是参考0ECD471—1997《细菌回复突变试验》并结合医疗器械/材料自身特点制定的。
请注意本文件的某些内容可能涉及专利。本文件的发布机构不承扣识别这些专利的责任。本部分由国家食品药品监督管现总局提出。本部分由全国医疗器械生物学评价标准化技术委员会(SAC/TC248)归口。本部分主要起草单位:国家食品药品监督管理局济南医疗器械质量监督检验中心。本部分参加起草单位:国家食品药品监督管理局天津医疗器械质量监督检验中心、国家食品药品监督管理局北京医疗器械质量监督检验中心。本部分主要起草人:曾冬明、黄经春、于兆琴,陶剑、汤菊莉。T
YY/T0870.1—2013
GB/T16886.3中给出的检测潜在遗传毒性物质的试验方法均为经济合作与发展组织(OECD)《化学品测试指南》中规定的方法,但这些方法足针对化学品的特性制定而成,同时末给出详细的试验步骤,因此不适宜直接用于医疗器械/材料的检测。YY/T0870参照OECD试验方法基本原则,并根据医疗器械/材料的特性对试验方法进行「适当的修改,规定了详细的试验步骤,可作为CB/T16886.3中遗传毒性试验的补充方法标准。
YY/T0870的本部分参照OECDNo.471(1997)方法,有或无代谢活化系统的情况下,通过观察医疗器械/材料导组氨酸营养缺陷型鼠伤寒沙门氏菌株(his-)和色氨酸营养缺陷型大肠杆菌菌株的突变情况,以评价其潜在的致突变性。点突变是许多人炎遗传性疾病的原因。有确切的证据表明,体细胞的癌基因和肿瘤抑制基因的点突变与人类和实验动物的肿瘤形成有关。许多试验菌株因具有多种特性,如回复位点的DNA序列,细胞对大分子通透性的增加.DNA修复系统的缺失或DNA修复过程中错配的提高等,而使得它们对突变的检测更为敏感。其中,细菌回复突变试验具有快捷、廉价并且相对容易操作等优点,可用来检测DNA碱基对的替代、增加或缺失,为遗传毒性物质诱导的突变类型提供有用的信息。1范围
医疗器械遗传毒性试验
第1部分:细菌回复突变试验
YY/T0870的本部分规定了医疗器械/材料细菌回复突变试验方法。本部分推荐使用平板掺人法
注:口腔材料的Ames试验见YY/T0127.102
规范性引用文件
YY/T0870.1—2013
下列文件对于本及件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本义件。凡是不注自期的引用文件,其最新版本(包括所有的修改单)适用于本文件GB/T168861
GB/T688613
医疗器械生物学评价第!部分,风险管理过程中的评价写试验医疗器械生物学评价第3部分遗传毒性、致癌性和生殖药性试验GB/T16886.12医疗器械生物学评价第12部分:样品制备与参照样品3术语和定义
G1B/116886.1、GB/T16886.1GB/T1688612界定的术讲和定义适用于本文件。主要设备
生物安全柜电热干爆箱、恒温培养箱、恒温水浴箱、恒温振荡水浴箱、压力蒸汽灰菌器、低温高速离心机、低温冰箱(—80C)或液氮罐、勾浆器、菌落计数仪和电子天平等5活化系统、培养基和试剂
试验用活化系统(S9和S9混合液)培养基和试剂按附录A和附录B的规定制备或购买市售产品。菌株及其鉴定和保存
6.1菌株
本部分宜至少采用4株鼠伤寒沙门氏菌突变型菌进行试验,推荐的菌株组合为:a)
鼠伤寒沙门氏菌株TA1537或TA97或TA97a;鼠伤寒沙门氏菌株TA98;
鼠伤寒沙门氏菌株TA100:
大肠杆菌WP2uvIA,或WP2uvrA(pKM101),或鼠伤寒沙门氏菌株TA102;d)
鼠伤寒沙门氏菌株TA1535(可供选择)。注:为了检测交联突变剂,所选菌株中最好包哲TA102或增加一种DNA易修复的大肠杆菌株(如WP2或WP2(pKMI0)
YY/T 0870.1—2013
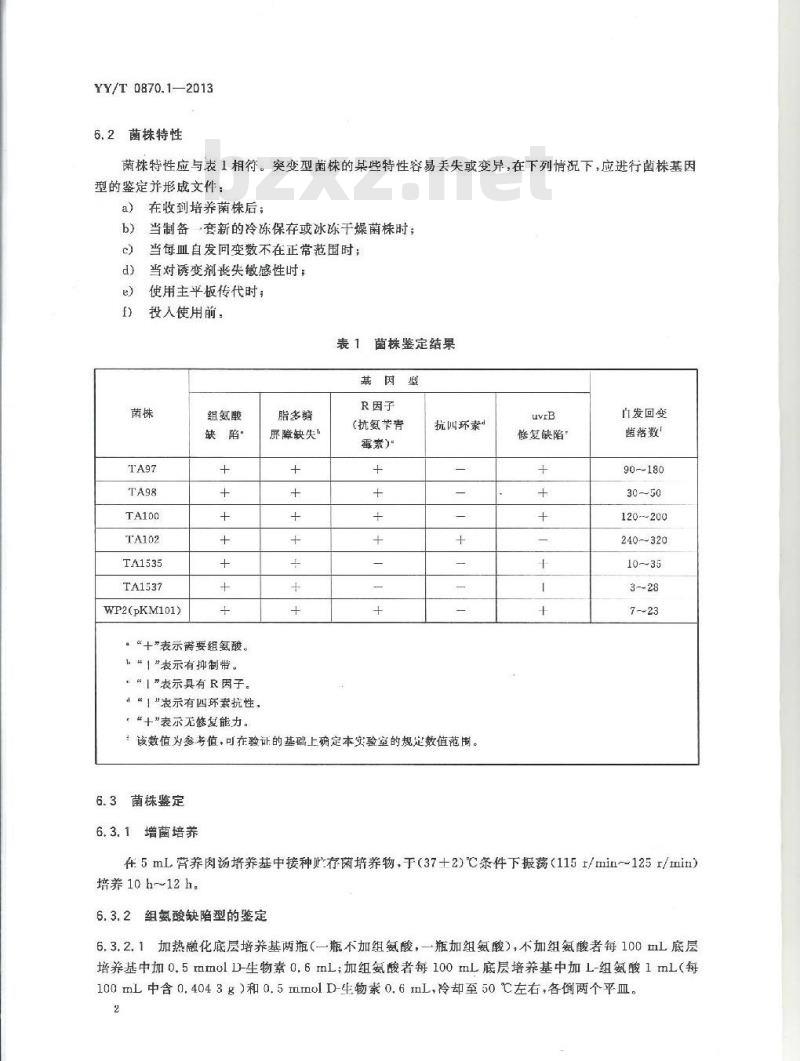
6.2菌株特性
菌株特性应与表1相符。突变型菌株的某些特性容易丢失或变异,在下列情况下,应进行菌株基因型的鉴定并形成文件;
a)在收到培养菌株后;
b)当制备套新的冷冻保存或冰冻于燥菌株时;当每血自发同变数不在正常范围时;当对诱变剂丧失敏感性时;
使用主平板传代时;
投入使用前:
菌株鉴定结果
基因型
TA1535
TA1537
WP2(pKM101)
组氨酸
缺陷”
。“+\表示需要组氨酸。
“1”表示有抑制带。
“|”农示具有R因子。
d“|\表示有四环素抗性。
““十”表示无修复能力。
脂多糖
屏障缺失
R因子
(抗氨苄背
霉素)
抗四环素
,该数值为参考值,可在验证的基础上确定本实验室的规定数值范围。6.3菌株鉴定
6.3.1增菌培养
修复缺陷
门发回变
菌落数
90--180
30~~50
120~200
240-~320
在5mL营养肉汤培养基中接种存菌培养物,于(37土2)℃条件下振荡(115/min~125r/min)培养10h~12h。
6.3.2组氨酸缺陷型的鉴定
6.3.2.1加热融化底层培养基两瓶(一瓶不加组氨酸:一瓶加组氨酸),不加组氨酸者每100mL底层培养基中加0.5mmolD-生物素0.6mL;加组氨酸者每100mL底层培养基中加L-组氨酸1mL(每100mL中含0.4043g)和0.5mmolD-生物素0.6mL,冷却至50℃左右各倒两个平血。YY/T0870.1-2013
6.3.2.2按种:取有组氮酸和无组氨酸培养基平血各一个,按菌株号顺序各取一白金耳菌液划线(直线)接种在培养基表面,37℃培养48h。6.3.2.3结果判定:受试菌株在有组氨酸培养基平Ⅲ表面各长出一条菌膜,无组氨酸培养基平血上除自发回复突变菌落外无菌膜,说明受试菌株确为组氨酸缺陷型。6.3.3脂多糖屏障缺陷的监定
6.3.3.1接种:取菌液0.1mL移人平血,迅速将加热融化的营养肉汤琼脂培养基(冷却至50℃左右)适量倒人平血,混勾,平放凝固。将一片无菌滤纸片放入已凝固的培养基平皿中央,用移液器在滤纸片上滴加0.1%结品紫溶液10μL,37℃培养24h,每个菌株做一个平m。6.3.3.2结果判定:阳性者在纸片周围出现一个透明的抑制带,说明存在rla(深粗型)突变。TA97、TA98.TA100、TA1535、TA1537、TA102和WP2(pKM101)均有抑制带,野生型鼠伤寒沙门氏菌和野生型WP2(pKM101)没有抑制带。
6.3.4R因子的鉴定
6.3.4.1加热融化营养肉汤琼脂培养基,冷却至50℃左右,适量倒人平血中,平放凝固,用移液器吸L,在凝固的培养基表面依中线涂成条带,待氨节青霉素溶液于后,用接种环与0.8%氨卡青霉素
氢卡青霉素带相交叉划线接种要鉴定的菌株,并具接种一个不具有R因于的菌株作氨苦青避素抗性的对照(一个平Ⅲ可同时鉴定几个菌株),37℃培养24h结果判定:菌株经过24五磨养,在氨节青蛋素带的周围依然生长不受抑制,即有抗氮芋青6.3.4.2
素效应,证明带有R因子
UWB修复缺陷型的鉴定
在营养肉汤琼脂增养基平血表面用接种环划线接种需要的菌株,接种后的平血一半用黑纸6.3.5.1
覆盖,在距15W紫外线灭菌灯33cm处照射837C培养24h结果判定对紫外线敏城的函株仅在没有照射过的部分生长6.3.5.2
6.3.6四环素抗性的鉴定
6.3.6.1用移液器各吸取ML~10uL0.8%的四环素溶液和0.8%的氨节青霉素溶液,在营养肉汤琼脂培养基平血表面依中线各涂成条带,待四环素和氨芋青霉素液干后,用接种环于四环素和氨卡青霉素带相交叉划线接种TA102和一种有R因于的凿株(作为四环素抗性的对照),37℃培养24h。6.3.6.2结果判定:TA102菌株生长不受抑制,对照菌株有一段生长抑制区,表明TA102菌株有抗四环素效应。
6.3.7自发回变菌落数的鉴定
6.3.7.1每株菌准备底层培养基平皿2个,同时融化项层培养基2管,每管2ml,在45℃水浴中保温。
6.3.7.2在每管项层培养基中,分别加人待鉴定的试验菌株的菌液0.1mT,各2管,轻轻勾,迅速将此试管的内容物倾入已固化的底层培养基平Ⅲ中,转动平血,使项层培养基均勾分布,平放固化,37℃培养48h计数菌落数,计算平均自发回变菌落数。6.3.7.3结果判定:每一菌株的平均白发回变菌落数应落在表1所列正常范用内。6.4菌株保存
鉴定合格的菌种应加入冷冻保扩剂(例如光谱级二甲基亚(DMSO)或甘油),保存在深低温3
YY/T 0870.1—2013
(如一80℃)或液氮中,或者冰冻十燥制成干粉,4℃保存。除液氮条件外,保存期一般不超过2年。主平板贮存在4℃,超过两月后丢弃,TA102主平板保存两周后应该丢弃。7试验前准备
7.1器具灭菌
与试验和对照样品接触的所有器具应采用可靠方法灭菌,置压力蒸汽灭菌器内121℃30min,或置电热干爆箱内160℃2h。
7.2试验环境要求
试验应在生物安全柜中进行。
8样品制备
根据GB/T16886.12的原则制备试验液。可采用生理盐水和/或其他适宜溶剂作为浸提介质。如怀疑试验样品可能对试验菌株产生抑制作用时,应进行预试验。注1:ISO10993.3正在修订,当新的样品制备方法在末来标准中得到确认后即可采用。注2:与经典的化学物全身毒性试验不同,医用材料一般得不到LD的剂量值,若采用浸提液进行试验,可考虑单剂虽组试验(即试验样品原液或100%的浸提原液),但它对试验所采用的剂量范提供相应的支持性数据。9对照样品制备
9. 1阴性对照
同批号试验样品的浸提介质,不加试验样品同条件制备。9.2阳性对照
每一试验菌株推荐的诱变剂和浓度见表2,适宜时也可采用其他已知诱变剂。表2推荐的诱变剂
试验菌株
S9混合物bZxz.net
阳性对照
对二甲基氨基苯重氮磺酸钠(敌克松)[CAS No. 140-56-7]
对二甲基氨基苯重氮磺酸钠(敌克松)[CAS No. 140-56-7]
2-氨基荔
[CAS No. 153-78-6]
对二甲基氨基苯重氮磺酸钠(敌克松)[CA5 No. 140-56-7]
甲基磺酸甲酯
[CAS No. 66 27 3]
诱变剂度
10mg/ml.,川无菌注射用水配制
1.0mg/mL,川无菌注射用水配制0.1mg/mL,用DMSO配制
1.0mg/mL,用无菌注射用水配制0.1mg/mL,用无菌注射用水配制武验菌株
WP2、WP2uvrA和
WP2uvrA(pKM101)
TA1535
TA1537
S9浪合物
表2(续)
阳性对服
叠氮化钠
[CASNu.26628-22-8]
2-氨基劳
CAS No. 153-78 6]
叠氮化钠
[CAS No. 26628 22-8]
对二甲基氨基苯重氮磺酸钠(敌克松)CAS No.140-56-7J
YY/T0870.1—2013
诱变剂浓度
1.0mg/nL,用无菌注射用水配制0.1mg/mL,用DMSO配制
1.0mg/mL,用无菌注射川水配制1.0mg/nL,用无菌注射用水配制注:诱变剂可配制为10×贮备液,分装在具赛玻璃试管内2℃-~8℃贮存,临用时稀释至上述液度。10试验菌液制备
取营养肉汤培养基5mL,加入无菌小锥形瓶或无菌试管中,将主平板或冷冻保存的菌株培养物接种于营养肉汤培养基内,在(37-L2)℃、(1151/min~125r/min)振荡培养10h12h至对数增长期,活菌数不少于1×109个/mL。培养瓶用黑纸包衰,以防光线照射细菌,11预试验
11.1对未知或怀疑可能对试验菌株有抑制作用的试验样品,应进行预试验。11.2
预试验步骤如下:
a)融化项层培养基分装于无菌小试管,每管2mL,在45℃水浴中保温。在每管项层培养基中,分别加入按10制备的试验菌株新鲜菌液0.1mL,各2管,轻轻摇匀,迅速将此试管的内容物倾人凹固化的底层培养基平血中,转动平血,使顶层培养基均勾分布,平放固化。取无菌滤纸圆片(直径为6mm)放在已固化的项层培养基的中央位置上;h)用移液器分别取0.1mL试验材料浸提液点在纸片上;c)同a)法操作,阴性对照组加人0.1mL浸提介质,阳性对照加入1.0mg/ml敌克松0.1mL;d)37℃培养18h~72h观察结果。11.3除阳性对照外,试验样品和浸提介质平血应尤抑制区域。如对试验菌株有抑制作用,应对试验样品或浸提液进行梯度稀释,所选的剂量浓度范围宜包括细胞毒性从最大到小或无细胞毒性,一般至少包括5个试验浓度梯度,并以小或无细胞毒性浓度按平板掺入法进行试验。注:细胞毒性表现为,回复突变的菌落数减少,背景菌苔减少等。12平板掺入法
12.1融化顶层培养基分装于无菌小试管,每管2mL,在45℃水浴中保温。12.2在保温的顶层培养基中依次加人每种试验菌株新鲜菌液0.1mL,混匀;试验样品组分别加0.1mL试验材料没提液,活化组再加10%S9混合液0.5mL,无活化组加0.2mol/L磷酸盐缓冲液0.5mL,每组3管,再混勾,迅速将每管溶液分别倾入底层培养基1:,转动平Ⅲ使项层培养基均匀分布5
YY/T0870.1-—2013
在底层上,平放固化。
12.3,阴性对照组分别加人0.1mL浸提介质,活化组再加10%S9混合液0.5mL无活化组加人0.2mol/L的磷酸盐缓冲液0.5mL。阳性对照组分别加表2列出的诱变剂0.1mL,活化组再加10%S9混合液0.5mL,无活化组加0.2mol/L磷酸盐缓冲液0.5ml,其他步骤同12.2。12.4全部平血倒置于37℃培养箱中培养48h~72h观察结果。13结果评价
13.1计数并记录每一平血的回变菌落数,并计算出3个平血的平均值。13.2阴性对照组回变菌落数应在预期的范围内(见表1),阳性对照组回变菌落数应至少为阴性对照的3倍,否则对不在范围内的菌株应重新试验。13.3在背景生长良好条件下,试验样品组回变菌落数至少为阴性对照组回变菌落数的两倍或两倍以上(即回变菌落数≥2×阴性对照数)即为阳性反应。如回变菌落数的增加与剂量相关并具有统计学意义,或者至少在一个剂量水平出现可重复的并有统计学意义的阳性反应时,即可认为验样品为阳性诱变剂。
14试验报告
试验报告中应包含下列信息
a)试验样品名称、规格型号和批号:b)试验和对照样品制备方法及说明;C)试验用菌株名称及特性鉴定:d)试验条件和试验步骤
试验结果;
结果评价:
结论。
A.1大鼠肝S9液
附录A
(资料性附录)
S9和S9混合液制备
YY/T 0870.1-2013
A.1.1选健康雄性成年SD或Wistar人白鼠,体重150g左右,约5~6周龄。将多氯联苯(Aroclor1254)溶于玉米油中,浓度为200mg/mL,按500mg/kg(体)无菌操作一次腹腔注射。注:也可采用苯巴比妥和β蔡黄酮联合诱导。A.1.2第6天用颈动脉放血法处死动物,打开腹腔,用20mL新鲜冷至4℃的0.15mol/L氯化钾溶液进行肝门静脉灌注后,小心分离并将肝脏完整取出。取出肝脏称重后,用0.151mo1/L氯化钾溶液连续冲洗数次,以便除去能抑制微粒体酶活性的血红蛋白。每克肝(湿重)加0.1mol/L氯化钾溶液3mL,连同烧杯移入冰浴中,用灭菌剪刀剪碎肝脏,在玻璃勾浆器(低于1000r/min,往复1min~2min),或组织勾浆器(20000r/min,1min)中制成肝匀浆。以上操作需注意无菌和局部冷环境(4℃)。A.1.3将制成的肝匀浆在低温(0~4℃)高速离心机上,以9000g离心10min,吸出上清液为肝S9液,A.1.4S9制成后,经无菌检查,测定蛋白含量(Lowry法),每毫升蛋白含量宜不超过40mg,并经间接致癌物(诱变剂)鉴定其生物活性合格后,分装于无菌冷冻管或安巾,每安瓶2mL左右,用液氮或于冰速冻后置一80℃低温保存,保存期不超过一年。A.2S9混合液辅助因子
A.2.10.4mol/L氯化镁(MgCl)溶液:称玻3.8g,加蒸馏水稀释至100mL。灭菌或滤菌。4℃保存。A.2.21.65mol/L氯化钾(KCD溶液:称取12.3g,加蒸馅水稀释至100ml。灭菌或滤菌。4C保存。A.2.30.2mol/L磷酸盐缓冲液(pH7.4),每500ml.出以下成分组成:磷酸氢二钠(NazHPO,)(14.2g/500mL)磷酸一氢钠(NaHzPO4.H,O)(13.8g/500mL)调pH为7.1,0.103MPa20min灭菌或滤菌。4℃保存。440mL
A.2.4辅酶-Il(氧化型)溶液:准确称取辅酶-Ⅱ,用无菌蒸馏水溶解配制成0.025mol/L溶液,低温保存(一20℃以下)。
A.2.5葡萄糖-6-磷酸钠盐溶液:称取葡萄糖-6-磷酸钠盐,用无菌蒸馏水溶解配制成0.05mo1/L,低温保存(一20℃以下)。
A.310%S9混合液
每10ml由以下成分组成:
磷酸盐缓冲液(0.2mol / L,pH7.4)氯化钾溶液(1.65mol/L)
氯化镁溶液(0.4mol/L)
葡萄糖-6-磷酸盐溶液(0.05mol/L)辅酶-Ⅱ溶液(0.025mol/L)
肝S9液
临用时新鲜无菌配制,混匀,置冰浴中待用。6.0mL
YY/T0870.1—-2013
培养基与试剂
营养肉汤培养基
牛肉膏
胰陈(或混合蛋白陈)
氯化钠
蒸馅水
附录B
(资料性附录)
培养基和试剂制备
加热落解,调节pH为7.2,分装后0.103MPa20min灭菌。1℃保存。营养肉汤琼脂培养基
琼脂粉
营养肉汤培养基
加热融化后调节pH为72.0.103MPa20min灭菌B.1.3底层培养基
磷酸盐贴备液
B. 1.3. 1
磷酸氢钠铵(NaNH,HPO·4H,O)柠檬(C.HO,HO)
磷酸氢二钾(KIPO)
硫酸镁(MgSO7H0)
加蒸馅水至100ml0.103MPa20min灭菌。4C保存。1.5g
注:待其他试剂完全溶解后毒将殖酸美组慢放人其中继续落溶解,否则易析出沉淀。B.1.3.2
40%葡萄糖溶液
将40.0g葡萄糖加蒸馏水至100mL,0.055MPa20min灭菌。4℃保存。B.1.3.31.5%琼脂培养基
琼脂粉
加蒸馏水至
融化后0.103MPa20min灭菌。
B.1.3.4底层培养基制备
无菌操作在灭菌琼脂培养基中(400mL)依次加入:磷酸盐贮备液
10%葡萄糖溶液
充分混匀,待冷却至80℃左右时注入培养皿,每皿(g90mm)约25mL,待培养基凝固后放入37℃8
恒温箱内,培养过夜以除去水分并检查有无污染。B.1.4顶层培养基
B.1.4.1顶层琼脂
琼胎粉
氯化钠
加蒸馏水至
B.1.4.20.5mmol/L组氨酸-0.5mmol/L生物素溶液(诱变试验用)D-生物素(相对分子质量244)
L组氨酸(相对分子质量155)
加热馏水率250扭L。4℃保存。
B.1.4.3顶层培养基制备
YY/T 0870.1—2013
加热融化顶层琼脂,每100L顶层琼脂中加0.5mmol/L组氨酸-生物素溶液10mL。混匀,分装在100mL锥形瓶中,0.103MPa20min灭菌。用时融化分装小试管,每管2mL,在45℃水浴中保温。
B.1.5特殊试剂和培养基
R.1.5.10.8%氨芙青霉素溶液
称取氮节青素40mg,用0.02mol/L氢氧化钠溶液稀释至5mL。无菌配制,4℃保存。B.1.5.20.1%结晶紫溶液
称取100ng结晶紫,溶于100mL无菌水。4℃保存。B.1.5.3L-组氨酸溶液和0.5mmol/LD-生物素溶液(鉴定菌株用)称取L-组氨酸0.4043g和D-生物素12.2rng,分别溶于100mL蒸馅水。0.103MPa20min灭菌,4℃保存。
B.1.5.40.8%四环素辫液(用于四坏素抗性试验和氨卡青霉素-四环素平板):称取40mg四环素用0.02mal/L盐酸缓冲液稀释率5mL保存于1℃冰箱。B.1.5.5氨苄青霉素平板和氨芋青霉素-四环素平板每1000mL中由以下成分组成:
底层培养基
磷酸盐贮备液
40%葡萄糖溶液
组氨酸水溶液(0.4043g/100mL)0.5mmol/LD-生物素溶液
0.8%氮卡青霉素溶液
0.8%四环素溶液
以上成分均分别灭菌或无菌制备,冷却至人约50℃,无菌条件下加入氮苦青霉素溶液和/或四环素溶液。
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
中华人民共和国医药行业标准
YY/T0870.1—2013
医疗器械遗传毒性试验
第1部分:细菌回复突变试验
Test for gcnotoxicity of medical devices-Part 1:Bacterial reverse mutation test2013-10-21发布
国家食品药品监督管理总局
2014-10-01实施
YY/T0870的总标题是《医疗器遗传声性试验》,包括以下部分:第1部分:细菌回复突变试验;
第2部分:体外哺乳动物细胞染色体畸变试验;第3部分:用小鼠淋巴瘤细胞进行的体外哺乳动物细胞基因突变试验;第4部分:哺乳动物骨髓红细胞微核试验;-第5部分:哺乳动物骨髓染色体畸变试验,有关其他方面的遗传毒性试验将有其他部分的标准。本部分为YY/T0870的第1部分。
本部分按照GB/T1.1—2009给出的规则起草。YY/T0870.1--2013
YY/T0870的本部分是参考0ECD471—1997《细菌回复突变试验》并结合医疗器械/材料自身特点制定的。
请注意本文件的某些内容可能涉及专利。本文件的发布机构不承扣识别这些专利的责任。本部分由国家食品药品监督管现总局提出。本部分由全国医疗器械生物学评价标准化技术委员会(SAC/TC248)归口。本部分主要起草单位:国家食品药品监督管理局济南医疗器械质量监督检验中心。本部分参加起草单位:国家食品药品监督管理局天津医疗器械质量监督检验中心、国家食品药品监督管理局北京医疗器械质量监督检验中心。本部分主要起草人:曾冬明、黄经春、于兆琴,陶剑、汤菊莉。T
YY/T0870.1—2013
GB/T16886.3中给出的检测潜在遗传毒性物质的试验方法均为经济合作与发展组织(OECD)《化学品测试指南》中规定的方法,但这些方法足针对化学品的特性制定而成,同时末给出详细的试验步骤,因此不适宜直接用于医疗器械/材料的检测。YY/T0870参照OECD试验方法基本原则,并根据医疗器械/材料的特性对试验方法进行「适当的修改,规定了详细的试验步骤,可作为CB/T16886.3中遗传毒性试验的补充方法标准。
YY/T0870的本部分参照OECDNo.471(1997)方法,有或无代谢活化系统的情况下,通过观察医疗器械/材料导组氨酸营养缺陷型鼠伤寒沙门氏菌株(his-)和色氨酸营养缺陷型大肠杆菌菌株的突变情况,以评价其潜在的致突变性。点突变是许多人炎遗传性疾病的原因。有确切的证据表明,体细胞的癌基因和肿瘤抑制基因的点突变与人类和实验动物的肿瘤形成有关。许多试验菌株因具有多种特性,如回复位点的DNA序列,细胞对大分子通透性的增加.DNA修复系统的缺失或DNA修复过程中错配的提高等,而使得它们对突变的检测更为敏感。其中,细菌回复突变试验具有快捷、廉价并且相对容易操作等优点,可用来检测DNA碱基对的替代、增加或缺失,为遗传毒性物质诱导的突变类型提供有用的信息。1范围
医疗器械遗传毒性试验
第1部分:细菌回复突变试验
YY/T0870的本部分规定了医疗器械/材料细菌回复突变试验方法。本部分推荐使用平板掺人法
注:口腔材料的Ames试验见YY/T0127.102
规范性引用文件
YY/T0870.1—2013
下列文件对于本及件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本义件。凡是不注自期的引用文件,其最新版本(包括所有的修改单)适用于本文件GB/T168861
GB/T688613
医疗器械生物学评价第!部分,风险管理过程中的评价写试验医疗器械生物学评价第3部分遗传毒性、致癌性和生殖药性试验GB/T16886.12医疗器械生物学评价第12部分:样品制备与参照样品3术语和定义
G1B/116886.1、GB/T16886.1GB/T1688612界定的术讲和定义适用于本文件。主要设备
生物安全柜电热干爆箱、恒温培养箱、恒温水浴箱、恒温振荡水浴箱、压力蒸汽灰菌器、低温高速离心机、低温冰箱(—80C)或液氮罐、勾浆器、菌落计数仪和电子天平等5活化系统、培养基和试剂
试验用活化系统(S9和S9混合液)培养基和试剂按附录A和附录B的规定制备或购买市售产品。菌株及其鉴定和保存
6.1菌株
本部分宜至少采用4株鼠伤寒沙门氏菌突变型菌进行试验,推荐的菌株组合为:a)
鼠伤寒沙门氏菌株TA1537或TA97或TA97a;鼠伤寒沙门氏菌株TA98;
鼠伤寒沙门氏菌株TA100:
大肠杆菌WP2uvIA,或WP2uvrA(pKM101),或鼠伤寒沙门氏菌株TA102;d)
鼠伤寒沙门氏菌株TA1535(可供选择)。注:为了检测交联突变剂,所选菌株中最好包哲TA102或增加一种DNA易修复的大肠杆菌株(如WP2或WP2(pKMI0)
YY/T 0870.1—2013
6.2菌株特性
菌株特性应与表1相符。突变型菌株的某些特性容易丢失或变异,在下列情况下,应进行菌株基因型的鉴定并形成文件;
a)在收到培养菌株后;
b)当制备套新的冷冻保存或冰冻于燥菌株时;当每血自发同变数不在正常范围时;当对诱变剂丧失敏感性时;
使用主平板传代时;
投入使用前:
菌株鉴定结果
基因型
TA1535
TA1537
WP2(pKM101)
组氨酸
缺陷”
。“+\表示需要组氨酸。
“1”表示有抑制带。
“|”农示具有R因子。
d“|\表示有四环素抗性。
““十”表示无修复能力。
脂多糖
屏障缺失
R因子
(抗氨苄背
霉素)
抗四环素
,该数值为参考值,可在验证的基础上确定本实验室的规定数值范围。6.3菌株鉴定
6.3.1增菌培养
修复缺陷
门发回变
菌落数
90--180
30~~50
120~200
240-~320
在5mL营养肉汤培养基中接种存菌培养物,于(37土2)℃条件下振荡(115/min~125r/min)培养10h~12h。
6.3.2组氨酸缺陷型的鉴定
6.3.2.1加热融化底层培养基两瓶(一瓶不加组氨酸:一瓶加组氨酸),不加组氨酸者每100mL底层培养基中加0.5mmolD-生物素0.6mL;加组氨酸者每100mL底层培养基中加L-组氨酸1mL(每100mL中含0.4043g)和0.5mmolD-生物素0.6mL,冷却至50℃左右各倒两个平血。YY/T0870.1-2013
6.3.2.2按种:取有组氮酸和无组氨酸培养基平血各一个,按菌株号顺序各取一白金耳菌液划线(直线)接种在培养基表面,37℃培养48h。6.3.2.3结果判定:受试菌株在有组氨酸培养基平Ⅲ表面各长出一条菌膜,无组氨酸培养基平血上除自发回复突变菌落外无菌膜,说明受试菌株确为组氨酸缺陷型。6.3.3脂多糖屏障缺陷的监定
6.3.3.1接种:取菌液0.1mL移人平血,迅速将加热融化的营养肉汤琼脂培养基(冷却至50℃左右)适量倒人平血,混勾,平放凝固。将一片无菌滤纸片放入已凝固的培养基平皿中央,用移液器在滤纸片上滴加0.1%结品紫溶液10μL,37℃培养24h,每个菌株做一个平m。6.3.3.2结果判定:阳性者在纸片周围出现一个透明的抑制带,说明存在rla(深粗型)突变。TA97、TA98.TA100、TA1535、TA1537、TA102和WP2(pKM101)均有抑制带,野生型鼠伤寒沙门氏菌和野生型WP2(pKM101)没有抑制带。
6.3.4R因子的鉴定
6.3.4.1加热融化营养肉汤琼脂培养基,冷却至50℃左右,适量倒人平血中,平放凝固,用移液器吸L,在凝固的培养基表面依中线涂成条带,待氨节青霉素溶液于后,用接种环与0.8%氨卡青霉素
氢卡青霉素带相交叉划线接种要鉴定的菌株,并具接种一个不具有R因于的菌株作氨苦青避素抗性的对照(一个平Ⅲ可同时鉴定几个菌株),37℃培养24h结果判定:菌株经过24五磨养,在氨节青蛋素带的周围依然生长不受抑制,即有抗氮芋青6.3.4.2
素效应,证明带有R因子
UWB修复缺陷型的鉴定
在营养肉汤琼脂增养基平血表面用接种环划线接种需要的菌株,接种后的平血一半用黑纸6.3.5.1
覆盖,在距15W紫外线灭菌灯33cm处照射837C培养24h结果判定对紫外线敏城的函株仅在没有照射过的部分生长6.3.5.2
6.3.6四环素抗性的鉴定
6.3.6.1用移液器各吸取ML~10uL0.8%的四环素溶液和0.8%的氨节青霉素溶液,在营养肉汤琼脂培养基平血表面依中线各涂成条带,待四环素和氨芋青霉素液干后,用接种环于四环素和氨卡青霉素带相交叉划线接种TA102和一种有R因于的凿株(作为四环素抗性的对照),37℃培养24h。6.3.6.2结果判定:TA102菌株生长不受抑制,对照菌株有一段生长抑制区,表明TA102菌株有抗四环素效应。
6.3.7自发回变菌落数的鉴定
6.3.7.1每株菌准备底层培养基平皿2个,同时融化项层培养基2管,每管2ml,在45℃水浴中保温。
6.3.7.2在每管项层培养基中,分别加人待鉴定的试验菌株的菌液0.1mT,各2管,轻轻勾,迅速将此试管的内容物倾入已固化的底层培养基平Ⅲ中,转动平血,使项层培养基均勾分布,平放固化,37℃培养48h计数菌落数,计算平均自发回变菌落数。6.3.7.3结果判定:每一菌株的平均白发回变菌落数应落在表1所列正常范用内。6.4菌株保存
鉴定合格的菌种应加入冷冻保扩剂(例如光谱级二甲基亚(DMSO)或甘油),保存在深低温3
YY/T 0870.1—2013
(如一80℃)或液氮中,或者冰冻十燥制成干粉,4℃保存。除液氮条件外,保存期一般不超过2年。主平板贮存在4℃,超过两月后丢弃,TA102主平板保存两周后应该丢弃。7试验前准备
7.1器具灭菌
与试验和对照样品接触的所有器具应采用可靠方法灭菌,置压力蒸汽灭菌器内121℃30min,或置电热干爆箱内160℃2h。
7.2试验环境要求
试验应在生物安全柜中进行。
8样品制备
根据GB/T16886.12的原则制备试验液。可采用生理盐水和/或其他适宜溶剂作为浸提介质。如怀疑试验样品可能对试验菌株产生抑制作用时,应进行预试验。注1:ISO10993.3正在修订,当新的样品制备方法在末来标准中得到确认后即可采用。注2:与经典的化学物全身毒性试验不同,医用材料一般得不到LD的剂量值,若采用浸提液进行试验,可考虑单剂虽组试验(即试验样品原液或100%的浸提原液),但它对试验所采用的剂量范提供相应的支持性数据。9对照样品制备
9. 1阴性对照
同批号试验样品的浸提介质,不加试验样品同条件制备。9.2阳性对照
每一试验菌株推荐的诱变剂和浓度见表2,适宜时也可采用其他已知诱变剂。表2推荐的诱变剂
试验菌株
S9混合物bZxz.net
阳性对照
对二甲基氨基苯重氮磺酸钠(敌克松)[CAS No. 140-56-7]
对二甲基氨基苯重氮磺酸钠(敌克松)[CAS No. 140-56-7]
2-氨基荔
[CAS No. 153-78-6]
对二甲基氨基苯重氮磺酸钠(敌克松)[CA5 No. 140-56-7]
甲基磺酸甲酯
[CAS No. 66 27 3]
诱变剂度
10mg/ml.,川无菌注射用水配制
1.0mg/mL,川无菌注射用水配制0.1mg/mL,用DMSO配制
1.0mg/mL,用无菌注射用水配制0.1mg/mL,用无菌注射用水配制武验菌株
WP2、WP2uvrA和
WP2uvrA(pKM101)
TA1535
TA1537
S9浪合物
表2(续)
阳性对服
叠氮化钠
[CASNu.26628-22-8]
2-氨基劳
CAS No. 153-78 6]
叠氮化钠
[CAS No. 26628 22-8]
对二甲基氨基苯重氮磺酸钠(敌克松)CAS No.140-56-7J
YY/T0870.1—2013
诱变剂浓度
1.0mg/nL,用无菌注射用水配制0.1mg/mL,用DMSO配制
1.0mg/mL,用无菌注射川水配制1.0mg/nL,用无菌注射用水配制注:诱变剂可配制为10×贮备液,分装在具赛玻璃试管内2℃-~8℃贮存,临用时稀释至上述液度。10试验菌液制备
取营养肉汤培养基5mL,加入无菌小锥形瓶或无菌试管中,将主平板或冷冻保存的菌株培养物接种于营养肉汤培养基内,在(37-L2)℃、(1151/min~125r/min)振荡培养10h12h至对数增长期,活菌数不少于1×109个/mL。培养瓶用黑纸包衰,以防光线照射细菌,11预试验
11.1对未知或怀疑可能对试验菌株有抑制作用的试验样品,应进行预试验。11.2
预试验步骤如下:
a)融化项层培养基分装于无菌小试管,每管2mL,在45℃水浴中保温。在每管项层培养基中,分别加入按10制备的试验菌株新鲜菌液0.1mL,各2管,轻轻摇匀,迅速将此试管的内容物倾人凹固化的底层培养基平血中,转动平血,使顶层培养基均勾分布,平放固化。取无菌滤纸圆片(直径为6mm)放在已固化的项层培养基的中央位置上;h)用移液器分别取0.1mL试验材料浸提液点在纸片上;c)同a)法操作,阴性对照组加人0.1mL浸提介质,阳性对照加入1.0mg/ml敌克松0.1mL;d)37℃培养18h~72h观察结果。11.3除阳性对照外,试验样品和浸提介质平血应尤抑制区域。如对试验菌株有抑制作用,应对试验样品或浸提液进行梯度稀释,所选的剂量浓度范围宜包括细胞毒性从最大到小或无细胞毒性,一般至少包括5个试验浓度梯度,并以小或无细胞毒性浓度按平板掺入法进行试验。注:细胞毒性表现为,回复突变的菌落数减少,背景菌苔减少等。12平板掺入法
12.1融化顶层培养基分装于无菌小试管,每管2mL,在45℃水浴中保温。12.2在保温的顶层培养基中依次加人每种试验菌株新鲜菌液0.1mL,混匀;试验样品组分别加0.1mL试验材料没提液,活化组再加10%S9混合液0.5mL,无活化组加0.2mol/L磷酸盐缓冲液0.5mL,每组3管,再混勾,迅速将每管溶液分别倾入底层培养基1:,转动平Ⅲ使项层培养基均匀分布5
YY/T0870.1-—2013
在底层上,平放固化。
12.3,阴性对照组分别加人0.1mL浸提介质,活化组再加10%S9混合液0.5mL无活化组加人0.2mol/L的磷酸盐缓冲液0.5mL。阳性对照组分别加表2列出的诱变剂0.1mL,活化组再加10%S9混合液0.5mL,无活化组加0.2mol/L磷酸盐缓冲液0.5ml,其他步骤同12.2。12.4全部平血倒置于37℃培养箱中培养48h~72h观察结果。13结果评价
13.1计数并记录每一平血的回变菌落数,并计算出3个平血的平均值。13.2阴性对照组回变菌落数应在预期的范围内(见表1),阳性对照组回变菌落数应至少为阴性对照的3倍,否则对不在范围内的菌株应重新试验。13.3在背景生长良好条件下,试验样品组回变菌落数至少为阴性对照组回变菌落数的两倍或两倍以上(即回变菌落数≥2×阴性对照数)即为阳性反应。如回变菌落数的增加与剂量相关并具有统计学意义,或者至少在一个剂量水平出现可重复的并有统计学意义的阳性反应时,即可认为验样品为阳性诱变剂。
14试验报告
试验报告中应包含下列信息
a)试验样品名称、规格型号和批号:b)试验和对照样品制备方法及说明;C)试验用菌株名称及特性鉴定:d)试验条件和试验步骤
试验结果;
结果评价:
结论。
A.1大鼠肝S9液
附录A
(资料性附录)
S9和S9混合液制备
YY/T 0870.1-2013
A.1.1选健康雄性成年SD或Wistar人白鼠,体重150g左右,约5~6周龄。将多氯联苯(Aroclor1254)溶于玉米油中,浓度为200mg/mL,按500mg/kg(体)无菌操作一次腹腔注射。注:也可采用苯巴比妥和β蔡黄酮联合诱导。A.1.2第6天用颈动脉放血法处死动物,打开腹腔,用20mL新鲜冷至4℃的0.15mol/L氯化钾溶液进行肝门静脉灌注后,小心分离并将肝脏完整取出。取出肝脏称重后,用0.151mo1/L氯化钾溶液连续冲洗数次,以便除去能抑制微粒体酶活性的血红蛋白。每克肝(湿重)加0.1mol/L氯化钾溶液3mL,连同烧杯移入冰浴中,用灭菌剪刀剪碎肝脏,在玻璃勾浆器(低于1000r/min,往复1min~2min),或组织勾浆器(20000r/min,1min)中制成肝匀浆。以上操作需注意无菌和局部冷环境(4℃)。A.1.3将制成的肝匀浆在低温(0~4℃)高速离心机上,以9000g离心10min,吸出上清液为肝S9液,A.1.4S9制成后,经无菌检查,测定蛋白含量(Lowry法),每毫升蛋白含量宜不超过40mg,并经间接致癌物(诱变剂)鉴定其生物活性合格后,分装于无菌冷冻管或安巾,每安瓶2mL左右,用液氮或于冰速冻后置一80℃低温保存,保存期不超过一年。A.2S9混合液辅助因子
A.2.10.4mol/L氯化镁(MgCl)溶液:称玻3.8g,加蒸馏水稀释至100mL。灭菌或滤菌。4℃保存。A.2.21.65mol/L氯化钾(KCD溶液:称取12.3g,加蒸馅水稀释至100ml。灭菌或滤菌。4C保存。A.2.30.2mol/L磷酸盐缓冲液(pH7.4),每500ml.出以下成分组成:磷酸氢二钠(NazHPO,)(14.2g/500mL)磷酸一氢钠(NaHzPO4.H,O)(13.8g/500mL)调pH为7.1,0.103MPa20min灭菌或滤菌。4℃保存。440mL
A.2.4辅酶-Il(氧化型)溶液:准确称取辅酶-Ⅱ,用无菌蒸馏水溶解配制成0.025mol/L溶液,低温保存(一20℃以下)。
A.2.5葡萄糖-6-磷酸钠盐溶液:称取葡萄糖-6-磷酸钠盐,用无菌蒸馏水溶解配制成0.05mo1/L,低温保存(一20℃以下)。
A.310%S9混合液
每10ml由以下成分组成:
磷酸盐缓冲液(0.2mol / L,pH7.4)氯化钾溶液(1.65mol/L)
氯化镁溶液(0.4mol/L)
葡萄糖-6-磷酸盐溶液(0.05mol/L)辅酶-Ⅱ溶液(0.025mol/L)
肝S9液
临用时新鲜无菌配制,混匀,置冰浴中待用。6.0mL
YY/T0870.1—-2013
培养基与试剂
营养肉汤培养基
牛肉膏
胰陈(或混合蛋白陈)
氯化钠
蒸馅水
附录B
(资料性附录)
培养基和试剂制备
加热落解,调节pH为7.2,分装后0.103MPa20min灭菌。1℃保存。营养肉汤琼脂培养基
琼脂粉
营养肉汤培养基
加热融化后调节pH为72.0.103MPa20min灭菌B.1.3底层培养基
磷酸盐贴备液
B. 1.3. 1
磷酸氢钠铵(NaNH,HPO·4H,O)柠檬(C.HO,HO)
磷酸氢二钾(KIPO)
硫酸镁(MgSO7H0)
加蒸馅水至100ml0.103MPa20min灭菌。4C保存。1.5g
注:待其他试剂完全溶解后毒将殖酸美组慢放人其中继续落溶解,否则易析出沉淀。B.1.3.2
40%葡萄糖溶液
将40.0g葡萄糖加蒸馏水至100mL,0.055MPa20min灭菌。4℃保存。B.1.3.31.5%琼脂培养基
琼脂粉
加蒸馏水至
融化后0.103MPa20min灭菌。
B.1.3.4底层培养基制备
无菌操作在灭菌琼脂培养基中(400mL)依次加入:磷酸盐贮备液
10%葡萄糖溶液
充分混匀,待冷却至80℃左右时注入培养皿,每皿(g90mm)约25mL,待培养基凝固后放入37℃8
恒温箱内,培养过夜以除去水分并检查有无污染。B.1.4顶层培养基
B.1.4.1顶层琼脂
琼胎粉
氯化钠
加蒸馏水至
B.1.4.20.5mmol/L组氨酸-0.5mmol/L生物素溶液(诱变试验用)D-生物素(相对分子质量244)
L组氨酸(相对分子质量155)
加热馏水率250扭L。4℃保存。
B.1.4.3顶层培养基制备
YY/T 0870.1—2013
加热融化顶层琼脂,每100L顶层琼脂中加0.5mmol/L组氨酸-生物素溶液10mL。混匀,分装在100mL锥形瓶中,0.103MPa20min灭菌。用时融化分装小试管,每管2mL,在45℃水浴中保温。
B.1.5特殊试剂和培养基
R.1.5.10.8%氨芙青霉素溶液
称取氮节青素40mg,用0.02mol/L氢氧化钠溶液稀释至5mL。无菌配制,4℃保存。B.1.5.20.1%结晶紫溶液
称取100ng结晶紫,溶于100mL无菌水。4℃保存。B.1.5.3L-组氨酸溶液和0.5mmol/LD-生物素溶液(鉴定菌株用)称取L-组氨酸0.4043g和D-生物素12.2rng,分别溶于100mL蒸馅水。0.103MPa20min灭菌,4℃保存。
B.1.5.40.8%四环素辫液(用于四坏素抗性试验和氨卡青霉素-四环素平板):称取40mg四环素用0.02mal/L盐酸缓冲液稀释率5mL保存于1℃冰箱。B.1.5.5氨苄青霉素平板和氨芋青霉素-四环素平板每1000mL中由以下成分组成:
底层培养基
磷酸盐贮备液
40%葡萄糖溶液
组氨酸水溶液(0.4043g/100mL)0.5mmol/LD-生物素溶液
0.8%氮卡青霉素溶液
0.8%四环素溶液
以上成分均分别灭菌或无菌制备,冷却至人约50℃,无菌条件下加入氮苦青霉素溶液和/或四环素溶液。
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。