YY 1116-2010
标准分类号
关联标准
出版信息
相关单位信息
标准简介
YY 1116-2010.Absorbable surgical suture.
1范围
YY 1116规定了可吸收性外科缝线的分类要求、试验方法、检验规则、标志使用说明书、包装、运输、贮存的要求。
YY 1116适用于可吸收性外科缝线(以下简称缝线)。缝线供医疗机构做外科手术时对人体组织缝合、结扎用。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 6682- -2008 分 析实验室用水规格和试验方法(ISO 3696:1987 ,MOD)
GB/T 9737- -2008 化学 试剂易 碳化物质测定通则(ISO 6353-1 :1982,NEQ)
GB/T 9969- -2008工业产 品使用说明书总则
GB/T 14233.1-2008医用输液输血、注射器具检验方法第 1部分:化学分析方法
GB/T 14436- -1993工业产 品保证文件总则
GB/T16175--2008医用有机硅材料生物学评价试验方法
GB/T 16886. 3- -2008医疗器械生物学评价第3部分:遗传毒性、致癌性和生殖毒性试验(ISO 10993-3 :2003 ,IDT)
GB/T16886.4-2003医疗器械生物学评价第4部分:与血液相互作用试验选择(ISO10993-4:2002 ,IDT)
GB/T 16886. 5- -2003 医疗 器械生物学评价第5部分:体外细胞毒性试验(ISO 10993-5.1999,IDT)
GB/T16886.6--1997医疗器械生物学评价第6部分:植入后局部反应试验(ISO10993-6:1994,IDT)
GB/T 16886. 10- 2005医疗器械生物学评价第10部分:刺激与迟发性超敏反应试验(ISO 10993-10 : 2002 ,IDT)
GB/T 16886. 11- 1997 医疗 器械生物学评价第 11部分:全身毒性试验(ISO 10993-11:1993,IDT)
GB/T16886.13-2001医疗器械生物学评价第13部分:聚合物医疗器械的降解产物的定性与定量(ISO 10993-13:1998,IDT)
YY 0043- -2005医 用缝合针
YY/T 0466.1- -2009医疗 器械用于医疗 器槭标签、标记和提供信息的符号第1部分:通用要求(ISO 15223-1:2007 ,IDT)
中华人民共和国药典2010年版(二部)
1范围
YY 1116规定了可吸收性外科缝线的分类要求、试验方法、检验规则、标志使用说明书、包装、运输、贮存的要求。
YY 1116适用于可吸收性外科缝线(以下简称缝线)。缝线供医疗机构做外科手术时对人体组织缝合、结扎用。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 6682- -2008 分 析实验室用水规格和试验方法(ISO 3696:1987 ,MOD)
GB/T 9737- -2008 化学 试剂易 碳化物质测定通则(ISO 6353-1 :1982,NEQ)
GB/T 9969- -2008工业产 品使用说明书总则
GB/T 14233.1-2008医用输液输血、注射器具检验方法第 1部分:化学分析方法
GB/T 14436- -1993工业产 品保证文件总则
GB/T16175--2008医用有机硅材料生物学评价试验方法
GB/T 16886. 3- -2008医疗器械生物学评价第3部分:遗传毒性、致癌性和生殖毒性试验(ISO 10993-3 :2003 ,IDT)
GB/T16886.4-2003医疗器械生物学评价第4部分:与血液相互作用试验选择(ISO10993-4:2002 ,IDT)
GB/T 16886. 5- -2003 医疗 器械生物学评价第5部分:体外细胞毒性试验(ISO 10993-5.1999,IDT)
GB/T16886.6--1997医疗器械生物学评价第6部分:植入后局部反应试验(ISO10993-6:1994,IDT)
GB/T 16886. 10- 2005医疗器械生物学评价第10部分:刺激与迟发性超敏反应试验(ISO 10993-10 : 2002 ,IDT)
GB/T 16886. 11- 1997 医疗 器械生物学评价第 11部分:全身毒性试验(ISO 10993-11:1993,IDT)
GB/T16886.13-2001医疗器械生物学评价第13部分:聚合物医疗器械的降解产物的定性与定量(ISO 10993-13:1998,IDT)
YY 0043- -2005医 用缝合针
YY/T 0466.1- -2009医疗 器械用于医疗 器槭标签、标记和提供信息的符号第1部分:通用要求(ISO 15223-1:2007 ,IDT)
中华人民共和国药典2010年版(二部)
标准图片预览




标准内容
ICS 11. 040. 30
中华人民共和国医药行业标准
YY1116—2010
代替YY1116—2002
可吸收性外科缝线
Absorbablesurgicalsuture
2010-12-27发布
国家食品药品监督管理局
2012-06-01实施
中华人民共和国医药
行业标摊
可吸收性外科缝线
YY 1116——2010
中国标准出版社出版发行
北京市朝阳区和平里西街2号(100013)北京市西城区三里河北街16号(100045)网址 www, spc, nct. cn
总编室:(010)64275323发行中心:(010)5178023读者服务部:(010)68523946
中国标准出版社秦皇岛印刷厂印剧各地新华书店经销
π本 880×1230 J/16
印张 1. 25 字数 33 千学
2011年12月第-版
2011年12月第一次印刷
35号:155066·2-2271:定价21.00元如有印装差错
告由本社发行中心调换
版权专有侵权必究
举报电话:(010)68510107
4.6.3含水量为推荐性条款,
本标准按照GB/1°1.12009给出的规则起草。言
本标准代替YY1116-2002《可吸收性外科缝线》。本标准与YY1116—2002主要差异如下:YY 1116-2010
取消1类缝线的分类结构,增加了工类继线的制式、Ⅱ类缝线染色/不染色的分类;修订了缝线的规格与直径、抗张强度、针线连接强度!增加Ⅱ类(单股)缝线的要求;
修订了缝线的坏氧乙烷残留量;修订了缝线植人试验要求;
修订了缝线生物降解试验的要求及其方法:修订了脱铬试验方法;
修订了含水量测试方法。
本标准参考欧洲药典6.0版利美国药典第31版。本标准由全国外科器械标准化技术委员会(SAC/TC94)提出并归口,本标准起萨单位:上海浦东金环医疗用品有限公司、牛(中国)医疗器材有限公司、江苏准阴医疗器械有限公司。
木标准主要起草人:张延肯、王风才、马义忠,陆广恒、强岁萍,衰双林本标准所代替的厉饮版本发布情况为:-7.BC48002—1989;
-YY91116—1999;
-YY11162002.
1范圈
可吸收性外科缝线
YY 1116--2010
本标准规定了可吸收性外科缝线的分类、要求、试验方法、检验规则,标志,使用说明书,包装、运输、些存的要求:
本标准适用于可吸收性外科缝线(以下简称缝线)。缝线供医疗机构做外科手术时对人体纠织缝合、结扎用。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注期的版本适用于本文竹。凡是不注口期的引用文件,其最新版本(包括所有的修改单)适用于本文件。GB/T 668220084
分析实验室用水规格和试验方法(ISO3696:1987,MOD)GB/T9737—2008化学试剂易碳化物质测定通则(ISO6353-1:1982,NEQ)GB/T9969--2008工业产品使用说明书总则GB/T14233.1---2008医用输液、输血、注射器具检验方法第1部分:化学分析方法GB/T14136--1993工业产品保证文件总则GB/T 16175—2008
医用有机硅材料生物学评价试验方法B/T 16886, 32008
(IS0 10993-3:2003,IDI)
医疗器械生物学评价第 3部分:遗传毒性、致癌性和生殖毒性试验医疗器械生物学评价第4部分:与血波相互作用试验选择(ISO10993-GB/T 16886,4—2003
4-2002.IDT)
GB/T16886.5—2003医疗器械生物学评价第5部分:体外细胞毒性试验(1SO10993-5:1999,IDI)GB/T 16886.61997
1994,II
GB/T 16886. 10-2005
(ISO 10993-10:2002,IDT)
医疗器械生物学评价第6部分:植人局部反应试验(ISO10993-6:医疗器械生物学评价第10部分:刺激与迟发性超数反应试验GB/T16886.11—1997医疗器械生物学评价第11部分:全身毒性试验(JS0【0993-1:1993,IDT)
GB/T16886.13一2001医疗器械生物学评价第13部分:聚合物医疗器械的降解产物的定性与定量(ISO 10993-13:1998,IDI)
YY00132005医用缝合针
YY/T0466.1一2009医疗器械用丁医疗器械标签,标记和提供信息的符号第1部分,通用要求(ISO 15223-1.2007,IDT)
中华人民共和国药典2010年版(二部)3分类
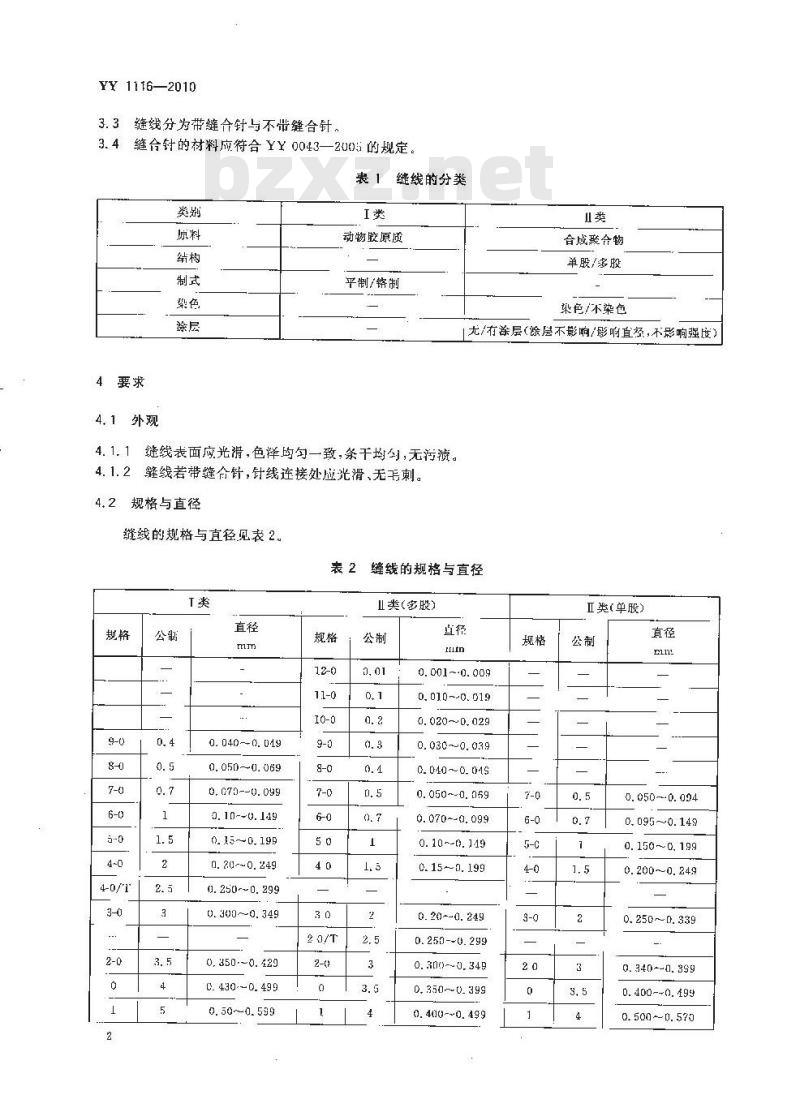
3.1缝线是由健康哺乳动物的胶原或人工合成的聚合物训工而成,可被活体哺乳动物组织吸收。3.2缝线的分类见表1。
YY 1116—2010
缝线分为带缝合针与不带缝合针3.3
3.4缝合针的材料应符合YY0043—2U05的规定表1缝线的分类
4.1外观
动物胶原质
平制/铬制
合成聚合物
单股/多股
梁色/木染色
尤/有杀层(涂层不影响/影响直经,不影响强度)缝线表面应光清,色洋均勾一致,条干均勺,无污溃4. 1. 1
肇线若带缝合针,针线连接处应光滑、无韦刺。4. 1. 2
规格与直径
缝线的规格与直径见表2。
缝线的规格与直径
0. 040--0. 019
0.050--0.069
0, 070--0.099
0. 10--0. 149
0.15-~0. 199
0.20-~0.249
0.250-~0.299
0. 300~~0.349
0.350-~0.429
0. 430--0. 499
0.50~~0.599
Ⅱ类(多股)
0.001--0. 009
0. 010~-0. 019
0.020~0,029
0.030~~0.039
0. 040~-0, 01S
0.050~-0.069
0.070~-0.099
0.10~-0.149
0. 15~-0. 199
0.20--0.249
0.250--0.299
0. 300-~0. 349
0. 350-~0. 399
0.40-~0.499
Ⅱ类(单胺)
0.050~-0. 094
0. 095--0.149
0.150~0.199
0.200~-0.24g
0. 250~0. 339
0.340--0.399
0. 400-~0. 499
0. 500 ~ 0. 570
0. 60--0. 699
0. 70~-0. 799
0.80--0.899
表2(续)
亚类(多股)
0. 500 ~·0. 599
0. 600~-0. 699
0. 700~~0. 793
YY 1116—2010
Ⅱ类(单段)
0.571--0. 610
注:除 I类 1-1/T,3-()、I 类(多胶)2-0/T、2-0 和 T 类(单股)等同采用欧洲药典 6, 0 版中吸收性外科续线的规格外,工类2-0.0修改采用美药典第31版,其余等同采用美闲药典31版吸收性外科经线的规格。4.3
抗张强度
缝线的抗张强度应符合表3的规定。表3
缝綫的抗张强度
抗张强度
平均值
单个值
Ⅱ类(多段)
抗张强度
单个值
平均值
类(单股)
抗张强度
平均值
单个值
注:除I类 9-0.4-0/T和Ⅱ类(多)2-0/T和I类(单股)等同采用欧洲药典6.0版中吸收性外科整线的规格外,其余等同采用美国药典第31版中吸收性外科续线的规格,3
YY 1116—2010
4.4缝线带针(如适用)
针线连接强度应符合表4的规定。4.4.1
表4针线连接强度
针线连接强度
平均值
单个值
Ⅱ类(股)
针线连接强度
单个值
Ⅱ类(单股)
针线连接强度
「并个值
平均值
注:除I类4-0/T、ⅡI类(多股)2-0/T和Ⅱ类(单股)等同采用欧洲药典6. 0 版外,其余等同采用美国药典第31版。
4.4.2缝合针,硬度应不小于490HIV。,其他要求应符合YY0043—2005中4.1、4.2(除4.2.1)和1.3(除4.3.4)的规定。
4.5长度
缝线的长度应不小于标示长度的95%,4.6缝线的化学性能
4.6.1可溶性铬化合物试验
I类铬制缝线不得脱铬,其浸提液的颜色不能深于重铬酸钾标准溶液(0.0001%的CI)的颜色。4.6.2重金属
I类平制缝线、Ⅱ类缝线的浸提液所呈现的颜色应不超过质量浓度p(Pb2+)-1g/mL的标准对照液的颜色。
4. 6. 3 含水量试验
聚乳酸、聚乙交酷、聚乙烯醇材料制成的Ⅱ类縫线的含水量应不大于0.05%。4.6.4色试验
Ⅱ类缝线若染色,褪色试验应合格。4.6.5环氧乙烷残留量试验
缝线若用环氙乙烷火菌,环氧乙烷残留量应不人于250μg/g。4.7缝线的生物性能
4.7.1细胞舞性或验反应不大于1级。4.7.2皮内刺激试验应为无刺激性。4.7. 3
应无溶血作用(溶血率不大于5%)。4.7.4急性全身毒性试验应无毒性。4.7.5迟发性超敏反应试验应无致敏反应。4.7.6应无致热原反应。
植入试验,生物学反应趋于稳定时,应明显的炎症反应。4.7.8Ames 试验应为阴性。
YY 1116—2010
4.7.9生物降解试验在12周的不间试验阶段,材料的失重应有明显的下降趋势;降解液中能测得降解产物的成分,
4.8无菌
缝线应尤菌。
4.9包装标志
包装标志应清晰,应符合7.1的规定,5试验方法
5.1外观
取10根继线,在正常光照下月测,应符合4、1的规定。5.2
缝线直径
5.2.1试验装置
线径测量仪,最小分度值0.002mm,压脚与基准面的乎整度在0.005mm之内,且互相平行,平行偏差在士0.005mm以下,圆形压脚直径为12.7mm士0.02mm,量具的基准面直径为50mm,压脚加在缝线上的总负载为210g土3g,测定公制不人于0.4缝线的直径时,加在缝线.上的总负载不得超过60g。
试验装置示意图见附录B。
YY 1116—2010
5.2.2试验程序
I类、Ⅱ类缝线直径的试验程序如下:a)I类缝线
从包装中取出缝线后不得拉伸,应立即测定其直径。犯缝线放置于压脚的中心,并轻轻地降低压脚,直笔整个重量施加到缝线上,测定每根缝线约1/4、1/2、3/4处三个点的直径,并按规定计算其平均直径。若缝线用液体包装,试验必须在缝线从体中取出后2min内完成。b)Ⅱ类缝线
1)将缝线效暨于压脚的中心,并轻轻地降低压脚,直整个重量施加到缝线上,不经预处理就立即进行测定。
测定每根缝线约1/4、1/2、3/4处三个点的相应直径,如果测定公制大丁2的多股缝线,则2
分别测定同一位置两个直角点,并取平均值作为该测定位置的直径。测定多股缝线时,把缝线-端接在固定夹中,放置缝线于压脚中心,将缝线固定在与基准3
面相间的乎面中,同时通过适当方式施加张力,例如缝线未被固定的一端连接个重量为该规格缝线的抗张强度1/2极限重量的祛码,在缝线上按5.2.2b)2)指定的位置点测量其直径,并按规定计算其平均直径。c)取[0根缝线,按5.2.2a)或5.2.2b)的程序测定。5.2.3试验结果
比较缝线的每一点直径,应不小丁上一个较小规格直径范国的中问值,不大于下一个较人规格直径的中间值。直径的平均值应符合4.2的规定。5. 3抗张强度
5.3.1试验设备
材料试验机,
5.3.2试验条件
拉伸速度为300mm/min.t50mm/tnin,试验标距为125mm~200mm。5. 3. 3 试验程序
取长约200mm的缝线,共取10根缝线进行试验。将缝线打个白出结,样品夹在材料试验机上,结应位于两夹头的中间,并使夹具间的缝线绷紧。对于公制小于0.4的Ⅱ类缝线应不打结,直接进行试验。若缝线朗裂在距夹其1cm之内,则该数据作废。5.3.4试验结果
比较单根缝线的抗张强度,I类,Ⅱ类缝线应不小丁表3中单个值。抗张强度的平均值应符合4.3的规定。
5.4缝线带针
5.4.1针线连接强度
把带有缝合针的缝线的针端线端分别夹于材料试验机的两个夹具上,以300mm/min+50mm/min的拉伸速度,10>mm的试验标距进行试验,共取5根缝线进行连接强度试验,其单个值、平均值应符合6
4.4的规定。
5.4.2缝合针
按YY0043—2005中相关的试验方法逃行,应符合4.4.2的规定,5.5长度
YY 1116—2010
取5根缝线以通用长度量具测量,在测量过程中不带张力牵直测量,应符合4.5的规定。5.6化学性能www.bzxz.net
5.6.1可溶性铬化合物试验
5.6.1.1取0.25gI类制缝线于锥形瓶内,加25ml.符合GB/T66822008规定的级水(以下筒称试验用水),加盖置于37℃环境下浸泡24h,冷却,取其浸提液;取5mL浸提液于一支小试管内,人2mL浓度为10g/L的二苯借肼乙醇溶液,再入2ml.浓度为1mol/L的稀硫酸溶液。5.6.1.2取5mL浓度为2.83g/mL的重铬酸钾标准溶液,依次加入2mL浓度为10g/L的二苯借饼乙醇溶液利2L浓度为1 mol/L的稀硫酸溶液。5.6.1.3在相同条件下比较,浸提液的色应不深于重铬酸钾标推溶液(0.0001%的Cr)的颜色,应符合4,6.1的规定。
5.6.2乖金属
5.6.2.1在同批缝线中随机抽取缝线1m,截成约1cm长的线段,试验用水20mL,使其外表面完全浸湿,加盖置于37℃环境浸泡21 h,最其浸提液。5.6.2.2按(/T14223.1—2008中5.6方法进行,应符合4.6.2的规定。5. 6. 3 水量试验
按录 C试验时,应符合4.6.3的规定,5. 6. 4褪色试验
5.6.4.1按GB/T5737—2008中4.3、4.4、4.5的规定,配制氯化钻、硫酸铜、三氯化铁三种溶液。然后按照表5的规定配制各种颜色的标准比色液。表5标准比色液
黄棕色
粉红色
蓝绿色
紫红色
硫酸钢(CuSO,)溶波
每10ml.标准比色液中含有
氯化结(CoCla)溶液
三氯化铁(FcCl)溶液
单位为牵齐
试验用水
5.6.4.2称取0.25g缝线,置于100mL锥形瓶,加25mL试验用水,并使其37℃士0.5℃恒温24h冷却后取其浸提液[U mI于比色管中,5.6.4.3根据浸提液颜色选对应的标准比色液。在相同条件下比较,浸提液颤色应不深于标准比色7
YY1116—2010
液的颜色,符合4.6.4的规定。
5.6.5环氧乙烷残留量试验
按GB/1'14233.1-200名中第9章*气相色谱法\的规定逃行,应符合4.6.5的规定。5.7缝线的生物性能
浸提液
浸提液的制备:
浸提温度:37℃±1℃;
浸提时间:24h±2h
浸提介质:牛理盐水
供试品按表面积与没提介质体积比例6 cm\/tnL。细胞毒性试验
按GB/T16886.52003中8.3的规定进行试验,应符合4.7.1的规定。5.7.3皮内刺激试验
取浸提液,按GB/T16886.102005中附录B.2的规定进行,应符合4.7.2的规定。5.7. 4血液相容性试验
取漫提液,按GB/T16886.4—2003中附录C.6的规定进行,应符合4.7.3的规定,5.7.5急性全身毒性试验
取浸提被,按GB/T16886.11—1997中6.5的规定进行,应符合4.7.4的规定,5.7.6迟发性超敏反应试验
取浸提液,按G13/T16886.10—2005中第7章的规定进行,应符合4.7.5的规定。5.7.7热原试验
取浸提液,按GB/T16175—2008中第10章的规定迹行,应符合4.7.6的规定。5.7.8植入试验
按GB/T16886.6一1997中第5章的规定进行,试验周期为3个月,观察取样时间为1周、4周、12周,应符合4.7.7的规定。
5.7. 9 Ams 试验
按GB/T16886.3:2008中第5章的规定进行,应符合4.7.8的规定。5.7.10生物降解试验
按GB/T16886.13—2001中的规定进行,应符合4.7.9的规定。8
5.8无菌试验
YY1116-2010
按《中华人民共和国药典》2010年版(二部)中附录无菌检查法避行,应衍合4.8的规定。5.9包装标志
以目力观察,应符合4.9的规定。6检验规则
6.1验收
缝线应由制造厂质量检验部门进行检验,并保证产品质量符合本标准的要求,方可提交验收6.2组批
一个检验批可由一个生产批构成;这些牛产批是在基本相同的材料、工艺设备等条件下制造山来的;若于个生产批次构成一个检验批时,必须是在同一次灭菌条件下生产的产品。6.3出厂检验
6.3.1缝线山厂时的检验项放抽样量见表6。表6出厂检验项目及抽样量
判定规则检验中,每一个检验项目均应合格。6. 3.2
11个小
1个小
若出现其他项月不合格,则抽取不合格项日的双倍样品,进行重复检验,应全部合格,若仍有不合格项,则判为该批产品不合格。
6.4型式检验
在下列情况下应进行型式检验:新产品投产前;
连续生产中每年不少于一次;
间隔半年以上再投产时;
在设计、技术条件、工艺或材料有重大改变时;d)
国家质量监督检验机构对产品质量逃行监督检查时,6.4.2
型式检验的检验项目及抽样量见表7,在下列在-情况下应增加4.7的检验:a)
产品用途改变时;
有迹象表明产品用于人体时会产生副作用;b)
初始包装或灭菌方式改变时;
贮存期内最终产品中的任何变化。d
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
中华人民共和国医药行业标准
YY1116—2010
代替YY1116—2002
可吸收性外科缝线
Absorbablesurgicalsuture
2010-12-27发布
国家食品药品监督管理局
2012-06-01实施
中华人民共和国医药
行业标摊
可吸收性外科缝线
YY 1116——2010
中国标准出版社出版发行
北京市朝阳区和平里西街2号(100013)北京市西城区三里河北街16号(100045)网址 www, spc, nct. cn
总编室:(010)64275323发行中心:(010)5178023读者服务部:(010)68523946
中国标准出版社秦皇岛印刷厂印剧各地新华书店经销
π本 880×1230 J/16
印张 1. 25 字数 33 千学
2011年12月第-版
2011年12月第一次印刷
35号:155066·2-2271:定价21.00元如有印装差错
告由本社发行中心调换
版权专有侵权必究
举报电话:(010)68510107
4.6.3含水量为推荐性条款,
本标准按照GB/1°1.12009给出的规则起草。言
本标准代替YY1116-2002《可吸收性外科缝线》。本标准与YY1116—2002主要差异如下:YY 1116-2010
取消1类缝线的分类结构,增加了工类继线的制式、Ⅱ类缝线染色/不染色的分类;修订了缝线的规格与直径、抗张强度、针线连接强度!增加Ⅱ类(单股)缝线的要求;
修订了缝线的坏氧乙烷残留量;修订了缝线植人试验要求;
修订了缝线生物降解试验的要求及其方法:修订了脱铬试验方法;
修订了含水量测试方法。
本标准参考欧洲药典6.0版利美国药典第31版。本标准由全国外科器械标准化技术委员会(SAC/TC94)提出并归口,本标准起萨单位:上海浦东金环医疗用品有限公司、牛(中国)医疗器材有限公司、江苏准阴医疗器械有限公司。
木标准主要起草人:张延肯、王风才、马义忠,陆广恒、强岁萍,衰双林本标准所代替的厉饮版本发布情况为:-7.BC48002—1989;
-YY91116—1999;
-YY11162002.
1范圈
可吸收性外科缝线
YY 1116--2010
本标准规定了可吸收性外科缝线的分类、要求、试验方法、检验规则,标志,使用说明书,包装、运输、些存的要求:
本标准适用于可吸收性外科缝线(以下简称缝线)。缝线供医疗机构做外科手术时对人体纠织缝合、结扎用。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注期的版本适用于本文竹。凡是不注口期的引用文件,其最新版本(包括所有的修改单)适用于本文件。GB/T 668220084
分析实验室用水规格和试验方法(ISO3696:1987,MOD)GB/T9737—2008化学试剂易碳化物质测定通则(ISO6353-1:1982,NEQ)GB/T9969--2008工业产品使用说明书总则GB/T14233.1---2008医用输液、输血、注射器具检验方法第1部分:化学分析方法GB/T14136--1993工业产品保证文件总则GB/T 16175—2008
医用有机硅材料生物学评价试验方法B/T 16886, 32008
(IS0 10993-3:2003,IDI)
医疗器械生物学评价第 3部分:遗传毒性、致癌性和生殖毒性试验医疗器械生物学评价第4部分:与血波相互作用试验选择(ISO10993-GB/T 16886,4—2003
4-2002.IDT)
GB/T16886.5—2003医疗器械生物学评价第5部分:体外细胞毒性试验(1SO10993-5:1999,IDI)GB/T 16886.61997
1994,II
GB/T 16886. 10-2005
(ISO 10993-10:2002,IDT)
医疗器械生物学评价第6部分:植人局部反应试验(ISO10993-6:医疗器械生物学评价第10部分:刺激与迟发性超数反应试验GB/T16886.11—1997医疗器械生物学评价第11部分:全身毒性试验(JS0【0993-1:1993,IDT)
GB/T16886.13一2001医疗器械生物学评价第13部分:聚合物医疗器械的降解产物的定性与定量(ISO 10993-13:1998,IDI)
YY00132005医用缝合针
YY/T0466.1一2009医疗器械用丁医疗器械标签,标记和提供信息的符号第1部分,通用要求(ISO 15223-1.2007,IDT)
中华人民共和国药典2010年版(二部)3分类
3.1缝线是由健康哺乳动物的胶原或人工合成的聚合物训工而成,可被活体哺乳动物组织吸收。3.2缝线的分类见表1。
YY 1116—2010
缝线分为带缝合针与不带缝合针3.3
3.4缝合针的材料应符合YY0043—2U05的规定表1缝线的分类
4.1外观
动物胶原质
平制/铬制
合成聚合物
单股/多股
梁色/木染色
尤/有杀层(涂层不影响/影响直经,不影响强度)缝线表面应光清,色洋均勾一致,条干均勺,无污溃4. 1. 1
肇线若带缝合针,针线连接处应光滑、无韦刺。4. 1. 2
规格与直径
缝线的规格与直径见表2。
缝线的规格与直径
0. 040--0. 019
0.050--0.069
0, 070--0.099
0. 10--0. 149
0.15-~0. 199
0.20-~0.249
0.250-~0.299
0. 300~~0.349
0.350-~0.429
0. 430--0. 499
0.50~~0.599
Ⅱ类(多股)
0.001--0. 009
0. 010~-0. 019
0.020~0,029
0.030~~0.039
0. 040~-0, 01S
0.050~-0.069
0.070~-0.099
0.10~-0.149
0. 15~-0. 199
0.20--0.249
0.250--0.299
0. 300-~0. 349
0. 350-~0. 399
0.40-~0.499
Ⅱ类(单胺)
0.050~-0. 094
0. 095--0.149
0.150~0.199
0.200~-0.24g
0. 250~0. 339
0.340--0.399
0. 400-~0. 499
0. 500 ~ 0. 570
0. 60--0. 699
0. 70~-0. 799
0.80--0.899
表2(续)
亚类(多股)
0. 500 ~·0. 599
0. 600~-0. 699
0. 700~~0. 793
YY 1116—2010
Ⅱ类(单段)
0.571--0. 610
注:除 I类 1-1/T,3-()、I 类(多胶)2-0/T、2-0 和 T 类(单股)等同采用欧洲药典 6, 0 版中吸收性外科续线的规格外,工类2-0.0修改采用美药典第31版,其余等同采用美闲药典31版吸收性外科经线的规格。4.3
抗张强度
缝线的抗张强度应符合表3的规定。表3
缝綫的抗张强度
抗张强度
平均值
单个值
Ⅱ类(多段)
抗张强度
单个值
平均值
类(单股)
抗张强度
平均值
单个值
注:除I类 9-0.4-0/T和Ⅱ类(多)2-0/T和I类(单股)等同采用欧洲药典6.0版中吸收性外科整线的规格外,其余等同采用美国药典第31版中吸收性外科续线的规格,3
YY 1116—2010
4.4缝线带针(如适用)
针线连接强度应符合表4的规定。4.4.1
表4针线连接强度
针线连接强度
平均值
单个值
Ⅱ类(股)
针线连接强度
单个值
Ⅱ类(单股)
针线连接强度
「并个值
平均值
注:除I类4-0/T、ⅡI类(多股)2-0/T和Ⅱ类(单股)等同采用欧洲药典6. 0 版外,其余等同采用美国药典第31版。
4.4.2缝合针,硬度应不小于490HIV。,其他要求应符合YY0043—2005中4.1、4.2(除4.2.1)和1.3(除4.3.4)的规定。
4.5长度
缝线的长度应不小于标示长度的95%,4.6缝线的化学性能
4.6.1可溶性铬化合物试验
I类铬制缝线不得脱铬,其浸提液的颜色不能深于重铬酸钾标准溶液(0.0001%的CI)的颜色。4.6.2重金属
I类平制缝线、Ⅱ类缝线的浸提液所呈现的颜色应不超过质量浓度p(Pb2+)-1g/mL的标准对照液的颜色。
4. 6. 3 含水量试验
聚乳酸、聚乙交酷、聚乙烯醇材料制成的Ⅱ类縫线的含水量应不大于0.05%。4.6.4色试验
Ⅱ类缝线若染色,褪色试验应合格。4.6.5环氧乙烷残留量试验
缝线若用环氙乙烷火菌,环氧乙烷残留量应不人于250μg/g。4.7缝线的生物性能
4.7.1细胞舞性或验反应不大于1级。4.7.2皮内刺激试验应为无刺激性。4.7. 3
应无溶血作用(溶血率不大于5%)。4.7.4急性全身毒性试验应无毒性。4.7.5迟发性超敏反应试验应无致敏反应。4.7.6应无致热原反应。
植入试验,生物学反应趋于稳定时,应明显的炎症反应。4.7.8Ames 试验应为阴性。
YY 1116—2010
4.7.9生物降解试验在12周的不间试验阶段,材料的失重应有明显的下降趋势;降解液中能测得降解产物的成分,
4.8无菌
缝线应尤菌。
4.9包装标志
包装标志应清晰,应符合7.1的规定,5试验方法
5.1外观
取10根继线,在正常光照下月测,应符合4、1的规定。5.2
缝线直径
5.2.1试验装置
线径测量仪,最小分度值0.002mm,压脚与基准面的乎整度在0.005mm之内,且互相平行,平行偏差在士0.005mm以下,圆形压脚直径为12.7mm士0.02mm,量具的基准面直径为50mm,压脚加在缝线上的总负载为210g土3g,测定公制不人于0.4缝线的直径时,加在缝线.上的总负载不得超过60g。
试验装置示意图见附录B。
YY 1116—2010
5.2.2试验程序
I类、Ⅱ类缝线直径的试验程序如下:a)I类缝线
从包装中取出缝线后不得拉伸,应立即测定其直径。犯缝线放置于压脚的中心,并轻轻地降低压脚,直笔整个重量施加到缝线上,测定每根缝线约1/4、1/2、3/4处三个点的直径,并按规定计算其平均直径。若缝线用液体包装,试验必须在缝线从体中取出后2min内完成。b)Ⅱ类缝线
1)将缝线效暨于压脚的中心,并轻轻地降低压脚,直整个重量施加到缝线上,不经预处理就立即进行测定。
测定每根缝线约1/4、1/2、3/4处三个点的相应直径,如果测定公制大丁2的多股缝线,则2
分别测定同一位置两个直角点,并取平均值作为该测定位置的直径。测定多股缝线时,把缝线-端接在固定夹中,放置缝线于压脚中心,将缝线固定在与基准3
面相间的乎面中,同时通过适当方式施加张力,例如缝线未被固定的一端连接个重量为该规格缝线的抗张强度1/2极限重量的祛码,在缝线上按5.2.2b)2)指定的位置点测量其直径,并按规定计算其平均直径。c)取[0根缝线,按5.2.2a)或5.2.2b)的程序测定。5.2.3试验结果
比较缝线的每一点直径,应不小丁上一个较小规格直径范国的中问值,不大于下一个较人规格直径的中间值。直径的平均值应符合4.2的规定。5. 3抗张强度
5.3.1试验设备
材料试验机,
5.3.2试验条件
拉伸速度为300mm/min.t50mm/tnin,试验标距为125mm~200mm。5. 3. 3 试验程序
取长约200mm的缝线,共取10根缝线进行试验。将缝线打个白出结,样品夹在材料试验机上,结应位于两夹头的中间,并使夹具间的缝线绷紧。对于公制小于0.4的Ⅱ类缝线应不打结,直接进行试验。若缝线朗裂在距夹其1cm之内,则该数据作废。5.3.4试验结果
比较单根缝线的抗张强度,I类,Ⅱ类缝线应不小丁表3中单个值。抗张强度的平均值应符合4.3的规定。
5.4缝线带针
5.4.1针线连接强度
把带有缝合针的缝线的针端线端分别夹于材料试验机的两个夹具上,以300mm/min+50mm/min的拉伸速度,10>mm的试验标距进行试验,共取5根缝线进行连接强度试验,其单个值、平均值应符合6
4.4的规定。
5.4.2缝合针
按YY0043—2005中相关的试验方法逃行,应符合4.4.2的规定,5.5长度
YY 1116—2010
取5根缝线以通用长度量具测量,在测量过程中不带张力牵直测量,应符合4.5的规定。5.6化学性能www.bzxz.net
5.6.1可溶性铬化合物试验
5.6.1.1取0.25gI类制缝线于锥形瓶内,加25ml.符合GB/T66822008规定的级水(以下筒称试验用水),加盖置于37℃环境下浸泡24h,冷却,取其浸提液;取5mL浸提液于一支小试管内,人2mL浓度为10g/L的二苯借肼乙醇溶液,再入2ml.浓度为1mol/L的稀硫酸溶液。5.6.1.2取5mL浓度为2.83g/mL的重铬酸钾标准溶液,依次加入2mL浓度为10g/L的二苯借饼乙醇溶液利2L浓度为1 mol/L的稀硫酸溶液。5.6.1.3在相同条件下比较,浸提液的色应不深于重铬酸钾标推溶液(0.0001%的Cr)的颜色,应符合4,6.1的规定。
5.6.2乖金属
5.6.2.1在同批缝线中随机抽取缝线1m,截成约1cm长的线段,试验用水20mL,使其外表面完全浸湿,加盖置于37℃环境浸泡21 h,最其浸提液。5.6.2.2按(/T14223.1—2008中5.6方法进行,应符合4.6.2的规定。5. 6. 3 水量试验
按录 C试验时,应符合4.6.3的规定,5. 6. 4褪色试验
5.6.4.1按GB/T5737—2008中4.3、4.4、4.5的规定,配制氯化钻、硫酸铜、三氯化铁三种溶液。然后按照表5的规定配制各种颜色的标准比色液。表5标准比色液
黄棕色
粉红色
蓝绿色
紫红色
硫酸钢(CuSO,)溶波
每10ml.标准比色液中含有
氯化结(CoCla)溶液
三氯化铁(FcCl)溶液
单位为牵齐
试验用水
5.6.4.2称取0.25g缝线,置于100mL锥形瓶,加25mL试验用水,并使其37℃士0.5℃恒温24h冷却后取其浸提液[U mI于比色管中,5.6.4.3根据浸提液颜色选对应的标准比色液。在相同条件下比较,浸提液颤色应不深于标准比色7
YY1116—2010
液的颜色,符合4.6.4的规定。
5.6.5环氧乙烷残留量试验
按GB/1'14233.1-200名中第9章*气相色谱法\的规定逃行,应符合4.6.5的规定。5.7缝线的生物性能
浸提液
浸提液的制备:
浸提温度:37℃±1℃;
浸提时间:24h±2h
浸提介质:牛理盐水
供试品按表面积与没提介质体积比例6 cm\/tnL。细胞毒性试验
按GB/T16886.52003中8.3的规定进行试验,应符合4.7.1的规定。5.7.3皮内刺激试验
取浸提液,按GB/T16886.102005中附录B.2的规定进行,应符合4.7.2的规定。5.7. 4血液相容性试验
取漫提液,按GB/T16886.4—2003中附录C.6的规定进行,应符合4.7.3的规定,5.7.5急性全身毒性试验
取浸提被,按GB/T16886.11—1997中6.5的规定进行,应符合4.7.4的规定,5.7.6迟发性超敏反应试验
取浸提液,按G13/T16886.10—2005中第7章的规定进行,应符合4.7.5的规定。5.7.7热原试验
取浸提液,按GB/T16175—2008中第10章的规定迹行,应符合4.7.6的规定。5.7.8植入试验
按GB/T16886.6一1997中第5章的规定进行,试验周期为3个月,观察取样时间为1周、4周、12周,应符合4.7.7的规定。
5.7. 9 Ams 试验
按GB/T16886.3:2008中第5章的规定进行,应符合4.7.8的规定。5.7.10生物降解试验
按GB/T16886.13—2001中的规定进行,应符合4.7.9的规定。8
5.8无菌试验
YY1116-2010
按《中华人民共和国药典》2010年版(二部)中附录无菌检查法避行,应衍合4.8的规定。5.9包装标志
以目力观察,应符合4.9的规定。6检验规则
6.1验收
缝线应由制造厂质量检验部门进行检验,并保证产品质量符合本标准的要求,方可提交验收6.2组批
一个检验批可由一个生产批构成;这些牛产批是在基本相同的材料、工艺设备等条件下制造山来的;若于个生产批次构成一个检验批时,必须是在同一次灭菌条件下生产的产品。6.3出厂检验
6.3.1缝线山厂时的检验项放抽样量见表6。表6出厂检验项目及抽样量
判定规则检验中,每一个检验项目均应合格。6. 3.2
11个小
1个小
若出现其他项月不合格,则抽取不合格项日的双倍样品,进行重复检验,应全部合格,若仍有不合格项,则判为该批产品不合格。
6.4型式检验
在下列情况下应进行型式检验:新产品投产前;
连续生产中每年不少于一次;
间隔半年以上再投产时;
在设计、技术条件、工艺或材料有重大改变时;d)
国家质量监督检验机构对产品质量逃行监督检查时,6.4.2
型式检验的检验项目及抽样量见表7,在下列在-情况下应增加4.7的检验:a)
产品用途改变时;
有迹象表明产品用于人体时会产生副作用;b)
初始包装或灭菌方式改变时;
贮存期内最终产品中的任何变化。d
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
