YY 1082-2007
标准分类号
关联标准
出版信息
相关单位信息
标准简介
YY 1082-2007.Rigid arthroscope.
YY 1082规定了硬性关节内窥镜的分类和标记、要求试验方法、检验规则、标志、标签和使用说明书、包装、运输、贮存。
YY 1082透用于硬性关节内窥镜(以下简称关节镜),关节镜适用于医学临床中对人体关节疾病的检查、诊断,配合相关手术系统可进行治疗。
2规范性引用文件
下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。
GB/T 191- -2000包 装储运图示标志
GB/T 2829- 2002周期检验计数抽样程序及表(适用于对过程稳定性的检验)
GB/T 6463- -2005金属和其他无机覆盖层厚度测量方法评述
GB9706.1-1995医用电气设备 第-部分 :安全通用要求(idt IEC 601-1:1988)
GB 9706.19- -2000 医 用电气设备第2部分:内窥镜设备安全专用要求(idt IEC 60601-2-18;1996)
GB 11244- -2005医用 内窥镜及附件通用要求
GB/T 14710- -1993医用电气设备环境要求及试验方法
GB/T 16886. 1- 2001医疗器械生物学评价第1部分:评价与试验(ISO 10993-1:1997 ,IDT)
GB/T 16886.5- -2003医疗器械生物学评价 第 5部分:体外细胞毒性试验(ISO 10993-5:1999,IDT)
GB/T 16886. 10- -2005医疗 器械生物学评价第10 部分:制激与迟发型超敏反应试验(ISO 10993-10:2002,IDT)
YY 0068医用硬管内窥镜通用技术条件
YY 0076- -1992金属制件镀层分类 技术条件
YY0466- 2003 医疗器械 用于医疗器械标签.标记和提供信息的符号(ISO 15223 :2000,IDT)
3组成
关节镜由内窥镜、镜鞘及闭孔器、穿刺针、器械穿刺套管、器械穿刺器针及导光束组成。
4要求
4.1关节镜属硬性内窥镜产 品,除下列要求外,还应符合YY 0068通用要求的规定。
4.2表面和边缘除穿刺针、器械穿刺针外关节镜的各组成件应当设计成对人体不会造成任何意外伤
YY 1082规定了硬性关节内窥镜的分类和标记、要求试验方法、检验规则、标志、标签和使用说明书、包装、运输、贮存。
YY 1082透用于硬性关节内窥镜(以下简称关节镜),关节镜适用于医学临床中对人体关节疾病的检查、诊断,配合相关手术系统可进行治疗。
2规范性引用文件
下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。
GB/T 191- -2000包 装储运图示标志
GB/T 2829- 2002周期检验计数抽样程序及表(适用于对过程稳定性的检验)
GB/T 6463- -2005金属和其他无机覆盖层厚度测量方法评述
GB9706.1-1995医用电气设备 第-部分 :安全通用要求(idt IEC 601-1:1988)
GB 9706.19- -2000 医 用电气设备第2部分:内窥镜设备安全专用要求(idt IEC 60601-2-18;1996)
GB 11244- -2005医用 内窥镜及附件通用要求
GB/T 14710- -1993医用电气设备环境要求及试验方法
GB/T 16886. 1- 2001医疗器械生物学评价第1部分:评价与试验(ISO 10993-1:1997 ,IDT)
GB/T 16886.5- -2003医疗器械生物学评价 第 5部分:体外细胞毒性试验(ISO 10993-5:1999,IDT)
GB/T 16886. 10- -2005医疗 器械生物学评价第10 部分:制激与迟发型超敏反应试验(ISO 10993-10:2002,IDT)
YY 0068医用硬管内窥镜通用技术条件
YY 0076- -1992金属制件镀层分类 技术条件
YY0466- 2003 医疗器械 用于医疗器械标签.标记和提供信息的符号(ISO 15223 :2000,IDT)
3组成
关节镜由内窥镜、镜鞘及闭孔器、穿刺针、器械穿刺套管、器械穿刺器针及导光束组成。
4要求
4.1关节镜属硬性内窥镜产 品,除下列要求外,还应符合YY 0068通用要求的规定。
4.2表面和边缘除穿刺针、器械穿刺针外关节镜的各组成件应当设计成对人体不会造成任何意外伤
标准图片预览




标准内容
ICS11.040.70
中华人民共和国医药行业标准
YY1082-2007
代誉YY910821999
硬性关节内美
Rigid arthroscope
2007-07-02发布
国家食品药品监督管理局
2008-03-01实施
本标准是对YY91082—1999膝关节镜》的修订。本标准与YY91082—1999相比主要变化如下:对标准名称进行了规范:
增加了型号标记和组成件代码标记:增加了“视向角”可清晰观察范围”这两项主要套数:增加了“漏斗型目镜罩”“温度变化,不得产生雾层”“照度均勾性”要求!增加了生物相容性要求。
YY1082-2007
电气连接部分全面贯彻GB9706.1-1995《医用电气设备第一部分:安全通用要求》和
GB9706.19一2000%医用电气设备第2部分:内窥镜设备安全专用要求》的有关规定,具体内容以附录A(规范性附录)的形式给出。本标准的附录A是规范性附录。
本标准由国家食品药品监督管理局批准本标准由全国医用光学仪器标准化分技术委员会提出并归口。本标准由沈阳沈大内魔镜有限公司起草,本标准主要起草人:姜克让、高明贤、纪念训、张长安本标准历次版本发布情况为:
ZBC40003—1989:
YY91082-1999.
1范围
硬性关节内窥镜
YY1082—2007
本标准规定了硬性关节内窥镜的分类和标记、要求、试验方法、检验规则、标志、标签和使用说明书、包装、运输、贮存,
本标准适用于硬性关节内魔镜(以下简称关节镜)关节镜适用于医学临床中对人体关节疾病的检查诊断,配合相关手术系统可进行治疗。2规范性引用文件
下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括谢误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这此文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准GB/T191-2000包装运图示标志
GB/T28292002
周期检验计数抽样程序及表(适用于对过程稳定性的检验)GB/T6463-—2005金属和其他无机覆盖层厚度测量方祛评述GB9706.1-1995
医用电气设备第部分:安全通用要求(idtIEC601-1.1988)GB9706.192000医用电气设备第2部分:内窥镜设备安全专用要求(idtIEC60601-2-18:1996)
GB11244-2005医用内窥镜及附件通用要求GB/T14710-1993医用电气设备环境要求及试验方法GB/T16886.1-2001医疗器械生物学评价第1部分:评价与试验(ISO10993-1:1997,IDT)GB/T16886.5—2003医疗器械生物学评价第5部分:体外细胞毒性试验(ISO10993-5:1999,IDT)
GB/T16886.10-2005
ISO10993-10.2002.IDT)
医疗器械生物学评价
YY0068医用硬管内窥镜通用技术条件YY0076-—1992金属制件链层分类技术条件第10部分:刺激与迟发型超微反应试验YY0466-2003医疗器械用于医疗器械标签、标记和提供信息的符号(ISO15223:2000,IDT)3组成
关节镜由内镜,镜鞘及闭孔器、穿刺针、器械穿刺套管、器械穿刺器针及导光束组成。4要求
4.1关节镜属硬性内窥镜产品,除下列要求外,还应符合YY0068通用要求的规定4.2表面和边缘除穿刺针,器械穿刺针外关节镜的各组成件应当设计成对人体不会造成任何意外伤害,其所有表面不得有细礼,裂纹和毛刺。4.3关节镜的基本尽寸应符合表1的规定。YX10822007
项日名称
最大插人部外程
最小器械孔道内径
插人部工作长度
导光束长度
关节镜的基本尺寸
基本参数
标称值
注,插人部为圆形管时用直径四表示,非圆形誉时用策效周长产,表示。4.4关节镜的内魔镜基本
表2内窥镜的基本参数
项日名称
镜体外径/mm
视场角/(
视向角/c)
放大倍率
分辨率/(lp/mm)
可清晰观察范围/
照度/1x
注1:当镜体外名气
注2:放大借率、分
关节镜的内窥镜
照度的工
分幸成大信
高场A4m
单位为毫米
般限偏差
不得大于标称值
不得小手标称值
限像差
股度生产业在产品标准中规定标尔值。内窥镜成像应清听场边缘应整,不得有影响观察的划痕,度点及随着物等疵病;漏斗型日镜罩:应合1
11244-2005中4.6的要求
温度在20℃~40℃
周①受化时,不得产生影响观察的享层;密封应良好,经密封试后,无成像程邮现免通过内窥镜观察,在工作距离4mI处,照明光斑应充满视场:当距离为50mm时,照度均匀性应不低了可以采用压力蒸汽灭菌的内窥镜,试验后,内窥镜的分辨率,照度不低于原始值的95%。4.6镜鞘与内窥镜,闭孔器和穿刺针连接锁紧后,各连接部位及水闵的密封应良好,在1min内落水应不多于三滴。
4.7镜鞘的内孔应清洁光滑,进出水阅开闭应灵活、有效,与内窥镜连接后,通水流量应不小于200 mL/min.
4.8穿刺针头部应光滑锋利,饨形闭孔器头部应光滑圆整,器穿刺针柄部应平整光滑。4.9器械穿刺套管内孔应清洁光滑,并能顺利通过器械穿刺针及配套手术器械。4.10穿刺针、器械穿刺针头部硬度应为HRC36~46。关节镜的焊接部位应牢固可靠,平整光滑,无虚焊或堆焊现象。4.11
4.12关节镜的电镀零件的镀层,应符合YY0076-1992中的V类2级要求,YY10822007
4.13关节镜属于短期接触损伤表面的医疗器械,其插人部的外表面材料应采用已被证明符合生物相容性的材料制造,否则应通过下列试验:a)细胞毒性记分应不大于1:
b)刺激反应类型应不大于轻度:e)应无致敏反应,
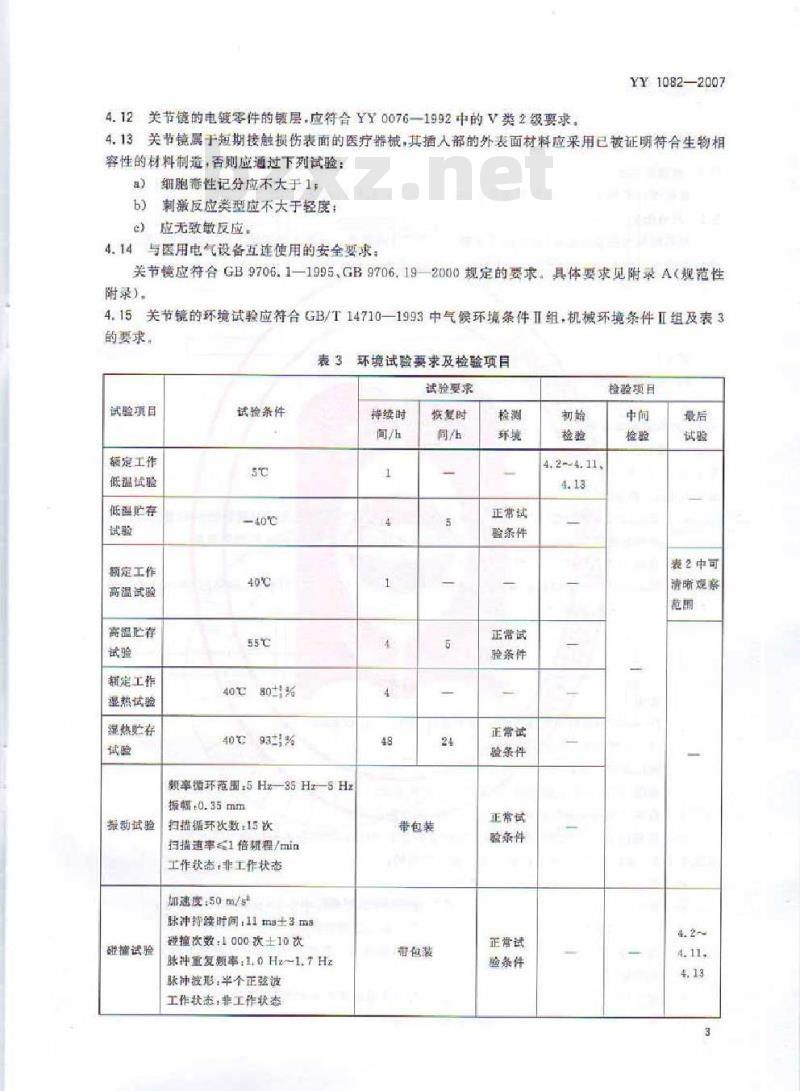
4.14与医用电气设备互连使用的安全要求:关节镜应符合GB9706.1-1995、GB9706.192000规定的要求。具体要求见附录A(规范性附录)。
4.15关节镜的环境试验应符合GB/T14710-1993中气候环境条件IⅡI组,机械环境条件Ⅱ组及表3的要求。
表3环境试验要求及检验项目
试验要求
试验项目
额定工作
低温试验
低温贮存
额定工作
高温试验
高温此春
额定工作
遵热试验
温热广存
摄动试验
础播试验
试验条件
-40℃
40℃801%
40℃93-%
额率循环范图:5Hz-35Hz-5Hz
振幅:0.35mm
扫描循环次数:15款
扫描速率1倍频程/min
工作状态:非工作状态
加惠度:50m/s
脉冲持续时间,1lms土3ms
硅撞次数:1000欢士10次
脉冲直复颜率:1.0Hz~1.7Hz
脉冲波形,半个正弦波
工作状态,非工作状态
持续时
恢复时
带包装
甜包装
正常试
验条件
正常试
验条件
正常试
验条件
正常试
验条件
正常试
验条件
4.2-~4.11
检验项目
表2中司
清晰观察
YY 1082—2007
5试验方法
5.1表面和边缘
在足够的照明下,以日测和手感检验,应符合4.2、4.8、4.11的要求5.2尺寸检验
用通用和专用量具检验,应符合4.3和4.4中尺寸的要求。若插人部的截面为非圆形,测量外切曲线的最小长度U,然后利用式C1)计算F的值,应件会43的要求。-10
式中:
等效周长,单
长(mm)
u—外切曲线量.单位为毫*mm)
5.3内窥镜基本参费
5.3.1视场角和视9
5. 3. 1.1 方法一
5.3.1.1.1测量
电)光具座享
头端面在
下列各部分组成
内庭宽进行成验并可调节内衰毒光轴与测标的中心重合,内窥镜设备,可支控
方向上距标
的同心圆测标中心点距离
目标夹#
用“度\分划
视场角和现向角测量的测
测标的圆
式中:
不同规场对测标圆环直径,单位为毫米(mm);规场角,单位
测标固定在仪器上
每隔10°应该有主标记线,开能有相应度数表示;在每个主标记线间应每隔2标上刻载一共叫条mm处测量视场
为单位,标明在
50mm处测量,
d)照明应采用白光照明测标,其最低照度不低于5001x,可以用内窥镜或外部光源。5.3.1.1.2试验方法,下面的试验方法只是推荐性的:a)按6.3.1.1a)把测标安装在设备上把内窥镜安装在内窥镜夹具上,并使头端窗口中心距测标中心50mm土0.2mm处b)
用内魔镜观察,并调节内窥镜,使测标的园环和视场周边同轴:d
读出最大可见圆环并记录为以“度”为单位的视场角。若属非圆形,则可读可见部分最大圆环的读数;
读出和记录以“度”为单位的测标度盘相对于内窥镜垂直轴的角度,作为视向角!e
从到e)重复进行重复足够的次数,测量结果应符合4.4的要求。4
图1光具座简图(不按比例)
YY10822007
YY 1082—2007
5.3.1.2方法二
图2视场角和视向角试验的测标(不按比例)将内窥镜置于图3所示位置,使目镜筒轴与平行光管光轴或示标重合或平行(适用于套管),并使光学系统人睡中心位于分度盘旋转轴上,调整分度盘至0位,然后,旋转分度盘使平行光管点状光阑的象分别移到视场边缘,设顺时针旋转角度为正,逆时针旋转角度为负,按式(3)和式(4)计算。20——0—8—
7- 1(α-0)/2-a
式中,
视场角,单位为度()
视向角,单位为度()
旋转角度,单位为度(\)):
9诞转角度,单位为度)
其中:Il>1]
应符合表2的要求。
平行光管:
导凯,
一分度盘:
分度盘旋转轴
一游标,
支持架:
内豌镜
图3视场角和视向角试验示意图(方法二)5.3.2放大倍率试验
按YY0068—1992中规定的方法试验,应符合4.4的要求5.3.3分辨率试验
YY1082-—2007
在光学平台上,将分辨辩率板放置在内窥镜前工作距高处,根据内窥镜的视向角对分辨率板进行调整,使分辨率板面垂直于内窥镜的轴向,并把要测试的分辨率线调节到内窥镜视场中心。采用光源从背面对分辩率板进行照明。将摄像头与内窥镜连接。调节该系统的放大倍率使被观案的分辨率线放大到最大。应在相同的调焦位置测量视场中心和视场边缘的分辨率。视场中心的分辨率在图4中的A点测量。能同时清楚观豪到垂直和水平两个方向的最高分拼率YY10822007
线即为中心分辨率。
视场边缘的分辨率在图4中的BBBB.点测量图4把物方视场分为4个象限,每个象限包合一个测量点,分别为BBB、B(此4个点为物方70%视场位置),测量时分别将分辨率线放置在各点,能同时清楚观察到垂直和水平两个方向的最高分辨率线即为该点分辨率,单位是Ip/mm,测量结果取平均值,即为视场边缘的分辨率。应符合4.4的要求。
图4分辨率和照度均勾性测试位置示意图5.3.4照度试验
在暗照度低于被测照度1%的环境下,用导光束将内宽镜与150W卤素灯冷光源连接,照度计探头置于内随镜工作距高处,开启冷光源并将光源照度值调至最大,照度计读数应符合4.4的要求。5.3.5可清晰观赛范威
将内窥镜固定,调节物镜与被观察物之间的距离,当距离在1mm和50mm两个位置时,通过内窥镜目镜观察应能清晰地看到宽度为1.2mm的线条,应符合4.4的要求。5.4内窥镜性能
5.4.1视场症角、光斑试验
接通冷光源并调至最亮状态,通过内窥镜目镜观察被照明的白纸,应符合4.5.1、4.5.5的要求5.4.2漏斗型目镜罩试验
按GB11244—2005中5.5的方法试验,应符合4.5.2的要求5.4.3雾层试验
将内窥镜的插人部插人温度为20℃以下的水中,10min后取出,随即插人温度为40℃的水中,然后取出擦干。从日镜中观察,应符合4.5.3的要求。5.4.4密封试验
按YY0068—1992中规定的方法试验,应符合4.5.4的要求。5.4.5照度均性
将照度计探头放置在内窥镜前距离50mm处,根据内窥镜的视向角对照度计探头进行调整,使照度计探头垂直于内窥镜的视向。在图4中的A点(A为物方视场中心点)用照度计测量该点的照度,即为视场中心的照度值E。。8
FY10822007
视场边缘的照度在图4中的BB,BB.点测量。图4把物方视场分为4个象限,每个象限包含个测量点,分别为B1B.B.B.(此4个点为物方70%视场位置)用照度计测量务点的照度.结儿即为视场边缘的照度值,分别记为E,EE.E.计算E/E。.E/E..E/E。E/E的数值均应该符合4.5.6的要求。5.4.6压力蒸汽试验
可以进行压力蒸汽消毒灭菌的内瘾镜,按CB9706.1—1995中44.7的方法试验后,应符合4.5.7的要求。
5.5渗漏试验
将镜鞘分别与穿刺针,内链连接并锁紧,将进,出水阀旋至美闭位置,镜鞘头端用橡胶球密封,在进水阀上用橡胶管连接压力10kPa的水源,打开进出水阀,观察各连接部位及进,出水阔渗漏情况应符合4.6的要求。
5.6镜鞘内孔、水阀及面水量试验旋转水阀并目测分别将进
出水闯旋至关阁店
置,在进水同上用胶管连接压力为10kPa的水源,打开进水商,不测量
内流出水的体积应台
7的要求。
5.7器械通过性量验
将器碱穿刺
5.8硬度试验
全手术器诚插人学做写期直管应等合自的要求。用洛氏硬度
格验,应符合
拍的要求
5.9镀层试验
试验前,用活清
的软布或棉
蓝去试样表面的油行
试样无反光的自命卡
b)照度:
1x~3001x
e)试样羊面与肉眼的距离为350式金时
应在下列条件下以目力观察,
或无反射光线的自色进射光下:0W日光灯300m处的照度:
镀层厚度及质摩的试验按
要求,
5.10生物相容性
查验符合生物
选的有关
a)按GB/T1
规定及相应的检验方去进行。应符合4.12的2005中的
否则按了述方达进行试验:
规定的方法进行,应符合4.13的要求,20
b)按GB/T1682005规定的方法进行,应符合4.13he)的录。5.11 与医用电气设备至连的安全要求按附录A(规范性附录)规是的方进行,应符合4.14的要求。5.12环境试验
按GB/T14710—1993中的试验顾席及试验方法及4的要求进行试验,应符合4.15的要求。6检验规则
6.1 总则
关节镜应由制造厂质量检测部门检验合格,并附有产品质量检验合格证后方可出厂6.2检验分类
关节镜检验分出厂检验和型式检验。6.3出厂检验
6.3.1关节镜的出厂检验应邀件进行,检验项目为4.2~4.9.4.11、第A.8章、第A.9章及YY0068中规定的出厂检验项目。
6.3.2出厂检验项目若有一项不合格,就判该件产品为不合格。9
YY1082-2007
6.4型式检验
6.4.1在下列情况下应进行型式检验:a)准产注册前(包括老产品转产):b)同陷一年以上投产时:
e)在设计工艺或材料有重大改变时:d国家质量监督检验部门提出要求时。6.4.2型式检验在同批原材料生产的出厂检验合格的产品中抽样,接照GB/T2829-2002的规定进行。采用一次抽样方案,其检验项日及不合格分类,判别水平(DL)、不合格质量水平(RQL)(每百单位产品不合格数)见表4的规定。
表4型式检验抽样表
不合格分类
检验项目www.bzxz.net
判别水平DL
不合格质量水平RQL
判别数组
6.5生物相容性评价
4.13,4.14
任一不合格
下列情况之一时,应进行生物相容性评价a)
准产注册前:
4.1.4.4-4.7.4.9.
4.10.4.12-4.15
材料首次使用时,未证明生物相容性是安全的制造产品的材料来源或技术条件改变时:产品配方、工艺、韧级包装或灭菌改变时:忙存期内最终产品中的任何变化:e
产品用途改变时:
)有迹象表明产品用于人体时会产生不良作用6.5,2进行生物相容性试验时,按检验所需量抽样并应全部合格。7标志、标签和使用说明书
7.1标志
7.1.1关节镜的各组成件上应标明产品代码商标或企业标志。C
4.2.4.3.4.8.4.11
7.1.2关节镜的内窥镜应标明最大插入部外径、最小器械孔道内径、视场角、视向角、工作长度等。7.1.3
由于尺寸或外形的原因,无法在关节镜上作标注时,应部分标注在包装或使用说明书上。7.1.4
能够进行压力蒸气消毒灭菌的内窥镜,应在内窥镜显著位置标注\autoclave”字样。外包装箱上应有下列标志:
制造厂名称:
产品名称及型号:
出厂年月:
体积(长X宽X高):
净重:
毛重,
产品标准号:
注册证号:
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
中华人民共和国医药行业标准
YY1082-2007
代誉YY910821999
硬性关节内美
Rigid arthroscope
2007-07-02发布
国家食品药品监督管理局
2008-03-01实施
本标准是对YY91082—1999膝关节镜》的修订。本标准与YY91082—1999相比主要变化如下:对标准名称进行了规范:
增加了型号标记和组成件代码标记:增加了“视向角”可清晰观察范围”这两项主要套数:增加了“漏斗型目镜罩”“温度变化,不得产生雾层”“照度均勾性”要求!增加了生物相容性要求。
YY1082-2007
电气连接部分全面贯彻GB9706.1-1995《医用电气设备第一部分:安全通用要求》和
GB9706.19一2000%医用电气设备第2部分:内窥镜设备安全专用要求》的有关规定,具体内容以附录A(规范性附录)的形式给出。本标准的附录A是规范性附录。
本标准由国家食品药品监督管理局批准本标准由全国医用光学仪器标准化分技术委员会提出并归口。本标准由沈阳沈大内魔镜有限公司起草,本标准主要起草人:姜克让、高明贤、纪念训、张长安本标准历次版本发布情况为:
ZBC40003—1989:
YY91082-1999.
1范围
硬性关节内窥镜
YY1082—2007
本标准规定了硬性关节内窥镜的分类和标记、要求、试验方法、检验规则、标志、标签和使用说明书、包装、运输、贮存,
本标准适用于硬性关节内魔镜(以下简称关节镜)关节镜适用于医学临床中对人体关节疾病的检查诊断,配合相关手术系统可进行治疗。2规范性引用文件
下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括谢误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这此文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准GB/T191-2000包装运图示标志
GB/T28292002
周期检验计数抽样程序及表(适用于对过程稳定性的检验)GB/T6463-—2005金属和其他无机覆盖层厚度测量方祛评述GB9706.1-1995
医用电气设备第部分:安全通用要求(idtIEC601-1.1988)GB9706.192000医用电气设备第2部分:内窥镜设备安全专用要求(idtIEC60601-2-18:1996)
GB11244-2005医用内窥镜及附件通用要求GB/T14710-1993医用电气设备环境要求及试验方法GB/T16886.1-2001医疗器械生物学评价第1部分:评价与试验(ISO10993-1:1997,IDT)GB/T16886.5—2003医疗器械生物学评价第5部分:体外细胞毒性试验(ISO10993-5:1999,IDT)
GB/T16886.10-2005
ISO10993-10.2002.IDT)
医疗器械生物学评价
YY0068医用硬管内窥镜通用技术条件YY0076-—1992金属制件链层分类技术条件第10部分:刺激与迟发型超微反应试验YY0466-2003医疗器械用于医疗器械标签、标记和提供信息的符号(ISO15223:2000,IDT)3组成
关节镜由内镜,镜鞘及闭孔器、穿刺针、器械穿刺套管、器械穿刺器针及导光束组成。4要求
4.1关节镜属硬性内窥镜产品,除下列要求外,还应符合YY0068通用要求的规定4.2表面和边缘除穿刺针,器械穿刺针外关节镜的各组成件应当设计成对人体不会造成任何意外伤害,其所有表面不得有细礼,裂纹和毛刺。4.3关节镜的基本尽寸应符合表1的规定。YX10822007
项日名称
最大插人部外程
最小器械孔道内径
插人部工作长度
导光束长度
关节镜的基本尺寸
基本参数
标称值
注,插人部为圆形管时用直径四表示,非圆形誉时用策效周长产,表示。4.4关节镜的内魔镜基本
表2内窥镜的基本参数
项日名称
镜体外径/mm
视场角/(
视向角/c)
放大倍率
分辨率/(lp/mm)
可清晰观察范围/
照度/1x
注1:当镜体外名气
注2:放大借率、分
关节镜的内窥镜
照度的工
分幸成大信
高场A4m
单位为毫米
般限偏差
不得大于标称值
不得小手标称值
限像差
股度生产业在产品标准中规定标尔值。内窥镜成像应清听场边缘应整,不得有影响观察的划痕,度点及随着物等疵病;漏斗型日镜罩:应合1
11244-2005中4.6的要求
温度在20℃~40℃
周①受化时,不得产生影响观察的享层;密封应良好,经密封试后,无成像程邮现免通过内窥镜观察,在工作距离4mI处,照明光斑应充满视场:当距离为50mm时,照度均匀性应不低了可以采用压力蒸汽灭菌的内窥镜,试验后,内窥镜的分辨率,照度不低于原始值的95%。4.6镜鞘与内窥镜,闭孔器和穿刺针连接锁紧后,各连接部位及水闵的密封应良好,在1min内落水应不多于三滴。
4.7镜鞘的内孔应清洁光滑,进出水阅开闭应灵活、有效,与内窥镜连接后,通水流量应不小于200 mL/min.
4.8穿刺针头部应光滑锋利,饨形闭孔器头部应光滑圆整,器穿刺针柄部应平整光滑。4.9器械穿刺套管内孔应清洁光滑,并能顺利通过器械穿刺针及配套手术器械。4.10穿刺针、器械穿刺针头部硬度应为HRC36~46。关节镜的焊接部位应牢固可靠,平整光滑,无虚焊或堆焊现象。4.11
4.12关节镜的电镀零件的镀层,应符合YY0076-1992中的V类2级要求,YY10822007
4.13关节镜属于短期接触损伤表面的医疗器械,其插人部的外表面材料应采用已被证明符合生物相容性的材料制造,否则应通过下列试验:a)细胞毒性记分应不大于1:
b)刺激反应类型应不大于轻度:e)应无致敏反应,
4.14与医用电气设备互连使用的安全要求:关节镜应符合GB9706.1-1995、GB9706.192000规定的要求。具体要求见附录A(规范性附录)。
4.15关节镜的环境试验应符合GB/T14710-1993中气候环境条件IⅡI组,机械环境条件Ⅱ组及表3的要求。
表3环境试验要求及检验项目
试验要求
试验项目
额定工作
低温试验
低温贮存
额定工作
高温试验
高温此春
额定工作
遵热试验
温热广存
摄动试验
础播试验
试验条件
-40℃
40℃801%
40℃93-%
额率循环范图:5Hz-35Hz-5Hz
振幅:0.35mm
扫描循环次数:15款
扫描速率1倍频程/min
工作状态:非工作状态
加惠度:50m/s
脉冲持续时间,1lms土3ms
硅撞次数:1000欢士10次
脉冲直复颜率:1.0Hz~1.7Hz
脉冲波形,半个正弦波
工作状态,非工作状态
持续时
恢复时
带包装
甜包装
正常试
验条件
正常试
验条件
正常试
验条件
正常试
验条件
正常试
验条件
4.2-~4.11
检验项目
表2中司
清晰观察
YY 1082—2007
5试验方法
5.1表面和边缘
在足够的照明下,以日测和手感检验,应符合4.2、4.8、4.11的要求5.2尺寸检验
用通用和专用量具检验,应符合4.3和4.4中尺寸的要求。若插人部的截面为非圆形,测量外切曲线的最小长度U,然后利用式C1)计算F的值,应件会43的要求。-10
式中:
等效周长,单
长(mm)
u—外切曲线量.单位为毫*mm)
5.3内窥镜基本参费
5.3.1视场角和视9
5. 3. 1.1 方法一
5.3.1.1.1测量
电)光具座享
头端面在
下列各部分组成
内庭宽进行成验并可调节内衰毒光轴与测标的中心重合,内窥镜设备,可支控
方向上距标
的同心圆测标中心点距离
目标夹#
用“度\分划
视场角和现向角测量的测
测标的圆
式中:
不同规场对测标圆环直径,单位为毫米(mm);规场角,单位
测标固定在仪器上
每隔10°应该有主标记线,开能有相应度数表示;在每个主标记线间应每隔2标上刻载一共叫条mm处测量视场
为单位,标明在
50mm处测量,
d)照明应采用白光照明测标,其最低照度不低于5001x,可以用内窥镜或外部光源。5.3.1.1.2试验方法,下面的试验方法只是推荐性的:a)按6.3.1.1a)把测标安装在设备上把内窥镜安装在内窥镜夹具上,并使头端窗口中心距测标中心50mm土0.2mm处b)
用内魔镜观察,并调节内窥镜,使测标的园环和视场周边同轴:d
读出最大可见圆环并记录为以“度”为单位的视场角。若属非圆形,则可读可见部分最大圆环的读数;
读出和记录以“度”为单位的测标度盘相对于内窥镜垂直轴的角度,作为视向角!e
从到e)重复进行重复足够的次数,测量结果应符合4.4的要求。4
图1光具座简图(不按比例)
YY10822007
YY 1082—2007
5.3.1.2方法二
图2视场角和视向角试验的测标(不按比例)将内窥镜置于图3所示位置,使目镜筒轴与平行光管光轴或示标重合或平行(适用于套管),并使光学系统人睡中心位于分度盘旋转轴上,调整分度盘至0位,然后,旋转分度盘使平行光管点状光阑的象分别移到视场边缘,设顺时针旋转角度为正,逆时针旋转角度为负,按式(3)和式(4)计算。20——0—8—
7- 1(α-0)/2-a
式中,
视场角,单位为度()
视向角,单位为度()
旋转角度,单位为度(\)):
9诞转角度,单位为度)
其中:Il>1]
应符合表2的要求。
平行光管:
导凯,
一分度盘:
分度盘旋转轴
一游标,
支持架:
内豌镜
图3视场角和视向角试验示意图(方法二)5.3.2放大倍率试验
按YY0068—1992中规定的方法试验,应符合4.4的要求5.3.3分辨率试验
YY1082-—2007
在光学平台上,将分辨辩率板放置在内窥镜前工作距高处,根据内窥镜的视向角对分辨率板进行调整,使分辨率板面垂直于内窥镜的轴向,并把要测试的分辨率线调节到内窥镜视场中心。采用光源从背面对分辩率板进行照明。将摄像头与内窥镜连接。调节该系统的放大倍率使被观案的分辨率线放大到最大。应在相同的调焦位置测量视场中心和视场边缘的分辨率。视场中心的分辨率在图4中的A点测量。能同时清楚观豪到垂直和水平两个方向的最高分拼率YY10822007
线即为中心分辨率。
视场边缘的分辨率在图4中的BBBB.点测量图4把物方视场分为4个象限,每个象限包合一个测量点,分别为BBB、B(此4个点为物方70%视场位置),测量时分别将分辨率线放置在各点,能同时清楚观察到垂直和水平两个方向的最高分辨率线即为该点分辨率,单位是Ip/mm,测量结果取平均值,即为视场边缘的分辨率。应符合4.4的要求。
图4分辨率和照度均勾性测试位置示意图5.3.4照度试验
在暗照度低于被测照度1%的环境下,用导光束将内宽镜与150W卤素灯冷光源连接,照度计探头置于内随镜工作距高处,开启冷光源并将光源照度值调至最大,照度计读数应符合4.4的要求。5.3.5可清晰观赛范威
将内窥镜固定,调节物镜与被观察物之间的距离,当距离在1mm和50mm两个位置时,通过内窥镜目镜观察应能清晰地看到宽度为1.2mm的线条,应符合4.4的要求。5.4内窥镜性能
5.4.1视场症角、光斑试验
接通冷光源并调至最亮状态,通过内窥镜目镜观察被照明的白纸,应符合4.5.1、4.5.5的要求5.4.2漏斗型目镜罩试验
按GB11244—2005中5.5的方法试验,应符合4.5.2的要求5.4.3雾层试验
将内窥镜的插人部插人温度为20℃以下的水中,10min后取出,随即插人温度为40℃的水中,然后取出擦干。从日镜中观察,应符合4.5.3的要求。5.4.4密封试验
按YY0068—1992中规定的方法试验,应符合4.5.4的要求。5.4.5照度均性
将照度计探头放置在内窥镜前距离50mm处,根据内窥镜的视向角对照度计探头进行调整,使照度计探头垂直于内窥镜的视向。在图4中的A点(A为物方视场中心点)用照度计测量该点的照度,即为视场中心的照度值E。。8
FY10822007
视场边缘的照度在图4中的BB,BB.点测量。图4把物方视场分为4个象限,每个象限包含个测量点,分别为B1B.B.B.(此4个点为物方70%视场位置)用照度计测量务点的照度.结儿即为视场边缘的照度值,分别记为E,EE.E.计算E/E。.E/E..E/E。E/E的数值均应该符合4.5.6的要求。5.4.6压力蒸汽试验
可以进行压力蒸汽消毒灭菌的内瘾镜,按CB9706.1—1995中44.7的方法试验后,应符合4.5.7的要求。
5.5渗漏试验
将镜鞘分别与穿刺针,内链连接并锁紧,将进,出水阀旋至美闭位置,镜鞘头端用橡胶球密封,在进水阀上用橡胶管连接压力10kPa的水源,打开进出水阀,观察各连接部位及进,出水阔渗漏情况应符合4.6的要求。
5.6镜鞘内孔、水阀及面水量试验旋转水阀并目测分别将进
出水闯旋至关阁店
置,在进水同上用胶管连接压力为10kPa的水源,打开进水商,不测量
内流出水的体积应台
7的要求。
5.7器械通过性量验
将器碱穿刺
5.8硬度试验
全手术器诚插人学做写期直管应等合自的要求。用洛氏硬度
格验,应符合
拍的要求
5.9镀层试验
试验前,用活清
的软布或棉
蓝去试样表面的油行
试样无反光的自命卡
b)照度:
1x~3001x
e)试样羊面与肉眼的距离为350式金时
应在下列条件下以目力观察,
或无反射光线的自色进射光下:0W日光灯300m处的照度:
镀层厚度及质摩的试验按
要求,
5.10生物相容性
查验符合生物
选的有关
a)按GB/T1
规定及相应的检验方去进行。应符合4.12的2005中的
否则按了述方达进行试验:
规定的方法进行,应符合4.13的要求,20
b)按GB/T1682005规定的方法进行,应符合4.13he)的录。5.11 与医用电气设备至连的安全要求按附录A(规范性附录)规是的方进行,应符合4.14的要求。5.12环境试验
按GB/T14710—1993中的试验顾席及试验方法及4的要求进行试验,应符合4.15的要求。6检验规则
6.1 总则
关节镜应由制造厂质量检测部门检验合格,并附有产品质量检验合格证后方可出厂6.2检验分类
关节镜检验分出厂检验和型式检验。6.3出厂检验
6.3.1关节镜的出厂检验应邀件进行,检验项目为4.2~4.9.4.11、第A.8章、第A.9章及YY0068中规定的出厂检验项目。
6.3.2出厂检验项目若有一项不合格,就判该件产品为不合格。9
YY1082-2007
6.4型式检验
6.4.1在下列情况下应进行型式检验:a)准产注册前(包括老产品转产):b)同陷一年以上投产时:
e)在设计工艺或材料有重大改变时:d国家质量监督检验部门提出要求时。6.4.2型式检验在同批原材料生产的出厂检验合格的产品中抽样,接照GB/T2829-2002的规定进行。采用一次抽样方案,其检验项日及不合格分类,判别水平(DL)、不合格质量水平(RQL)(每百单位产品不合格数)见表4的规定。
表4型式检验抽样表
不合格分类
检验项目www.bzxz.net
判别水平DL
不合格质量水平RQL
判别数组
6.5生物相容性评价
4.13,4.14
任一不合格
下列情况之一时,应进行生物相容性评价a)
准产注册前:
4.1.4.4-4.7.4.9.
4.10.4.12-4.15
材料首次使用时,未证明生物相容性是安全的制造产品的材料来源或技术条件改变时:产品配方、工艺、韧级包装或灭菌改变时:忙存期内最终产品中的任何变化:e
产品用途改变时:
)有迹象表明产品用于人体时会产生不良作用6.5,2进行生物相容性试验时,按检验所需量抽样并应全部合格。7标志、标签和使用说明书
7.1标志
7.1.1关节镜的各组成件上应标明产品代码商标或企业标志。C
4.2.4.3.4.8.4.11
7.1.2关节镜的内窥镜应标明最大插入部外径、最小器械孔道内径、视场角、视向角、工作长度等。7.1.3
由于尺寸或外形的原因,无法在关节镜上作标注时,应部分标注在包装或使用说明书上。7.1.4
能够进行压力蒸气消毒灭菌的内窥镜,应在内窥镜显著位置标注\autoclave”字样。外包装箱上应有下列标志:
制造厂名称:
产品名称及型号:
出厂年月:
体积(长X宽X高):
净重:
毛重,
产品标准号:
注册证号:
小提示:此标准内容仅展示完整标准里的部分截取内容,若需要完整标准请到上方自行免费下载完整标准文档。
